2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306
海马(Hippocampus)属于海龙目(Syngnathiformes)海龙科(Syngnathidae),主要分布于50°N到50°S的温带和热带沿海区域,常栖息于藻体,世界范围内已发现隶属于海马属的动物48种[1]。目前海马除用作观赏鱼类及部分应用于传统医药外,对其精深加工报道较少。研究表明,海马具有一系列功能性作用,如抗氧化[2-5]、抗炎[6-9]、抗肿瘤[10-11]、激素样作用[12-13]等,且对高血压、血栓、阳痿及某些神经退行性疾病具有良好缓解作用[12, 14]。目前对海马的研究多集中在甾体[15-16]、脂肪酸[17-18]、多肽[19]等组分,对海马多糖研究尚不深入,相关报道较少。多糖是天然大分子物质,生物活性多样[20-22],在医药、保健品、食品及化妆品等领域的产品开发具有广泛应用前景。本文以日本海马(Hippocampus mohnikei)为原料,通过响应面优化超声辅助提取海马多糖工艺,并经分级纯化得到均一多糖,初步研究其单糖组成及抗氧化活性,可为海马多糖的产业化应用提供科学依据和技术支撑,有助于提升海马加工的技术水平与附加值。
1 材料与方法 1.1 材料与试剂日本海马(体长3~5 cm,体质量10~20 mg,月龄3~10个月)取自山东省日照市;氯化钠、纯化填料,上海兰拓生物科技有限公司;硫酸、三氯甲烷、二氯甲烷,上海柯灵斯有限公司;95%乙醇、乙酸酐、三氯乙酸、抗坏血酸、DPPH,国药集团化学试剂有限公司;盐酸羟胺,北京化工厂;苯酚、三氟乙酸,阿达玛斯试剂有限公司。
1.2 仪器与设备主要仪器:恒流泵,上海沪西分析仪器厂;电热恒温鼓风干燥箱(DH6-907385-Ⅲ),上海讯博实业有限公司医疗设备厂;80-2离心机,金坛荣华仪器厂;旋转蒸发仪(RE3000-D),上海亚荣生化仪器厂;气质联用仪,美国Agilent公司;紫外可见分光光度计,上海美谱达仪器有限公司;酶标仪,美国伯腾仪器有限公司。
1.3 实验方法 1.3.1 海马粗多糖的提取恒温鼓风干燥箱60 ℃海马干燥至恒重,粉碎成粉末。乙醇回流法脱脂:液料比10 mL/g、温度80 ℃、水浴3 h、重复3次,过滤得到脱脂海马粉,烘干。按30 mL/g液料比向脱脂海马粉内加入蒸馏水超声辅助提取、过滤、浓缩、乙醇沉淀、离心(4 000 r/min,4 ℃,20 min)去除上清液,冷冻干燥,即得海马粗多糖HP[23]。
1.3.2 单因素实验按照1.3.1节所述方法,以液料比20 mL/g、超声30 min、80 ℃浸提3 h设定为基本实验条件,测定超声时间(20、30、40、50、60 min)、浸提温度(50、60、70、80、90 ℃)、液料比(10、20、30、40、50 mL/g)对多糖得率的影响[24]。海马粗多糖得率按下式计算:
 (1)
(1)
式中: W为多糖得率,%;m为粗多糖质量,mg;M为称取的海马质量,mg。
1.3.3 响应面试验以单因素试验结果为依据,选择三因素三水平进行响应面试验(表 1),测定各试验条件对多糖得率的影响,利用Design-Expert 11软件进行回归分析,确定海马多糖最佳提取工艺条件[25-26]。
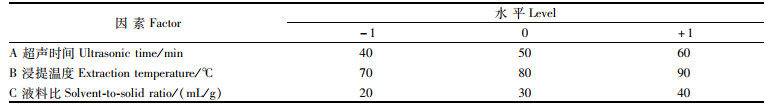
|
表 1 响应面试验的因素及水平 Tab.1 Factors and levels of response surface text |
(1) 脱蛋白
取适量海马粗多糖溶于蒸馏水中,离心(4 000 r/min,4 ℃,20 min),取上清液加入适量三氯乙酸,使其终浓度为3%,搅拌均匀放置过夜,离心(4 000 r/min,4 ℃,20 min),取上清液旋蒸浓缩后,透析(截留分子量3 500 u),收集透析液,备用[23]。
(2) DEAE-52离子纤维素交换柱纯化
充分溶胀DEAE-52填料1 h,去除杂质,玻棒引流缓慢装柱,防止产生气泡,待填料不再下降,超纯水平衡过夜。取适量透析液上样,0、0.1、0.3、0.5 mol/L的NaCl溶液作为洗脱液,苯酚-硫酸检测吸光值,绘制曲线,收集出峰管,浓缩、透析进行下一步纯化。
(3) Sephadex G-100葡聚糖凝胶柱纯化
充分溶胀葡聚糖凝胶填料24 h,去除上层凝胶碎片颗粒,进行装柱,超纯水平衡3~5个柱体积,备用。取适量经DEAE-52纤维素离子交换柱纯化后的多糖溶液进行上样,分别用0.1和0.3 mol/L NaCl溶液进行洗脱,收集,苯酚-硫酸检测吸光度值,绘制洗脱曲线,收集出峰管,透析浓缩,冻干即得海马纯化多糖。
1.3.5 HP-1和HP-2单糖组成测定参考文献[25]的方法对标准品、海马多糖进行水解及乙酰化,随后上机分析,氦气作为载气,流速为1 mL/min。温度程序:发射能量为70 eV; 离子源温度为150 ℃;柱温在165 ℃下保持7 min,以5 ℃/min上升至185 ℃;5 min后,以4 ℃/min速度上升至200 ℃;设定升温速度为20 ℃/min,上升至280 ℃,保持2 min,进行GC-MS分析。
1.3.6 抗氧化活性评价(1) DPPH自由基清除能力[27]
Vc为对照组,测定HP、HP-1、HP-2对二苯代苦味酰基自由基(DPPH·)的清除能力。配置不同质量浓度HP、HP-1、HP-2(1、2、3、4、5 mg/mL)溶液,取同体积多糖和DPPH溶液于96孔板,反应30 min(避光),测定517 nm吸光度值,根据公式(2)计算HP、HP-1、HP-2对DPPH·的清除率。
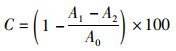 (2)
(2)
式中:C为DPPH·清除率,%;A0为空白对照吸光度;A1为样品吸光度;A2为样品本底吸光度。
(2) 总还原力测定
配置0.2 mol/L PBS(pH 6.6)、1%六氰铁酸钾溶液、10%三氯乙酸和0.1%三氯化铁,按文献[28]方法测定不同浓度HP、HP-1、HP-2溶液的还原力。
1.4 数据处理分别采用Origin 9.0、SPSS 17.0、Design expert 11.0软件分析实验相关图表、单因素实验数据与响应面试验及其显著性。
2 结果与分析 2.1 超声时间、浸提温度及液料比对海马粗多糖得率的影响如图 1a所示,随着超声时间延长,多糖得率逐渐提高,当达到50 min时,达到最大值11.30%,随后多糖得率降低,这是由于超声时间增加有利于海马的细胞组织破碎,加速多糖溶出,但随着时间继续增加,杂质溶出增多,且超声时间延长可能会引发多糖降解,导致乙醇沉淀时多糖得率有所降低[29],因此确定超声时间为50 min。如图 1b所示,随着浸提温度升高,多糖得率逐渐增大,当达到80 ℃时,达到最大值11.07%,温度进一步升高,多糖得率下降,表明在一定范围内温度升高可加快多糖溶出,但超过一定温度,则不利于多糖溶出。如图 1c所示,随着溶剂量增大,多糖得率逐渐上升,当液料比为30 mL/g时,达到最大值9.47%,表明在一定范围内,增加液料比可提高海马多糖产率,这源于溶剂量的增加会提高多糖在水边界层的浓度差,从而促进其扩散[30]。
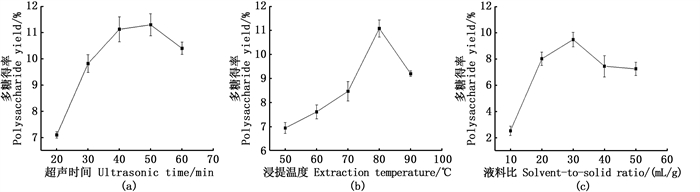
|
图 1 超声时间、浸提温度、液料比对海马多糖得率的影响 Fig. 1 Effect of ultrasonic treatment time, extraction temperature, solvent-to-solid ratio on the yield of Hippocampus mohnikei polysaccharide |
在单因素实验的基础上,根据Box-Benhnken的中心组合试验设计进行了17组试验,如表 2所示,多糖得率波动范围较大,最小为4.93%,最大为11.32%,表明相同试验因素的不同水平对多糖得率有较大影响,因此进一步对其进行回归方程的方差分析。
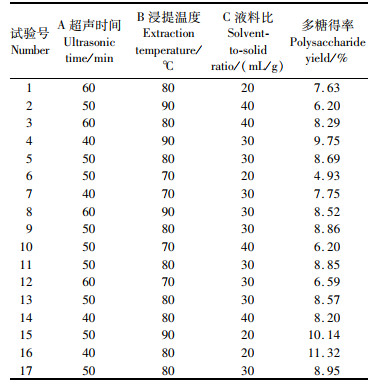
|
表 2 响应面试验设计及结果 Tab.2 Design and results for response surface analysis |
采用Design-Expert 11.0软件对试验结果进行拟合分析得到二次多项式回归模型:Y=8.78-0.7480 A+1.14 B-0.6420 C-0.0170 AB+0.9460 AC-1.30 BC+0.6838 A2-1.31 B2-0.6032 C2。
如表 3所示,对该回归方程进行方差分析,得到模型P < 0.01,具有显著性,表明模型具有较高可信度;失拟项不显著P>0.05、相关系数R2=0.987 9,表明模型拟合良好;且信躁比Adeq precision=30.501 4>4,综合以上结果表明该回归二次模型成立,可用于分析和预测海马多糖的提取工艺[26]。根据F值大小可以得到3个因素对于海马多糖得率影响的主次顺序依次为浸提温度(B)、超声时间(A)、液料比(C)。其中除了交互项AB对多糖得率的影响不显著外,其余项对多糖得率均具有极显著影响(P < 0.01)。

|
表 3 回归模型的方差分析 Tab.3 Analysis of variance in regression model |
图 2为液料比、浸提温度、超声时间之间交互作用对多糖得率的影响,其中浸提温度与液料比、超声时间与液料比的交互作用对海马多糖得率影响极显著,而浸提温度与超声时间的交互作用不明显。通过对实验模型的分析,得到最优工艺条件为超声时间47.37 min、浸提温度86.73 ℃、液料比22.86 mL/g,多糖得率为10.16%。考虑到实验可操作性,将最佳提取工艺更正为超声时间47 min、浸提温度87 ℃、液料比23 mL/g,测得其得率为9.91%,与响应面试验结果相近,表明该最佳提取工艺可行。

|
图 2 各因素相互作用对海马多糖得率影响 Fig. 2 Interactive effects of various factors on polysaccharide yield |
HP首先通过DEAE-52离子交换柱纯化,如图 3a所示,洗脱液为不同浓度NaCl溶液(0、0.1、0.3、0.5 mol/L),收集0.1 mol/L(27~29)和0.3 mol/L(52~54)NaCl溶液洗脱下的多糖溶液,经Sephadex G-100葡聚糖凝胶柱进一步纯化,得到单一对称的曲线图,表明其为均一多糖,如图 3b所示,收集出峰管,浓缩、透析、冷冻干燥得到纯化多糖,命名为HP-1和HP-2。

|
图 3 海马多糖洗脱曲线 Fig. 3 Elution curve of Hippocampus mohnikei polysaccharides |
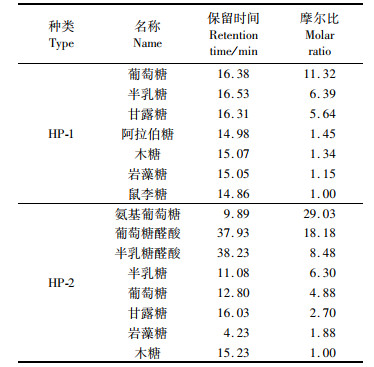
经GC-MS分析,HP-1和HP-2均是杂多糖,其中HP-1中含有葡萄糖、阿拉伯糖和鼠李糖,且葡萄糖含量最多,而HP-2中含有较多的氨基葡萄糖及糖醛酸。见表 4。
|
表 4 HP-1和HP-2单糖组成 Tab.4 Monosaccharide composition of HP-1 and HP-2 |
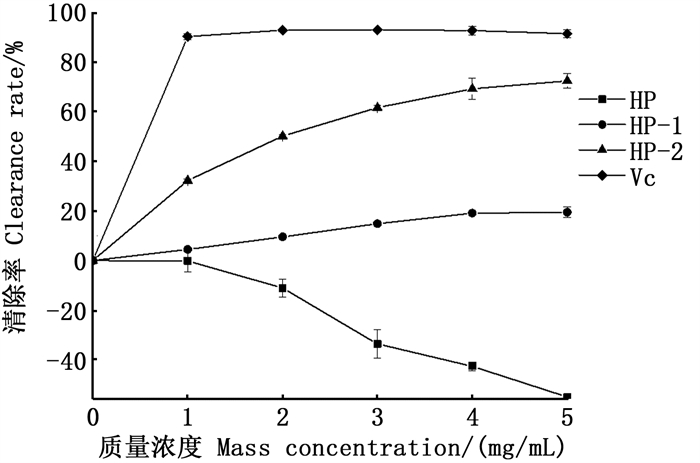
如图 4所示,质量浓度为0~5 mg/mL时,HP对DPPH自由基无清除作用,纯化后的海马多糖HP-1和HP-2其清除效果明显增强,尤其是HP-2,在浓度为5 mg/mL时,其DPPH自由基清除率为72.48%,虽与Vc有差距,但依然展示了较强的抗氧化能力。黄素华等[31]对枇杷叶多糖的研究表明,纯化后的多糖对DPPH自由基的清除效果更好,也说明纯化的多糖抗氧化活性得到提升。
|
图 4 HP、HP-1、HP-2对DPPH自由基清除能力 Fig. 4 Scavenging effect of HP, HP-1, HP-2 on DPPH free radical |
铁氰化钾中的三价铁可被具有抗氧化功能的多糖还原成二价亚铁,与三氯化铁反应生成在700 nm处有最大紫外吸收值的普鲁士蓝。如图 5所示,随着多糖浓度增加,吸光度值逐渐增大,表明HP、HP-1、HP-2的还原力随着浓度增加而逐渐增强,且在相同浓度下,HP-2的还原力最强,而由于粗多糖成分复杂,因素影响众多[32-34],使HP还原力高于HP-1。在0~5 mg/mL浓度范围内,HP、HP-1、HP-2的线性拟合方程分别为yHP=0.026+0.030x,R2=0.967;yHP-1=0.021+0.024 x,R2=0.983;yHP-2=0.047+0.030 x,R2=0.973。如图 6所示,HP-1、HP-2清除DPPH自由基能力和还原力间具有相关性,其相关系数R2均大于0.9,由于HP只有还原力,但对DPPH没有清除力,所以不存在HP的还原力与DPPH·清除率的相关性。

|
图 5 HP、HP-1、HP-2还原力 Fig. 5 Reducing power of HP, HP-1, HP-2 |

|
图 6 HP-1、HP-2的还原力与DPPH·清除率的相关性 Fig. 6 Correlation between the reducing power and DPPH· clearance of HP-1 and HP-2 |
多糖提取主要有水提法、酸提法、碱提法和酶提法等[35],其中水提法因其工艺简单、无污染而最常用,在传统水提法基础上,引入超声辅助提取可缩短提取时间,提高提取效率,降低多糖损失[36],本研究采用响应面法优化了超声辅助提取海马粗多糖工艺,得到最佳提取条件,多糖得率达到9.91%。粗多糖组分及结构复杂多样,限制了其进一步应用,因此将其制备为均一多糖,是当前国内外多糖研究的重点,也是提高其附加值的关键,目前多糖纯化方法有沉淀法、柱层析法和超滤法等[37],其中柱层析法较常用,本文采用柱层析分级纯化得到2种均一多糖HP-1及HP-2,整体而言,HP-2相比粗多糖具有更好的抗氧化活性,表明多糖纯化与否对其生物活性有较大影响,这与文献[32]报道一致。
单糖组成是多糖最基本的结构特征,是影响其生物活性的重要因素[38-39],HP-1及HP-2单糖组成较为复杂,经GC-MS分析,HP-1主要由葡萄糖、半乳糖、甘露糖组成,HP-2主要由氨基葡萄糖、葡萄糖醛酸、半乳糖醛酸、半乳糖、葡萄糖、甘露糖组成,这为其进一步结构表征和活性分析奠定了基础。多糖生物活性多样,研究[40]发现,多糖的抗氧化性是其抗肿瘤、抗炎、降血糖、降血脂等功效的作用机制之一,国内外非常关注多糖的抗氧化活性,已成为食品、生物等领域的研究热点。自由基具有高度化学活性,是人体代谢产物,产生过多会引起脂质过氧化作用、DNA氧化破坏或交联,进一步损伤机体细胞和器官组织,诱发多种疾病[22]。多糖的抗氧化作用可通过转移电子给DPPH·,中和自身自由基而实现,另外还原力是多糖抗氧化性的直接体现[41],因此本文以DPPH自由基清除力和还原力为指标,评价了海马多糖的抗氧化活性,以期为海马多糖的功能研究打下基础,也为开发海洋动物来源的抗氧化剂提供实验依据。
| [1] |
KOLDEWEY H J, MARTIN-SMITH K M. A global review of seahorse aquaculture[J]. Aquaculture, 2010, 302(3/4): 131-152. |
| [2] |
KIM H S, JE J G, RYU B, et al. Antioxidant and angiotensin-I converting enzyme inhibitory peptides from Hippocampus abdominalis[J]. European Food Research and Technology, 2019, 245(2): 479-487. DOI:10.1007/s00217-018-3179-0 |
| [3] |
SANAYE S V, PISE N M, PAWAR A P, et al. Evaluation of antioxidant activities in captive-bred cultured yellow seahorse, Hippocampus kuda (Bleeker, 1852)[J]. Aquaculture, 2014, 434: 100-107. DOI:10.1016/j.aquaculture.2014.08.007 |
| [4] |
QIAN Z J, KANG K H, KIM S K. Isolation and antioxidant activity evaluation of two new phthalate derivatives from seahorse, Hippocampus kuda Bleeler[J]. Biotechnology and Bioprocess Engineering, 2012, 17(5): 1031-1040. DOI:10.1007/s12257-012-0115-1 |
| [5] |
PERERA N C N, GODAHEWA G I, LEE J. Copper-zinc-superoxide dismutase (CuZnSOD), an antioxidant gene from seahorse (Hippocampus abdominalis); molecular cloning, sequence characterization, antioxidant activity and potential peroxidation function of its recombinant protein[J]. Fish & Shellfish Immunology, 2016, 57: 386-399. |
| [6] |
LI H D, SUN H S, BAI X F, et al. HC2 of Pseudomonas sp. induced enteritis in Hippocampus japonicus[J]. Aquaculture Research, 2016, 47(6): 2027-2030. DOI:10.1111/are.12646 |
| [7] |
HIMAYA S W A, RYU B M, QIAN Z J, et al. Paeonol from Hippocampus kuda Bleeler suppressed the neuro-inflammatory responses in vitro via NF-κB and MAPK signaling pathways[J]. Toxicology in Vitro, 2012, 26(6): 878-887. DOI:10.1016/j.tiv.2012.04.022 |
| [8] |
PANGESTUTI R, KIM S K. Peptide-derived from seahorse exerts a protective effect against cholinergic neuronal death in in vitro model of Alzheimer's disease[J]. Procedia Chemistry, 2015, 14: 343-352. DOI:10.1016/j.proche.2015.03.047 |
| [9] |
陈莉萍, 申铉日, 陈国华. 三斑海马脂溶性组分对脂多糖刺激小鼠单核巨噬细胞RAW264.7体外抗炎作用的研究[C]//2015年中国水产学会学术年会论文摘要集. 杭州: 中国水产学会, 2015. CHEN L P, SHEN X R, CHEN G H. Study on the effect upon lipopolysaccharide induced murine monocyte macrophages RAW264.7 inflammation in vitro of lipid soluble components from three-spot seahorse[C]//Proceedings of 2015 Chinese Fisheries Society Academic Annual Conference Paper Abstract Collection. Hangzhou: Chinese Fisheries Society, 2015. |
| [10] |
朱爱民. 海马乙醇提取物药理作用的研究[J]. 中国药事, 2005, 19(1): 23-24. ZHU A M. Pharmacologic researches on ethanol extracts from hippocampus[J]. Chinese Pharmaceutical Affairs, 2005, 19(1): 23-24. DOI:10.3969/j.issn.1002-7777.2005.01.010 |
| [11] |
于曼曼. 三斑海马长链碱的制备及体外抗肿瘤作用的研究[D]. 海口: 海南大学, 2018. YU M M. Study on preparation on anti-tumor activity of sphingoid bases from Hippocampus trimaculatus leach[D]. Haikou: Hainan University, 2018. |
| [12] |
陆茵, 陈文星, 华永庆, 等. 海马壮阳软胶囊温肾壮阳的实验药理学研究[J]. 南京中医药大学学报(自然科学版), 2001, 17(2): 99-101. LU Y, CHEN W X, HUA Y Q, et al. Pharmacological research on effect of Haima Zhuangyang capsule in warming kidney and strengthening Yang[J]. Journal of Nanjing University (Natural Science), 2001, 17(2): 99-101. DOI:10.3969/j.issn.1000-5005.2001.02.013 |
| [13] |
张洪, 罗毅, 罗顺德. 日本海马对雄性大鼠附性器官及垂体──性腺轴的影响[J]. 中国海洋药物, 2001(2): 39-41, 35. ZHANG H, LUO Y, LUO S D. Affect of the sea horse Hippocampus japonicus on pituitary- gonadal axis in male rats[J]. Chinese Journal of Marine Drugs, 2001(2): 39-41, 35. DOI:10.3969/j.issn.1002-3461.2001.02.011 |
| [14] |
陈梦, 陈建真, 葛宇清, 等. 海马化学成分及药理活性研究进展[J]. 中草药, 2017, 48(19): 4089-4099. CHEN M, CHEN J Z, GE Y Q, et al. Research progress on chemical constituents and pharmacological activities of Hippocampus[J]. Chinese Traditional and Herbal Drugs, 2017, 48(19): 4089-4099. DOI:10.7501/j.issn.0253-2670.2017.19.029 |
| [15] |
杨毅, 王真, 顾艳玲, 等. 短刺海马的化学成分研究[J]. 中国药房, 2014, 25(19): 1780-1782. YANG Y, WANG Z, GU Y P, et al. Study on chemical constituents of Hippocampus erinaceus[J]. China Pharmacy, 2014, 25(19): 1780-1782. DOI:10.6039/j.issn.1001-0408.2014.19.17 |
| [16] |
WU J N, LIU Z Y, SU J, et al. Anti-inflammatory activity of 3β-hydroxycholest-5-en-7-one isolated from Hippocampus trimaculatus leach via inhibiting iNOS, TNF-α, and 1L-1β of LPS induced RAW 264.7 macrophage cells[J]. Food & Function, 2017, 8(2): 788-795. |
| [17] |
RYU B M, QIAN Z J, KIM S K. Purification of a peptide from seahorse, that inhibits TPA-induced MMP, iNOS and COX-2 expression through MAPK and NF-κB activation, and induces human osteoblastic and chondrocytic differentiation[J]. Chemico-Biological Interactions, 2010, 184(3): 413-422. DOI:10.1016/j.cbi.2009.12.003 |
| [18] |
RYU B M, QIAN Z J, KIM S K. SHP-1, a novel peptide isolated from seahorse inhibits collagen release through the suppression of collagenases 1 and 3, nitric oxide products regulated by NF-κB/p38 kinase[J]. Peptides, 2010, 31(1): 79-87. DOI:10.1016/j.peptides.2009.10.019 |
| [19] |
PANGESTUTI R, RYU B M, HIMAYA S W A, et al. Optimization of hydrolysis conditions, isolation, and identification of neuroprotective peptides derived from seahorse Hippocampus trimaculatus[J]. Amino Acids, 2013, 45(2): 369-381. DOI:10.1007/s00726-013-1510-4 |
| [20] |
FAGGIO C, PAGANO M, DOTTORE A, et al. Evaluation of anticoagulant activity of two algal polysaccharides[J]. Natural Product Research, 2016, 30(17): 1934-1937. DOI:10.1080/14786419.2015.1086347 |
| [21] |
FAGGIO C, MORABITO M, MINICANTE S A, et al. Potential use of polysaccharides from the brown alga Undaria pinnatifida as anticoagulants[J]. Brazilian Archives of Biology and Technology, 2015, 58(5): 798-804. DOI:10.1590/S1516-8913201500400 |
| [22] |
梁云. 几种天然抗氧化剂抗氧化性能比较研究[D]. 无锡: 江南大学, 2008. LIANG Y. A comparative study on the antioxidant activities of some natural antioxidants[D]. Wuxi: Jiangnan University, 2008. |
| [23] |
崔明晓. 大石花菜多糖的分离、结构表征及其抗炎活性研究[D]. 上海: 上海海洋大学, 2019. CUI M X. Isolation, characterization and anti-inflammatory activity of Gelidium pacificum Okamura polysaccharide[D]. Shanghai: Shanghai Ocean University, 2019. |
| [24] |
李玲玉, 邱志常, 朱姗姗, 等. 响应面法优化牛蒡多糖超声辅助提取工艺与抗氧化活性评价[J]. 食品科技, 2020, 45(11): 197-204, 211. LI L Y, QIU Z C, ZHU S S, et al. Optimization of polysaccharides from Arctium Lappa L. by ultrasound-assisted extraction using responsse surface methodology and its antioxidant activities[J]. Food Science and Technology, 2020, 45(11): 197-204, 211. |
| [25] |
芮光伟, 李维, 蒙英. 川芎多糖提取及GC-MS法测定其单糖含量及结构分析[J]. 食品科技, 2013, 38(9): 150-152. RUI G W, LI W, MENG Y. Determination of content on monosaccharide and structure of Ligusticum wallichii polysaccharide extraction by GC-MS method[J]. Food Science and Technology, 2013, 38(9): 150-152. |
| [26] |
史晓宇, 高珍珍, 张超, 等. 蓝刺头多糖提取工艺优化及其抗氧化活性[J]. 食品工业科技, 2020, 41(24): 137-142. SHI X Y, GAO Z Z, ZHANG C, et al. Optimization of extraction of Echinops lotifolis tausch polysaccharides and its antioxidant activity[J]. Science and Technology of Food Industry, 2020, 41(24): 137-142. |
| [27] |
SULAIMAN M, FAZILAH A M. Analysis of total phenolics, tannins and flavonoids from Moringa oleifera seed extract[J]. Journal of Chemical and Pharmaceutical Research, 2015, 7(1): 132-135. |
| [28] |
龚文静, 王磊, 邱玥, 等. 甜橙油抗氧化活性研究[J]. 安徽农业科学, 2011, 39(35): 21783-21784, 22131. GONG W J, WANG L, QIU Y, et al. Study on the antioxidant activity of sweet orange oil[J]. Journal of Anhui Agricultural Sciences, 2011, 39(35): 21783-21784, 22131. DOI:10.3969/j.issn.0517-6611.2011.35.084 |
| [29] |
崔蕊静, 赵玉华, 常学东. 微波辅助提取安梨皮渣中多酚类物质工艺优化[J]. 食品工业, 2015, 36(9): 16-19. CUI R J, ZHAO Y H, CHANG X D. Optimization for the processes of extracting polyphenols from Ann pears assisted with microwave[J]. The Food Industry, 2015, 36(9): 16-19. |
| [30] |
邱涛涛, 王华, 毛世红. 石榴叶总酚测定及提取工艺研究[J]. 食品科学, 2009, 30(10): 131-134. QIU T T, WANG H, MAO S H. Study on determination and extraction of total polyphenols from leaves of Punica granatum L.[J]. Food Science, 2009, 30(10): 131-134. |
| [31] |
黄素华, 邱丰艳, 戴婉妹, 等. 枇杷叶多糖纯化工艺及抗氧化活性研究[J]. 食品工业科技, 2017, 38(5): 205-209. HUANG S H, QIU F Y, DAI W M, et al. Purification process and antioxidant activity of loquat polysaccharide[J]. Science and Technology of Food Industry, 2017, 38(5): 205-209. |
| [32] |
刘玉婷, 李井雷. 多糖体外抗氧化活性研究进展[J]. 食品研究与开发, 2019, 40(6): 214-219. LIU Y T, LI J L. Advances in research on Antioxidant activity of polysaccharides in vitro[J]. Food Research and Development, 2019, 40(6): 214-219. |
| [33] |
GUO Y J, DENG G F, XU X R, et al. Antioxidant capacities, phenolic compounds and polysaccharide contents of 49 edible macro-fungi[J]. Food & Function, 2012, 3(11): 1195-1205. |
| [34] |
高静. 天然抗氧化剂及其协同作用[J]. 食品安全质量检测学报, 2020, 11(6): 1859-1864. GAO J. Natural antioxidants and synergistic effects[J]. Journal of Food Safety and Quality, 2020, 11(6): 1859-1864. |
| [35] |
朱春晓. 太平洋侧花海葵多糖营养成分分析及多糖提取分离[D]. 青岛: 中国海洋大学, 2011. ZHU C X. Studies on the nutritional components extraction, isolution, structure of polysaccharides from Anthopleura nirescens (Verrill)[D]. Qingdao: Ocean University of China, 2011. |
| [36] |
崔明晓, 王晓晨, 王玉, 等. 超声辅助提取大石花菜多糖及其抗氧化研究[J]. 上海海洋大学学报, 2018, 27(5): 797-804. CUI M X, WANG X C, WANG Y, et al. Ultrasonic-assisted extraction and anti-oxidation of polysaccharides from Gelidium pacifium Okam[J]. Journal of Shanghai Ocean University, 2018, 27(5): 797-804. |
| [37] |
邬军文. 中华仙影海葵多糖的分离及抗炎活性[D]. 上海: 上海海洋大学, 2018. WU J W. Isolation and anti-inflammatory activities of polysaccharide from Cereus sinensis[D]. Shanghai: Shanghai Ocean University, 2018. |
| [38] |
ZHANG X R, QI C H, GUO Y, et al. Toll-like receptor 4-related immunostimulatory polysaccharides: Primary structure, activity relationships, and possible interaction models[J]. Carbohydrate Polymers, 2016, 149: 186-206. |
| [39] |
王倩文, 程春露, 秦霞, 等. 羊栖菜多糖生物活性及其构效关系研究进展[J]. 广东化工, 2021, 48(9): 164-165. WANG Q W, CHENG C L, QIN X, et al. Progress in bioactivity and structure-activity relationship of Sargassum fusiforme polysaccharides[J]. Guangdong Chemical Industry, 2021, 48(9): 164-165. |
| [40] |
邢爽, 方颂平, 姚洪礼, 等. 基于中药、菌菇及茶多糖的研究进展[J]. 北方园艺, 2020(18): 144-151. XING S, FANG S P, YAO H L, et al. Research progress on polysaccharides from Chinese herbs, mushroom and tea[J]. Northern Horticulture, 2020(18): 144-151. |
| [41] |
吴丰鹏, 李芹英, 吴彦超, 等. 九蒸九制对黄精多糖单糖组成及其抗氧化性的影响[J]. 食品工业科技, 2021, 42(2): 42-46. WU F P, LI Q Y, WU Y C, et al. Effects of nine-steam-nine-bask on the monosaccharide composition and antioxidant activities of Polygonatum sibiricum polysaccharide[J]. Science and Technology of Food Industry, 2021, 42(2): 42-46. |
2. Shanghai Aquatic Products Processing and Storage Engineering Technology Research Center, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


