2. 上海海洋大学 农业农村部淡水水产种质资源重点实验室, 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
浙江青田“稻鱼共生系统”延续了1 300余年,2005年被联合国粮农组织(FAO)认定为首批5个全球重要农业文化遗产(Globally Important Agricultural Heritage System, GIAHS)保护项目之一。FAO开启GIAHS项目,旨在发掘、保护、利用和传承世界范围内有重要意义的包括农业物种资源与生物多样性等在内的传统农业系统,以满足当地经济与文化发展的需要[1]。浙江青田稻鱼共生系统中的鲤和水稻共同生活于稻田浅水环境,这两类物种的正相互作用维持了稻鱼共生系统的可持续性[2]。青田田鱼(Cyprinus carpio var qingtianensis)作为青田稻鱼共生系统中重要养殖品种,是一种极具特色的稻田养殖鲤鱼,因其长期生活于稻田之中,人们习惯称之为“田鱼”,其抗应激能力强,营养丰富,肉质鲜美,鳞片可食,体色鲜艳[3-6]。经长期的自然选择及人工驯化,青田田鱼已完全适应稻田环境,适合稻田养殖,但因当地农民长期自繁自养或随意引入外来鲤品种混养,导致田鱼优良性状有一定的退化,田鱼的种质资源遭受破坏[7]。
鱼类雌核发育技术是鱼类遗传育种最为有效的技术之一,用遗传物质失活的精子刺激成熟卵子发育,通过人工诱导染色体加倍得到子代[8]。人工诱导雌核发育可快速建立纯系,培育良种,也为鱼类性别决定机制的研究提供极佳材料。目前,人工诱导鱼类雌核发育技术广泛应用于鱼类育种,如草鱼(Ctenopharyngodon idella)[9]、鲫(Carassius auratus auratus)[10]、鲤(Cyprinus carpio)[11]、罗非鱼(Oreochroms mossambcus)[12]、泥鳅(Misgurnus anguillicaudatus)[13]和虹鳟(Oncorhynchus mykiss)[14]等。由于精子遗传物质失活的失败率高,对于雌核子代的鉴定至关重要,利用分子标记技术探索亲本与子代的关系,可有效鉴别雌核发育子代[14-15]。SNP又称“单核苷酸多态性”,属于第三代分子标记技术,广泛应用于亲缘关系鉴定[16]、品种鉴定[17]、遗传多样性分析[15]、遗传图谱构建[18]等领域。
本研究利用灭活的田鱼精子诱导田鱼卵子发育,通过冷休克促使染色体加倍获得雌核发育子代,对雌核发育子代形态特征及性腺发育进行研究,利用SNP标记技术对雌核发育子代进行遗传鉴定及分析。研究结果将极大缩短田鱼选育时间,降低选育成本,建立田鱼纯系,为田鱼优良种质资源保护和开发利用奠定坚实基础[19]。
1 材料与方法 1.1 实验材料和亲鱼催产2020年5月,在浙江省青田县愚公生态农场挑选出年龄、大小一致的田鱼作为亲本,在该农场开展田鱼的人工繁殖,所用催产药物为促黄体素释放激素类似物(LRH-A2)和绒毛膜促性腺激素(HCG), 雌鱼注射量为(LRH-A2 8 μg +HCG 1 000单位)/kg,雄鱼注射量减半[20]。雌核发育实验时,2尾红色雌性田鱼(M1, M2)卵子,与1尾青灰色雄性田鱼(D1)灭活精子“受精”,获得雌核发育鱼G1;普通对照实验时,1尾红色田鱼(♀)与1尾青灰色田鱼(♂)交配繁殖,获得普通实验鱼F1。实验组与普通组均在同等条件下进行催产、孵化和养殖。
1.2 雌核发育子代制备精子灭活:用Hank’s液以体积比4∶1稀释精液,将其均匀涂在预冷培养皿上,保证精液厚度不超过1 mm,用180 W紫外灯照射灭活精子,灯管与精液表面垂直距离为25 cm,照射时间为90 s,照射过程中培养皿放置于摇床上以110 r/min缓慢摇动,精子灭活全程遮光,灭活精液保存于4 ℃冰箱备用[21]。
染色体加倍:灭活精液与卵子“受精”3 min后,放入0~4 ℃冰水混合物中对卵子进行冷休克处理30 min,抑制卵子第二极体排出使染色体加倍[22],之后将卵子置于25 ℃的水中孵化,每隔3 h换1次水,直至鱼苗孵出。随机选取160日龄G1鱼苗10尾,用丁香酚麻醉,使用预先加入ACD抗凝剂的无菌注射器,采用尾静脉抽血的方法,抽取10尾G1静脉抽血0.5 mL,注入1.5 mL无菌EP于-80 ℃冰箱保存备用。
1.3 形态特征测量和统计对160日龄的G1和F1统计体色,各随机抽取60尾用游标卡尺(精确度0.01 cm)及电子天平(精确度0.1 g)测量体长和体质量。用Image J软件[23]对全长、体高、头长、尾柄高和尾柄长进行测量。
参考唐晓阳[24]的方法,比较全长/体长、全长/头长、全长/体高、全长/尾柄长、体高/尾柄高和尾柄长/尾柄高。计算相关数据的均值(mean)、标准差(standard deviation, SD)、标准误差(standard error of mean, SEM)及变异系数(coefficient of variation, CV),其中CV(%)=SD/Means×100。Excel分析数据,SPSS软件进行非参数检验(Kruskal-Wallis)等分析,P<0.05表示差异显著,P<0.01表示差异极显著。
1.4 性腺组织学切片观察对160日龄的G1和F1随机选取15尾,用丁香酚麻醉,解剖取出性腺,肉眼观察之后,剪刀剪取0.3 cm3的性腺组织块,水冲洗后保存于Bouin氏液24 h。依据WANG等[25]的方法进行组织切片,包括乙醇梯度脱水、二甲苯透明、石蜡包埋、苏木精-伊红(H.E)染色、中性树胶封片等步骤。切片厚度为6~8 μm。在Axio Scope.A1光学显微镜下观察、拍照和记录。性腺分期参照刘筠[26]的划分标准。
1.5 SNP变异位点分析 1.5.1 DNA提取利用动物基因组DNA快速提取试剂盒(上海生工),提取亲本和G1样本血液的DNA,操作依照试剂盒说明书,紫外分光光度计检测DNA浓度,利用1%琼脂糖凝胶电泳检测DNA质量,-20 ℃冰箱保存[27]。
1.5.2 高通量测序和数据处理由武汉希望组生物科技有限公司对样本采用Illumina Hiseq技术进行基因组重测序。根据鲤鱼参考基因组1.53 Gb (NCBI GenBank project accession PRJNA202478), 青田田鱼雌核发育中的亲本(M1、M2、D1)基因组重测序深度为30×,雌核发育子代基因组重测序深度为10×。原始数据(Raw Reads)经fastp软件[28]处理,得到高质量的Clean Reads,利用BWA软件[29]将Clean Reads比对到参考基因组上,比对结果经GATK Mark Duplicates[30]去除重复。
1.5.3 遗传鉴定样本与参考基因组进行比对之后, 采用GATK Haplotype Caller[30]检测SNP,过滤参数设置为MAF (Minor allele frequency) > 0.05,检出率> 80%。统计样本检测到的SNP,然后进行遗传纯度比较及SNP同源性分析。比较每个子代的SNP位点与可能的亲本SNP位点的百分比,判断子代来自于哪个亲本。将母本M1和M2共有SNP纯合位点去除之后,计算子代与母本共享的SNP纯合位点的百分比,确定子代的母本来源。雌核发育的子代,如果因紫外线照射精子灭活不彻底,可能有父母本交配子代混入其中。因此,通过去除双亲(M1、M2、D1)共有SNP纯合位点后,计算子代与父本D1共享的SNP纯合位点的百分比,确定子代的父本来源。
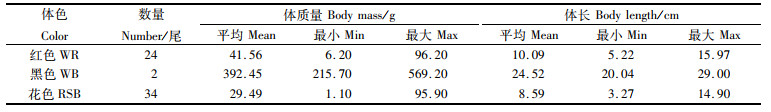
2 结果与分析 2.1 形态特征观察实验获得的田鱼G1发现有3种体色:黑色(whole black,WB)、红色(whole red,WR)和红色体表参杂少许黑斑的小花色(whole red with small black spots,RSB),见图版Ⅰ。G1中选取的60尾,包括WR 24尾,WB 2尾,RSB 34尾。体长和体质量,WB>WR>RSB;WB平均体质量为392.45 g,最大为569.20 g,平均体长为24.52 cm,最大为29.00 cm;WR平均体质量为41.56 g,最大体质量为96.20 g;而RSB平均体质量为29.49 g, 最大体质量为95.90 g。WR和RSB两种体色最大个体体长不超过16 cm。WB体型显著大于WR和RSB,生长速度明显较快,表明田鱼具有较强的生长潜力(表 1)。

|
1.黑色G1;2, 4, 6.不同大小的红色G1;3, 5.不同大小的花色G1。 1. Black G1; 2, 4 and 6.Red G1 with different sizes; 3 and 5.Red with small black spots. 图版 Ⅰ 青田田鱼雌核发育子代形态观察 Plate Ⅰ Morphology of gynogenetic offspring of paddy field carp |
|
表 1 雌核发育子代160日龄生长性状描述性统计 Tab.1 Descriptive statistics of 160 days growth traits in the gynogenetic offspring |
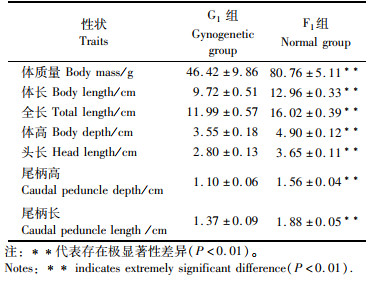
田鱼G1与F1在生长性状方面存在极显著性差异(P<0.01),在体质量、体长、全长等生长指标方面,F1均显著大于G1(表 2),说明雌核发育技术在制备G1的过程中冷休克处理在一定程度上影响了G1的早期生长。
|
表 2 雌核组G1与普通组F1的160日龄生长性状描述性统计 Tab.2 Descriptive statistics of 160 days growth traits in gynogenetic individuals and normal individuals |
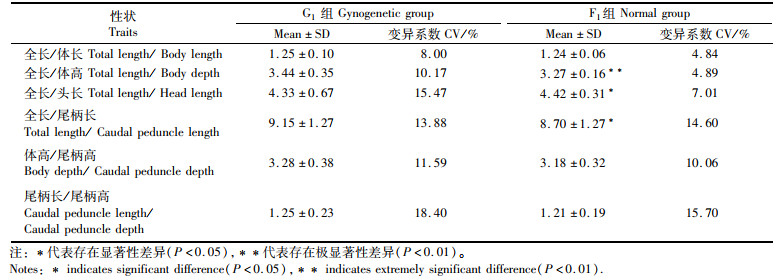
田鱼G1与F1的形态特征统计:两者的全长/体长、尾柄长/尾柄高、体高/尾柄高无显著性差异;全长/头长和全长/尾柄长存在显著性差异(P<0.05);全长/体高存在极显著性差异(P<0.01)。G1的全长/体长、全长/头长等变异系数为8.00%~18.40%。除全长/尾柄长之外,其余特征的变异系数均大于普通群体,绝大多数变异系数超过10%,这说明G1经过1次遗传物质纯化,表征在形态上与F1存在一定差异(表 3)。
|
表 3 雌核组G1与普通组F1形态参数和变异系数 Tab.3 Morphological traits and coefficient of variation in gynogenetic individuals and normal individuals |
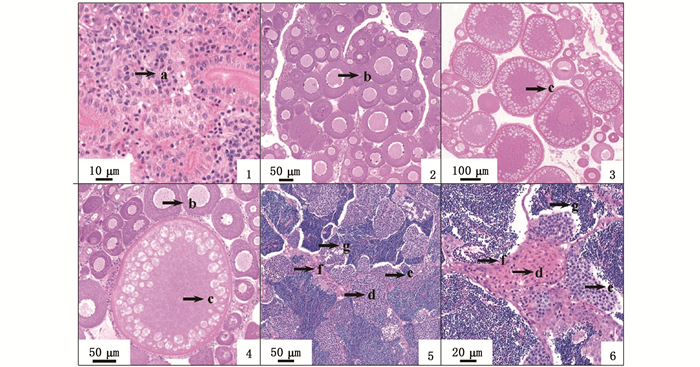
从160日龄田鱼G1中随机选取15尾,经测量,平均体长为12.11 cm, 平均体质量为104.50 g,最大个体体质量为568.60 g,最小个体体质量为6.80 g,用手挤压后均无精液流出,解剖后,肉眼观察到性腺粉红色,经过性腺组织学切片观察,15尾G1样本全部为雌性。不同大小G1样本的性腺发育程度不一样,小体型样本的卵巢处于Ⅰ期,生殖细胞基本为卵原细胞,呈细胞团结构(图版Ⅱ-1)。大多数中等大小样本的卵巢处于Ⅱ期,正逐步向Ⅲ期过度,生殖细胞大多数为Ⅱ时相初级卵母细胞,进入小生长阶段,出现卵黄核及滤泡细胞,少数为Ⅲ时相初级卵母细胞(图版Ⅱ-2)。大体型样本的卵巢处于Ⅲ期,生殖细胞多数为Ⅲ时相初级卵母细胞,仅有少数Ⅱ时相初级卵母细胞,卵巢进入大生长阶段,滤泡细胞数量明显增加,开始出现卵黄粒,正逐渐向Ⅳ期过度[31],进入繁殖期(图版Ⅱ-3)。
|
1~3均为田鱼G1卵巢结构; 4为田鱼F1卵巢结构; 5~6为田鱼F1精巢结构;a.Ⅰ时相卵母细胞; b.Ⅱ时相卵母细胞; c.Ⅲ时相卵母细胞; d.精原细胞; e.精母细胞; f.精子细胞; g.精子。 From 1 to 3 represent the ovary of G1; The picture 4 represents the ovary of F1; The pictures 5 and 6 represent the testis of F1; a.primary oocytes in stage Ⅰ; b.primary oocytes in stage Ⅱ; c.primary oocytes in stage Ⅲ; d. spermatogonia; e.spermatocytes; f. spermatids; g. sperms. 图版 Ⅱ 田鱼雌核发育G1及普通繁殖F1性腺发育情况 Plate Ⅱ Gonadal development of gynogenetic offsprings(G1)and normal offspring (F1) of Qingtian paddy field carp |
从160日龄田鱼F1中随机挑选15尾,平均体长14.47 cm,平均体质量103.20 g,最大个体体质量为193.70 g,最小个体体质量为49.00 g。其中有2尾可以直接挤出精液,解剖后肉眼观察到乳白色的精巢和粉红色的卵巢,性腺组织学切片观察发现样本中包含有5尾雄鱼。卵巢基本处于Ⅱ期至Ⅲ期的过渡阶段,生殖细胞既有Ⅱ时相卵母细胞,也有Ⅲ时相卵母细胞(图版Ⅱ-4),精巢处于Ⅴ期阶段,性腺中布满成熟精子,有部分精子细胞、精母细胞以及少数精原细胞(图版Ⅱ-5, 6),表明田鱼雄性个体已经发育成熟[32]。
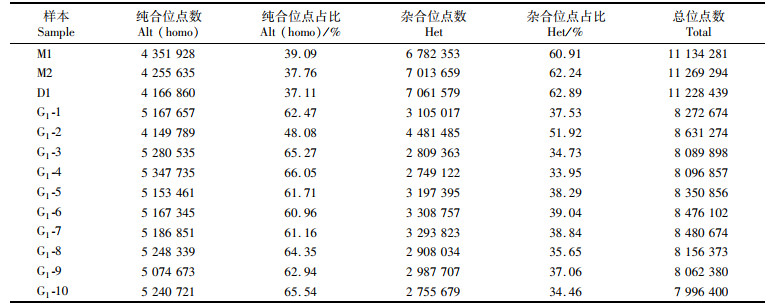
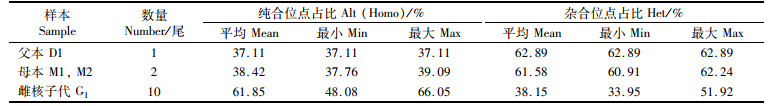
2.3 SNP位点分析随机选取10尾G1样本,及其母本M1、M2和父本D1,进行基因组测序,3尾父母本高质量的基因组数据为38.8~42.5 Gb, 10尾G1高质量的基因组数据为11.7~14.1 Gb。通过SNP检测,与参考基因组比较发现: 母本M1的纯合位点数为39.09%,杂合位点数为60.91%;母本M2的纯合位点数为37.76%,杂合位点数为62.24%;父本D1的纯合位点数为37.11%,杂合位点数为62.89%。父母本的杂合位点数目明显高于纯合位点数,亲本杂合度较高(表 4)。G1平均纯合位点数为61.85%,平均杂合位点数为38.15%,这说明通过1次雌核发育技术处理,大幅度提高了田鱼G1的遗传纯合位点比例(表 5)。
|
表 4 SNP位点数目统计 Tab.4 Statistics of SNP |
|
表 5 SNP位点描述性统计 Tab.5 Descriptive statistics of SNP |
亲本(M1、M2)的SNP平均纯合位点数为38.42%,平均杂合位点数为61.58%, 而G1的SNP平均纯合位点数为61.85%,平均杂合位点数为38.15%。G1的SNP纯合位点数极为显著地高于亲本(P<0.01),而杂合位点数极为显著地低于亲本(P<0.01),表明雌核发育技术极为显著地提高了田鱼G1的基因纯度(图 1)。

|
**代表极显著性差异(P<0.01)。 **indicates extremely significant difference (P < 0.01). 图 1 亲本与雌核发育子代的SNP纯合位点及杂合位点统计 Fig. 1 Alt (homo) and het of parents and gynogenetic offspring |
除去亲本之间共有SNP纯合突变位点后,统计G1样本与亲本一致的SNP纯合突变位点数(表 6),G1-1、5、6、7、9、10样本与母本M2的相同SNP纯合位点数为18.42%~19.49%, 而与母本M1相同SNP纯合位点数不超过6%,说明这些G1样本的母系物质来自母本M2。G1-3、4、8样本与母本M1的相同SNP纯合位点数为19.27%~19.45%,而与母本M2相同SNP纯合位点数不超过6%,说明这些G1样本的母系物质来自母本M1。上述G1样本与父本D1相同SNP纯合位点数不超过4%,表明父本没有为G1样本贡献遗传物质。值得注意的是,G1-2与亲本M1、M2、D1的相同SNP纯合位点数分别为10.65%、10.52%、5.82%。G1-2与M1或M2的相同SNP纯合位点数远大于D1,但与G1其他样本比较,G1-2与D1的SNP一致纯合突变位点数偏高,可能是由于G1-2遗传物质中渗入了少量的D1遗传物质,这一现象也在其他雌核发育鱼中发现[33],总体上降低了与母本的一致SNP纯合位点比例。

|
表 6 雌核子代SNP纯合突变位点统计 Tab.6 Statistics of SNP homozygous sites in the gynogenetic offsprings |
对青田田鱼采用人工诱导雌核发育技术,成功得到田鱼雌核发育子一代。此次雌核发育母本体色为红色,但G1出现3种体色,这可能是由于雌核发育导致基因座位纯化,从而产生性状分离[15],也可能是由于微量父本染色体进入子代胚胎所致[34]。雌核发育操作对胚胎造成了一定程度的损伤[20],导致G1平均生长速度明显慢于普通F1,而G1群体生长速度两极化:部分个体生长迅速,极为显著地超过普通F1;部分个体生长慢,出苗1个月后几乎停止生长。G1与F1的形态特征参数存在极显著性差异,说明G1在形体上有所变化。赵海涛等[23]比较分析牙鲆雌核发育群体、养殖群体和野生群体的形态差异,发现38个形态学指标存在显著差异。翘嘴鲌雌核发育群体与普通群体之间亦存在形态差异[35]。经济鱼类通常携带有隐性有害基因,且以杂合态存在,正常养殖过程中不会显现,雌核发育技术将基因座纯合化后有害基因关联的性状便表现出来,由此淘汰携带有害基因的个体,筛选优良隐性基因的个体,有利于优良品种的培育。G1表现出的体色和生长分化,表明其具有很大潜在的优良养殖性状选育价值[36]。G1和F1的性腺组织学切片结果表明,G1样本全部为雌性个体,没有发现雄性个体,性腺能够进行正常发育。G1与F1的卵巢早期发育阶段差异不大,160日龄的卵巢中没有Ⅳ时相卵母细胞,为Ⅱ时相向Ⅲ时相过度,Ⅲ时相卵母细胞中有卵黄出现。F1部分样本的精巢完全发育成熟。
采用SNP分型技术,在全基因组水平上根据SNP纯合位点数比例,对G1样本遗传物质来源进行鉴定和分析,发现G1样本的SNP纯合位点数比例得到快速提高,极为显著地高于其亲本,而杂合位点数比例显著地低于亲本,说明雌核发育技术有助于田鱼纯系培育。通过SNP纯合突变位点数百分比的高低,判断G1是否混入了双亲交配产生的子代。G1与其来源母本的共有纯合SNP的百分比,高达18.42%~19.49% (G1-2除外),而与其非来源母本的共有纯合SNP的百分比,仅为5.35%~5.98%(G1-2除外)。依据G1纯合SNP偏向亲本比例的大小,表明G1遗传物质为母本来源。推测田鱼的性别决定方式为XX/XY型[37]。雌核子代与其非亲母本的共有纯合SNP的百分比,不超过6%,以此为子代与亲本亲缘关系的判定阈值,从G1与其可能父本D1的共有纯合SNP的百分比不超过4%(G1-2除外)来看,可判断G1与父本D1无亲缘关系,故而排除G1由双亲交配产生的可能性。例外的是,G1-2样本,较其他G1样本而言,与母本的一致SNP纯合位点数比例偏低,与可能父本D1的一致SNP纯合位点比例偏高,达5.82%,但小于6%,很可能因为其基因组中混入了少量父系遗传物质,这种现象常见于人工雌核发育鱼[38]。这可能是因为父系遗传物质的渗入,降低了子代与母本一致SNP纯合位点数,引起母本偏向性不明显,但可导致体色和生长方面明显差异,需进一步深入研究。本研究成功得到了田鱼人工雌核发育群体,为今后的田鱼育种及种质资源开发奠定了良好的基础。
| [1] |
XIE J, HU L L, TANG J J, et al. Ecological mechanisms underlying the sustainability of the agricultural heritage rice-fish coculture system[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(50): E1381-E1387. |
| [2] |
HU L L, ZHANG J, REN W Z, et al. Can the co-cultivation of rice and fish help sustain rice production?[J]. Scientific Reports, 2016, 6: 28728. DOI:10.1038/srep28728 |
| [3] |
REN W Z, HU L L, GUO L, et al. Preservation of the genetic diversity of a local common carp in the agricultural heritage rice-fish system[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(3): E546-E554. |
| [4] |
齐明, 侯懿玲, 刘韬, 等. 急性低氧胁迫和复氧恢复对青田田鱼幼鱼氧化应激和能量代谢的影响[J]. 淡水渔业, 2020, 50(6): 92-98. QI M, HOU Y L, LIU T, et al. The effects of acute hypoxia stress and re-oxygenation on oxidative stress and energy metabolism of juvenile Cyprinus carpio var qingtianensis[J]. Freshwater Fisheries, 2020, 50(6): 92-98. DOI:10.3969/j.issn.1000-6907.2020.06.013 |
| [5] |
胡文静, 苏超群, 刘韬, 等. 青田田鱼和金华田鱼肌肉营养成分的比较[J]. 上海海洋大学学报, 2020, 29(4): 552-558. HU W J, SU C Q, LIU T, et al. Analysis of muscle nutrient composition of Cyprinus carpio var. color in Qingtian and Jinhua[J]. Journal of Shanghai Ocean University, 2020, 29(4): 552-558. |
| [6] |
龚小玲, 岳丽佳, 王米雪, 等. 软、硬鳞瓯江彩鲤鳞片生化成分比较[J]. 上海海洋大学学报, 2014, 23(5): 663-668. GONG X L, YUE L J, WANG M X, et al. Comparison of biochemical compositions in the soft scale and the hard scale of the Oujiang color common carp (Cyprinus carpio var. color)[J]. Journal of Shanghai Ocean University, 2014, 23(5): 663-668. |
| [7] |
郭梁, 任伟征, 胡亮亮, 等. 传统稻鱼系统中"田鲤鱼"的形态特征[J]. 应用生态学报, 2017, 28(2): 665-672. GUO L, REN W Z, HU L L, et al. Morphological traits of indigenous field carps maintained in traditional rice-based farming systems[J]. Chinese Journal of Applied Ecology, 2017, 28(2): 665-672. |
| [8] |
徐康, 段巍, 肖军, 等. 鱼类遗传育种中生物学方法的应用及研究进展[J]. 中国科学: 生命科学, 2015, 58(12): 1272-1288. XU K, DUAN W, XIAO J, et al. Development and application of biological technologies in fish genetic breeding[J]. Science China Life Sciences, 2015, 58(2): 187-201. |
| [9] |
MAO Z W, FU Y Q, WANG S, et al. Further evidence for paternal DNA transmission in gynogenetic grass carp[J]. Science China Life Sciences, 2020, 63(9): 1287-1296. DOI:10.1007/s11427-020-1698-x |
| [10] |
董传举, 李学军, 孙效文. 我国鲫种群遗传多样性及起源进化研究进展[J]. 水产学报, 2020, 44(6): 1046-1062. DONG C J, LI X J, SUN X W. Research progress of the genetic diversity, origin and evolution of Carassius auratus in China[J]. Journal of Fisheries of China, 2020, 44(6): 1046-1062. |
| [11] |
梁拥军, 孙向军, 史东杰, 等. 用团头鲂精子诱导红白锦鲤雌核发育研究[J]. 安徽农业科学, 2010, 38(29): 16262-16265, 16270. LIANG Y J, SUN X J, SHI D J, et al. Induction of gynogenesis in Cyprinus carpio. L by heterologous sperms of Megalobrama amblycephala[J]. Journal of Anhui Agricultural Sciences, 2010, 38(29): 16262-16265, 16270. DOI:10.3969/j.issn.0517-6611.2010.29.076 |
| [12] |
肖俊, 甘西, 罗永巨. 罗非鱼育种研究进展[J]. 湖南科技大学学报(自然科学版), 2014, 29(1): 106-112. XIAO J, GAN X, LUO Y J. The progress of tilapia breeding[J]. Journal of Hunan University of Science & Technology (Natural Science Edition), 2014, 29(1): 106-112. |
| [13] |
MORISHIMA K, YOSHIKAWA H, ARAI K. Meiotic hybridogenesis in triploid Misgurnus loach derived from a clonal lineage[J]. Heredity, 2008, 100(6): 581-586. DOI:10.1038/hdy.2008.17 |
| [14] |
VALE L, DIEGUEZ R, SÁNCHEZ L, et al. A sex-associated sequence identified by RAPD screening in gynogenetic individuals of turbot (Scophthalmus maximus)[J]. Molecular Biology Reports, 2014, 41(3): 1501-1509. DOI:10.1007/s11033-013-2995-3 |
| [15] |
OCALEWICZ K, GURGUL A, POLONIS M, et al. Preliminary identification of candidate genes related to survival of gynogenetic rainbow trout (Oncorhynchus mykiss) based on comparative transcriptome analysis[J]. Animals, 2020, 10(8): 1326. DOI:10.3390/ani10081326 |
| [16] |
刘峻宇, 刘均辉, 孔杰, 等. 凡纳滨对虾SNP标记开发与家系亲缘关系验证分析[J]. 渔业科学进展, 2021, 42(1): 108-116. LIU J Y, LIU J H, KONG J, et al. Development of SNP markers and verification analysis of relationship on family in Litopenaeus vannamei[J]. Progress in Fishery Sciences, 2021, 42(1): 108-116. |
| [17] |
刘加林, 贾永义, 刘士力, 等. 太湖鲂鲌F2代GH基因结构、系统发育和表达特征[J]. 海洋与湖沼, 2020, 51(6): 1440-1451. LIU J L, JIA Y Y, LIU S L, et al. Structure, phylogeny and tissue distribution of GH in Culter alburnu♀×Megalobrama terminalis♂[J]. Oceanologia et Limnologia Sinica, 2020, 51(6): 1440-1451. |
| [18] |
JAAFAR R, ÅDEGØRD J, MATHIESSEN H, et al. Quantitative trait loci (QTL) associated with resistance of rainbow trout Oncorhynchus mykiss against the parasitic ciliate Ichthyophthirius multifiliis[J]. Journal of Fish Diseases, 2020, 43(12): 1591-1602. DOI:10.1111/jfd.13264 |
| [19] |
LUO K K, XIAO J, LIU S J, et al. Massive production of all-female diploids and triploids in the crucian carp[J]. International Journal of Biological Sciences, 2011, 7(4): 487-495. DOI:10.7150/ijbs.7.487 |
| [20] |
李兰兰, 肖伟, 邢露梅, 等. 雌核发育兰州鲇胚胎发育和形态特征的研究[J]. 中国细胞生物学学报, 2020, 42(5): 820-828. LI L L, XIAO W, XING L M, et al. Study on morphological characteristics and embryonic development of the gynogenesis Silurus lanzhouensis[J]. Chinese Journal of Cell Biology, 2020, 42(5): 820-828. |
| [21] |
陶敏, 宋祯彦, 肖军, 等. 翘嘴红鲌(Erythroculteri lishaeformis)精子诱导的雌核发育团头鲂(Megalobrama amblycephala)细胞及其分子遗传学分析[J]. 动物学研究, 2013, 34(5): 479-486. TAO M, SONG Z Y, XIAO J, et al. Cytogenetic and molecular genetic analysis of gynogenesis in Megalobrama amblycephala using spermatozoa of Erythroculter ilishaeformis[J]. Zoological Research, 2013, 34(5): 479-486. |
| [22] |
李停, 贾永义, 刘士力, 等. 二次正交旋转组合设计优化人工诱导翘嘴鲌雌核发育[J]. 中国水产科学, 2016, 23(1): 77-89. LI T, JIA Y Y, LIU S L, et al. Optimizing conditions to induce artificial gynogenesis in Culter alburnus using a quadratic orthogonal rotation design[J]. Journal of Fishery Sciences of China, 2016, 23(1): 77-89. |
| [23] |
赵海涛, 范宁宁, 万玉美, 等. 雌核发育、野生及养殖牙鲆形态差异分析[J]. 河北渔业, 2019(11): 1-7, 27. ZHAO H T, FAN N N, WAN Y M, et al. Analysis on morphological variations of gynogenesis, wild and cultured Paralichthys olivaceus[J]. Hebei Fisheries, 2019(11): 1-7, 27. DOI:10.3969/j.issn.1004-6755.2019.11.001 |
| [24] |
唐晓阳. 克隆牙鲆形态、遗传特性以及温度对杂合克隆牙鲆生长发育影响的研究[D]. 上海: 上海海洋大学, 2014. TANG X Y. Morphologic and genetic characteristics of clones and temperature influence on growth and development of heterozygous clones of Japanese flounder (Paralichthys olivaceus)[D]. Shanghai: Shanghai Ocean University, 2014. |
| [25] |
WANG J, LIU S J, XIAO J, et al. Evidence for the evolutionary origin of goldfish derived from the distant crossing of red crucian carp×common carp[J]. BMC Genetics, 2014, 15(1): 33. DOI:10.1186/1471-2156-15-33 |
| [26] |
刘筠. 中国养殖鱼类繁殖生理学[M]. 北京: 中国农业出版社, 1993: 22-30. LIU Y. Reproductive physiology of cultural fish in China[M]. Beijing: China Agriculture Press, 1993: 22-30. |
| [27] |
JEFFRIES D L, COPP G H, HANDLEY L L, et al. Comparing RAD seq and microsatellites to infer complex phylogeographic patterns, an empirical perspective in the Crucian carp, Carassius carassius L.[J]. Molecular Ecology, 2016, 25(13): 2997-3018. DOI:10.1111/mec.13613 |
| [28] |
CHEN S F, ZHOU Y Q, CHEN Y R, et al. fastp: an ultra-fast all-in-one FASTQ preprocessor[J]. Bioinformatics, 2018, 34(17): i884-i890. DOI:10.1093/bioinformatics/bty560 |
| [29] |
LI H. Aligning sequence reads, clone sequences and assembly contigs with BWA-MEM[J/OL]. arXiv preprint arXiv, 2013, 13(3): 3997-3999. [2013-05-26]. https://arxiv.org/abs/1303.3997v1.
|
| [30] |
MCKENNA A, HANNA M, BANKS E, et al. The genome analysis toolkit: a MapReduce framework for analyzing next-generation DNA sequencing data[J]. Genome Research, 2010, 20(9): 1297-1303. DOI:10.1101/gr.107524.110 |
| [31] |
ZHOU R, SHANG R J, GONG D B, et al. Characterization of H3 methylation in regulating oocyte development in cyprinid fish[J]. Science China Life Sciences, 2019, 62(6): 829-837. DOI:10.1007/s11427-018-9346-6 |
| [32] |
陈松, 王静, 刘少军, 等. 改良三倍体鲫鱼的生物学特性研究[J]. 中国科学C辑: 生命科学, 2009, 52(5): 479-484. CHEN S, WANG J, LIU S J, et al. Biological characteristics of an improved triploid crucian carp[J]. Science in China Series C: Life Sciences, 2009, 52(8): 733-738. |
| [33] |
LIMBORG M T, WAPLES R K, ALLENDORF F W, et al. Linkage mapping reveals strong chiasma interference in Sockeye Salmon: implications for interpreting genomic data[J]. G3-Genes|Genomes|Genetics, 2015, 5(11): 2463-2473. |
| [34] |
URIBE M C, GRIER H J, DE LA ROSA-CRUZ G, et al. The occurrence of spermatozoa in the ovary of the gynogenetic viviparous teleost Poecilia formosa (POECILⅡDAE)[J]. Journal of Morphology, 2016, 277(3): 341-350. DOI:10.1002/jmor.20499 |
| [35] |
刘月亮, 贾永义, 蒋文枰, 等. 雌核发育翘嘴鲌胚胎发育和形态特征的研究[J]. 上海海洋大学学报, 2017, 26(2): 203-211. LIU Y L, JIA Y Y, JIANG W P, et al. Study on morphological characteristics and embryonic development of the gynogenesis top mouth culter (Culter alburnus)[J]. Journal of Shanghai Ocean University, 2017, 26(2): 203-211. |
| [36] |
SHAO G M, LI X Y, WANG Y, et al. Whole genome incorporation and epigenetic stability in a newly synthetic allopolyploid of gynogenetic gibel carp[J]. Genome Biology and Evolution, 2018, 10(9): 2394-2407. |
| [37] |
MEI J, GUI J F. Genetic basis and biotechnological manipulation of sexual dimorphism and sex determination in fish[J]. Science China Life Sciences, 2015, 58(2): 124-136. |
| [38] |
ZHENG X H, LU C Y, ZHAO Y Y, et al. A set of polymorphic trinucleotide and tetranucleotide microsatellite markers for silver crucian carp (Carassius auratus gibelio) and cross-amplification in crucian carp[J]. Biochemical Genetics, 2010, 48(7/8): 624-635. |
2. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


