2. 上海海洋大学 农业农村部鱼类营养与环境生态研究中心,上海 201306;
3. 上海水产养殖工程技术研究中心,上海 201306;
4. 东莞市生态环保研究院有限公司,广东 东莞 523000;
5. 东莞松山湖高新技术产业开发区水务工程建设运营中心,广东 东莞 523000
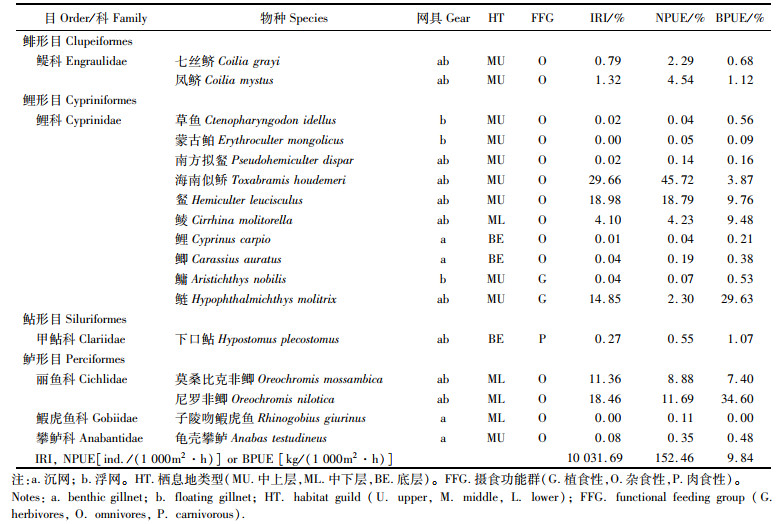
 (IRI占比29.66%)、
(IRI占比29.66%)、 (18.98%)、尼罗非鲫(18.46%)、鲢(14.85%)和莫桑比克非鲫(11.36%),其中单位捕捞努力量渔获数量(NPUE)以海南似
(18.98%)、尼罗非鲫(18.46%)、鲢(14.85%)和莫桑比克非鲫(11.36%),其中单位捕捞努力量渔获数量(NPUE)以海南似 (45.72%)占优、单位捕捞努力量渔获质量(BPUE)以尼罗非鲫(34.60%)为主。聚类分析表明,鱼类物种组成在季节间无显著差异,物种数、NPUE和BPUE亦无季节变化。鱼类群落物种数、NPUE和BPUE沉浮网间无显著差异,但鱼类数量组成沉浮网间存在极显著差异(P < 0.001),与海南似
(45.72%)占优、单位捕捞努力量渔获质量(BPUE)以尼罗非鲫(34.60%)为主。聚类分析表明,鱼类物种组成在季节间无显著差异,物种数、NPUE和BPUE亦无季节变化。鱼类群落物种数、NPUE和BPUE沉浮网间无显著差异,但鱼类数量组成沉浮网间存在极显著差异(P < 0.001),与海南似 有关,其NPUE浮网显著高于沉网,其他5种主要鱼类的NPUE沉浮网间无显著差异。透明度、pH和总磷是影响鱼类物种数量时空分布的关键环境因子。研究表明,松木山水库鱼类多样性低,可能与水面积较小、连通性低、外来种入侵及入库河道以人工排渠为主有关,为科学合理评估鱼类数量组成建议水库鱼类调查需要同时使用沉浮网。
有关,其NPUE浮网显著高于沉网,其他5种主要鱼类的NPUE沉浮网间无显著差异。透明度、pH和总磷是影响鱼类物种数量时空分布的关键环境因子。研究表明,松木山水库鱼类多样性低,可能与水面积较小、连通性低、外来种入侵及入库河道以人工排渠为主有关,为科学合理评估鱼类数量组成建议水库鱼类调查需要同时使用沉浮网。中国是全世界水库数量最多的国家,在水污染仍然不容乐观的形势之下,水库成为保障饮用水安全的重要屏障[1]。松木山水库是一座中型水库,位于广东东莞,隶属珠江三角洲的东江流域,兼具供水、防洪、发电、灌溉、渔业和旅游等多重功能。近年来,随着东莞经济的快速发展,水污染已成为东莞可持续发展的制约因素[2]。为了改善区域内水环境质量,东莞市政府实施了东江与水库联网供水水源工程项目,其中松木山水库为东线调水水库[3]。尽管如此,因松木山水库仍存在废水偷排现象,其水生态环境质量仍不容乐观,水体富营养化现象一直存在[4],2019年的调查结果表明,该水库浮游植物密度很高,已经发生蓝藻水华,急需采取有效的防控措施。
鱼类作为水生生物食物网中的高级消费者,在水生态系统的物质循环和能量流动中起着重要作用。鱼类群落结构的合理调控和重建如放养浮游植物食性和肉食性鱼类,可以控制浮游植物、改善水质,从而有助于水生态系统的修复[5-7],但在采用鱼类开展水质调控和生态修复之前需要弄清鱼类的群落结构特征[8]。目前,对东莞范围内东江水系及淡水鱼类区系和鱼类资源开展了一些研究报道[9-10],但松木山水库的鱼类群落结构仍不得而知。笔者对松木山水库的鱼类进行调查,分析松木山水库的鱼类群落结构、多样性及其与环境因子之间的关系,以期为该水库的水生态修复及渔业资源管理提供基础数据和参考依据。
1 材料与方法 1.1 采样地点松木山水库(22°52′44″~22°56′05″N,113°51′37″~113°54′39″E)位于东莞市大朗镇大陂海上游、松山湖高新技术产业园内。水库集雨面积54.2 km2,正常水位为24 m,正常水位库容量为3.97×107 m3,水域面积约8 km2。东莞水务局监测报告显示,2012—2019年松木山水库蓄水量为(0.233±0.057) 亿m3(平均值±标准差),为中型水库。水库地处南亚热带季风气候区,具有气候温和、雨量充沛、日照充足、湿度较大、无霜期长的特点,年均气温约22.6 ℃,年均降雨量约1 831.7 mm。
1.2 采样方法在松木山水库设置S1、S2和S3等3个鱼类采样站点,水深分别为(5.0±1.5) m、(8.4±0.9) m和(9.6±1.0) m。S3站点位于大坝附近,大坝以北不远处有一座漫水坝,北部库区的水经此坝流向大坝,因渔船难以开进北部库区,在此库区未设置站点(图 1)。于2019年5、6、7、9和12月采用多网目刺网在各站点进行鱼类采样,受新冠疫情的影响未能在2020年1—2月开展1次鱼类调查,将5、7、9和12月分别划归春夏秋冬[11]。为了充分反映该水库的鱼类多样性以及尽可能将更多数据参与分析,仅探讨季节(月份)变化的统计分析,未利用2019年6月数据。每个采样站点放置1套漂浮和贴底放置1套底层多网目刺网,每套多网目刺网由12个网目(1.0、1.25、1.6、2.0、2.5、3.1、3.9、4.8、5.8、7.0、8.6和11.0 cm)网片组成,网目大小为1.0~2.5 cm的网片长2.5 m,其他网片长10.0 m,各网片高度均为1.7 m,随机抽取水库采样点周围25处的水面宽度,最窄的水面为166 m,平均水面宽度为(527.08±211.38) m,符合本套网具的使用条件。松木山水库旅游发展得较好,开发了垂钓、游船等水上活动项目,游客和各种闲杂人员较多,为了保障游客等人员的人身安全及科研网具的正常使用,未采用过夜捕捞方法。每次调查于清晨8:00左右放网,2 h后收网[12]。所采集鱼类样本根据《广东淡水鱼类志》[13]进行种类鉴定,同时对体长(0.1 cm)和体质量(0.1 g)等数据进行测量。

|
图 1 松木山水库采样位点分布 Fig. 1 Distribution of sampling stations in Songmushan Reservoir |
在采集鱼类样本的同时,采用便携式多参数水质分析仪(YSI profession plus)现场测定水温(WT)、电导率(SPC)、溶解氧(DO)和溶解性固体总量(TDS);采用塞氏盘(Secchi disk)测定透明度(SD);采用pH仪(pH-902)测定水体pH;采用便携式声呐测深仪(SM-5)测定水深(Depth)。用采水器采集表层和底层水样各5 L,混匀后保留1 000 mL水样带回实验室,用于水体总氮(TN,HJ 636—2012)、总磷(TP,GB 11893—1989)、亚硝酸盐(NO2-N,GB 7493—87)、磷酸盐(PO43--P,GB 3838—2002)、氨氮(NH3-N,HJ 535—2009)、高锰酸盐指数(CODMn,HJ/T 132—2003)和叶绿素a(Chl.a)测定。
1.3 数据统计采用相对重要性指数(IRI)来衡量鱼类群落优势种:
 (1)
(1)
式中: IRI为相对重要性指数;N为某物种尾数占总尾数的相对多度;W为其质量占总质量的相对质量;F为该物种的出现率。将IRI ≥1 000的物种定为优势种[14]。
采用丰度和生物量曲线(abundance biomass comparison method,ABC)评价松木山水库鱼类群落受到的干扰程度,W值作为ABC曲线方法的一个统计量。W的取值为[-1, 1]:当W趋于1时,表明水体未受到干扰;当W趋于-1时,表明水体受到严重干扰;当W在0附近时,表明水体受到中度干扰[15]。
按月份、站点和水层统计鱼类数量和质量,均换算成单位捕捞努力量渔获量(CPUE),即单位捕捞努力量渔获数量[NPUE,ind./(1 000 m2·h)]和单位捕捞努力量渔获质量[BPUE,kg/(1 000 m2·h)][16],以探讨以上参数在沉网和浮网间的差异性。分析前对所有月份数据进行平方根、反正弦和立方根转换,对满足正态分布和方差齐性的数据进行成对样本t检验,否则进行Wilcoxon配对样本非参数检验。对5、7、9、12月采集的且满足正态分布和方差齐性的数据采用单因素方差分析(One-way ANOVA)探讨CPUE在季节间的差异性,否则进行Kruskal-Wallis非参数检验。
利用物种NPUE数据进行聚类分析以探讨鱼类物种组成在季节间的差异。聚类分析方法为组平均聚类法,聚类分析中以d = 1- r(r为皮尔逊相关系数)作为相异性指标,以d=0.3作为划分群落类型的依据[17]。
利用Canoco 4.5软件探讨鱼类物种与环境因子之间的关系,将主要鱼类密度和不包含pH的环境因子数据进行lg (x+1) 转换。首先,对主要鱼类物种密度矩阵进行趋势对应分析(detrended correspondence analysis,DCA),得到排序轴中最大梯度长度为3.3,可以采用冗余分析(redundancy analysis, RDA)。RDA分析中对每个环境变量的重要性及显著性用蒙特卡洛筛选法测试(P < 0.05),以确定对鱼类物种分布具有重要且独立作用的最小变量组合,并用于最终分析。
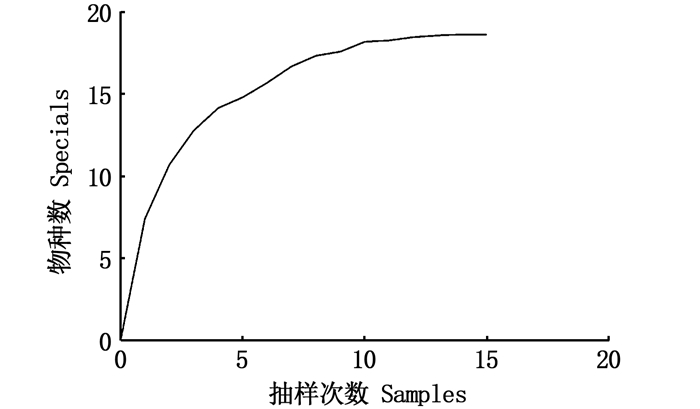
2 结果 2.1 鱼类群落结构特征 2.1.1 物种组成及优势种2019年在松木山水库共捕捞到17种鱼类,累计1 549尾,隶属4目6科(表 1)。其中,鲤形目鱼类物种数居多,有1科10种(58.82%),其次为鲈形目(3科4种,23.53%)和鲱形目(1科2种,11.76%),鲇形目鱼类最少(1科1种,5.88%)。物种累积曲线达到了渐近线水平,且实际调查的物种数达到了期望值(18.6)的91.2%,见图 2。
|
表 1 松木山水库鱼类群落物种组成 Tab.1 Fishes species composition of Songmushan reservoir |
|
图 2 松山湖水库鱼类群落物种累计曲线 Fig. 2 Species accumulation curve of fish community in Songmushan Reservoir |
据栖息水层划分(表 1),中上层鱼类10种(58.82%),中下层鱼类4种(23.53%),下层鱼类3种(17.65%)。按食性划分(表 1),杂食性鱼类14种(82.35%),植食性和肉食性鱼类分别有2种(11.76%)和1种(5.88%)。
海南似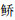
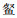
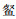
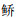
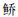
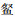
松木山水库鱼类群落的ABC曲线(图 3)基本重叠,且W值为-0.022 4,在0值附近,表明该水库鱼类群落受到了中等程度的干扰。

|
图 3 松木山水库鱼类群落ABC曲线 Fig. 3 ABC curve of fish community in Songmushan Reservoir |
根据聚类分析(图 4)结果,松木山水库鱼类物种组成在月份间无显著差异,海南似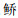
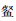

|
图 4 松木山水库鱼类群落聚类分析 Fig. 4 Cluster analysis of species composition of fish communities in Songmushan Reservoir |
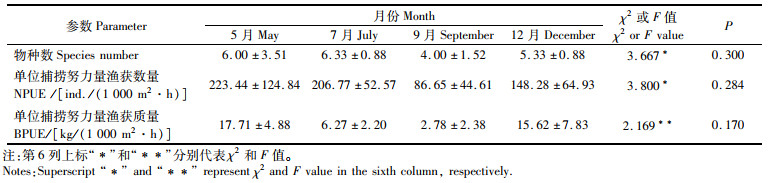
物种数、NPUE和BPUE在月份间均无显著性差异(表 2,P>0.05)。整个调查期间,5、7、9和12月捕获的物种数分别为13种、9种、7种和8种。
|
表 2 鱼类群落物种数和单位捕捞努力量渔获量在月间的差异性(平均值±标准误) Tab.2 Significant test for differences in species number and catch per unit effort (CPUE) between months (Mean±SE) |
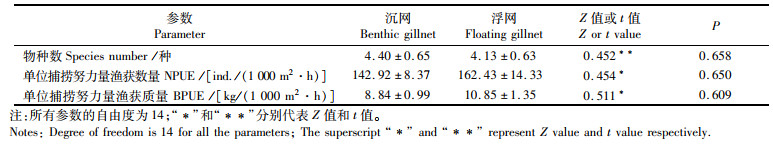
渔获物NPUE和BPUE浮网均高于沉网,每站次捕获的物种数相反,沉网高于浮网,但网具类型间均无显著差异(P>0.05,表 3)。整个调查期间,沉网和浮网捕获的物种数分别为14种和13种。
|
表 3 多样性指数和单位捕捞努力量渔获量在沉网与浮网间的差异性(平均值±标准误) Tab.3 Significant test for differences in diversity indices and catch per unit effort (CPUE) between benthic gillnet and floating gillnet (Mean±SE) |
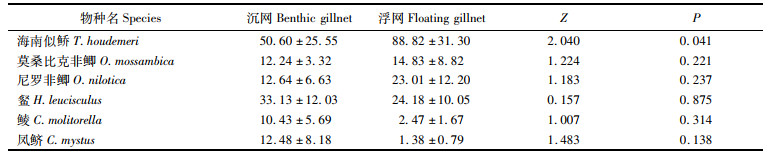
列联表分析表明,鱼类物种组成沉网和浮网间存在极显著差异(χ2=353.4,P < 0.001,df=16)。海南似
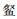
|
表 4 主要鱼类的单位捕捞努力量渔获数量在沉网和浮网间差异性检验(平均值±标准误) Tab.4 Significant test for differences in number per unit effort (NPUE) of the main fish species between benthic gillnet and floating gillnet (Mean±SE) |
RDA分析表明,第1轴和第2轴特征值为0.257和0.113,共解释了鱼类数据37.0%的方差值。第1轴、第2轴鱼类物种与环境因子的相关性分别为0.844和0.831,表明物种与环境因子具有较强的相关性。第1轴主要与TP(0.630)、pH(0.404)和SD(0.290)正相关:第2轴主要与pH(0.728)和TP(0.235)正相关,与SD(-0.701)负相关。尼罗非鲫与TP和pH正相关,海南似
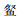
|
CirM.鲮; CoiG.七丝鲚; CoiM.凤鲚; HemL.  ; HypM.鲢; OreM.莫桑比克非鲫; OreN.尼罗非鲫; ToxH.海南似 ; HypM.鲢; OreM.莫桑比克非鲫; OreN.尼罗非鲫; ToxH.海南似 。
CirM. Cirrhina molitorella; CoiG. Coilia grayi; CoiM. Coilia mystus; HemL. Hemiculter leucisculus; HypM. Hypophthalmichthys molitrix; OreM. Oreochromis mossambica; OreN. Oreochromis nilotica; ToxH. Toxabramis houdemeri.
图 5 主要鱼类丰度和环境因子RDA分析排序图
Fig. 5 RDA ordination bioplot of major fish abundance and environmental factor 。
CirM. Cirrhina molitorella; CoiG. Coilia grayi; CoiM. Coilia mystus; HemL. Hemiculter leucisculus; HypM. Hypophthalmichthys molitrix; OreM. Oreochromis mossambica; OreN. Oreochromis nilotica; ToxH. Toxabramis houdemeri.
图 5 主要鱼类丰度和环境因子RDA分析排序图
Fig. 5 RDA ordination bioplot of major fish abundance and environmental factor
|
结果表明,松木山水库鱼类群落结构具有4个特点: (1)小型鱼类数量占优,如海南似
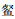
松木山水库鱼类多样性低可能与水污染、所采用的捕捞工具及松木山水库面积小且与其他水系的隔离度较大等因素有关。松木山水库处于中度富营养或超富营养状态[3, 20],本研究的监测结果表明该水库也处在中度富营养化状态(综合营养状态指数为65.8),而过度干扰如严重污染会导致物种多样性下降[21]。所有渔具如刺网对鱼类物种均具有不同程度的选择性[22],因此单一渔具采集到的物种数低于或明显低于多种渔具同时使用捕获到的,如刺网抓捕到的物种数较为明显地低于4种渔具一起捕获到的物种数[23-24],这与刺网对扁平型、棍棒型和鳗鲡体型鱼类的捕捞效率较低有关[22],从而导致具有以上特征的一些物种未被本次调查捕获。尽管本研究仅布设了3个采样点且在冬季因新冠疫情未能安排采样,但采集到的物种数已达到物种累积曲线期望值的90%以上,说明刺网鱼类调查强度已经满足要求[25],是否如此还需要进一步安排包含更多采样点以及4个季节的调查加以验证。岛屿生物地理学理论提出,物种多样性如鱼类的多样性与水域面积成正比[21, 26],同时江湖阻隔会降低鱼类多样性[27],松木山水库水域面积仅8 km2,其水源主要通过人工排渠入库,如4个主要排水口集水面积约占水库总集水面积的41%,大坝也会极大地降低其与下游水系的连通性,因此该水库与周边水系的连通性较低及水面积小导致其鱼类多样性低可以预料。入侵物种会导致物种多样性下降[28-29],罗非鱼具有入侵物种的典型特征,可能会通过竞争和捕食作用导致了一些土著物种已从该水库中消失[10, 30-31]。
广东是多水库省份,数量居全国第3位,但该省水库鱼类群落结构及多样性方面鲜有报道,搜索到的几篇文献有的未列出名录,或仅报道草食性鱼类物种组成[32],或仅报道多个水库的常见鱼类物种[33]。对比发现,鲢、鳙、罗非鱼、鲮、贝氏

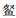

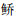
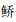
鱼类群落结构的时空特征受到各种生物和非生物因素的影响[38],如鱼类群落结构的季节变化与内源性因素如繁殖、摄食及洄游活动和外源性因素如水温等环境因子的季节性波动有关[39]。松木山水库鱼类物种组成无显著季节差异性,主要与每个月海南似



| [1] |
韩博平. 中国水库生态学研究的回顾与展望[J]. 湖泊科学, 2010, 22(2): 151-160. HAN B P. Reservoir ecology and limnology in China: a retrospective comment[J]. Journal of Lake Sciences, 2010, 22(2): 151-160. |
| [2] |
何舸, 牛宇琛, 王成坤, 等. 高度城镇化地区跨区水污染协同综合治理——东莞案例[J]. 中国给水排水, 2020, 36(12): 25-30. HE G, NIU Y C, WANG C K, et al. Cross-regional cooperative comprehensive control of water pollution in highly urbanized areas: a case study of Dongguan[J]. China Water & Wastewater, 2020, 36(12): 25-30. |
| [3] |
罗概, 马茵茵, 蓝于倩, 等. 东莞市25座水库的营养现状与水质管理对策[J]. 水生态学杂志, 2014, 35(5): 34-42. LUO G, MA Y Y, LAN Y Q, et al. Eutrophication and water quality management of reservoirs in Dongguan City[J]. Journal of Hydroecology, 2014, 35(5): 34-42. DOI:10.3969/j.issn.1674-3075.2014.05.006 |
| [4] |
罗锋, 华松林, 王兴, 等. 东莞水库底泥重金属污染及潜在生态风险评价[J]. 环境科学与技术, 2018, 41(2): 183-188. LUO F, HUA S L, WANG X, et al. Pollution characteristics and potential ecological risk assessment of heavy metals in sediments from eight reservoirs of Dongguan City[J]. Environmental Science & Technology, 2018, 41(2): 183-188. |
| [5] |
ZHANG X, XIE P, HUANG X P. A review of nontraditional biomanipulation[J]. The Scientific World Journal, 2008, 8: 1184-1196. DOI:10.1100/tsw.2008.144 |
| [6] |
刘其根, 张真. 富营养化湖泊中的鲢、鳙控藻问题: 争议与共识[J]. 湖泊科学, 2016, 28(3): 463-475. LIU Q G, ZHANG Z. Controlling the nuisance algae by silver and bighead carps in eutrophic lakes: disputes and consensus[J]. Journal of Lake Sciences, 2016, 28(3): 463-475. |
| [7] |
谷孝鸿, 曾庆飞, 毛志刚, 等. 太湖2007—2016十年水环境演变及"以渔改水"策略探讨[J]. 湖泊科学, 2019, 31(2): 305-318. GU X H, ZENG Q F, MAO Z G, et al. Water environment change over the period 2007-2016 and the strategy of fishery improve the water quality of Lake Taihu[J]. Journal of Lake Sciences, 2019, 31(2): 305-318. |
| [8] |
SPECZIÁR A, GYÖRGY Á I, ERÖS T. Within-lake distribution patterns of fish assemblages: the relative roles of spatial, temporal and random environmental factors in assessing fish assemblages using gillnets in a large and shallow temperate lake[J]. Journal of Fish Biology, 2013, 82(3): 840-855. DOI:10.1111/jfb.12029 |
| [9] |
李本旺, 蓝昭军, 李强, 等. 东莞淡水和河口鱼类资源状况调查[J]. 南方水产科学, 2011, 7(2): 22-28. LI B W, LAN Z J, LI Q, et al. Investigation of fish resources in fresh water and estuary of Dongguan City[J]. South China Fisheries Science, 2011, 7(2): 22-28. DOI:10.3969/j.issn.2095-0780.2011.02.004 |
| [10] |
张邦杰, 莫介化, 陈浩, 等. 东莞内陆自然水域鱼类资源变动的调查与分析[J]. 广东海洋大学学报, 2013, 33(4): 56-65. ZHANG B J, MO J H, CHEN H, et al. Variations of the fish stocks in inland natural waters of Dongguan[J]. Journal of Guangdong Ocean University, 2013, 33(4): 56-65. DOI:10.3969/j.issn.1673-9159.2013.04.011 |
| [11] |
孙莹蓓, 罗潋葱, 韦桂峰, 等. 大沙河水库浮游植物种类组成及季节性变化[J]. 资源科学, 2014, 36(8): 1732-1738. SUN Y B, LUO L C, WEI G F, et al. Species composition and seasonal variation in phytoplankton at Dashahe reservoir[J]. Resources Science, 2014, 36(8): 1732-1738. |
| [12] |
ERÖS T, SPECZIÁR A, BÍRÓ P. Assessing fish assemblages in reed habitats of a large shallow lake-a comparison between gillnetting and electric fishing[J]. Fisheries Research, 2009, 96(1): 70-76. DOI:10.1016/j.fishres.2008.09.009 |
| [13] |
中国水产科学研究院珠江水产研究所. 广东淡水鱼类志[M]. 广州: 广东科技出版社, 1991. Pearl River Fisheries Research Institute. The freshwater fishes of Guangdong province[M]. Guangzhou: Guangdong Science and Technology Press, 1991. |
| [14] |
俞存根, 宋海棠, 姚光展. 东海蟹类群落结构特征的研究[J]. 海洋与湖沼, 2005, 36(3): 213-220. YU C G, SONG H T, YAO G Z. Crab community structure in the East China Sea[J]. Oceanologia et Limnologia Sinica, 2005, 36(3): 213-220. DOI:10.3321/j.issn:0029-814X.2005.03.004 |
| [15] |
刘乐丹, 王先云, 陈丽平, 等. 淀山湖底栖动物群落结构及其与沉积物碳氮磷的关系[J]. 长江流域资源与环境, 2018, 27(6): 1269-1278. LIU L D, WANG X Y, CHEN L P, et al. Community structure of macrozoobenthos with relationships to carbon, nitrogen and phosphorus in the sediment of Dianshan Lake (Shanghai, China)[J]. Resources and Environment in the Yangtze Basin, 2018, 27(6): 1269-1278. DOI:10.11870/cjlyzyyhj201806010 |
| [16] |
张顺, 胡忠军, 陈丽平, 等. 基于刺网的淀山湖鱼类群落结构时空变化及网目大小对其产生的影响[J]. 应用与环境生物学报, 2019, 25(4): 877-884. ZHANG S, HU Z J, CHEN L P, et al. Temporal and spatial variations in fish community structure in Dianshan Lake and the effect of mesh size on its structural characteristics[J]. Chinese Journal of Applied & Environmental Biology, 2019, 25(4): 877-884. |
| [17] |
陈飞鹏, 汪殿蓓, 暨淑仪, 等. 深圳南山区天然植物群落的聚类分析[J]. 武汉植物学研究, 2001, 19(5): 385-390. CHEN F P, WANG D P, JI S Y, et al. Clustering analysis on natural plant communities of Nanshan in Shenzhen City[J]. Journal of Wuhan Botanical Research, 2001, 19(5): 385-390. DOI:10.3969/j.issn.2095-0837.2001.05.006 |
| [18] |
刘其根, 沈建忠, 陈马康, 等. 天然经济鱼类小型化问题的研究进展[J]. 上海水产大学学报, 2005, 14(1): 79-83. LIU Q G, SHEN J Z, CHEN M K, et al. Advances of the study on the miniaturization of natural economical fish resources[J]. Journal of Shanghai Fisheries University, 2005, 14(1): 79-83. |
| [19] |
郑慈英. 珠江鱼类志[M]. 北京: 科学出版社, 1989. ZHEN C Y. Zhujiang fish[M]. Beijing: Science Press, 1989. |
| [20] |
陈飞, 唐鹊辉, 肖利娟, 等. 南亚热带城市中小型水库蓝藻种类组成及其群落季节动态[J]. 应用与环境生物学报, 2018, 24(3): 595-601. CHEN F, TANG Q H, XIAO L J, et al. Species composition and seasonal community dynamics of cyanobacteria in small-and medium-sized reservoirs in subtropical cities of southern China[J]. Chinese Journal of Applied & Environmental Biology, 2018, 24(3): 595-601. |
| [21] |
孙儒泳. 动物生态学原理[M]. 3版. 北京: 北京师范大学出版社, 2006. SUN R Y. Principles of animal ecology[M]. 3rd ed. Beijing: Beijing Normal University Publishing House, 2006. |
| [22] |
LI Y L, LIU Q G, CHEN L P, et al. A comparison between benthic gillnet and bottom trawl for assessing fish assemblages in a shallow eutrophic lake near the Changjiang River estuary[J]. Journal of Oceanology and Limnology, 2018, 36(2): 572-586. DOI:10.1007/s00343-018-6219-5 |
| [23] |
叶少文, 曾文涛, 陈宇顺, 等. 浅水湖泊四种渔具捕捞选择性及对鱼类群落影响比较研究[J]. 水生生物学报, 2018, 42(6): 1107-1115. YE S W, ZENG W T, CHEN Y S, et al. Comparisons of selectivity by four fishing methods on fish community assessment in a shallow Yangtze lake, and implications for fishery management[J]. Acta Hydrobiologica Sinica, 2018, 42(6): 1107-1115. |
| [24] |
刘鹏飞, 张婉平, 徐东坡, 等. 钱塘江西湖段鱼类群落结构特征[J]. 上海海洋大学学报, 2021, 30(3): 525-535. LIU P F, ZHANG W P, XU D P, et al. Current situation of fish community structure in West Lake section of Qiantang River[J]. Journal of Shanghai Ocean University, 2021, 30(3): 525-535. |
| [25] |
MORENO C E, HALFFTER G. Assessing the completeness of bat biodiversity inventories using species accumulation curves[J]. Journal of Applied Ecology, 2000, 37(1): 149-158. DOI:10.1046/j.1365-2664.2000.00483.x |
| [26] |
周伟, 李明会, 李有兰. 滇西南四个自然保护区鱼类多样性及评价指标探究[J]. 生物多样性, 2016, 24(3): 313-320. ZHOU W, LI M H, LI Y L. Fish diversity in four nature reserves in Southwest Yunnan, China and the evaluation indicators[J]. Biodiversity Science, 2016, 24(3): 313-320. |
| [27] |
茹辉军, 刘学勤, 黄向荣, 等. 大型通江湖泊洞庭湖的鱼类物种多样性及其时空变化[J]. 湖泊科学, 2008, 20(1): 93-99. RU H J, LIU X Q, HUANG X R, et al. Diversity of fish species and its spatio-temporal variations in lake Dongting, a large Yangtze-connected lake[J]. Journal of Lake Sciences, 2008, 20(1): 93-99. DOI:10.3321/j.issn:1003-5427.2008.01.014 |
| [28] |
张晓可, 王慧丽, 万安, 等. 淠河流域河源溪流鱼类空间分布格局及主要影响因素[J]. 湖泊科学, 2017, 29(1): 176-185. ZHANG X K, WANG H L, WAN A, et al. Fishes in headwater streams of the Pihe River basin: spatial distribution pattern and its main influencing factors[J]. Journal of Lake Sciences, 2017, 29(1): 176-185. |
| [29] |
IRONS K S, SASS G G, MCCLELLAND M A, et al. Reduced condition factor of two native fish species coincident with invasion of non-native Asian carps in the Illinois River, U.S.A, is this evidence for competition and reduced fitness?[J]. Journal of Fish Biology, 2007, 71: 258-273. DOI:10.1111/j.1095-8649.2007.01670.x |
| [30] |
GU D E, MA G M, ZHU Y J, et al. The impacts of invasive Nile tilapia (Oreochromis niloticus) on the fisheries in the main rivers of Guangdong Province, China[J]. Biochemical Systematics and Ecology, 2015, 59: 1-7. DOI:10.1016/j.bse.2015.01.004 |
| [31] |
GU D E, HU Y C, XU M, et al. Fish invasion in the river systems of Guangdong Province, south China: possible indicators of their success[J]. Fisheries Management and Ecology, 2017, 25(1): 44-53. |
| [32] |
马丽霞, 邓维德, 胡晓梅, 等. 韶关市南水水库草食性鱼类多样性现状观察[J]. 区域治理, 2019(47): 137-140. MA L X, DENG W D, HU X M, et al. Observation on the diversity of herbivorous fish in Nanshui Reservoir in Shaoguan City[J]. Regional Governance, 2019(47): 137-140. DOI:10.3969/j.issn.2096-4595.2019.47.045 |
| [33] |
袁一文. 广东省典型水库枯水期鱼类和磷分布特征[D]. 广州: 暨南大学, 2016. YUAN Y W. Fish and phosphorus distribution in typical reservoirs of Guangdong Province during dry season[D]. Guangzhou: Jinan University, 2016. |
| [34] |
王崇, 谢山, 谢文星, 等. 红水河干流梯级运行后鱼类资源调查[J]. 淡水渔业, 2015, 45(2): 30-36. WANG C, XIE S, XIE W X, et al. Investigation on fish resources in the mainstream of Hongshuihe River after the formation of the cascade reservoirs[J]. Freshwater Fisheries, 2015, 45(2): 30-36. DOI:10.3969/j.issn.1000-6907.2015.02.006 |
| [35] |
王伟营, 杨君兴, 陈小勇. 云南境内南盘江水系鱼类种质资源现状及保护对策[J]. 水生态学杂志, 2011, 32(5): 19-29. WANG W Y, YANG J X, CHEN X Y. Current status and conservation strategies of fish germplasm resources of Nanpanjiang River system in Yunnan[J]. Journal of Hydroecology, 2011, 32(5): 19-29. |
| [36] |
李德越, 李荣辉, 吴志强, 等. 广西南宁大王滩水库鱼类物种组成及多样性分析[J]. 南方水产科学, 2018, 14(2): 110-117. LI D Y, LI R H, WU Z Q, et al. Species composition and diversity of fish in Dawangtan Reservoir in Nanning, Guangxi[J]. South China Fisheries Science, 2018, 14(2): 110-117. DOI:10.3969/j.issn.2095-0780.2018.02.015 |
| [37] |
余梵冬, 顾党恩, 佟延南, 等. 基于鱼类多样性与生物完整性的海南岛南渡江河流健康评价[J]. 生态学杂志, 2018, 37(9): 2717-2726. YU F D, GU D E, TONG Y N, et al. The ecological health assessment based on species diversity and biotic integrity of fish for Nandujiang River, Hainan Island[J]. Chinese Journal of Ecology, 2018, 37(9): 2717-2726. |
| [38] |
ROTHERHAM D, CHAPMAN M G, UNDERWOOD A J, et al. Untangling spatial and temporal variation in abundances of estuarine fish sampled with multi-mesh gillnets[J]. Marine Ecology Progress Series, 2011, 435: 183-195. DOI:10.3354/meps09204 |
| [39] |
韩洁, 张杰, 宋蒙蒙, 等. 济南市水域鱼类功能群结构及其季节性变[J]. 环境科学研究, 2018, 31(9): 1537-1544. HAN J, ZHANG J, SONG M M, et al. Structure and seasonal changes of fish functional groups in Jinan region[J]. Research of Environmental Sciences, 2018, 31(9): 1537-1544. |
| [40] |
DONG X H, XIANG T, JU T, et al. Age, growth, mortality and recruitment of thin sharpbelly Toxabramis swinhonis Günther, 1873 in three shallow lakes along the middle and lower reaches of the Yangtze River basin, China[J]. PeerJ, 2019, 7: e6772. DOI:10.7717/peerj.6772 |
| [41] |
代培, 阎明军, 周游, 等. 太湖五里湖沿岸带浮游植物群落生态特征(2014—2015年)[J]. 长江流域资源与环境, 2018, 27(10): 2348-2357. DAI P, YAN M J, ZHOU Y, et al. Ecological characteristics of phytoplankton community structure in the littoral zone of Lake Wuli, Lake Taihu in 2014-2015[J]. Resources and Environment in the Yangtze Basin, 2018, 27(10): 2348-2357. |
| [42] |
GREENE S, MCELARNEY Y R, TAYLOR D. Water quality effects following establishment of the invasive Dreissena polymorpha (Pallas) in a shallow eutrophic lake: implications for pollution mitigation measures[J]. Hydrobiologia, 2015, 743(1): 237-253. DOI:10.1007/s10750-014-2041-z |
2. Centre for Research on Environmental Ecology and Fish Nutrion, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China;
4. Dongguan Ecological Environmental Protection Research Institute Co., Ltd, Dongguan 523000, Guangdong, China;
5. Water Engineering Construction and Operation Center of Dongguan Songshan Lake Hi-Tec Industrial Development Zone, Dongguan 523000, Guangdong, China
 2022,
Vol. 31
2022,
Vol. 31


