2. 上海海洋大学 水产科学国家级实验教学示范中心,上海 201306;
3. 上海海洋大学 农业农村部鱼类营养与环境生态研究中心,上海 201306;
4. 安徽省水产技术推广总站,安徽 合肥 230000;
5. 大北农神爽水产科技有限公司,福建 诏安 363500
克氏原螯虾(Procambarus clarkii) 是一种淡水杂食性虾类,其适应性强,生长发育快,是我国一种重要的经济水产动物[1], 其养殖面积在2019年高达128.6万hm2,总产量突破200万t[2]。当前大部分养殖户采用秋季留塘亲虾自行繁殖的方法获取苗种,但这种“繁养一体”模式面临产量波动大、养殖规格小、种质退化等问题越来越严重,正逐渐被“繁养分离,精准养殖”模式所取代。“繁养分离”模式通过将苗种和成虾分开养殖,不仅能够保证自身早期苗种投放,还能在成虾收获后不断补充苗种,延长了上市周期,提升了养殖户的经济效益[3]。
在“繁养分离”模式中,苗种的培育至关重要,而要想确保苗种的健康成长并提高其成活率,除了需要良好的生长环境外,投喂适宜的饵料也至关重要。研究[4]表明,轮虫具有适口性好的优点,并且含有多种营养物质及微量元素,是世界公认的鱼虾蟹类苗种培养的优质开口生物饵料[5],但其在大规模生产时需要大量的设备和人力,且受外界环境因素影响较大,因此,在实际养殖中常投喂冷冻轮虫[6],而在克氏原螯虾仔虾中的应用还未见报道。人工配合饲料在克氏原螯虾中的应用较为广泛[7],但其存在适口性差、吸收利用率低、对水质污染严重等问题。生物絮团技术是将水体中的含氮有机物转化为能被水产动物摄食的菌体蛋白[8],具有调节水质、降低饲料系数、增强养殖动物免疫力等优点[9-11],近年来,已被作为饵料应用到凡纳滨对虾(Litopenaeus vannamei)[12]、罗氏沼虾(Macrobrachium rosenbergii)[13]养殖中,且在克氏原螯虾的幼虾养殖中也有较好的效果[14],但对克氏原螯虾仔虾的影响研究尚未见报道。
本实验选用了生物絮团、人工配合饲料和冰冻萼花臂尾轮虫(Brachionus calyciflorus) 3种饵料对刚脱离母体的克氏原螯虾仔虾进行为期42 d的养殖实验,实验结束后对仔虾的生长性能、消化酶和非特异性免疫酶活性进行比较分析,探究克氏原螯虾仔虾的最佳饵料,以期为克氏原螯虾苗种培育中饵料的选择提供一定的依据。
1 材料与方法 1.1 实验材料实验所用克氏原螯虾仔虾由上海海洋大学崇明基地抱卵虾孵化所得。选取由同一亲本(体质量为36.45 g)孵化的270只平均体质量为(0.017 9±0.000 5) g的克氏原螯虾仔虾进行正式实验。实验所用饲料来自浙江澳华饲料有限公司(表 1),冰冻萼花臂尾轮虫由上海鳞港生物科技有限公司提供。
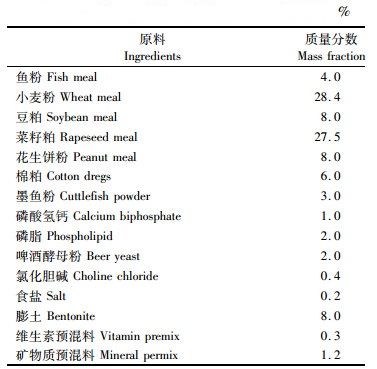
|
表 1 商品饲料配方 Tab.1 Composition of the commercial diet |
实验开始前30 d,先进行稳定生物絮团的培养。具体方法为在经过高锰酸钾消毒过的养殖桶(直径×高=357 mm×420 mm)中导入40 L自来水(曝气24 h),每天按照磨碎的商品饲料(表 1)和葡萄糖(国药集团化学试剂有限公司)质量比1∶ 2添加营养源,使水体C/N>15,从而培养稳定的生物絮团。培养期间持续曝气,曝气量约为66 L/min,溶氧保持在7 mg/L以上,pH大于7,温度为26 ℃。30 d后将成熟稳定的生物絮团加入到生物絮团养殖组各实验桶中,通过加入自来水(曝气24 h)将生物絮团浓度(BFV) 调整为10 mL/L。
实验共分为3组,分别为生物絮团养殖组(絮团组)、投喂人工配合饲料养殖组(饲料组)和投喂冰冻萼花臂尾轮虫养殖组(轮虫组),每组3个重复,共9个养殖桶(直径×高=357 mm×420 mm),每桶随机放入30只活力充足、附肢完整的克氏原螯虾仔虾,并在桶底放置假水草作为遮蔽物。养殖期间,每天分2次(7:00和19:00)投喂,絮团组按照饲料与葡萄糖质量比1∶ 2添加营养源,饲料组投喂商品饲料,轮虫组投喂冰冻轮虫,因仔虾在初期摄食能力弱,所以每次都足量投喂,3个实验组投喂总能相同。饲料组和轮虫组每次投喂前吸除残饵和粪便,每3天换1次水,换水量约为总水量的1/4,絮团组不换水,只补充因蒸发而损失掉的水分,养殖周期为42 d。
1.3 测量的指标与方法 1.3.1 水样的采集与测定养殖期间,每天上午用哈希多参数水质测量仪测定养殖用水的溶解氧、温度和pH;每3天的中午在各个实验桶中取300 mL水样用于测定水体总氮(TN) 和总磷(TP) 的浓度,经0.45 μm微孔滤膜过滤后进行亚硝态氮(NO2--N)、氨氮(NH4+-N)、硝态氮(NO3--N) 的测定。TN浓度的测定采用碱性过硫酸钾消解紫外分光光度法;TP浓度的测定采用过硫酸钾消解-钼锑抗分光光度法;NO2--N浓度的测定采用N-(1-萘基)-乙二胺光度法;NH4+-N浓度的测定采用纳氏试剂光度法;NO3--N浓度的测定采用紫外分光光度法;实验中所用到的化学试剂均购自国药集团化学试剂有限公司。
1.3.2 样品的采集与生长性能的测定实验期间,每隔6天清点1次各个实验桶中现有的克氏原螯虾成活数量,从中随机捞取5只,测定并记录其体质量。
实验结束后,先用干燥的滤纸吸干虾体表面的水分并用电子天平(精准度=0.01 g)称量其体质量,再用游标卡尺测量其体长和头胸甲宽,最后解剖各组仔虾,取出肝胰腺及肌肉组织放入离心管中,-40 ℃保存,用于后续酶活的测定。统计各组体长体质量等生长指标,各实验组成活率、增重率、特定生长率的计算公式:
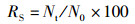 (1)
(1)
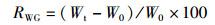 (2)
(2)
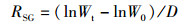 (3)
(3)
式中:RS为成活率, %;RWG为增重率, %;RSG为特定生长率, %/d;N0为初始克氏原螯虾存活数量,只;Nt为终末克氏原螯虾存活数量,只;W0为初始克氏原螯虾体质量,g;Wt为终末克氏原螯虾体质量,g;D表示养殖天数,d。
1.3.3 不同饵料营养成分的测定实验结束后,将水体中的生物絮团用尼龙网(200目)进行过滤收集,将其和饲料、轮虫于105 ℃下烘干至恒重,测得水分含量后,密封保存于-20 ℃冰箱待测。粗蛋白测定用凯氏定氮法,粗脂肪测定用Folch[15]索氏抽提法。
1.3.4 消化酶活性的测定测定前称取0.2 g肝胰腺鲜样,加入9倍冷生理盐水,用匀浆器在冰浴中匀浆30 s后,离心15 min(4 ℃,10 000 r/min),小心吸取中层清液用于测定消化酶活性。用南京建成生物工程公司试剂盒测定4种消化酶,分别为α-淀粉酶、脂肪酶、胰蛋白酶和胃蛋白酶。
1.3.5 非特异性免疫酶活性的测定测定时分别称取0.2 g肝胰腺以及肌肉组织鲜样,加入9倍冷生理盐水,用匀浆器在冰浴中匀浆30 s后,离心15 min(4 ℃, 10 000 r/min),取上层清液测定非特异性免疫酶的活性。用南京建成生物工程公司试剂盒测定6种非特异性免疫酶,分别为酸性磷酸酶、碱性磷酸酶、总抗氧化能力、超氧化物歧化酶、过氧化氢酶和丙二醛。
1.4 数据分析所有实验数据均用平均值±标准误(Mean±SE)表示。利用SPSS 23.0和Excel进行数据分析和统计,采用单因素方差分析法(One-Way ANOVA)对实验数据进行方差分析, 同时用Duncan氏法进行多重比较,P<0.05为差异显著,P>0.05为差异不显著。
2 结果 2.1 不同饵料对克氏原螯虾养殖水质的影响由表 2可知:絮团组水体的TN、TP、NO2--N、NH4+-N、NO3--N浓度均低于饲料组和轮虫组,其中NO2--N和NO3--N浓度与其他两组差异显著(P<0.05)。3个实验组的溶解氧、温度以及pH差异不显著(P>0.05)。
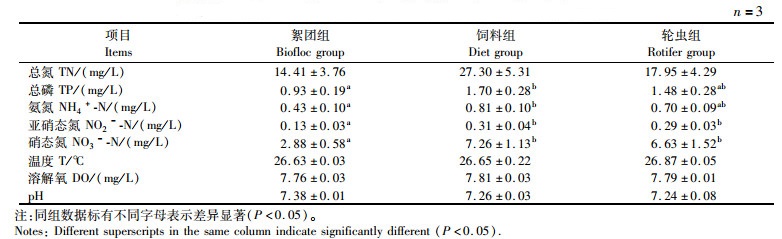
|
表 2 实验期间各实验组水体指标 Tab.2 Water quality parameters in different experimental groups |
图 1显示的是实验期间各实验组水体化学指标的变化。3个实验组的TN、TP、NH4+-N、NO2--N浓度变化均为先上升后下降,只有NO3--N浓度呈一直上升趋势。实验期间,饲料组和轮虫组的NO2--N浓度在前12 d呈上升趋势,絮团组则呈下降趋势,12 d后,3个实验组的NO2--N浓度均有不同程度的上升,24 d后,3个实验组的NO2--N浓度均开始逐步下降(图 1d)。
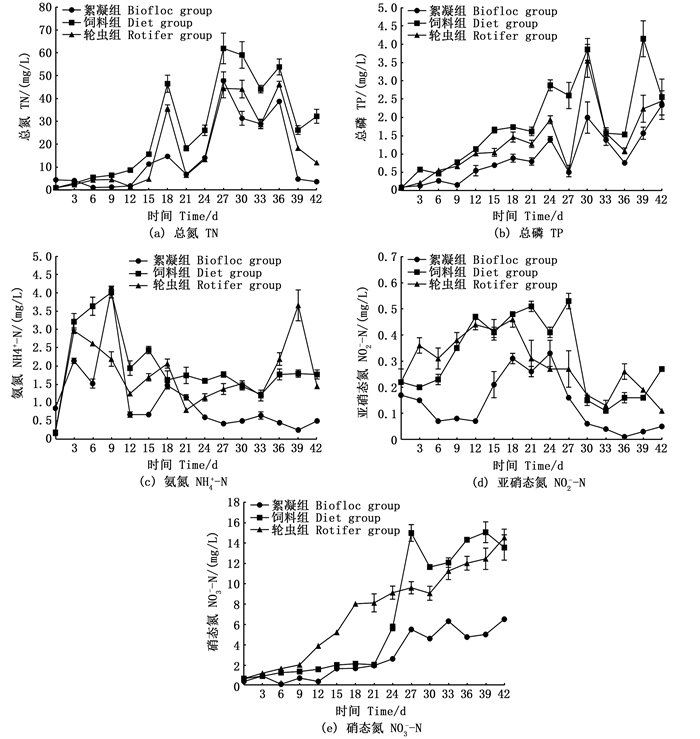
|
图 1 实验期间各实验组水体化学指标浓度的变化 Fig. 1 Fluctuation of hydrochemical indices concentration in different experimental groups |
由表 3可知:3个实验组仔虾的终末体质量、终末体长、WG和SGR均无显著差异(P>0.05),但絮团组的存活率显著高于饲料组(P<0.05)。
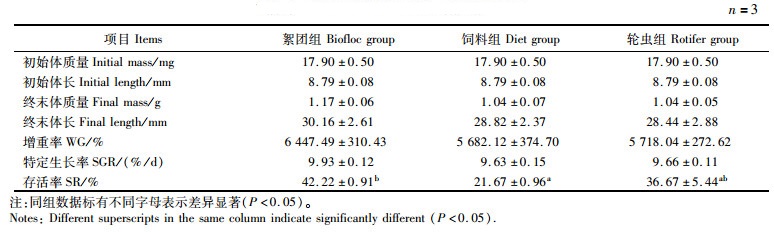
|
表 3 克氏原螯虾仔虾的生长指标 Tab.3 Growth index of P. clarkii larvae |
由图 2可知:在前24 d,絮团组每6 d成活率高于其他两组; 24 d后,絮团组成活率降低,几乎与轮虫组持平,均高于饲料组的成活率(P<0.05)。絮团组每6天体质量略高于饲料组和轮虫组,但3个实验组之间差异不显著(P>0.05)。
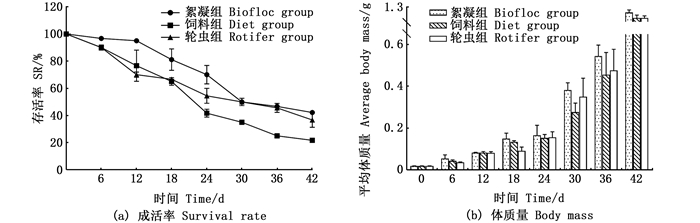
|
图 2 实验期间各实验组成活率和体质量的变化 Fig. 2 Fluctuation of survival rate and body mass in different experimental groups |
实验结束后,对3种饵料的营养成分进行分析,发现它们的粗蛋白含量为35% ~41%,无显著差异(P>0.05),但轮虫的粗脂肪含量较高,其次是饲料,最后是生物絮团,3组之间差异显著(P<0.05)。见表 4。

|
表 4 不同饵料营养成分组成(干质量) Tab.4 Proximate composition of different initial feed (dry mass) |
由表 5可知:3个实验组中絮团组的胰蛋白酶和胃蛋白酶活性显著高于饲料组(P<0.05);饲料组的脂肪酶活性显著最高(P<0.05),其次是轮虫组,最后是絮团组;饲料组的α-淀粉酶活性显著高于絮团组(P<0.05);轮虫组的α-淀粉酶、胰蛋白酶和胃蛋白酶活性均与其他两组差异不显著(P>0.05)。
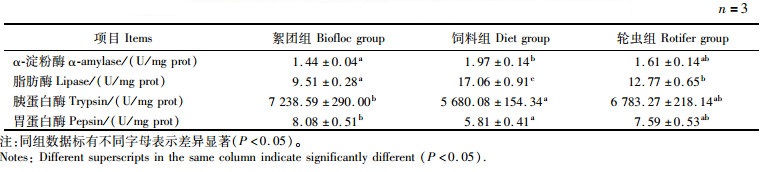
|
表 5 克氏原螯虾仔虾肝胰腺中消化酶活性 Tab.5 Digestive enzyme activities in the hepatopancreas of P. clarkii larvae |
对3个实验组仔虾肝胰腺和肌肉组织的非特异性免疫酶活性分别进行对比,仔虾肝胰腺中的非特异性免疫酶活性均高于肌肉组织(表 6)。絮团组仔虾肝胰腺和肌肉组织中的T-AOC和CAT活性均显著高于饲料组和轮虫组(P<0.05),且MDA含量显著最低(P<0.05)。
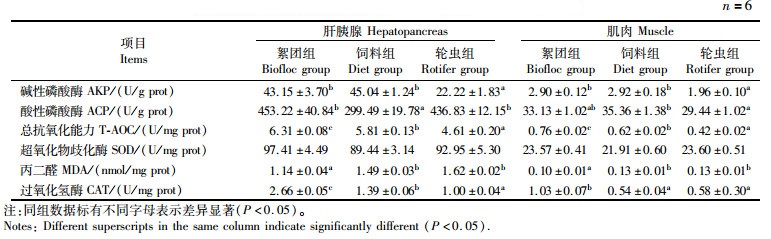
|
表 6 不同饵料对克氏原螯虾仔虾肝胰腺和肌肉非特异性免疫酶活性的影响 Tab.6 Effects of different initial diets on non-specific immune enzyme activities in hepatopancreas and muscle of P. clarkia larvae |
养殖水质的优劣直接影响水产动物的增长率和成活率,而引起养殖水质变化的主要因素有温度、溶解氧含量、pH以及水体化学指标[16-17]。在本实验中,3个实验组的温度、溶解氧和pH均在适宜范围内[17-18],但水体化学指标有一定的差异。絮团组水体中NO2--N和NH4+-N浓度均显著最低,并在养殖后期处于较低的浓度水平,与李京昊等[19]发现生物絮团养殖克氏原螯虾幼虾时水体中的NO2--N和NH4+-N浓度较低的研究结果相似。有研究[20]发现,生物絮团在形成过程中能够通过硝化作用将水体中的含氮物质转变成可被养殖动物摄食的菌体蛋白质,从而起到降低水体NO2--N和NH4+-N浓度的作用。另外,絮团组仔虾的成活率显著最高,刘国兴等[21]研究发现随着克氏原螯虾数量的增多养殖水质会逐渐恶化,但本实验中絮团组的水质状况最好,这说明利用生物絮团技术养殖克氏原螯虾,可以改善并维持良好的养殖水质。而饲料组水体中的NO2--N和NH4+-N浓度最高,可能是因为饲料被长时间的浸泡造成水中氨氮等有害物质的积累[22],从而使水体中的NO2--N和NH4+-N浓度升高。
3.2 不同饵料对克氏原螯虾仔虾生长性能的影响研究[23-24]表明,克氏原螯虾在仔虾阶段需要的蛋白质含量为22%~27%,脂质含量为4%~7%。本实验对3种饵料的粗蛋白、粗脂肪和水分含量进行了测定,结果显示3种饵料的粗蛋白含量无显著差异,均能满足克氏原螯虾仔虾对蛋白质的需求。LI等[25]和BALLESTER等[26]发现生物絮团中粗脂肪含量较低,本研究也测得生物絮团的粗脂肪含量显著低于其他2种饵料,约为4.2%,但其理论上仍在克氏原螯虾仔虾的脂质需求范围内。
在人工养殖条件下,水产动物的增重与人工投喂的饵料密切相关,因此饵料的适口与否直接关系到水产动物的生长发育和存活[27]。本实验结果显示3个实验组仔虾的终末体质量、增重率以及特定生长率均无显著差异,但絮团组的各项生长指标均高于其他2组。研究[28]表明,克氏原螯虾在仔虾阶段主要摄食有机碎屑和藻类,而生物絮团的主要成分是有机碎屑,在适口性上可能优于饲料组和轮虫组。REN等[29]和LOBATO等[30]发现在集约化养殖体系中,生物絮团可以提高虾类在苗种阶段的生长率。另外,比较3个实验组的成活率,发现絮团组的成活率最高,刘杜娟等[31]将生物絮团技术运用到罗氏沼虾育苗中,也得到了较高的成活率。产生这一结果的原因可能有以下3种:一是絮团组的各项水体指标均为最低,有效避免了“氨中毒”现象[32-33];二是生物絮团降低养殖水体的透光性,减少仔虾自相残杀[34];三是生物絮团中的某些活性物质具有增强仔虾免疫力的作用[35]。
3.3 不同饵料对克氏原螯虾仔虾肝胰腺消化酶活性的影响通过研究肝胰腺中主要消化酶的活性,可以了解克氏原螯虾对不同食物的消化利用能力[36],而消化酶的活性也与其摄食饵料中营养物质的种类和含量关系密切[27]。比较各实验组的消化酶活性,发现饲料组仔虾肝胰腺中α-淀粉酶和脂肪酶活性最高,这可能是因为饲料中淀粉等碳水化合物的含量要高于生物絮团(18%~25%)和轮虫[37],JONES等[38]发现饲料中的淀粉含量与甲壳动物体内的淀粉酶活性呈正相关。絮团组仔虾的脂肪酶活性最低,可能与生物絮团的粗脂肪含量显著最低有关。苏时萍等[39]研究发现饲料的蛋白质含量对克氏原螯虾蛋白酶活性有显著影响,本实验中生物絮团的粗蛋白含量虽然最低,但絮团组仔虾肝胰腺中的胰蛋白酶和胃蛋白酶活性反而显著高于饲料组和轮虫组。PANIGRAHI等[40]发现在饲料中添加生物絮团可以提高南美白对虾肝胰腺中蛋白类消化酶活性,与本实验结果相似。有研究[41]报道,活饵料中的一些微量活性物质可能会在一定程度上促进水产动物分泌蛋白酶。JU等[42]分析发现,生物絮团中含有大量的微生物和多种生物活性物质,以及多种胞外酶[40],这些物质都能刺激克氏原螯虾仔虾的肝胰腺分泌更多的蛋白类消化酶[43]。LI等[14]利用生物絮团技术养殖体质量约3.4 g的克氏原螯虾幼虾时,也发现絮团组的胃蛋白酶活性显著高于饲料组。这意味着利用生物絮团技术养殖克氏原螯虾仔虾,可以提高仔虾的消化能力,进而促进苗种的生长速度。
3.4 不同饵料对克氏原螯虾仔虾肝胰腺和肌肉非特异性免疫酶活性的影响克氏原螯虾与其他甲壳动物一样,只能依靠非特异性免疫来抵抗病原的入侵[44],其体内的非特异性免疫酶活性可以反映机体的免疫水平以及抗氧化能力。AKP和ACP是甲壳类动物防御系统的重要组成部分,是吞噬细胞杀菌的物质基础。本研究结果发现絮团组仔虾的AKP和ACP活性分别高于轮虫组和饲料组,说明絮团组仔虾机体中吞噬细胞的杀菌能力较强。另外,研究表明,T-AOC反映机体的总抗氧化能力,CAT通过清除自由基保护脂质免受过氧化损伤,MDA是评价抗氧化系统平衡的重要指标,其含量越高说明机体的损伤越大[45-47]。在本实验中,絮团组仔虾肝胰腺和肌肉组织中的T-AOC和CAT活性均显著高于饲料组和轮虫组,且MDA含量显著最低,这可能是因为生物絮团中含有多种益生菌,如乳酸菌、芽孢杆菌等,同时也能分泌聚-β-羟丁酸(PHB) 等活性产物[48-49],这些都能增强养殖动物的免疫力和抗氧化能力。综上所述,发现利用生物絮团技术养殖克氏原螯虾仔虾,可以增强仔虾清除氧自由基的能力,降低机体脂质的过氧化损伤水平,从而在一定程度上提高苗种的成活率。
| [1] |
李京昊, 成永旭, 王海锋, 等. 不同条件对克氏原螯虾幼虾摄食生物絮凝的影响[J]. 南方水产科学, 2018, 14(3): 58-64. LI J H, CHENG Y X, WANG H F, et al. Effects of different conditions on feeding biofloc of red swamp crayfish (Procambarus clarkii) juveniles[J]. South China Fisheries Science, 2018, 14(3): 58-64. DOI:10.3969/j.issn.2095-0780.2018.03.007 |
| [2] |
全国水产技术推广总站, 中国水产学会. 2020中国小龙虾产业发展报告[J]. 中国水产, 2020(7): 8-17. National Fisheries Technology Extension Center, China Society of Fisheries. Report on crayfish industry development in China (2020)[J]. China Fisheries, 2020(7): 8-17. |
| [3] |
白志毅, 冯建彬, 崔文涛, 等. 繁养分离稻虾种养模式的优势及实践[J]. 中国水产, 2020(12): 81-83. BAI Z Y, FENG J B, CUI W T, et al. Advantages and practices of separate breeding rice and shrimp farming model[J]. China Fisheries, 2020(12): 81-83. |
| [4] |
邓平, 喻运珍, 艾桃山, 等. 轮虫的培育条件和饵料基础研究进展[J]. 安徽农业科学, 2014, 42(26): 9054-9056. DENG P, YU Y Z, AI T S, et al. Research progress on culture conditions and food elements of rotifer[J]. Journal of Anhui Agricultural Sciences, 2014, 42(26): 9054-9056. DOI:10.3969/j.issn.0517-6611.2014.26.068 |
| [5] |
QI J B, GU X L, MA L B, et al. The research progress on food organism culture and technology utilization in crab seed production in ponds in China[J]. Agricultural Sciences, 2013, 4(10): 563-569. DOI:10.4236/as.2013.410076 |
| [6] |
李飞, 郭建林, 张宇飞, 等. 淡水轮虫土池培育技术研究及应用[J]. 安徽农业科学, 2014, 42(28): 9786-9787. LI F, GUO J L, ZHANG Y F, et al. Study and application of the culture technology for freshwater rotifer in earthen ponds[J]. Journal of Anhui Agricultural Sciences, 2014, 42(28): 9786-9787. DOI:10.3969/j.issn.0517-6611.2014.28.049 |
| [7] |
史振鹏, 王爱民, 陈开健, 等. 克氏原螯虾营养与饲料的研究进展[J]. 盐城工学院学报(自然科学版), 2019, 32(2): 52-56. SHI Z P, WANG A M, CHEN K J, et al. Research progress on nutrition and feed of Procambarus clarkii[J]. Journal of Yancheng Institute of Technology (Natural Science Edition), 2019, 32(2): 52-56. |
| [8] |
AVNIMELECH Y. Carbon/nitrogen ratio as a control element in aquaculture systems[J]. Aquaculture, 1999, 176(3/4): 227-235. |
| [9] |
KUMAR V S, PANDEY P K, ANAND T, et al. Biofloc improves water, effluent quality and growth parameters of Penaeus vannamei in an intensive culture system[J]. Journal of Environmental Management, 2018, 215: 205-215. |
| [10] |
HAMIDOGHLI A, WON S, AYA F A, et al. Dietary lipid requirement of whiteleg shrimp Litopenaeus vannamei juveniles cultured in biofloc system[J]. Aquaculture Nutrition, 2020, 26(3): 603-612. DOI:10.1111/anu.13021 |
| [11] |
AGUILERA-RIVERA D, ESCALANTE-HERRERA K, GAXIOLA G, et al. Immune response of the Pacific white shrimp, Litopenaeus vannamei, previously reared in biofloc and after an infection assay with Vibrio harveyi[J]. Journal of the World Aquaculture Society, 2019, 50(1): 119-136. DOI:10.1111/jwas.12543 |
| [12] |
DANTAS JR E M, VALLE B C S, BRITO C M S, et al. Partial replacement of fishmeal with biofloc meal in the diet of postlarvae of the Pacific white shrimp Litopenaeus vannamei[J]. Aquaculture Nutrition, 2016, 22(2): 335-342. DOI:10.1111/anu.12249 |
| [13] |
BALLESTER E L C, MARZAROTTO S A, DE CASTRO C S, et al. Productive performance of juvenile freshwater prawns Macrobrachium rosenbergii in biofloc system[J]. Aquaculture Research, 2017, 48(9): 4748-4755. DOI:10.1111/are.13296 |
| [14] |
LI J H, LI J Y, LI W, et al. Juvenile Procambarus clarkii farmed using biofloc technology or commercial feed in zero-water exchange indoor tanks: A comparison of growth performance, enzyme activity and proximate composition[J]. Aquaculture Research, 2019, 50(7): 1834-1843. DOI:10.1111/are.14065 |
| [15] |
FOLCH J, LEES M, SLOANE STANLEY G H. A simple method for the isolation and purification of total lipides from animal tissues[J]. Journal of Biological Chemistry, 1957, 226(1): 497-509. DOI:10.1016/S0021-9258(18)64849-5 |
| [16] |
钟君伟, 朱永安, 孟庆磊, 等. 氨氮对2种规格克氏原螯虾的急性毒性研究[J]. 长江大学学报(自科版), 2013, 10(23): 55-59. ZHONG J W, ZHU Y A, MENG Q L, et al. Acute toxicity of ammonia-N to two specifications of Procambarus clarkii adult[J]. Journal of Yangtze University (Natural Science Edition), 2013, 10(23): 55-59. |
| [17] |
任信林, 凌武海, 纪翠萍. 环境因子对克氏原螯虾养殖的影响[J]. 水产科学, 2009, 28(11): 710-712. REN X L, LING W H, JI C P. Effects of the environmental factors on breeding of Procambarus clarkii[J]. Fisheries Science, 2009, 28(11): 710-712. DOI:10.3969/j.issn.1003-1111.2009.11.024 |
| [18] |
张龙岗, 钟君伟, 朱永安. 温度对克氏原螯虾苗种生长和存活的影响[J]. 河北渔业, 2015(1): 4-5. ZHANG L G, ZHONG J W, ZHU Y A. Effects of temperature on seedling growth and survival of Procambarus clarkii[J]. Hebei Fisheries, 2015(1): 4-5. DOI:10.3969/j.issn.1004-6755.2015.01.002 |
| [19] |
李京昊, 成永旭, 王海锋, 等. 利用生物絮团技术对克氏原螯虾的养殖效果初探[J]. 水产学报, 2019, 43(4): 968-977. LI J H, CHEN Y X, WANG H F, et al. A preliminary study on the feeding effect of the red swamp crayfish (Procambarus clakii) using biofloc technology[J]. Journal of Fisheries of China, 2019, 43(4): 968-977. |
| [20] |
鲁璐, 罗国芝, 谭洪新, 等. 生物絮凝技术处理水产养殖用水效果的初步研究[J]. 渔业现代化, 2010, 37(6): 6-10, 14. LU L, LUO G Z, TAN H X, et al. Bio-flocs technology application in aquacultural water treatment[J]. Fishery Modernization, 2010, 37(6): 6-10, 14. DOI:10.3969/j.issn.1007-9580.2010.06.002 |
| [21] |
刘国兴, 李玲, 彭刚, 等. 放养密度对克氏原螯虾生长和养殖水质的影响[J]. 江西农业学报, 2014, 26(4): 86-89, 93. LIU G X, LI L, PENG G, et al. Effects of stocking density on growth of Procambarus clarkii and aquaculture water quality[J]. Acta Agriculturae Jiangxi, 2014, 26(4): 86-89, 93. DOI:10.3969/j.issn.1001-8581.2014.04.024 |
| [22] |
许元钊, 张春梅, 毕永红, 等. 饲料溶失对养殖水质的影响及其处置技术[J]. 水产学杂志, 2020, 33(4): 50-58. XU Y Z, ZHANG C M, BI Y H, et al. Effects of feed dissolution on water quality and its treatment technique in aquaculture[J]. Chinese Journal of Fisheries, 2020, 33(4): 50-58. DOI:10.3969/j.issn.1005-3832.2020.04.010 |
| [23] |
XU W N, LIU W B, SHEN M F, et al. Effect of different dietary protein and lipid levels on growth performance, body composition of juvenile red swamp crayfish (Procambarus clarkii)[J]. Aquaculture International, 2013, 21(3): 687-697. DOI:10.1007/s10499-012-9603-8 |
| [24] |
JOVER M, FERNÁNDEZ-CARMONA J, DEL RÍO M C, et al. Effect of feeding cooked-extruded diets, containing different levels of protein, lipid and carbohydrate on growth of red swamp crayfish (Procambarus clarkii)[J]. Aquaculture, 1999, 178(1/2): 127-137. |
| [25] |
LI J H, HUANG J, LI C L, et al. Evaluation of the nutritional quality of edible tissues (muscle and hepatopancreas) of cultivated Procambarus clarkii using biofloc technology[J]. Aquaculture Reports, 2021, 19: 100586. DOI:10.1016/j.aqrep.2021.100586 |
| [26] |
BALLESTER E L C, ABREU P C, CAVALLI R O, et al. Effect of practical diets with different protein levels on the performance of Farfantepenaeus paulensis juveniles nursed in a zero exchange suspended microbial flocs intensive system[J]. Aquaculture Nutrition, 2010, 16(2): 163-172. DOI:10.1111/j.1365-2095.2009.00648.x |
| [27] |
姜爱兰, 王信海, 金倩, 等. 不同底栖饵料对克氏原螯虾生长、消化酶活性、血清生化指标及肌肉营养成分的影响[J]. 江西农业学报, 2020, 32(1): 97-101. JIANG A L, WANG X H, JIN Q, et al. Effects of different benthos baits on growth, activities of digestive enzyme, serum biochemical indicators and muscle compositions of Procambarus clarkii[J]. Acta Agriculturae Jiangxi, 2020, 32(1): 97-101. |
| [28] |
徐增洪, 周鑫, 水燕. 克氏原螯虾的食物选择性及其摄食节律[J]. 大连海洋大学学报, 2012, 27(2): 166-170. XU Z H, ZHOU X, SHUI Y. Food preference and feeding rhythm in red swamp crayfish Procambarus clarkii[J]. Journal of Dalian Ocean University, 2012, 27(2): 166-170. DOI:10.3969/j.issn.1000-9957.2012.02.014 |
| [29] |
REN W J, LI L, DONG S L, et al. Effects of C/N ratio and light on ammonia nitrogen uptake in Litopenaeus vannamei culture tanks[J]. Aquaculture, 2019, 498: 123-131. DOI:10.1016/j.aquaculture.2018.08.043 |
| [30] |
LOBATO O S C, RIBEIRO F D S, MIRANDA-BAEZA A, et al. Production performance of Litopenaeus vannamei (Boone, 1931) fed with different dietary levels of tilapia processing waste silage reared in biofloc system using two carbon sources[J]. Aquaculture, 2019, 501: 515-518. DOI:10.1016/j.aquaculture.2018.12.006 |
| [31] |
刘杜娟, 潘晓艺, 尹文林, 等. 生物絮团在罗氏沼虾育苗中的应用[J]. 上海海洋大学学报, 2013, 22(1): 47-53. LIU D J, PAN X Y, YIN W L, et al. Bio-flocs technology application in breeding of Macrobrachium rosenbergii[J]. Journal of Shanghai Ocean University, 2013, 22(1): 47-53. |
| [32] |
罗静波, 曹志华, 蔡太锐, 等. 氨氮对克氏原螯虾幼虾的急性毒性研究[J]. 长江大学学报(自然科学版), 2006, 3(4): 183-185. LUO J B, CAO Z H, CAI T R, et al. Acute toxic research of ammonia nitrogen on Procambarus clarkii juvenile[J]. Journal of Yangtze University (Natural Science Edition), 2006, 3(4): 183-185. |
| [33] |
罗静波, 曹志华, 温小波, 等. 亚硝酸盐氮对克氏原螯虾仔虾的急性毒性效应[J]. 长江大学学报(自然科学版), 2005, 2(11): 64-66. LUO J B, CAO Z H, WEN X B, et al. Acute toxic effects of nitrite nitrogen on Procambarus clarkii post larvae[J]. Journal of Yangtze University (Natural Science Edition), 2005, 2(11): 64-66. |
| [34] |
MOORE P A. Agonistic behavior in freshwater crayfish: the influence of intrinsic and extrinsic factors on aggressive behavior and dominance[M]. Oxford: Oxford University Press, 2007: 90-114.
|
| [35] |
XU W J, PAN L Q. Effects of bioflocs on growth performance, digestive enzyme activity and body composition of juvenile Litopenaeus vannamei in zero-water exchange tanks manipulating C/N ratio in feed[J]. Aquaculture, 2012, 356-357: 147-152. |
| [36] |
肖英平, 吴志强, 胡向萍, 等. 克氏原螯虾幼体发育时期消化酶活力及氨基酸含量研究[J]. 淡水渔业, 2009, 39(1): 41-44. XIAO Y P, WU Z Q, HU X P, et al. Study on digestive enzyme activities and the contents of amino acid during the larval development of Procambarus clarkii[J]. Freshwater Fisheries, 2009, 39(1): 41-44. |
| [37] |
El-SAYED A F M. Use of biofloc technology in shrimp aquaculture: a comprehensive review, with emphasis on the last decade[J]. Reviews in Aquaculture, 2021, 13(1): 676-705. |
| [38] |
JONES D A, KUMLU M, LE VAY L, et al. The digestive physiology of herbivorous, omnivorous and carnivorous crustacean larvae: a review[J]. Aquaculture, 1997, 155(1/4): 285-295. |
| [39] |
苏时萍, 施培松, 杨启超, 等. 饲料蛋白质水平对克氏原螯虾幼体消化酶活性和肌肉成分的影响[J]. 安徽农业大学学报, 2009, 36(2): 231-235. SU S P, SHI P S, YANG Q C, et al. Effects of dietary protein levels on the activities of digestive enzymes and the muscle compositon of juvenile red swamp crayfish Procambarus clarkii Girard[J]. Journal of Anhui Agricultural University, 2009, 36(2): 231-235. |
| [40] |
PANIGRAHI A, ESAKKIRAJ P, JAYASHREE S, et al. Colonization of enzymatic bacterial flora in biofloc grown shrimp Penaeus vannamei and evaluation of their beneficial effect[J]. Aquaculture International, 2019, 27(6): 1835-1846. |
| [41] |
LE RUYET J P, ALEXANDRE J C, THÉBAUD L, et al. Marine fish larvae feeding: formulated diets or live prey?[J]. Journal of the World Aquaculture Society, 1993, 24(2): 211-224. |
| [42] |
JU Z Y, FORSTER I, CONQUEST L, et al. Enhanced growth effects on shrimp (Litopenaeus vannamei) from inclusion of whole shrimp floc or floc fractions to a formulated diet[J]. Aquaculture Nutrition, 2008, 14(6): 533-543. |
| [43] |
LONG L N, YANG J, LI Y, et al. Effect of biofloc technology on growth, digestive enzyme activity, hematology, and immune response of genetically improved farmed tilapia (Oreochromis niloticus)[J]. Aquaculture, 2015, 448: 135-141. |
| [44] |
VAZQUEZ L, ALPUCHE J, MALDONADO G, et al. Immunity mechanisms in crustaceans[J]. Innate Immunity, 2009, 15(3): 179-188. |
| [45] |
刘永涛, 董靖, 夏京津, 等. 不同饲料对稻田养殖克氏原螯虾生长、非特异性免疫酶及体成分的影响[J]. 中国渔业质量与标准, 2020, 10(1): 43-51. LIU Y T, DONG J, XIA L J, et al. Effects of different feeds on growth, non-specific immune enzymes and body composition of Crawfish, Procambarus clarkia cultured in rice fields[J]. Chinese Fishery Quality and Standards, 2020, 10(1): 43-51. |
| [46] |
任秀芳, 柏爱旭, 张萍, 等. 壳聚糖对水质和克氏原螯虾仔虾非特异性免疫酶的影响[J]. 江苏农业科学, 2013, 41(9): 202-204. REN X F, BAI A X, ZHANG P, et al. Effect of chitosan on water quality and non-specific immune enzymes in crayfish (Penaeus vannamei) littermates[J]. Jiangsu Agricultural Sciences, 2013, 41(9): 202-204. |
| [47] |
王海锋, 成永旭, 李京昊, 等. 干露和再入水对克氏原螯虾抗氧化应激能力的影响[J]. 南方水产科学, 2019, 15(5): 69-76. WANG H F, CHENG Y X, LI J H, et al. Effects of desiccation and resubmersion on oxidative stress response of crayfish (Procambarus clarkii)[J]. South China Fisheries Science, 2019, 15(5): 69-76. |
| [48] |
ANAND P S S, KUMAR S, KOHLI M P S, et al. Dietary biofloc supplementation in black tiger shrimp, Penaeus monodon: effects on immunity, antioxidant and metabolic enzyme activities[J]. Aquaculture Research, 2017, 48(8): 4512-4523. |
| [49] |
ZHAO P, HUANG J, WANG X H, et al. The application of bioflocs technology in high-intensive, zero exchange farming systems of Marsupenaeus japonicus[J]. Aquaculture, 2012, 354-355: 97-106. |
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
3. Center for Research on Environmental Ecology and Fish Nutrion, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China;
4. Aquatic Technology Promotion Station of Anhui Province, Hefei 230000, Anhui, China;
5. Dabeinong Shenshuang Aquatic Products Technology Cmpany, Zhaoan 363500, Fujian, China
 2022,
Vol. 31
2022,
Vol. 31


