2. 上海海洋大学 水产动物遗传育种中心上海市协同创新中心,上海 201306;
3. 上海海洋大学 上海水产养殖工程技术研究中心,上海 201306
全世界有淡水蚌类200多种,我国有100多种,这些淡水蚌主要分布在江河、池塘、湖泊等水域之中,如今,国内外主要用于生产珍珠的品种为三角帆蚌(Hyriopsis cumingii)、池蝶蚌(Hyriopsis schlegelii)、褶纹冠蚌(Cristaria plicata)和紫踵劈蚌(Potamilus alatus)等,其中三角帆蚌为我国特有种,是最主要的淡水育珠蚌[1]。三角帆蚌具有受精卵在雌蚌外鳃育儿囊发育至钩介幼虫的繁殖习性,因此,雌性三角帆蚌外鳃不仅是重要的呼吸和滤食器官[2],也是重要的受精发育场所,许多雌性水生生物也是如此[3-5]。国内学者对背角无齿蚌(Anodonta woodiana)、绢丝丽蚌(Lamprotula fibrosa Heude)、褶纹冠蚌及三角帆蚌鳃组织的初步研究早已开展[6-9]。三角帆蚌雌蚌外鳃发育为育儿囊的时期,怀卵雌性三角帆蚌外鳃腔内充满了早期发育胚胎,降低了鳃呼吸代谢效率,导致蚌处于低氧状态,因此,研究三角帆蚌在低氧条件下鳃组织形态变化和酶活性变化,对理解鳃育儿囊生理变化也具有重要意义。近年来,国内外关于环境因子对双壳贝类鳃结构的影响研究相继开展[5, 10-13],但目前对于淡水蚌类的低氧条件下生理生态的研究较少,且未发现关于低氧胁迫对三角帆蚌鳃组织生理生化影响的研究。
本文对雌性三角帆蚌外鳃进行1周年连续石蜡切片,观察其组织形态特征,探究雌性三角帆蚌外鳃组织形态周年变化规律, 并对低氧胁迫雌性三角帆蚌外鳃组织形态变化及酶活性变化做出初步研究,以期了解雌性三角帆蚌外鳃育儿囊结构和酶活性变化规律,为提升三角帆蚌苗种繁育技术奠定基础,进一步丰富三角帆蚌的繁殖生物学基础资料。
1 材料与方法 1.1 三角帆蚌养殖及选取将3龄三角帆蚌吊养在浙江武义伟民养殖基地同一养殖池塘,用于外鳃育儿囊形态周年变化观察及低氧胁迫实验。2019年1月至12月,每月从基地挑选20只健康雌性三角帆蚌送到实验室,选取5只外鳃完整的雌性三角帆蚌作为实验材料;12月时捞取60只同批次雌性三角帆蚌,设置低氧组和对照组,每组设3个重复,每个重复10只雌性三角帆蚌,分别置于体积为20 L的盛有曝气72 h自来水的塑料盆中。低氧胁迫组采用充氮方法,使水体中的溶解氧质量浓度维持在(1.7±0.2)mg/L,对照组充气增氧,溶解氧质量浓度维持在(7.9±0.2)mg/L,分别于第1、3、5、7、9天进行三角帆蚌的解剖取样。
1.2 鳃组织石蜡切片制作与观察取三角帆蚌外鳃组织,大小为5 mm×5 mm,浸没在质量分数为4%多聚甲醛固定液中20~24 h,然后转至75%乙醇(体积分数)中保存,备用。
外鳃组织脱水透明时,将75%乙醇中的组织取出,放置在做好标记的小烧杯中,进行梯度浓度乙醇脱水,使用70%乙醇进行第1次脱水,时间30 min, 再用80%乙醇脱水30 min, 然后用95%乙醇脱水20 min, 最后用无水乙醇脱水10 min(2次)。乙醇脱水完成后将组织放入二甲苯与无水乙醇体积比为1∶1的溶液中浸泡20 min, 然后转移至二甲苯溶液中进行透明,每次10 min,共2次。
浸蜡和包埋在65 ℃烘箱中进行,先将处理完的组织放入二甲苯与石蜡体积比为1∶1的溶液中浸泡60 min, 然后转入石蜡Ⅰ中浸泡60 min,再转入石蜡Ⅱ中浸泡60 min。取出浸泡完的组织逐个进行包埋,包埋完成后保存于4 ℃冰箱中固化,随后用切片机对包埋好的组织蜡块进行切片,厚度为5~6 μm,经过脱蜡、复水、H.E染色、中性树胶封片,制作成石蜡切片[14-15]。
用Lcica DM 2500生物显微镜观察其组织结构;用LAS V4.5软件来测量鳃瓣厚度及鳃腔宽度。
1.3 雌性三角帆蚌外鳃组织酶活性测定用于酶活性测定的外鳃组织置于-80 ℃冰箱中保存,采用试剂盒测定酶活性,分别为南京建成生物公司生产的过氧化氢(CAT)测定试剂盒、乳酸脱氢酶(LDH)试剂盒、总超氧化物歧化酶(SOD)试剂盒和琥珀酸脱氢酶(SDH)试剂盒,测定过程参考相关试剂盒说明书。
1.4 数据处理与分析采用SPSS 19.0软件进行统计分析,使用t检验的方法来进行显著性差异分析,P<0.05表示差异显著,P<0.01表示差异极显著。
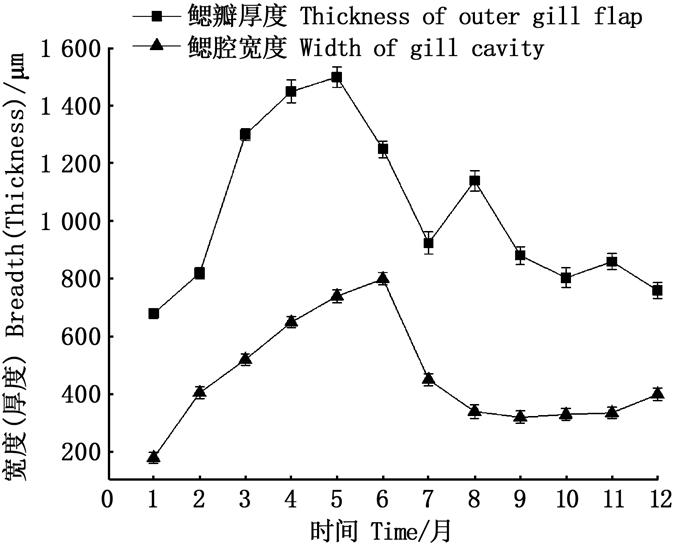
2 结果 2.1 雌性三角帆蚌外鳃组织形态周年变化1至12月,对3龄雌性三角帆蚌的外鳃组织取样制作石蜡切片,观察发现三角帆蚌的外鳃育儿囊的生理结构会在繁育季节发生明显变化,如图 1~3所示,外鳃瓣的厚度在5月达到最大,外鳃瓣厚度为(1 576.52±112.56)μm,较最低厚度的1月(685.43±32.25)μm显著增厚130.07%,5月之后鳃瓣厚度逐渐变薄,在8月时出现第2次增厚趋势,随后一直减小;鳃腔宽度在1—6月呈增长趋势,6—9月呈缩小趋势,9—12月则无较显著变化,在6月时达到最大值(754.42±43.23)μm,较1月的最低值(178.57±26.36)μm显著提升约171.22%, 在3—6月的繁殖季节,外鳃瓣发育为育儿囊,组织切片的鳃腔中发现了许多三角帆蚌早期发育胚胎,该时期外鳃瓣厚度明显增加,鳃腔也显著扩大(P<0.05),为受精卵的发育提供了足够的空间。
|
图 1 雌性三角帆蚌外鳃鳃瓣厚度及鳃腔宽度周年变化 Fig. 1 Annual changes of outer gill flap thickness and gill cavity width of female Hyriopsis cumingii |
|
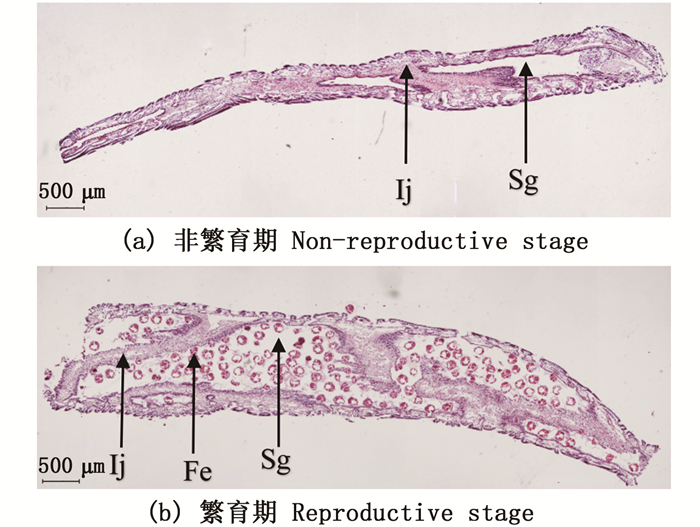
Ij.interlamellar junction (瓣间隔);Sg.small gill cavities (鳃小腔);Fe.fertilized eggs(受精卵)。 图 2 雌性三角帆蚌外鳃纵切对比图 Fig. 2 Contrast diagram of longitudinal-cut outer gill of female Hyriopsis cumingii |
|
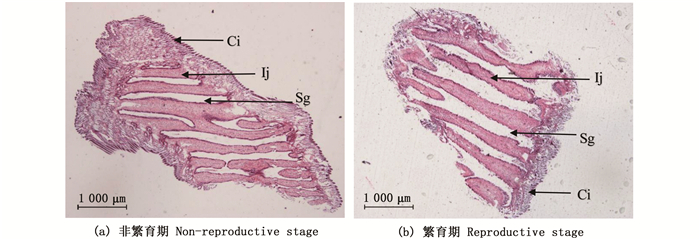
Ci.cilium(纤毛);Ij.interlamellar junction (瓣间隔);Sg.small gill cavities (鳃小腔)。 图 3 雌性三角帆蚌外鳃横切对比图 Fig. 3 Contrast of cross sections of outer gill of female Hyriopsis cumingii |
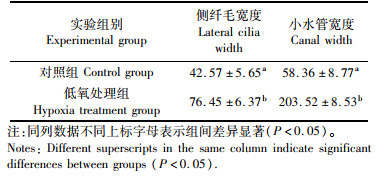
由表 1及图 4、5所示,三角帆蚌外鳃侧纤毛在低氧环境下,较对照组贴合逐渐紧密,在低氧胁迫5 d后,外鳃侧纤毛宽度增长为(76.45±6.37)μm,较对照组的侧纤毛宽度(42.57±5.65)μm提高了79.58%;同样,三角帆蚌呼吸作用中的重要结构小水管也明显增宽,在低氧胁迫5 d后,鳃小水管宽度增加为(203.52±8.53)μm,较对照组三角帆蚌的鳃小水管宽度(58.36±8.77)μm增加了248.73%。
|
表 1 低氧处理5 d后三角帆蚌外鳃侧纤毛宽度与小水管宽度的变化
Tab.1 Changes of cilia width and aqueduct width in the lateral gill of H. cumingii exposed to hypoxia for 5 days |

|
图 4 低氧胁迫后雌性三角帆蚌外鳃侧纤毛组织切片图 Fig. 4 Histological section of cilia on the lateral gill of female H. cumingii under hypoxia stress |

|
Ca.canal(小水管)。 图 5 低氧胁迫后雌性三角帆蚌外鳃小水管组织切片图 Fig. 5 Histological section of outer gill aqueduct of female H. cumingii under hypoxia stress |
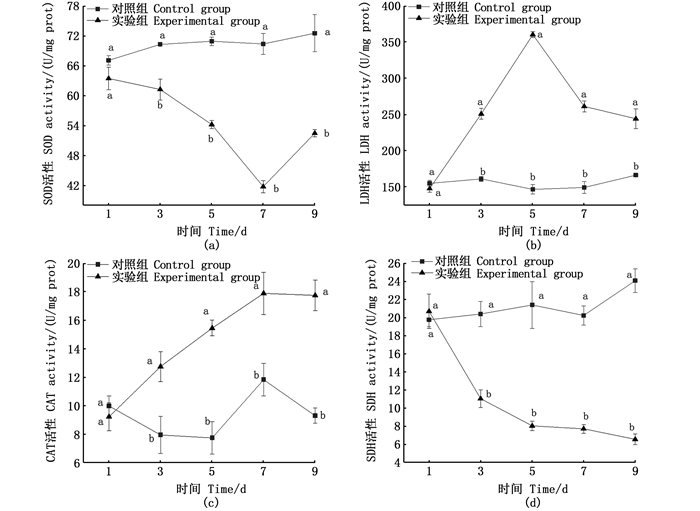
由图 6可知:低氧处理3、5、7、9 d的三角帆蚌外鳃LDH活性都显著高于对照组(P < 0.05),在1~5 d时LDH活性呈现显著的上升趋势,5~9 d呈下降趋势,在第5天实验组LDH活性达到最高值(360.38±4.07)U/mg prot较对照组的(155.94±4.92)U/mg prot显著提升了131.1%;三角帆蚌外鳃中的SOD活性在3、5、7、9 d的都显著低于对照组(P < 0.05),在1~7 d时SOD的活性呈持续下降的趋势,7~9 d缓慢上升,在第7天时实验组达到最低值(41.79±1.22)U/mg prot较对照组(70.28±4.92)U/mg prot显著降低了40.53%;三角帆蚌外鳃中CAT活性在1~7 d时呈持续上升趋势,第7~9天无显著(P>0.05)变化,都显著高于对照组(P < 0.05),在第7天实验组达到最高值(17.91±1.49)U/mg prot,较对照组平均值(9.36±0.96)U/mg prot显著提升了91.34%;随着低氧胁迫时间增加,三角帆蚌中SDH活性在1~9 d持续下降,低氧胁迫下三角帆蚌外鳃中SDH活性都显著低于对照组(P < 0.05),在第9天实验组达到最低值(6.59±0.57)U/mg prot,较对照组(21.19±1.46)U/mg prot显著降低了68.9%。
|
同时间数据不同上标字母表示组间差异显著(P < 0.05)。 Different superscript letters indicate significant difference between groups at the same time (P < 0.05). 图 6 雌性三角帆蚌在低氧条件下外鳃组织中4种酶活性变化 Fig. 6 Changes of four enzymes in the outer gill of female H. cumingii under hypoxia |
外鳃是三角帆蚌主要的呼吸器官,也是滤食器官,对于雌性三角帆蚌来说还是重要的繁殖器官,有研究[16-17]表明前侧纤毛与三角帆蚌的摄食中食物运输有关,有一定的滤食作用,三角帆蚌的鳃丝前侧毛会相互搭接形成一个过滤网[18-20],从而筛选过滤食物。通过对3龄三角帆蚌外鳃进行为期1年(每月1次)的石蜡切片制作,观察三角帆蚌外鳃结构的周年变化,发现雌性三角帆蚌中有许多鳃小腔,而这些鳃小腔就是三角帆蚌受精卵发育的地方,3—6月在进入繁殖期时,雌性三角帆蚌的外鳃会逐渐变厚,外鳃中的鳃小腔变大,给受精卵发育提供足够的发育空间。根据邓道贵等[3]的研究,褶纹冠蚌在繁殖期间其鳃丝会明显变宽,繁殖期后会恢复到正常水平,且瓣间隔上的单层柱状上皮细胞顶端及其附近的外鳃腔内含有丰富的分泌物,瓣间隔发生扭曲, 并突出鳃水管内, 将鳃水管隔成更多更小的空腔, 作为胚胎发育的孵化室。笔者观察到的三角帆蚌鳃丝并没有明显增宽,但繁殖期间,三角帆蚌瓣间隔会发生不同程度的曲折,从而把鳃腔隔成许多育儿囊用于受精卵发育。这与褶纹冠蚌将鳃水管隔成更多更小的空腔相似。在4、5月的三角帆蚌外鳃切片中发现大量的三角帆蚌早期胚胎,为三角帆蚌的生物学研究提供依据。根据实验数据所得,外鳃瓣在3—6月与8月处皆有上升趋势,证明三角帆蚌在1年中有2次生理繁殖状态,但是3—6月的波峰显著高于8月,表明3—6月是三角帆蚌的主要繁殖时间。
3.2 低氧胁迫对雌三角帆蚌外鳃组织形态及生理变化的影响在低氧条件下,三角帆蚌为了从缺氧水体中获得更多氧气,除了提高鳃丝血细胞的携氧能力外[20],最直接的方法就是加大水流和加快滤水[21]。本研究发现,在低氧胁迫条件下三角帆蚌的外鳃上侧纤毛组织会变粗,加大滤水的速度,且外鳃组织内部的小水管也会明显增宽,用来增加水流速度与滤水量,从而在缺氧的水体中获得更多的氧气。
3.2.1 低氧胁迫对雌性三角帆蚌外鳃中部分抗氧化酶活性的影响SOD的活性高低反映了生物机体对O2-清除能力的高低,随着低氧胁迫时间的增长,三角帆蚌摄入的O2减少,机体产生的O2-减少,故而在实验组测得的SOD含量相对于对照组显著(P<0.05)降低,PANNUNZIO等[22]与WILLMORE等[23]的研究也发现类似结果,三角帆蚌所处水体DO过低,导致反应底物缺少,SOD的活力也随之下降,但在低氧胁迫第9天SOD的活性与对照组无明显差异,可能是由于个体差异所致。CAT是抗氧化系统中的关键酶之一,能催化H2O2分解为H2O和O2[24-25],三角帆蚌外鳃在低氧胁迫下CAT的活性上升,证明了低氧胁迫下三角帆蚌外鳃机体内反应底物H2O2增加,分解后获得更多的氧气。对鱼类的研究也表明,在低氧胁迫下,鱼体鳃组织中CAT的活性会上升[26]。
3.2.2 低氧胁迫对雌性三角帆蚌外鳃中部分呼吸酶活性的影响LDH能够催化生物体内丙酮酸和乳酸相互转化,是无氧代谢过程中非常重要的酶,其活性通常能反映出无氧代谢的水平[27],故常被用作反映无氧代谢能力大小的重要指标[23]。本实验中,三角帆蚌在低氧胁迫下外鳃中的LDH活力显著高于(P < 0.05)对照组,且在低氧胁迫第7天达到最高值,低氧胁迫7 d与9 d的LDH活力无显著(P>0.05)差异,反映三角帆蚌在低氧胁迫下,LDH的活性会达到最高值后趋于稳定。SDH是参与柠檬酸循环及呼吸电子传递的酶,是有氧代谢中的一种标志酶,其活性能大致反映出有氧代谢的水平,所以,通常被用来衡量机体有氧呼吸能力大小的重要指标[28]。本实验中, 在低氧胁迫下三角帆蚌的外鳃中SDH的活性都显著低于(P<0.05)对照组,本研究结果与低氧环境导致青海沙蜥(Phrynocephalus vlangalii)和日本沼虾(Macrobrachium nipponense)组织中的SDH活性降低、LDH活性增强的研究[26, 29]结果相同,表明三角帆蚌在低氧环境下呼吸酶活性会随着低氧时间增加而显著变化,且抗氧化系统会显著波动导致抗氧化酶活性显著变化。
| [1] |
严俊, 方飚, 张姗姗, 等. 双壳纲三角帆蚌贝壳的三维微结构及其化学组成研究[J]. 材料导报, 2013, 27(16): 108-112. YAN J, FANG B, ZHANG S S, et al. Study on three-dimensional microstructure and chemical composition of bivalve shells of Hyriopsis cumingii (Lea)[J]. Materials Review, 2013, 27(16): 108-112. DOI:10.3969/j.issn.1005-023X.2013.16.029 |
| [2] |
刘佳敏. 三角帆蚌细胞周期蛋白筛选及其功能的初步分析[D]. 上海: 上海海洋大学, 2019. LIU J M. Screening and preliminary functional identification of cyclin from Hyriopsis cymingii[D]. Shanghai: Shanghai Ocean University, 2019. |
| [3] |
邓道贵, 李瑞芝. 褶纹冠蚌鳃的组织学和扫描电镜观察[J]. 水产学报, 2002, 26(4): 301-306. DENG D G, LI R Z. Histological and scanning electron microscopic observations on the gill of Cristaria plicata[J]. Journal of Fisheries of China, 2002, 26(4): 301-306. |
| [4] |
张硕, 董双林, 王芳. 中国对虾生物能量学研究Ⅰ——温度、体重、盐度和摄食状态对耗氧率和排氨率的影响[J]. 青岛海洋大学学报, 1998(2): 223-227. ZHANG S, DONG S L, WANG F. Studies on the bioenergetics of Penaeus chinensis Ⅰ. oxygen consumption and ammonia N excretion rates under different conditions[J]. Journal of Ocean University of Qingdao, 1998(2): 223-227. |
| [5] |
孙虎山, 王晓安. 紫彩血蛤鳃的组织化学和扫描电镜研究[J]. 动物学杂志, 1999, 34(4): 9-12. SUN H S, WANG X A. Histochemical and electron scanning microscopic studies on the gills of Nuttallia olivacea[J]. Chinese Journal of Zoology, 1999, 34(4): 9-12. |
| [6] |
张根芳, 王旦旦, 方爱萍, 等. 三角帆蚌怀卵期外侧瓣鳃结构初步研究[J]. 上海水产大学学报, 2006, 15(4): 419-424. ZHANG G F, WANG D D, FANG A P, et al. Preliminary study on outside lamina structure of Hyriopsis cumingii during egg-bearing period[J]. Journal of Shanghai Fisheries University, 2006, 15(4): 419-424. |
| [7] |
丛宁, 袁莉民. 背角无齿蚌外套膜和鳃瓣的扫描电镜初步观察[J]. 水生生物学报, 1993, 17(3): 288-289. CONG N, YUAN L M. Preliminary scanning electron microscopic observations on mantle and gill lamella of Anodonta woodiana Lea[J]. Acta Hydrobiologica Sinica, 1993, 17(3): 288-289. DOI:10.3321/j.issn:1000-3207.1993.03.015 |
| [8] |
欧阳珊, 吴小平, 舒凤月, 等. 淡水瓣鳃类鳃的扫描电镜观察[J]. 南昌大学学报(理科版), 2000, 24(2): 188-191. OUYANG S, WU X P, SU F Y, et al. Sem observation on the gill of freshwater Lamellibranchia[J]. Journal of Nanchang University (Natural Science), 2000, 24(2): 188-191. DOI:10.3969/j.issn.1006-0464.2000.02.018 |
| [9] |
张训蒲, 陈宇, 龚世园. 绢丝丽蚌鳃的显微结构观察[J]. 华中农业大学学报, 2007, 26(3): 376-379. ZHANG X P, CHEN Y, GONG S Y. Microstructure of gills of Lamprotula fibrosa[J]. Journal of Huazhong Agricultural University, 2007, 26(3): 376-379. DOI:10.3321/j.issn:1000-2421.2007.03.024 |
| [10] |
GREGORY M A, GEORGE R C. The structure and surface morphology of gill filaments in the brown mussel Perna perna[J]. African Zoology, 2000, 35(1): 121-129. |
| [11] |
CHEUNG S G, SHIN P K S. Size effects of suspended particles on gill damage in green-lipped mussel Perna viridis[J]. Marine Pollution Bulletin, 2005, 51(8/12): 801-810. |
| [12] |
崔龙波, 侯竹美, 周雪莹. 缢蛏鳃的光镜与扫描电镜研究[J]. 水产科学, 2006, 25(3): 129-132. CUI L B, HOU Z M, ZHOU X Y. Light and electron microscopic observation of gill in Sinonvaculina constricta[J]. Fisheries Science, 2006, 25(3): 129-132. |
| [13] |
崔龙波, 刘传林, 陆瑶华, 等. 大连湾牡蛎鳃的光镜和扫描电镜研究[J]. 水产学报, 1998, 22(s1): 1-6. CUI L B, LIU C L, LU Y H, et al. Studies on the gill of Ostrea talienwhanensis crosse with optical and scanning electron microscopes[J]. Journal of Fisheries of China, 1998, 22(s1): 1-6. |
| [14] |
周杰, 刘艳, 张桂荣, 等. 石蜡切片技术改进及细胞生物学实验的统筹[J]. 实验室研究与探索, 2014, 33(5): 167-170. ZHOU J, LIU Y, ZHANG G R, et al. Improvement of the technology of paraffin sections and the time arrangement in cell biology experiments[J]. Research and Exploration in Laboratory, 2014, 33(5): 167-170. |
| [15] |
李洁. 石蜡切片技术在本科实验教学中的应用[J]. 中国现代教育装备, 2008(12): 103-105. LI J. The application of paraffin-section technique in experiment education for undergraduate[J]. China Modern Educational Equipment, 2008(12): 103-105. |
| [16] |
刘巧林, 许宝红, 钟蕾, 等. 三角帆蚌瘟病组织病理学动态变化[J]. 湖南农业大学学报(自然科学版), 2009, 35(4): 406-411. LIU Q L, XU B H, ZHONG L, et al. Histopathological on dynamic characteristics of Hyriopsis cumingii plague[J]. Journal of Hunan Agricultural University (Natural Sciences), 2009, 35(4): 406-411. |
| [17] |
费志良, 吴军, 赵钦, 等. 三角帆蚌对藻类滤食及消化的研究[J]. 淡水渔业, 2006, 36(5): 24-27. FEI Z L, WU J, ZHAO Q, et al. Effect of filtration and digestion of Hyriopsis cumingii to algae[J]. Freshwater Fisheries, 2006, 36(5): 24. |
| [18] |
闻海波, 徐钢春, 华丹. 圆背角无齿蚌幼蚌在特定条件下的选择滤食与生长的初步研究[J]. 上海水产大学学报, 2005, 14(4): 464-467. WEN H B, XU G C, HUA D. Preliminary study on the selective feeding and growth of Anodonta woodiana Pacifica juveniles under the particular conditions[J]. Journal of Shanghai Fisheries University, 2005, 14(4): 464-467. |
| [19] |
BECK K, NEVES R J. An evaluation of selective feeding by three age-groups of the rainbow mussel Villosa iris[J]. North American Journal of Aquaculture, 2003, 65(3): 203-209. |
| [20] |
顾叶丹, 尚跃勇, 袁明哲, 等. 缺氧和有毒微囊藻胁迫下三角帆蚌鳃和主要消化器官以及晶杆体的扫描电镜观察[J]. 水产学报, 2016, 40(9): 1486-1496. GU Y D, SHANG Y Y, YUAN M Z, et al. Scanning electron microscopic observations of gill, digestive organ and crystal rod of Hyriopsis cumingii exposed to hypoxia and toxic Microcystis aeruginosa[J]. Journal of Fisheries of China, 2016, 40(9): 1486-1496. |
| [21] |
DABRUZZI T F, BENNETT W A. Hypoxia effects on gill surface area and blood oxygen-carrying capacity of the Atlantic stingray, Dasyatis sabina[J]. Fish Physiology and Biochemistry, 2014, 40(4): 1011-1020. |
| [22] |
PANNUNZIO T M, STOREY K B. Antioxidant defenses and lipid peroxidation during anoxia stress and aerobic recovery in the marine gastropod Littorina littorea[J]. Journal of Experimental Marine Biology and Ecology, 1998, 221(2): 277-292. |
| [23] |
WILLMORE W G, STOREY K B. Antioxidant systems and anoxia tolerance in a freshwater turtle Trachemys scripta elegans[J]. Molecular and Cellular Biochemistry, 1997, 170(1/2): 177-185. |
| [24] |
杨佳栋, 魏凤菊, 潘新新, 等. 动物过氧化氢酶(CAT)的研究进展[J]. 黑龙江畜牧兽医, 2016(13): 59-62. YANG J D, WEI F J, PAN X X, et al. Research process of animal catalase (CAT)[J]. Heilongjiang Animal Science and Veterinary Medicine, 2016(13): 59-62. |
| [25] |
LUSHCHAK V I, LUSHCHAK L P, MOTA A A, et al. Oxidative stress and antioxidant defenses in goldfish Carassius auratus during anoxia and reoxygenation[J]. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology, 2001, 280(1): 100-107. |
| [26] |
管越强, 王慧春, 李利. 硫化物胁迫对日本沼虾呼吸代谢和能量代谢酶的影响[J]. 生态环境学报, 2009, 18(6): 2017-2022. GUAN Y Q, WANG H C, LI L. Effects of sulphide on the enzyme of respiratory metabolism and energy metabolism of Macrobrachium nipponense[J]. Ecology and Environment, 2009, 18(6): 2017-2022. |
| [27] |
RUTTER J, WINGE D R, SCHIFFMAN J D. Succinate dehydrogenase-Assembly, regulation and role in human disease[J]. Mitochondrion, 2010, 10(4): 393-401. |
| [28] |
COHEN A, NUGEGODA D, GAGNON M M. Metabolic responses of fish following exposure to two different oil spill remediation techniques[J]. Ecotoxicology and Environmental Safety, 2001, 48(3): 306-310. |
| [29] |
和建政. 青海沙蜥低氧习服和适应的不同调节机制及低氧对荒漠沙蜥体温调节和静止代谢率的影响[D]. 兰州: 兰州大学, 2013. HE J Z. The different mechanisms of hypoxic acclimatization and adaption in lizard Phrynocephalus vlangalii, thermo regulatory and metabolic responses to hypoxia in lizard, Phrynocephalus przewalskii[D]. Lanzhou: Lanzhou University, 2013. |
2. Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


