2. 上海海洋大学 水产种质资源发掘与利用教育部重点实验室,上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心,上海 201306;
4. 上海海洋大学 海洋科学学院,上海 201306
溶氧量(dissolved oxygen, DO)是水生态环境的关键理化因子之一,也是鱼类养殖中的重要限制因素。低溶氧量即低氧,会对鱼类的行为、生理学、免疫学和生长产生负面影响[1-3]。在饲养中,长时间缺氧会导致鱼类采食量降低,生长迟缓且极易患病[4-5]。研究[6-7]表明,鱼类缺氧后其红细胞(red blood cell,RBC),血红蛋白(hemoglobin,Hb)和/或血细胞比容(hematocrit,Ht)会迅速增加。血红蛋白是红细胞内运输氧的重要蛋白质,因此,在低氧条件下,需要合成更多的血红蛋白以增加氧气的供应。
铁离子是血红蛋白的主要成分之一,机体内有60%~75%的铁用于血红蛋白的合成。同时,铁还参与各种重要的生理活动,例如DNA的合成和修复、多种酶活性的调节、各种代谢和免疫反应等[8-10],因此铁供应不足或过量都会引起机体病变。而肝脏作为机体对外界刺激反应最早、最敏感的组织之一,也是最早出现损伤的组织,严重时则会使鱼类肝脏处于超负荷状态[11]。同时,肝脏在铁稳态中也起着重要作用,其不仅是体内多余铁的储存场所,而且在调节肠上皮细胞和巨噬细胞释放铁离子到血液中也起着至关重要的作用[12-13]。
因此,本研究通过建立缺氧或补铁或去铁的ZFL模型,探究铁代谢对ZFL细胞在低氧适应过程中的影响,旨在从分子机制层面研究ZFL细胞在低氧环境中的反应以及铁离子对其适应低氧胁迫的影响,从而为今后深入研究鱼类应对低氧胁迫的调控机制奠定基础。
1 材料与方法 1.1 主要试剂主要试剂:胎牛血清(Gibco,美国);DMEM F12培养基(Gibco,美国);Alamar Blue试剂盒(Invitrogen,美国);柠檬酸铁胺(Sigma-Aldrich,美国);去铁胺(Abcam,英国);TRIzol试剂(Ambion,美国);反转录试剂盒(TaKaRa,日本);SYBR Green Ⅰ荧光定量染料(Roche,瑞士);Ferritin抗体(杭州华安生物技术有限公司,杭州);Actin抗体(杭州华安生物技术有限公司,杭州);蛋白显影液(上海碧云天生物技术有限公司,上海);H2DCFDA ROS探针(ThermoFisher,美国)
1.2 实验方法 1.2.1 细胞培养及低氧胁迫取出保存于液氮中冻存的ZFL细胞系,28 ℃溶解后800 r/min离心5 min,去掉上清,细胞沉淀加入到含10% 胎牛血清和1% PS抗生素的DMEM完全培养基中,置于28 ℃、5% CO2培养箱中进行培养。待细胞密度生长至80% ~ 90% 时,用0.25%胰酶进行消化传代。当获得足够数量的ZFL细胞时,将一部分ZFL细胞进行低氧胁迫处理,即通过不断的充入N2使培养箱内氧气含量恒定维持在0.1%。对ZFL细胞低氧胁迫后,分别提取实验组和对照组细胞的总RNA和总蛋白进行验证实验。
1.2.2 实验分组及处理将生长状态良好的ZFL细胞分为(1)常氧组:ZFL细胞在28 ℃、5% CO2、21% O2的正常培养箱中进行培养;(2)低氧组:ZFL细胞在28 ℃、5% CO2、0.1% O2的培养箱中培养2~5 d;(3)FAC组(补充铁处理):分别用含有不同浓度FAC(0、0.1、0.25、0.5、0.75、1、2 mmol/L)的培养基在28 ℃、5% CO2、0.1% O2的培养箱中培养ZFL细胞2~5 d;(4)DFO组(清除铁处理):分别用含有不同浓度DFO(0、10、30、50、70、90、100 μmol/L)的培养基在28 ℃、5% CO2、0.1% O2的培养箱中培养ZFL细胞2~5 d。
1.2.3 Alamar blue法检测细胞活力将适量对数生长期的ZFL细胞接种于96孔板,每组设置4个重复孔。细胞过夜培养后按照1.2.2节分组处理。分别在2、3、4和5 d各拿出1组常氧组、低氧组、FAC组和DFO组细胞测定其在不同处理条件下的活力情况:首先在培养基中加入10 μL Alamar blue溶液,28 ℃继续培养细胞3 h。然后使用微量酶标仪分别检测细胞在570 nm和600 nm波长下的吸光值,并将常氧组样品的吸光值设置为100% 来计算不同处理后细胞的活力变化情况。细胞活力为处理组样品的OD值与常氧组样品的OD值之比。
1.2.4 蛋白免疫印迹检测细胞的铁蛋白表达水平变化铁蛋白是机体内贮存铁的可溶性组织蛋白,其分子量约为500 ku,由2种亚基按不同比例组成,一种是重链亚基(Heavy chain,H),分子量约为21 ku,另一种是轻链亚基(Light chain,L),分子量约为19 ku,本研究主要以检测铁蛋白重链的表达水平来表示铁蛋白的表达水平[14]。为了检测常氧组、低氧组、FAC组和DFO组细胞中铁蛋白的表达情况,首先取低氧处理3 d的ZFL细胞,去掉培养基,向各组的ZFL细胞中加入适量细胞裂解液(RIPA-buffer),再加入1%蛋白酶抑制剂(PMSF),4 ℃裂解20 min后,15 000 r/min离心10 min,获得的上清即为总蛋白溶液。然后利用BCA法测定各蛋白浓度后,再用12%的聚丙烯酰胺凝胶进行蛋白分离,0.22 μm的PVDF膜进行转膜,5%脱脂奶粉封闭2.5 h,3%脱脂奶粉稀释的一抗4 ℃过夜孵育,PBST洗涤液清洗3次后,孵育二抗2 h,洗涤后进行蛋白显影。
1.2.5 相对定量PCR检测细胞的铁代谢相关基因mRNA表达水平的变化采用TRIzol法分别提取常氧和低氧处理3 d的各组ZFL细胞的总RNA,并测定RNA的浓度和纯度。利用反转录试剂盒合成cDNA,以cDNA为模板进行PCR扩增,并以β-actin为内参(表 1)。采用2-ΔΔCt法计算各基因的相对mRNA表达水平。

|
表 1 引物信息 Tab.1 Primer information |
收集低氧处理3 d的各组ZFL细胞和对照组细胞,按照说明书加入适量的H2DCFDA工作液。将细胞置于28 ℃孵育30 min后,去掉工作液,PBS清洗3次,利用BD Accuri C6流式细胞仪定量荧光强度,并用ZEISS荧光显微镜观察ROS水平。
1.2.7 统计学处理运用GraphPad Prism 7软件对数据进行作图分析,所有实验均设3次重复,利用t检验检测不同样品间的差异显著性(P < 0.05表示有统计学差异;P < 0.01表示有显著统计学差异;P < 0.001表示有极其显著的统计学差异)。
2 结果 2.1 铁离子浓度影响低氧胁迫下ZFL细胞的存活率 2.1.1 低氧胁迫下补充铁离子可提高ZFL细胞的增殖能力和存活率为了探究低氧胁迫下铁离子浓度对ZFL细胞生存能力的影响,利用FAC对ZFL细胞进行外源补铁。结果表明,随着低氧胁迫(0.1% O2)时间的延长,与常氧组(control-21% O2)相比,未补充FAC的ZFL细胞(0 mmol/L)的增殖能力和存活率逐渐下降。而补充不同浓度FAC的ZFL细胞较未补充外源铁的低氧组(0 mmol/L)的增殖能力和存活率显著提高(图 1)。并且在低氧胁迫2 d时,FAC组(0.1、0.25、0.5 mmol/L)细胞的增殖能力和存活率甚至高于常氧组[图 1(a)]。而第4、5天时,与低氧组(0 mmol/L)相比,FAC组ZFL细胞的存活率增加了约2~3倍。因此,补充外源铁离子能够提高ZFL细胞在低氧条件下的增殖能力和存活率。

|
柱状图上方*表示与低氧组(0 mmol/L)相比在P < 0.05水平有有统计学差异;**表示在P < 0.01水平有显著统计学差异;***代表在P < 0.001水平有极其显著的统计学差异。 *. Represented statistical difference(P < 0.05)compared with the hypoxic group (0 mmol/L); **. There are significantly statistical differences at P < 0.01 level; ***. There are significant statistical differences at P < 0.001 level. 图 1 不同浓度FAC处理的ZFL细胞进行低氧胁迫2~5 d后的细胞存活率 Fig. 1 Cell survival rate of ZFL cells treated with different concentrations of FAC after 2-5 days of hypoxic stress |
去铁胺(DFO)能够螯合游离铁、铁蛋白和含铁血黄素中的铁离子[15],因此利用DFO清除ZFL细胞的内源及外源铁离子。实验结果表明,随着低氧胁迫(0.1% O2)时间的延长,不同浓度的DFO处理后,仅在处理第2天时,ZFL细胞的增殖能力和存活率比未清除铁的低氧组(0 μmol/L)略有下降,其中当DFO浓度为70 μmol/L时最为明显,约减少了25%[图 2(a)]。但是处理第4天,当DFO浓度为10~50 μmol/L时,ZFL细胞的增殖能力和存活率反而比低氧组(0 μmol/L)增加约30%。而第3天和第5天无显著的变化。综上所述,清除内源和外源铁离子能在一定程度上改变ZFL细胞在低氧条件下的增殖能力和存活率。
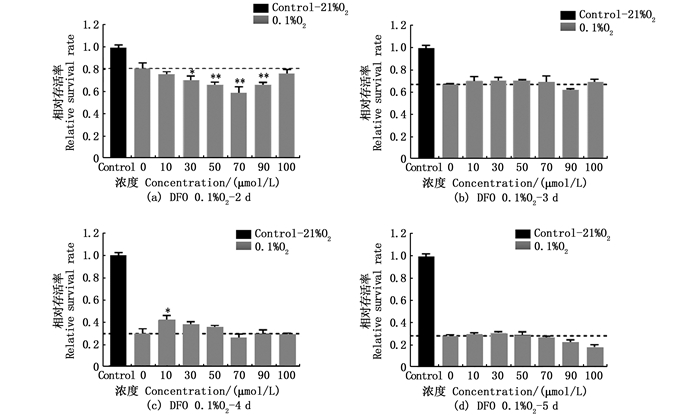
|
柱状图上方*表明与低氧组(0 μmol/L)相比在P < 0.05水平有统计学差异;**表示在P < 0.01水平有显著统计学差异。 *. Represented statistical difference(P < 0.05)compared with the hypoxic group (0 μmol/L); **. There are significantly statistical differences at P < 0.01 level. 图 2 不同浓度DFO处理的ZFL细胞进行低氧胁迫2~5 d后的细胞存活率 Fig. 2 Cell survival rate of ZFL cells treated with different concentrations of DFO after 2-5 days of hypoxic stress |
为了进一步探究铁离子含量对ZFL细胞应激低氧胁迫的影响,对在低氧胁迫(0.1% O2)条件下培养3 d的FAC组、DFO组和WT组的细胞状态进行形态学观察,结果表明FAC组的活细胞数量显著多于DFO组和WT组,且细胞状态良好,死细胞较少[图 3(a)]。继而对铁蛋白重链(Ferritin heavy chain,FTH)的表达水平检测发现,与常氧组(21% O2)相比,低氧胁迫后ZFL细胞中FTH的表达量明显减少,而FAC补铁后,细胞中的FTH表达量急剧增加,同时DFO去除Fe3+后,则呈相反趋势[图 3(b)]。这些结果说明细胞中铁离子的含量对ZFL细胞应对低氧胁迫至关重要,外源补铁能够提高低氧胁迫下ZFL细胞中铁离子的水平,从而提高低氧胁迫下ZFL细胞的存活率。

|
图 3 低氧胁迫下不同处理的ZFL细胞的显微观察和FTH表达水平检测 Fig. 3 Microscopic observation and ferritin heavy chain expression level of ZFL cells with different treatments under hypoxic stress |
铁泵蛋白(Ferroportin,FPN)是脊椎动物细胞中目前已知的唯一铁跨膜外排蛋白,吸收进入小肠上皮的铁离子最终通过FPN进入血液循环系统[16-17]。而转铁蛋白(transferrin,TF)是血浆中主要的含铁蛋白质,负责机体内铁的运输,携带铁离子的TF与发育中的红细胞表面的高亲和性转铁蛋白受体1 (transferrin receptor 1,TFR1)结合,Tf-Fe/TFR复合体通过内吞进入细胞内,为细胞活动提供铁离子[18-20]。血液循环中的铁,满足机体所需后,多余的铁则存储在铁蛋白(Ferritin)中[21]。由此可见,这些蛋白的表达水平对铁代谢具有重要的调控作用。为了探究铁稳态在ZFL细胞应激低氧胁迫中的作用,利用相对定量PCR技术,检测FAC组、DFO组、低氧组和常氧组的ZFL细胞中的铁泵蛋白、转铁蛋白和铁蛋白相关基因的mRNA表达水平。结果表明,与常氧组(21% O2)相比,低氧胁迫后ZFL细胞中的铁泵蛋白基因(fpn)、转铁蛋白及其受体基因(tfa 和tfr2 )和铁蛋白基因(fthl27、fthl28、fthl31)的mRNA表达量均显著下降,从而导致低氧胁迫下细胞内的总铁水平及铁离子的利用率均降低。但是向细胞内添加FAC能够在一定程度上恢复这些基因的表达水平,其中铁蛋白基因(fthl27、fthl28、fthl31)的表达量甚至远高于常氧组,fthl28 的表达水平更是比常氧组增加了7.5倍,这一结果与铁蛋白表达量增加一致。内源及外源铁离子的清除进一步降低了这些与铁吸收、储存和外排相关基因的表达量(图 4)。因此,补充外源铁离子(Fe3+,FAC)可以提高低氧胁迫下ZFL细胞中铁离子代谢相关基因的表达水平,从而提高ZFL细胞中铁的含量以提高低氧胁迫下的存活率。
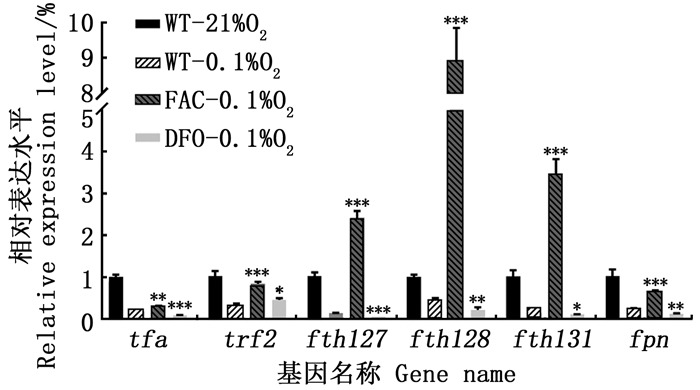
|
柱状图上方*表明与低氧组(WT-0.1% O2)相比在P < 0.05水平有统计学差异;**表示在P < 0.01水平有显著统计学差异;***代表在P < 0.001水平有极其显著的统计学差异。 The "*" above the bar represented statistical difference(P < 0.05)compared with the hypoxic group (WT-0.1% O2); **. There are significantly statistical differences at P < 0.01 level; ***. There are significant statistical differences at P < 0.001 level. 图 4 0.1%低氧胁迫ZFL细胞3 d后FAC组、DFO组和低氧组及常氧组铁代谢相关基因表达量的测定 Fig. 4 Expression level of iron metabolism-related genes of ZFL cells in FAC group, DFO group and hypoxic group under 0.1% hypoxic stress for 3 days and normoxic group |
为了探究铁离子浓度对低氧胁迫下ZFL细胞中ROS水平的影响,利用H2DCFDA探针和流式细胞仪对FAC组、DFO组、低氧组和常氧组进行ROS水平检测,结果表明低氧组(0.1% O2)ZFL细胞内ROS水平比常氧组(21% O2)明显降低约60%,而FAC组细胞内ROS水平比低氧组增加约20%,但DFO组的ROS水平无明显变化[图 5(a)]。利用荧光显微镜观察荧光强度[图 5(b)],其结果与流式细胞仪一致,即低氧组荧光强度较常氧组低,但是FAC组荧光强度较低氧组有所增强,DFO组与低氧组一致。因此,同低氧组相比,补充Fe3+可以适当恢复低氧胁迫下ZFL细胞内ROS的水平,说明在一定范围内ROS水平的增加有利于提高ZFL细胞在低氧下的存活率。
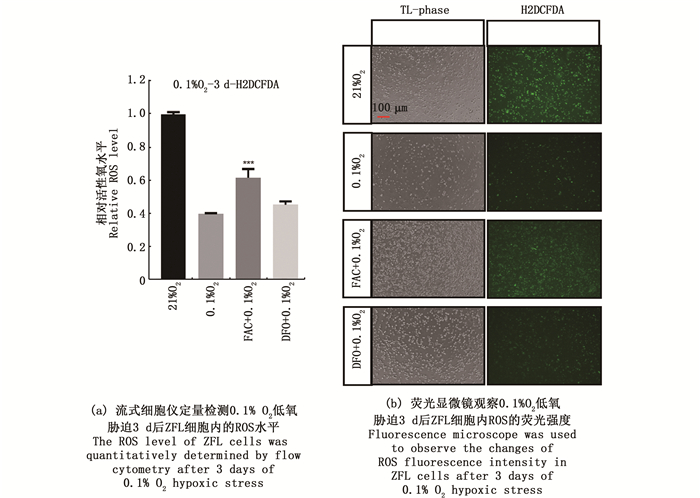
|
柱状图上方***表明与低氧组(0.1% O2)相比在P < 0.001水平有极其显著的统计学差异。 The "***"above the bar represented extremely significant statistical difference(P < 0.001)compared with the hypoxic group (0.1% O2). 图 5 低氧胁迫下不同处理的ZFL细胞的ROS水平检测 Fig. 5 ROS levels of ZFL cells treated with different treatments under hypoxic stress |
在低氧条件下,机体需要通过增加红细胞和血红蛋白的数量、增强血液携带氧的能力来提高血氧含量和容量,以此发挥机体代偿作用机制[22]。而铁是血红蛋白的重要成分,因此应对缺氧的反应也增加了机体对铁的需求。此外铁也是维持其他生命活动和支持几乎所有类型细胞生长所必需的元素。例如,在真核生物中,它大量存在于线粒体呼吸链的电子转移中心,并且是许多蛋白质和酶的活性位点[23]。研究[24]发现,从生长培养基中去除Fe3+会导致铁依赖性酶-核糖核苷酸还原酶的活性降低,从而使细胞周期停滞在G1 / S期。因此,铁对于细胞增殖也是必不可少的。所以在低氧环境中,细胞对铁的吸收、转运、循环再利用等过程也会随之发生改变[25]。本研究发现,低氧胁迫时给ZFL细胞补充Fe3+,能增加其胞内铁吸收、转运及储存相关基因的表达,从而促进细胞对铁的吸收以满足低氧环境下的需求,使细胞仍能维持正常的增殖等生命活动。相反,去除Fe3+一定程度上会抑制细胞在低氧环境下的生理活动。但是DFO也用于缺氧模拟,因为它可以激活缺氧诱导因子(HIF-1α)途径[26]。HIF-1α是目前发现的唯一一个在特异性缺氧状态下发挥活性的转录因子,是介导缺氧信号的转导中枢[27]。缺氧诱导因子1(HIF-1)与促红细胞生成素、血管内皮生长因子和其他基因中的顺式作用缺氧反应元件结合,以在缺氧细胞中激活转录。此外,它还可以诱导控制葡萄糖代谢、细胞增殖和血管形成的相关蛋白表达[28],从而调控细胞产生一系列应对缺氧的代偿反应,在机体的生长发育及生理和病理过程中发挥重要作用。在本研究中利用DFO去除ZFL细胞的内源及外源铁离子后,可能激活了HIF-1α信号通路,所以ZFL细胞的生存状态与低氧组相比没有明显的恶化。这表明ZFL细胞在适应低氧时,除了铁需求增加以外,还有其他机制在调节铁的储存和使用中起着积极的作用。
所有的多细胞生物都依赖于消耗氧气并通过氧化磷酸化途径来产生ATP,但是其中约有2%的氧气会与未能传递到末端氧化酶的电子结合并形成ROS[29]。此外游离铁可直接通过Fenton和Haber-Weiss反应生成高反应性ROS[30]。ROS积累是多种细胞应激反应的触发因素,包括DNA损伤反应和其他与信号转导相关的反应[31]。ROS的过度积累和氧化损伤与多种疾病有关,因此ROS一直被认为是有氧代谢的不可避免的毒性副产物[32]。然而,ROS的产生对于机体来说并不总是有害的。事实上,分子氧引发氧化应激产生的ROS和自由基(Free radical,FR)是正常细胞代谢的结果,它们的副产物是有效的杀菌剂,能积极地破坏入侵性病原体,并且在各种代谢途径中也起着关键作用[33-34]。另外,少量的线粒体ROS(mROS)诱导可以作为分子警报系统促进细胞对应激源的适应性,如低氧下的HIF活化、饥饿下的自噬活化、病原体感染下炎性细胞因子的产生、受体依赖性刺激下的分化,这些活动都促进了细胞存活[35]。
有研究发现,鳉鱼(Fundulus heteroclitus)、虾虎鱼(Perccottus glenii)等鱼类长期暴露于恒定或间歇性缺氧环境下会增加其抗氧化酶活性并降低线粒体ROS的释放率[36-38]。同时有研究[39]认为缺氧会降低线粒体的丰度,降低骨骼肌氧化磷酸化的能力,从而下调ROS水平,这可能有助于平衡氧气供需的适应性状。本研究发现,低氧胁迫显著降低了ZFL细胞内的ROS水平,以帮助其适应低氧环境,相应的,补铁恢复了ROS水平,暗示增加铁源缓解了ZFL细胞的低氧应激反应,并且细胞内存在一定的ROS对其生命活动是有利的。但是,调节ROS水平的具体机制尚不清楚。
综上所述,补充外源铁离子能够缓解ZFL细胞应对低氧胁迫的压力,所以补充铁源或许可以作为养殖鱼类抵抗低氧胁迫的有效方法。但是补充铁源的方式以及用量还需进一步在养殖鱼体内进行探究。
| [1] |
QIANG J, ZHONG C Y, BAO J W, et al. The effects of temperature and dissolved oxygen on the growth, survival and oxidative capacity of newly hatched hybrid yellow catfish larvae (Tachysurus fulvidraco♀×Pseudobagrus vachellii♂)[J]. Journal of Thermal Biology, 2019, 86: 102436. DOI:10.1016/j.jtherbio.2019.102436 |
| [2] |
VALAVANIDIS A, VLAHOGIANNI T, DASSENAKIS M, et al. Molecular biomarkers of oxidative stress in aquatic organisms in relation to toxic environmental pollutants[J]. Ecotoxicology and Environmental Safety, 2006, 64(2): 178-189. DOI:10.1016/j.ecoenv.2005.03.013 |
| [3] |
吴志昊, 尤锋, 王英芳, 等. 低氧和高氧对大菱鲆幼鱼红细胞核异常及氧化抗氧化平衡的影响[J]. 上海海洋大学学报, 2011, 20(6): 808-813. WU Z H, YOU F, WANG Y F, et al. The effects of hypoxia and hyperoxia on nucleus anomaly, SOD, CAT activities and MDA content in juvenile turbot Scophthalmus maximus[J]. Journal of Shanghai Ocean University, 2011, 20(6): 808-813. |
| [4] |
PÖRTNER H O. Oxygen-and capacity-limitation of thermal tolerance: a matrix for integrating climate-related stressor effects in marine ecosystems[J]. Journal of Experimental Biology, 2010, 213(6): 881-893. DOI:10.1242/jeb.037523 |
| [5] |
张冬梅, 赵柳兰, 刘巧, 等. 大口黑鲈leptin A基因的组织表达及其对急性低氧胁迫的响应[J]. 水产学报, 2020, 44(10): 1609-1618. ZHANG D M, ZHAO L L, LIU Q, et al. Tissue expression of leptin A gene in Micropterus salmoides and its response to acute hypoxia stress[J]. Journal of Fisheries of China, 2020, 44(10): 1609-1618. |
| [6] |
AFFONSO E G, POLEZ V L P, CORRÊA C F, et al. Blood parameters and metabolites in the teleost fish Colossoma macropomum exposed to sulfide or hypoxia[J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2002, 133(3): 375-382. |
| [7] |
CRISPO E, CHAPMAN L J. Geographic variation in phenotypic plasticity in response to dissolved oxygen in an African cichlid fish[J]. Journal of Evolutionary Biology, 2010, 23(10): 2091-2103. DOI:10.1111/j.1420-9101.2010.02069.x |
| [8] |
OEXLE H, GNAIGER E, WEISS G. Iron-dependent changes in cellular energy metabolism: influence on citric acid cycle and oxidative phosphorylation[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1999, 1413(3): 99-107. DOI:10.1016/S0005-2728(99)00088-2 |
| [9] |
SHAH Y M, XIE L W. Hypoxia-inducible factors link iron homeostasis and erythropoiesis[J]. Gastroenterology, 2014, 146(3): 630-642. DOI:10.1053/j.gastro.2013.12.031 |
| [10] |
PUIG S, RAMOS-ALONSO L, ROMERO A M, et al. The elemental role of iron in DNA synthesis and repair[J]. Metallomics, 2017, 9(11): 1483-1500. DOI:10.1039/C7MT00116A |
| [11] |
KIETZMANN T. Liver zonation in health and disease: hypoxia and hypoxia-inducible transcription factors as concert masters[J]. International Journal of Molecular Sciences, 2019, 20(9): 2347. DOI:10.3390/ijms20092347 |
| [12] |
ANDERSON E R, SHAH Y M. Iron homeostasis in the liver[J]. Comprehensive Physiology, 2013, 3(1): 315-330. |
| [13] |
RISHI G, SUBRAMANIAM V N. The liver in regulation of iron homeostasis[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2017, 313(3): G157-G165. DOI:10.1152/ajpgi.00004.2017 |
| [14] |
KNOVICH M A, STOREY J A, COFFMAN L G, et al. Ferritin for the clinician[J]. Blood Reviews, 2009, 23(3): 95-104. DOI:10.1016/j.blre.2008.08.001 |
| [15] |
HERSHKO C, KONIJN A M, NICK H P, et al. ICL670A: a new synthetic oral chelator: evaluation in hypertransfused rats with selective radioiron probes of hepatocellular and reticuloendothelial iron stores and in iron-loaded rat heart cells in culture[J]. Blood, 2001, 97(4): 1115-1122. DOI:10.1182/blood.V97.4.1115 |
| [16] |
TROADEC M B, WARD D M, LO E, et al. Induction of FPN1 transcription by MTF-1 reveals a role for ferroportin in transition metal efflux[J]. Blood, 2010, 116(22): 4657-4664. DOI:10.1182/blood-2010-04-278614 |
| [17] |
DONOVAN A, BROWNLIE A, ZHOU Y, et al. Positional cloning of zebrafish ferroportin1 identifies a conserved vertebrate iron exporter[J]. Nature, 2000, 403(6771): 776-781. DOI:10.1038/35001596 |
| [18] |
KAWABATA H, GERMAIN R S, VUONG P T, et al. Transferrin receptor 2-α supports cell growth both in iron-chelated cultured cells and in vivo[J]. Journal of Biological Chemistry, 2000, 275(22): 16618-16625. DOI:10.1074/jbc.M908846199 |
| [19] |
GIANNETTI A M, HALBROOKS P J, MASON A B, et al. The molecular mechanism for receptor-stimulated iron release from the plasma iron transport protein transferrin[J]. Structure, 2005, 13(11): 1613-1623. DOI:10.1016/j.str.2005.07.016 |
| [20] |
WALLY J, HALBROOKS P J, VONRHEIN C, et al. The crystal structure of iron-free human serum transferrin provides insight into inter-lobe communication and receptor binding[J]. Journal of Biological Chemistry, 2006, 281(34): 24934-24944. DOI:10.1074/jbc.M604592200 |
| [21] |
HARRISON P M, AROSIO P. The ferritins: molecular properties, iron storage function and cellular regulation[J]. Biochimica et Biophysica Acta (BBA)-Bioenergetics, 1996, 1275(3): 161-203. DOI:10.1016/0005-2728(96)00022-9 |
| [22] |
RENASSIA C, PEYSSONNAUX C. New insights into the links between hypoxia and iron homeostasis[J]. Current Opinion in Hematology, 2019, 26(3): 125-130. DOI:10.1097/MOH.0000000000000494 |
| [23] |
LE N T V, RICHARDSON D R. The role of iron in cell cycle progression and the proliferation of neoplastic cells[J]. Biochimica et Biophysica Acta (BBA)-Reviews on Cancer, 2002, 1603(1): 31-46. DOI:10.1016/S0304-419X(02)00068-9 |
| [24] |
COTRUVO J A JR, STUBBE J. Class I ribonucleotide reductases: metallocofactor assembly and repair in vitro and in vivo[J]. Annual Review of Biochemistry, 2011, 80(1): 733-767. DOI:10.1146/annurev-biochem-061408-095817 |
| [25] |
XU M M, WANG J, XIE J X. Regulation of iron metabolism by hypoxia-inducible factors[J]. Acta Physiologica Sinica, 2017, 69(5): 598-610. |
| [26] |
VRTAC ČNIK P, MARC J, OSTANEK B. Hypoxia mimetic deferoxamine influences the expression of histone acetylation-and DNA methylation-associated genes in osteoblasts[J]. Connective Tissue Research, 2015, 56(3): 228-235. DOI:10.3109/03008207.2015.1017573 |
| [27] |
杨梦思, 周娜, 王志钢, 等. 转录因子HIF-1α及其信号通路在疾病发生中的作用研究进展[J]. 生物技术通报, 2016, 32(8): 8-13. YANG M S, ZHOU N, WANG Z G, et al. Research progress on the role of transcription factor HIF-1α and its signal pathway in the pathogenesis[J]. Biotechnology Bulletin, 2016, 32(8): 8-13. |
| [28] |
JIANG B H, ZHENG J Z, LEUNG S W, et al. Transactivation and inhibitory domains of hypoxia-inducible factor 1 α. Modulation of transcriptional activity by oxygen tension[J]. The Journal of Biological Chemistry, 1997, 272(31): 19253-19260. DOI:10.1074/jbc.272.31.19253 |
| [29] |
FUHRMANN D C, BRVNE B. Mitochondrial composition and function under the control of hypoxia[J]. Redox Biology, 2017, 12: 208-215. DOI:10.1016/j.redox.2017.02.012 |
| [30] |
KEHRER J P. The Haber-Weiss reaction and mechanisms of toxicity[J]. Toxicology, 2000, 149(1): 43-50. DOI:10.1016/S0300-483X(00)00231-6 |
| [31] |
RAY P D, HUANG B W, TSUJI Y. Reactive oxygen species (ROS) homeostasis and redox regulation in cellular signaling[J]. Cellular Signalling, 2012, 24(5): 981-990. DOI:10.1016/j.cellsig.2012.01.008 |
| [32] |
VAAHTERA L, BROSCHÉ M, WRZACZEK M, et al. Specificity in ROS signaling and transcript signatures[J]. Antioxidants & Redox Signaling, 2014, 21(9): 1422-1441. |
| [33] |
CROSS C E, HALLIWELL B, BORISH E T, et al. Oxygen radicals and human disease[J]. Annals of Internal Medicine, 1987, 107(4): 526-545. DOI:10.7326/0003-4819-107-4-526 |
| [34] |
DONG M, LIANG Y M, RAMALINGAM R, et al. Proteomic characterization of the interactions between fish serum proteins and waterborne bacteria reveals the suppression of anti-oxidative defense as a serum-mediated antimicrobial mechanism[J]. Fish & Shellfish Immunology, 2017, 62: 96-106. |
| [35] |
SENA L A, CHANDEL N S. Physiological roles of mitochondrial reactive oxygen species[J]. Molecular Cell, 2012, 48(2): 158-167. |
| [36] |
DU S N N, MAHALINGAM S, BOROWIEC B G, et al. Mitochondrial physiology and reactive oxygen species production are altered by hypoxia acclimation in killifish (Fundulus heteroclitus)[J]. Journal of Experimental Biology, 2016, 219(8): 1130-1138. |
| [37] |
LUSHCHAK V I. Environmentally induced oxidative stress in aquatic animals[J]. Aquatic Toxicology, 2011, 101(1): 13-30. |
| [38] |
LUSHCHAK V I, BAGNYUKOVA T V. Hypoxia induces oxidative stress in tissues of a goby, the rotan Perccottus glenii[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2007, 148(4): 390-397. |
| [39] |
HORSCROFT J A, MURRAY A J. Skeletal muscle energy metabolism in environmental hypoxia: climbing towards consensus[J]. Extreme Physiology & Medicine, 2014, 3(1): 19. |
2. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
4. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


