2. 上海海洋大学 水产科学国家级实验教学示范中心,上海 201306
草鱼(Ctenopharyngodon idella)是我国重要的淡水经济鱼类,据2020年中国渔业统计年鉴统计,2019年,我国草鱼的总产量为553.30万t,是养殖产量最大的淡水鱼类。随着社会的发展进步,草鱼营养需求及饲料配方技术的研究广泛开展,饲料工业产业蓬勃发展,以投喂饲料为核心的草鱼精养模式已成为养殖产业的必由之路。在产业一线,养殖草鱼往往出现腹腔脂肪过度蓄积和脂肪肝等营养代谢性疾病,增加了死亡率,降低了饲料效率和肉质品质,是降低养殖效益的重要因子[1]。因此,有效调控草鱼脂肪蓄积是解决当前养殖产业困扰的重要途径,已成为研究的重要方向和热点领域。
在哺乳动物中,肠道菌群的丰度及组成是影响肥胖的重要因素,如无菌小鼠(Mus muscculus)摄食多于正常小鼠30%,但体内的脂肪含量反而降低42%,对这类小鼠进行肠道菌群的移植后,能够恢复脂肪的沉积[2]。类似地,在鱼类中,通过抗生素改变肠道菌群组成后,也会发生肠道和肝脏内脂肪含量的改变[3-4]。有研究[5]表明,肥胖的小鼠和人肠道内厚壁菌门(Firmicutes)细菌的含量增加,而拟杆菌门(Bacteroidetes)细菌的含量降低。机制上认为,肠道微生物产生代谢的物质,如短链脂肪酸、内毒素、二级胆汁酸等,是影响宿主脂肪蓄积的重要因子[6-9]。在哺乳动物上,通过饲料干预的方式调控肠道菌群的组成能够改善宿主体内脂肪的过度蓄积,其中一个主要的方式是增加膳食纤维的含量[10],如在小鼠的饲料中增加竹笋类纤维含量比较高的食物,可显著增加拟杆菌门和降低疣微菌门(Verrucomicrobia)的含量,进而预防肥胖的产生[11]。在传统草鱼养殖生产中,养殖户尝试配合饲料与牧草结合投喂的方式,如美国矮象草(Pennisetum purpereum)[12]、杂交狼尾草(Pennisetum americanum×P. purpure)[13]、黑麦草(Lolium perenne)[14]和苏丹草(Sorghum sudanense)[15]等,可达到较好的降脂效果。类似地,在饲料中添加不同水平的苜蓿草(Medicago sativa L.)粉饲喂黄河鲤(Cyprinus carpio-haematopterus),其血清、肝胰脏和肌肉中总胆固醇和甘油三酯含量均随苜蓿草粉添加量的增加依次降低[16]。同时,饲料中苜蓿草粉的添加也降低了团头鲂(Megalobrama amblycephala)肌肉粗脂肪的含量[17]。可见,在养殖鱼类饲料中添加青草类饲料原料也是减脂的一个重要途径,然而这其中内在的机制尚不明确,肠道菌群的改变是否是其中的一个重要的途径需要进一步探索。另外,不同类别的纤维影响肠道菌群的组成及功能也存在差异[11]。因此,针对不同的饲料原料验证和评估亟待展开。
皇竹草(Pennisetum sinese Roxb)为多年生禾本科植物,由象草和美洲狼尾草杂交选育而成,属四碳植物[18]。皇竹草营养丰富,含有较高的蛋白(17.96%,DM)、脂肪(2.74%,DM)和纤维(23.26%,DM) [19]。此外,有研究[20-21]指出,皇竹草含19种氨基酸,且赖氨酸、矿物质和维生素等含量较高,可以满足鱼类生长发育的需要且具有用于鱼饲料的潜力。本研究室前期发现饲料中添加皇竹草粉后显著降低了草鱼腹腔内脂肪的含量,同时肠道菌群也发生了变化,包括拟杆菌门和厚壁菌门的比例下调[22-23],但该研究中草粉饲料的能量低于配合饲料,鱼体中肠道菌群和脂肪蓄积的变化是皇竹草粉本身的作用还是饲料能量的差异造成的并不清楚。本研究以纯化饲料为基础,深入探讨在等氮等能饲料的前提下添加皇竹草粉对草鱼肠道菌群和脂肪蓄积的影响及作用机制,明确皇竹草粉的营养作用,以期为该饲料原料在产业一线的应用提供参考资料和理论基础。
1 材料与方法 1.1 试验饲料试验用草粉(皇竹草)购自广东省江门市鹤山广佛饲料厂。参考LOVELL[24]中的饲料配方,以酪蛋白和明胶为蛋白源,鱼油和大豆油为脂肪源,设置3组蛋白质水平为33%,脂肪水平为8%的等氮等能纯化饲料。对照组(C)不做处理,处理组分别添加10%和20%皇竹草粉(PSR1和PSR2),每组添加0.1%二丁基羟基甲苯作为抗氧化剂(表 1)。饲料制备前先将饲料原料粉碎,过60目筛。按比例准确称取饲料原料,按照含量从小到大的原则逐级混合,然后再将油和水分别混入,搓匀。将混合均匀的原料用饲料制粒机挤压出2.0 mm粒径的颗粒饲料,在阴凉处风干后放在-20 ℃储存备用。

|
表 1 试验饲料组成及成分 Tab.1 Formulation and chemical composition of the experimental diets |
试验用草鱼购自佛山市南海通威水产科技有限公司,养殖试验在中国水产科学研究院珠江水产研究所绿色养殖基地进行。试验鱼先放于4.5 m×4.5 m×1.1 m的水泥池中暂养2周,以对照组饲料对草鱼驯食。暂养结束后,挑选规格均一、体格健壮的198尾草鱼[(28.51±0.04) g]分配到9个养殖缸(1.2 m×0.6 m×0.5 m)中,每个缸放鱼22尾。每组饲料随机投喂3个养殖缸,试验周期为8周,每天08: 30和16: 30各投喂1次,采用饱食投喂方式。每天记录进食量、水温、天气和死亡情况,其间水体pH为6.5~7.8,溶氧量为5.7~7.6 mg/L,氨氮浓度≤0.20 mg/L,水温为28.0~33.0 ℃。
1.3 采样与处理养殖结束后停食24 h,对所有鱼进行采样。采样前先用MS-222(0.06 g/L)进行麻醉,测量体质量和体长。从每个鱼缸中随机选取6尾草鱼,在无菌超净台内,用1 mL无菌注射器从尾静脉取血,装于1.5 mL无菌离心管中,4 ℃静置过夜后3 500 r/min离心10 min,吸取上清液,分装于1.5 mL无菌离心管中,并保存在-80 ℃冰箱中,用于血清指标的测定。另随机取9尾草鱼进行解剖,分别对其内脏团、肝脏、腹腔脂肪等组织进行称重。将中肠道内容物、肝脏、腹腔脂肪迅速置于液氮中冻存,再转移到-80 ℃超低温冰箱保存。随机挑选3尾鱼采集0.5~1.0 g的肝脏组织、脂肪组织,固定于4%多聚甲醛溶液中,用于组织切片。肠道内容物用于提取肠道菌群DNA。试验鱼的肥满度(condition factor, CF)、脏体比(viscerosomatic index,VSI)、肝体比(hepatosomatic index,HSI)、肠脂比(mesenteric fat index,MFI)等计算公式:
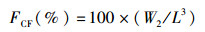 (1)
(1)
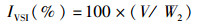 (2)
(2)
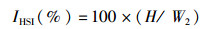 (3)
(3)
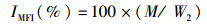 (4)
(4)
式中:FCF为肥满度;IVSI为脏体比;IHSI为肝体比;IMFI为肠指比;W2为实验结束时鱼体质量,g;L为实验结束时鱼体长,cm;V为鱼体内脏质量,g;H为鱼体肝脏质量,g;M为鱼体肠系膜脂肪质量,g。
1.4 血清与肝脏生化指标和酶活性的测定血清甘油三脂(triglyceride, TG)、总胆固醇(total cholesterol, TC)和游离脂肪酸(non-esterified fatty acid, NEFA)等指标使用试剂盒检测(南京建成生物科技有限公司,南京,中国),操作步骤均按照试剂盒说明书进行,每缸选取3尾鱼的样品进行检测。
肝脏TG、TC、NEFA的测定使用试剂盒进行,并参照说明书进行具体操作。其中,TC和NEFA试剂盒由南京建成生物科技有限公司(南京,中国)生产, TG试剂盒由北京普利莱基因技术有限公司(北京,中国)生产。每缸选取3尾鱼的样品进行检测。
1.5 组织切片肝脏组织采用油红O染色(oil red O staining),脂肪组织采用H.E染色。肝脏组织固定在4%多聚甲醛中过夜(4 ℃),而后在4 ℃下与30%蔗糖孵育3 d。将肝脏组织包埋在最佳切割温度(optimal cutting temperature, OCT)化合物(Leica,德国)中,切片为6~10 μm,用蒸馏水冲洗。将玻片在60%异丙醇中漂洗20~30 s后,用油红O(Sigma,美国)染色10 min。随后立即将玻片在60%异丙醇中脱色3 min,并用蒸馏水清洗。然后用苏木精复染切片1 min,并用蒸馏水洗涤10 min。最后,用甘油明胶封盖玻片。使用光学显微镜(Olympus BX41,日本)拍摄载玻片。将固定的脂肪组织样品在自来水中洗涤12 h,然后在一系列梯度乙醇(体积分数)中进行脱水(30%、50%、70%、80%、90%、95%和100%2次)。根据先前描述的标准组织学技术,将样品在二甲苯中平衡并包埋在石蜡中[25]。用旋转切片机(RM2235,莱卡,德国)切割5 μm的切片,安装在载玻片上并用H.E染色。使用立式显微镜(Leica biosystems,Wetzlar,德国)观察组织学样品并拍照。
1.6 组织总RNA提取、反转录及相关基因表达量检测 1.6.1 总RNA的提取肝脏和脂肪组织总RNA采用TRIZOL试剂盒(TaKaRa,日本)提取,并用1%琼脂糖变性胶来检测总RNA的提取质量和完整性。除去总RNA中的DNA后,以1 μg总RNA为模板,利用PrimeScriptTM反转录试剂盒(TaKaRa,日本)进行cDNA的合成,反应程序为37 ℃ 15 min,85 ℃反应5 s,4 ℃结束。cDNA保存在-20 ℃用于基因检测。
1.6.2 实时定量PCR检测的基因引物是根据已经发表的草鱼β-肌动蛋白(β-actin),载脂蛋白E(apoe),二酰基甘油O酰基转移酶(dgat),硬脂酰CoA去饱和酶(scd),乙酰CoA羧化酶(acc),脂肪组织甘油三酯脂肪酶(atgl),肉毒碱棕榈酰转移酶1(cpt-1), 脂肪酸合酶(fas),激素敏感性脂肪酶(hsl),过氧化物酶体增殖物激活受体α(pparα),过氧化物酶体增殖物激活受体γ(pparγ),法尼酯X受体(fxr),胆固醇7α羟化酶(cyp7a1)序列基础上设计的,由生工生物工程(上海)有限公司合成。参照TIAN等[26]的方法,以β-actin作为内参基因,用LightCycler® 96—TimePCR Detection System(Roche,瑞士)检测各基因的相对表达水平。通过先前研究中描述的比较CT方法(2-ΔΔCt)计算基因表达值[27]。所有的RNA样品都以3个重复进行检测。所分析的12个基因引物序列见表 2。

|
表 2 实时定量引物信息 Tab.2 Primers used in real-time quantitative PCR |
将肠道样品放在无菌培养皿内,用无菌解剖剪纵向剖开肠壁,刮取内壁黏液,置于2.0 mL离心管中,即为肠道内容物样品。为降低个体间差异,将每缸中3条鱼的肠道内容物合并,以进行微生物群分析。采集的肠道内容物样品使用细菌DNA提取试剂盒(NucleoSpin Microbial DNA, MN, 德国)提取细菌DNA。肠内容物样本约250 mg,使用混合研磨珠振荡混合,并用1%琼脂糖凝胶检测每个DNA样品的质量和完整性。所有DNA均在-20 ℃下保存直至使用。
1.8 微生物16S rRNA高通量测序应用高通量测序技术对草鱼肠道容物进行16S rRNA V3+V4区测序(百迈客生物科技有限公司,北京)。16S rRNA基因V3+V4可变区特异性引物扩增序列338F: 5′-ACTCCTACGGGAGGCAGCA-3′, 806R: 5′-GGACTACHVGGGTWTCTAAT-3′。PCR体系10 μL: KOD FX Neo Buffer 5 μL,dNTP (2 mmol/L) 2 μL,基因组DNA 50 ng,338F上下游引物(10 μmmol/L)各0.3 μL,KOD FX Neo 0.2 μL,ddH2O补至10 μL。PCR扩增程序:95 ℃预变性5 min,95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸40 s,25个循环,72 ℃ 7 min,4 ℃ ∞。1.8%的琼脂糖凝胶,电压120 V,40 min检测电泳产物。之后对原始数据进行拼接(FLASH, version 1.2.11),将拼接得到的序列进行质量过滤(Trimmomatic, version 0.33),并去除嵌合体(UCHIME, version 8.1),得到高质量的Tags序列,最终得到的序列用于聚成操作分类单元(Operational Taxonomic Units, OTUs) 分析。在相似性97% 的水平上对序列进行聚类(USEARCH, version 10.0),以测序所有序列数的0.005%作为阈值过滤OUT,比对的16S rRNA参考数据库是Silva(Release132, http://www.arb-silva.de)。然后用RDP classifier(version 2.2, http://sourceforge.net/projects/rdpclassifier/)贝叶斯算法对OTU的代表性序列进行物种分类学分析,并在不同物种分类水平下统计每个样本的群落组成以及组间物种差异。基于OTU的分析结果,采用对样本序列进行随机抽样的方法,分别计算Ace、Chao1、香农(Shannon)及辛普森(Simpson)等Alpha多样性指数。
1.9 数据计算与分析数据以平均值±标准差表示,采用SPSS 22.0软件进行单因素方差(One-way ANOVA) 分析,差异显著时,采用Duncan’s进行多重比较,P<0.05表示差异显著。
2 结果 2.1 饲料添加皇竹草粉对草鱼稚鱼形体指标的影响养殖过程中草鱼摄食积极,生长良好。表 3显示,PSR1组和PSR2组的肠脂比显著低于C组,分别降低了19.93%和24.35%(P<0.05)。各组间的肥满度、脏体比、肝体比没有显著性差异(P>0.05)。
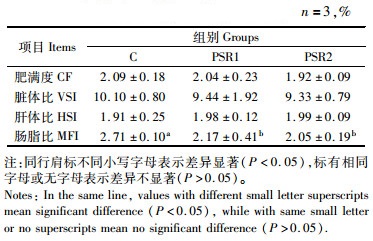
|
表 3 饲料中添加皇竹草粉对草鱼稚鱼形体指标的影响 Tab.3 Effects of dietary supplemented with Pennisetum sinese Roxb meal on physical indicators of juvenile grass carp |
如表 4所示,饲料中添加皇竹草粉明显降低草鱼血清中的TG、TC和NEFA的含量,其中,添加20%皇竹草粉能够达到显著性差异(P<0.05),分别降低了26.67%、19.23%和59.49%。
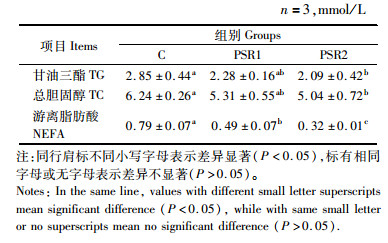
|
表 4 饲料中添加皇竹草粉对草鱼稚鱼血清TG、TC和NEFA的影响 Tab.4 Effects of the dietary Pennisetum sinese Roxb meal on serum TG, TC and NEFA levels of juvenile grass carp |
由表 5可知,饲料中添加10%和20%皇竹草粉均显著降低肝脏中的TG、TC和NEFA的含量,分别降低了19.32% 和26.14%,64.00% 和72.55%,以及49.84% 和57.21%(P<0.05)。

|
表 5 饲料中皇竹草粉对草鱼肝脏TG、TC和NEFA的影响 Tab.5 Effects of the dietary Pennisetum sinese Roxb meal on the hepatic TG, TC and NEFA levels of juvenile grass carp |
在相同倍数下的肝脏显微结构示意图(图版Ⅰ-1~3)中可以看出,采用油红O染色脂滴后,与C组相比,PSR1组和PSR2组的脂滴数量明显减少,其较小的脂滴(红色)与细胞核(紫色)均匀分布在整个组织。脂肪组织的显微结构如图版Ⅰ-4~6所示,PSR1组和PSR2组的脂肪细胞直径明显比C组小,且相同比例视野内的细胞数目明显增多。
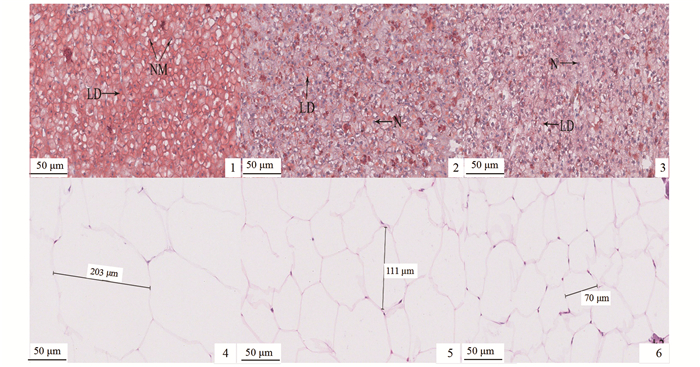
|
1、2、3为草鱼肝脏油红O染色切片的显微结构图;4、5、6为草鱼脂肪H.E染色切片的显微结构图;1和4为对照组;2和5为10%皇竹草粉组;3和6为20%皇竹草粉组;N.细胞核;NM.核偏移;LD.脂肪滴。 1, 2 and 3 for the microstructures of grass carp liver oil red O stained sections, respectively. 4, 5 and 6 for the microstructures of H.E stained slices of grass carp fat, respectively. 1 and 4 for Control; 2 and 5 for 10% Pennisetum sinese Roxb meal group; 3 and 6 for 20% pennisetum sinese Roxb meal group. N. nucleus; NM. nucleus migration; LD. lipid droplet. 图版 Ⅰ 饲料中皇竹草粉对草鱼肝脏和脂肪组织的影响(×400) Plate Ⅰ Effects of the dietary Pennisetum sinese Roxb meal on the microstructure of liver and adipose tissue in juvenile grass carp (× 400) |
饲料中添加皇竹草粉对草鱼肝脏组织脂代谢相关基因表达的影响: 脂肪生成基因中pparγ、fas、scd、acc和dgat的mRNA水平随着皇竹草粉添加水平的增加呈现显著下降的趋势(P<0.05),而脂肪分解基因中pparα、hsl、atgl、cpt-1和apoe的mRNA水平则呈现显著升高的趋势(P<0.05);胆汁酸合成基因中fxr的mRNA水平在饲喂皇竹草粉后显著提高(P<0.05),而cyp7a1的mRNA水平则显著降低(P<0.05)。见图 1。
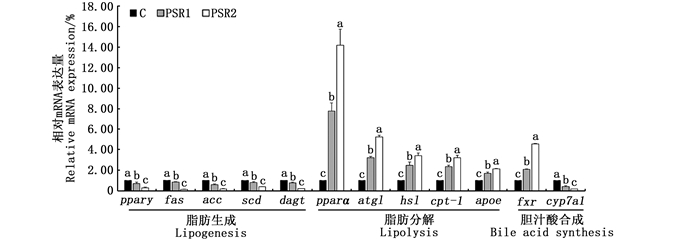
|
C.对照组;PSR1.10%皇竹草粉组;PSR2.20%皇竹草粉组。不同的小写字母表示数据间差异显著(P<0.05)。 C. control; PSR1.10% Pennisetum sinese Roxb meal group; PSR2.20% Pennisetum sinese Roxb meal group. Different lowercase letters indicate statistically significant differences between the data (P < 0.05). 图 1 饲料添加皇竹草粉对草鱼肝脏组织脂代谢基因相对表达量的影响(n=3) Fig. 1 Effects of diets supplemented with Pennisetum sinese Roxb meal on the relative mRNA expression of the liver in grass carp (n=3) |
脂肪组织的脂质代谢的基因表达结果如图 2所示。与肝脏组织类似,脂肪生成基因中pparγ、fas、scd、acc和dgat的mRNA水平随着皇竹草粉浓度的增加而增加,且差异显著(P<0.05)。脂肪分解基因中pparα、hsl、atgl和cpt-1的mRNA水平显著提高(P<0.05)。
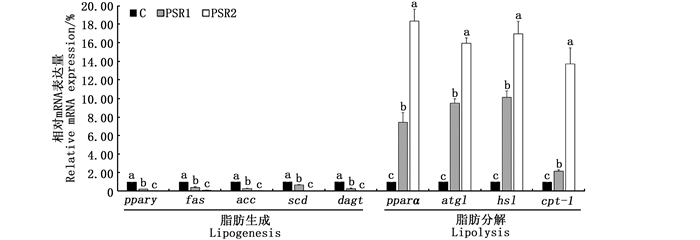
|
C. 对照组;PSR1. 10%皇竹草粉组;PSR2. 20%皇竹草粉组。不同的小写字母表示数据间差异显著(P<0.05)。 C. control; PSR1. 10% Pennisetum sinese Roxb meal group; PSR2. 20% Pennisetum sinese Roxb meal group. Different lowercase letters indicate statistically significant differences between the data (P < 0.05). 图 2 饲料添加皇竹草粉对草鱼脂肪组织脂代谢基因相对表达量的影响(n=3) Fig. 2 Effects of diets supplemented with Pennisetum sinese Roxb meal on the relative mRNA expression of the adipose tissue in grass carp (n=3) |
测序共获得1 884 512对序列,鉴定出715个OTU。基于OTU系统发育多样性进行样本关系的评估,结果显示所有样本测序覆盖率(>0.90)均已达标,表明样本OTU具有代表性。见图 3(a)。
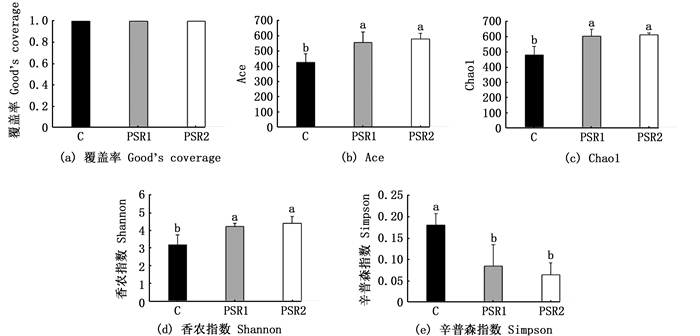
|
C. 对照组;PSR1. 10%皇竹草粉组;PSR2. 20%皇竹草粉组。不同的小写字母表示数据间差异显著(P<0.05)。 C. control; PSR1. 10% Pennisetum sinese Roxb meal group; PSR2. 20% Pennisetum sinese Roxb meal group. Different lowercase letters indicate statistically significant differences between the data (P < 0.05). 图 3 饲料添加皇竹草粉对草鱼肠道细菌的多样性指数的影响 Fig. 3 Effects of diets supplemented with Pennisetum sinese Roxb meal on the diversity indices of bacterial community in the gut |
根据OTU比例对细菌多样性和丰富度指数进行分析,以计算每组的细菌多样性。结果显示,PSR1组和PSR2组的Ace、Chao1和Shannon指数均显著高于C组[P<0.05, 见图 3(b)~(d)],Simpson指数显著低于C组[P<0.05,图 3(e)]。
2.7 基于门水平肠道菌群分析基于门水平对样品进行物种注释分析,共获得20个菌门。位于前10位的细菌组成如图 4(a)所示,其他物种合并为Others。在所有样品中,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、梭杆菌门(Fusobacteria)和拟杆菌门(Bacteroidetes)的丰度最高,分别为39.25%、18.36%、15.84%和8.52%。各组间在门水平下的差异性如图 4(b)所示,PSR1组和PSR2组中厚壁菌门的丰度显著低于C组(P<0.05),拟杆菌门、Epsilonbacteraeota和绿弯菌门(Chloroflexi)的丰度高于C组但无显著差异(P>0.05),PSR2组中梭杆菌门的丰度显著高于C组(P<0.05)。PSR1和PSR2组相比于C组,放线菌门(Actinobacteria)、蓝细菌门(Cyanobacteria)、衣原体门(Chlamydiae)的丰度呈下降趋势,但差异都不显著(P>0.05)。
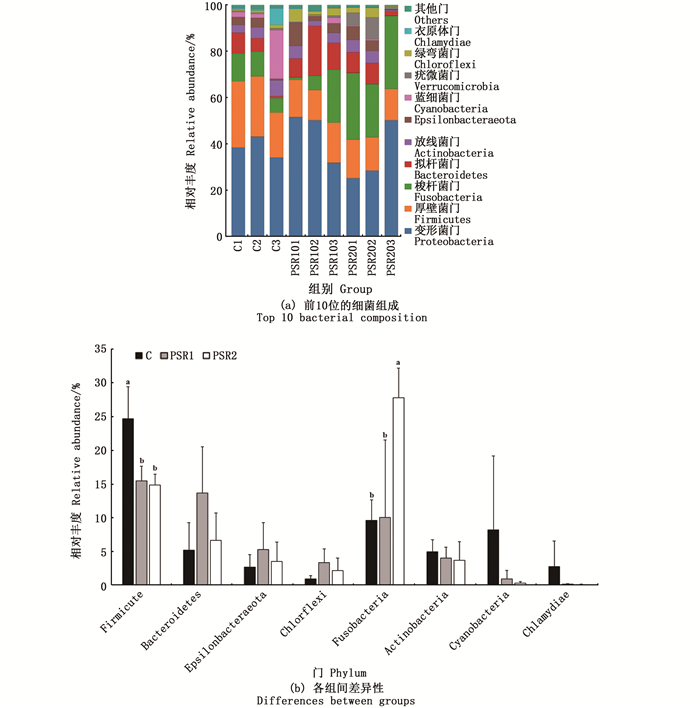
|
C. 对照组;PSR1. 10%皇竹草粉组;PSR2. 20%皇竹草粉组。不同的小写字母表示数据间差异显著(P<0.05)。 C. control; PSR1. 10% Pennisetum sinese Roxb meal group; PSR2. 20% Pennisetum sinese Roxb meal group. Different lowercase letters indicate statistically significant differences between the data (P < 0.05). 图 4 饲料添加皇竹草粉对草鱼肠道菌群在门水平的分布情况 Fig. 4 Effects of diets supplemented with Pennisetum sinese Roxb meal on the distribution of intestinal microflora at the phylum level in grass carp |
基于属水平对样品进行物种注释分析,共获得367个菌属。位于前10位的细菌组成如图 5(a)所示,分别是鲸杆菌属(Cetobacterium,16.65%),红杆细菌属(Rhodobacter,7.26%)、气单胞菌属(Aeromonas,6.50%)、柠檬酸杆菌属(Citrobacter,5.57%)、uncultured_bacterium_f_Muribaculaceae(4.02%)、乳杆菌属(Lactobacillus,3.00%)、弓形杆菌属(Arcobacter,2.83%)、玫瑰单胞菌属(Roseomonas,2.60%)、艾克曼菌属(Akkermansia,2.58%)和根瘤菌属(Uncultured_Bacterium_f_Rhizobiales_Incertae_Sedis,2.11%),其他物种合并为Others。整体上看,各组中以鲸杆菌属,气单胞菌属为主,其中鲸杆菌属比例最高。各组间差异性如图 5(b)所示,PSR1组和PSR2组中的鲸杆菌属、红杆细菌属、艾克曼菌属的丰度高于C组,但差异并不显著(P>0.05),PSR2组中的根瘤菌属的丰度显著高于C组。PSR1组和PSR2组中的乳杆菌属、玫瑰单胞菌属的丰度在数值上低于C组(P>0.05),气单胞菌属的丰度显著低于C组(P<0.05)。
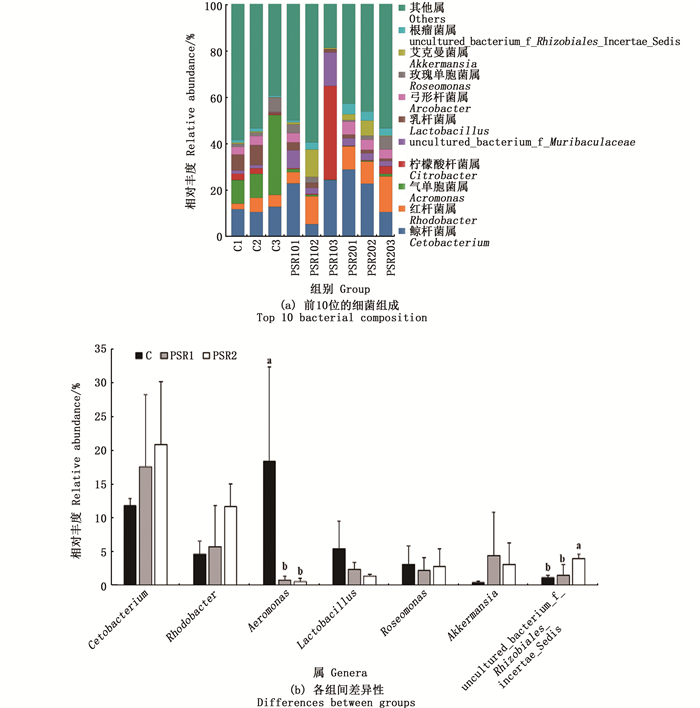
|
C.对照组;PSR1.10%皇竹草粉组;PSR2.20%皇竹草粉组。不同的小写字母表示数据间差异显著(P<0.05)。 C.control; PSR1.10% Pennisetum sinese Roxb meal group; PSR2. 20% Pennisetum sinese Roxb meal group. Different lowercase letters indicate statistically significant differences between the data (P < 0.05). 图 5 饲料添加皇竹草粉对草鱼肠道菌群在属水平的分布情况 Fig. 5 Effects of diets supplemented with Pennisetum sinese Roxb meal on the distribution of grass carp intestinal microflora at the genus levels |
研究发现在等氮等能的基础上,添加10%和20%皇竹草粉的饲料饲喂草鱼均表现出了脂肪蓄积降低的结果:(1)腹腔脂肪组织系数降低,脂肪细胞直径减小;(2)肝脏内TG、TC、NEFA减少,脂滴含量明显降低;(3)血清中TG、TC、NEFA显著降低。该结果与单纯饲喂皇竹草降低草鱼体脂蓄积和苜蓿草粉降低黄河鲤的脂肪含量的结果一致[22, 28-29]。
从分子层面来看,肝脏和腹腔脂肪组织内脂肪生成基因pparγ、fas、scd、acc和dgat均显著下降,而脂肪分解相关的基因如pparα、hsl、atgl和cpt-1均显著升高,这些结果提示皇竹草粉通过降低了脂肪自身生成能力,促进了脂肪分解能力,达到脂肪蓄积减少的表观性状。哺乳动物上,pparα以及下游脂肪酸吸收和β氧化基因的表达,以及脂肪自身合成的能力基因的表达,是影响体脂蓄积的重要途径[30]。
值得注意的是,本研究发现fxr基因显著上调,其为一类核受体家族,受到微生物代谢产物的调控,近期有研究指出FXR在影响草鱼脂肪蓄积过程中担当负调控的作用[4]。为此,皇竹草粉可能通过影响微生物的群落及其代谢产物,进而影响FXR信号通路以及脂肪蓄积。
哺乳动物中肠道菌群的丰度及组成越来越被认可为能够影响机体脂肪蓄积及代谢疾病的重要因素[31-32],而食物的组成是能够影响肠道菌群的一个关键因子[33-34]。研究[35]表明肥胖患者的肠道微生物群落的多样性要低于偏瘦的人群。本研究中,草鱼在摄食皇竹草饲料后α-多样性指标均显著升高,表明这类饲料增加了草鱼肠道内肠道菌群的丰度和多样性,与脂肪蓄积的结果相关联。肠道菌群具有将初级胆汁酸转化为二级胆汁酸的能力,而不同类型的胆汁酸对于激活FXR的活性存在差异[36],从这个角度分析,可能皇竹草粉通过改变肠道菌群,影响了胆汁酸的组分,进而影响脂肪沉积的状况。研究[37]发现,小鼠肠道微生物的改变,影响肠道菌群中胆汁酸的变化,进而显著降低小鼠的脂肪蓄积。
本研究的草鱼肠道内主要菌门有变形菌门、厚壁菌门、梭杆菌门和拟杆菌门,与牙鲆(Paralichthys olivaceus)[38]、栉孔扇贝(Azumapecten farreri)[39]、海参(Stichopus japonicus)[40]、鲫(Carassius auratus)、鳙(Aristichthys nobilis)[41]等肠道内的优势菌门及含量相似。研究[42-43]发现,肠道菌群的组成与机体糖代谢和脂质代谢密切相关,其中拟杆菌门和厚壁菌门可能是影响机体能量代谢的主要菌门。如肥胖型小鼠肠道中厚壁菌门的比例较正常小鼠高,而拟杆菌门的数量则偏低[44],可能是由于拟杆菌门里脂代谢和糖代谢相关的酶要低于厚壁菌门[45],对于食物内热量吸收的差异导致。也有其他研究发现,肥胖患者在经过1年的减肥措施体质量明显下降以后,肠道菌群紊乱现象得到了一定程度的改善,拟杆菌门数量逐渐增加,而厚壁菌门数量下降[46-47]。因此,本研究中,摄食皇竹草粉后,草鱼肠道内厚壁菌门降低,拟杆菌门增加,可能是机体脂肪含量降低的原因之一。从属水平上看,本研究发现摄食皇竹草粉后草鱼肠道菌群内气单胞菌属显著下调。有研究[48]指出,气单胞菌属是一类条件致病菌,往往造成草鱼的肠道炎症,本课题组发现肠道的炎症往往和脂肪蓄积呈现正相关关系[49-50],结果表明皇竹草粉可能通过降低气单胞菌属菌群而减缓肠道炎症,进而降低草鱼的脂肪蓄积,但具体机制有待进一步探讨。
| [1] |
吉红, 李杰. 草鱼脂质营养与饲料科学研究进展[J]. 饲料工业, 2010(s1): 50-54. JI H, LI J. Research progress in lipid nutrition and feed of Grass carp[J]. Feed Industry, 2010(s1): 50-54. |
| [2] |
BÁCKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44): 15718-15723. DOI:10.1073/pnas.0407076101 |
| [3] |
SHENG Y, REN H, LIMBU S M, et al. The presence or absence of intestinal microbiota affects lipid deposition and related genes expression in Zebrafish (Danio rerio)[J]. Frontiers in Microbiology, 2018, 9: 1124. DOI:10.3389/fmicb.2018.01124 |
| [4] |
TIAN J J, JIN Y Q, YU E M, et al. Farnesoid X receptor is an effective target for modulating lipid accumulation in grass carp, Ctenopharyngodon idella[J]. Aquaculture, 2021, 534: 736248. DOI:10.1016/j.aquaculture.2020.736248 |
| [5] |
KALLUS S J, BRANDT L J. The intestinal microbiota and obesity[J]. Journal of Clinical Gastroenterology, 2012, 46(1): 16-24. DOI:10.1097/MCG.0b013e31823711fd |
| [6] |
SAMUEL B S, SHAITO A, MOTOIKE T, et al. Effects of the gut microbiota on host adiposity are modulated by the short-chain fatty-acid binding G protein-coupled receptor, Gpr41[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(43): 16767-16772. DOI:10.1073/pnas.0808567105 |
| [7] |
KIMURA I, OZAWA K, INOUE D, et al. The gut microbiota suppresses insulin-mediated fat accumulation via the short-chain fatty acid receptor GPR43[J]. Nature Communications, 2013, 4: 1829. DOI:10.1038/ncomms2852 |
| [8] |
DEN BESTEN G, VAN EUNEN K, GROEN A K, et al. The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism[J]. Journal of Lipid Research, 2013, 54(9): 2325-2340. DOI:10.1194/jlr.R036012 |
| [9] |
CAO S Y, ZHAO C N, XU X Y, et al. Dietary plants, gut microbiota, and obesity: effects and mechanisms[J]. Trends in Food Science & Technology, 2019, 92: 194-204. |
| [10] |
RIVERA-PIZA A, LEE S J. Effects of dietary fibers and prebiotics in adiposity regulation via modulation of gut microbiota[J]. Applied Biological Chemistry, 2020, 63(1): 2. DOI:10.1186/s13765-019-0482-9 |
| [11] |
LI X F, GUO J, JI K L, et al. Bamboo shoot fiber prevents obesity in mice by modulating the gut microbiota[J]. Scientific Reports, 2016, 6(1): 32953. DOI:10.1038/srep32953 |
| [12] |
陈丽婷. 3种优质青饲料对草鱼饲养效果及投喂技术研究[D]. 长沙: 湖南农业大学, 2013. CHEN L T. The effects of 3 qualified forage on feeding value and feeding technology in grass carp (Ctenopharyngon idella)[D]. Changsha: Hunan Agricultural University, 2013. |
| [13] |
冯德庆. 南方山区鱼用优质牧草筛选和饲喂草鱼效果研究[D]. 福州: 福建农林大学, 2009. FENG D Q. Screening and Research qualified forage as fish fodder to grass carp in mountainous area of south China[D]. Fuzhou: Fujian Agriculture and Forestry University, 2009. |
| [14] |
程辉辉, 谢从新, 李大鹏, 等. 种青养鱼模式下的草鱼肌肉营养成分和品质特性[J]. 水产学报, 2016, 40(7): 1050-1059. CHENG H H, XIE C X, LI D P, et al. The study of muscular nutritional components and fish quality of grass carp (Ctenopharyngodon idella) in ecological model of cultivating grass carp with grass[J]. Journal of Fisheries of China, 2016, 40(7): 1050-1059. |
| [15] |
赵慧星. 苏丹草施肥效果及对草鱼生长和品质的影响[D]. 武汉: 华中农业大学, 2007. ZHAO H X. Effect of fertilization on the sudangrass and the growth and quality of grass carp[D]. Wuhan: Huazhong Agricultural University, 2007. |
| [16] |
王成章, 何云, 史莹华, 等. 饲粮中添加苜蓿草粉对黄河鲤鱼抗氧化性能及脂质代谢的影响[J]. 草业学报, 2008, 17(4): 141-148. WANG C Z, HE Y, SHI Y H, et al. Effect of adding alfalfa meal in diet on antioxidant function and lipid metabolism of Cyprinus carpio-haematopterus[J]. Acta Prataculturae Sinica, 2008, 17(4): 141-148. DOI:10.3321/j.issn:1004-5759.2008.04.019 |
| [17] |
胡喜峰, 王成章, 张春梅, 等. 不同水平苜蓿草粉对团头鲂生长性能及肉品质的影响[J]. 西北农林科技大学学报(自然科学版), 2005, 33(11): 49-56. HU X F, WANG C Z, ZHANG C M, et al. Study on effect of alfalfa meal on growth performance and qulity of fish of bluntnose black bream (Megalobrama amblycepnala)[J]. Journal of Northwest Sci-Tech University of Agriculture and Forestry (Natural Science Edition), 2005, 33(11): 49-56. DOI:10.3321/j.issn:1671-9387.2005.11.010 |
| [18] |
夏先玖. 优质高产牧草皇竹草综述[J]. 四川草原, 1999(3): 15-17. XIA X J. Comprehensive report on hybrid giant Napier[J]. Journal of Sichuan Grassland, 1999(3): 15-17. |
| [19] |
姜琼, 谢妤, 赵友华. 宜春引种皇竹草的营养成分和无机元素的实验测定与评价[J]. 宜春学院学报, 2014, 36(6): 112-114. JIANG Q, XIE Y, ZHAO Y H. Experimental determination and evaluation of nutrients and inorganic elements of pennisetum introduced to Yichun[J]. Journal of Yichun University, 2014, 36(6): 112-114. DOI:10.3969/j.issn.1671-380X.2014.06.039 |
| [20] |
丁翠华. 皇竹草特性及综合开发利用[J]. 现代化农业, 2008(12): 33-34. DING C H. Characteristics and comprehensive utilization of Pennisetum hydridum[J]. Modernizing Agriculture, 2008(12): 33-34. DOI:10.3969/j.issn.1001-0254.2008.12.003 |
| [21] |
吴斌, 贺刚, 王庆萍, 等. "皇竹草+草鱼+微流水"模式的关键技术及典型案例[J]. 渔业致富指南, 2018(11): 31-34. WU B, HE G, WANG Q P, et al. The key technologies and typical cases of the "Pennisetum sinese Roxb + grass carp + micro-flowing water" model[J]. Fishery Guide to be Rich, 2018(11): 31-34. |
| [22] |
毛东东, 张凯, 欧红霞, 等. 2种饲料投喂下草鱼肌肉品质的比较分析[J]. 动物营养学报, 2018, 30(6): 2226-2234. MAO D D, ZHANG K, OU H X, et al. Comparative analysis on flesh quality of grass crap (Ctenopharyngodon idella) fed with two kinds of feeds[J]. Chinese Journal of Animal Nutrition, 2018, 30(6): 2226-2234. DOI:10.3969/j.issn.1006-267x.2018.06.026 |
| [23] |
靳雅琦, 郁二蒙, 张凯, 等. 三种饵料对草鱼血清酶活性和肠道组织结构及细菌菌群的影响[J]. 农业生物技术学报, 2019, 27(9): 1652-1663. JIN Y Q, YU E M, ZHANG K, et al. Effects of three feeds on serum enzyme activity, intestinal structure and bacterial flora of Ctenopharyngodon idella[J]. Journal of Agricultural Biotechnology, 2019, 27(9): 1652-1663. |
| [24] |
LOVELL T. Nutrition and feeding of fish[M]. New York: Van Nostrand Reinhold, 1989.
|
| [25] |
YU E M, ZHANG H F, LI Z F, et al. Proteomic signature of muscle fibre hyperplasia in response to faba bean intake in grass carp[J]. Scientific Reports, 2017, 7: 45950. DOI:10.1038/srep45950 |
| [26] |
TIAN J J, FU B, YU E M, et al. Feeding faba beans (Vicia faba L.) reduces myocyte metabolic activity in grass carp (Ctenopharyngodon idella)[J]. Frontiers in Physiology, 2020, 11: 391. DOI:10.3389/fphys.2020.00391 |
| [27] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [28] |
毛东东, 张凯, 欧红霞, 等. 投喂皇竹草和配合饲料对草鱼生长及肌肉营养成分的影响[J]. 大连海洋大学学报, 2018, 33(1): 7-13. MAO D D, ZHANG K, OU H X, et al. Effects of hybrid giant napier Pennisetum sinese roxb and formulated feed on growth and nutrient compositions in muscle of grass carp Ctenopharyngodon idella[J]. Journal of Dalian Ocean University, 2018, 33(1): 7-13. |
| [29] |
张亮, 郑爱荣, 王彦华. 苜蓿草粉对黄河鲤鱼肌肉营养成分及其肥满度的影响[J]. 现代牧业, 2017, 1(4): 14-17. ZHANG L, ZHENG A R, WANG Y H. Effect of alfalfa meal on nutritive composition in muscle and relative fatness of Cyprinus carpio haematopterus[J]. Modern Animal Husbandry, 2017, 1(4): 14-17. DOI:10.3969/j.issn.1008-3111.2017.04.004 |
| [30] |
RIVERA-PIZA A, CHOI L, SEO J, et al. Effects of high-fiber rice Dodamssal (Oryza sativa L.) on glucose and lipid metabolism in mice fed a high-fat diet[J]. Journal of Food Biochemistry, 2020, 44(6): e13231. |
| [31] |
TURNBAUGH P J, LEY R E, MAHOWALD M A, et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444(7122): 1027-1031. DOI:10.1038/nature05414 |
| [32] |
CLEMENTE J C, URSELL L K, PARFREY L W, et al. The impact of the gut microbiota on human health: an integrative view[J]. Cell, 2012, 148(6): 1258-1270. DOI:10.1016/j.cell.2012.01.035 |
| [33] |
O'CONNOR E M, O'HERLIHY E A, O'TOOLE P W. Gut microbiota in older subjects: variation, health consequences and dietary intervention prospects[J]. Proceedings of the Nutrition Society, 2014, 73(4): 441-451. DOI:10.1017/S0029665114000597 |
| [34] |
董学兴, 吕林兰, 赵卫红, 等. 不同养殖模式下罗氏沼虾肠道菌群结构特征及其与环境因子的关系[J]. 上海海洋大学学报, 2019, 28(4): 501-510. DONG X X, LYU L L, ZHAO W H, et al. Effects of different cultural patterns on microbial communities in the intestine of Macrobrachium rosenbergii and interactions with environment factors[J]. Journal of Shanghai Ocean University, 2019, 28(4): 501-510. |
| [35] |
TURNBAUGH P J, HAMADY M, YATSUNENKO T, et al. A core gut microbiome in obese and lean twins[J]. Nature, 2009, 457(7228): 480-484. DOI:10.1038/nature07540 |
| [36] |
WAHLSTRÖM A, KOVATCHEVA-DATCHARY P, STÅHLMAN M, et al. Crosstalk between bile acids and gut microbiota and its impact on farnesoid X receptor signalling[J]. Digestive Diseases, 2017, 35(3): 246-250. DOI:10.1159/000450982 |
| [37] |
苏含, 张枫琳, 宋敏, 等. 饮水添加氯化钙对高脂日粮饲喂小鼠脂肪沉积和肠道菌群的影响[J]. 华南农业大学学报, 2019, 40(3): 1-5. SU H, ZHANG F L, SONG M, et al. Effects of calcium chloride supplementation in drinking water on fat deposition and intestinal flora in mice fed with high-fat diet[J]. Journal of South China Agricultural University, 2019, 40(3): 1-5. |
| [38] |
李存玉, 徐永江, 柳学周, 等. 池塘和工厂化养殖牙鲆肠道菌群结构的比较分析[J]. 水产学报, 2015, 39(2): 245-255. LI C Y, XU Y J, LIU X Z, et al. Comparative analysis of composition, diversity and origin of intestinal bacterial community in pond - and indoor tank-culture Japanese flounder (Paralichthys olivaceus)[J]. Journal of Fisheries of China, 2015, 39(2): 245-255. |
| [39] |
杨彩霞. 两个养殖海区及栉孔扇贝消化盲囊细菌群落多样性分析[D]. 青岛: 中国海洋大学, 2011. YANG C X. Seasonal changes of bacterial community composition in two culture area and digestive diverticula of scallops, Chlamys farreri[D]. Qingdao: Ocean University of China, 2011. |
| [40] |
窦妍, 丁君, 王轶南, 等. 黄、渤海春季刺参肠道及养殖池塘细菌菌群的多样性[J]. 大连海洋大学学报, 2014, 29(6): 572-576. DOU Y, DING J, WANG Y N, et al. Flora diversity in intestine and culture ponds in sea cucumber Apostichopus japonicus in Yellow Sea and Bohai in spring[J]. Journal of Dalian Ocean University, 2014, 29(6): 572-576. DOI:10.3969/J.ISSN.2095-1388.2014.06.006 |
| [41] |
李彤彤. 池塘养殖鱼类共附生细菌群落结构的研究[D]. 北京: 中国科学院大学, 2015. LI T T. Study on the community structure of symbiotic bacteria in pond cultured fish[D]. Beijing: University of Chinese Academy of Sciences, 2015. |
| [42] |
李竞. 姜黄通过肠道菌群改善机体脂质代谢作用的实验研究[J]. 新中医, 2018, 50(11): 15-18. LI J. Curcuma has effect on the improvement of lipid metabolism of body through intestinal flora[J]. Journal of New Chinese Medicine, 2018, 50(11): 15-18. |
| [43] |
THERIOT C M, KOENIGSKNECHT M J, CARLSON JR P E, et al. Antibiotic-induced shifts in the mouse gut microbiome and metabolome increase susceptibility to Clostridium difficile infection[J]. Nature Communications, 2014, 5: 3114. DOI:10.1038/ncomms4114 |
| [44] |
宋晨. 乳杆菌对高脂膳食诱导小鼠肥胖形成抑制作用及机制研究[D]. 哈尔滨: 哈尔滨工业大学, 2016. SONG C. The inhibition effect and mechanism of Lactobacillius on high fat diet-induced obesity in mice[D]. Harbin: Harbin Institute of Technology, 2016. |
| [45] |
STEPHENS R W, ARHIRE L, COVASA M. Gut microbiota: from microorganisms to metabolic organ influencing obesity[J]. Obesity, 2018, 26(5): 801-809. DOI:10.1002/oby.22179 |
| [46] |
LEY R E, TURNBAUGH P J, KLEIN S, et al. Human gut microbes associated with obesity[J]. Nature, 2006, 444(7122): 1022-1023. DOI:10.1038/4441022a |
| [47] |
TAGLIABUE A, ELLI M. The role of gut microbiota in human obesity: recent findings and future perspectives[J]. Nutrition, Metabolism and Cardiovascular Diseases, 2013, 23(3): 160-168. DOI:10.1016/j.numecd.2012.09.002 |
| [48] |
ZHOU L, WEI J F, LIN K T, et al. Intestinal microbial profiling of grass carp (Ctenopharyngodon idella) challenged with Aeromonas hydrophila[J]. Aquaculture, 2020, 524: 735292. DOI:10.1016/j.aquaculture.2020.735292 |
| [49] |
LI Z F, YU E M, WANG G J, et al. Broad bean (Vicia faba L.) induces intestinal inflammation in grass carp (Ctenopharyngodon idella C. et V) by increasing relative abundances of intestinal gram-negative and flagellated bacteria[J]. Frontiers in Microbiology, 2018, 9: 1913. DOI:10.3389/fmicb.2018.01913 |
| [50] |
TIAN J J, JI H, WANG Y F, et al. Lipid accumulation in grass carp (Ctenopharyngodon idella) fed faba beans (Vicia faba L.)[J]. Fish Physiology and Biochemistry, 2019, 45(2): 631-642. DOI:10.1007/s10695-018-0589-7 |
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


