白细胞介素34(Interleukin34,IL-34)是一种促炎细胞因子,对单核细胞和巨噬细胞髓系细胞存活、增殖和分化起着重要的调控作用[1-3]。IL-34诱导Ⅱ型巨噬细胞表达IL-10,抑制IL-12合成,促使Ⅱ型巨噬细胞极化[3]。研究[4-5]报道,在应激反应中,IL-34的表达受体Nuclear Factor kappa-B(NF-κB)介导信号通路调控。IL-34与多种疾病相关,包括自身免疫性疾病、炎症和癌症等[6-9]。例如,IL-34在类风湿性关节炎和皮肤干燥综合征患者中过度表达[6]。另外,IL-34能促进白血病患者的单核细胞分化,为治疗白血病提供了新的靶点[8]。
IL-34和巨噬细胞集落刺激因子(macrophage-colony stimulating factor,M-CSF)激活同一受体,即巨噬细胞集落刺激因子受体(macrophage-colony stimulating factor receptor,M-CSFR),因此具有与M-CSF相似的免疫功能。IL-34和M-CSF可促进细胞生长和存活[10],诱导趋化因子的产生和分泌[11]。然而,IL-34与M-CSF的生物活性和作用机制不完全一致[12]。它们对原代巨噬细胞中单核细胞趋化因子-1(monocyte chemotactic protein-1,MCP-1)和嗜酸细胞活化趋化因子-2(eotaxin-2)的合成、对TF-1-fms细胞的形态影响以及对J774A细胞的迁移等具有不同的效应[13]。与M-CSF相比,IL-34能更有效地诱导巨噬细胞产生eotaxin-2。M-CSF培养的TF-1-fms细胞会形成众多大聚集体,而在IL-34培养的细胞中这种大聚集体非常少见,并且IL-34诱导J774A细胞迁移的能力明显较M-CSF弱[13]。相比于M-CSF,IL-34与M-CSFR亲和力强,能快速诱导效应物的合成,并迅速下调M-CSFR的表达[13]。研究[14-15]发现IL-34与受体蛋白酪氨酸磷酸酶(protein tyrosine phosphatase-ζ,PTP-ζ)和多配体蛋白聚糖(syndecan-1)的亲和力较低。IL-1β和TNF-α通过激活丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)诱导IL-34表达,但是对M-CSF的表达没有影响[5]。
尽管IL-34与其他已知蛋白缺乏明显的序列相似性,但被归类为短链螺旋细胞因子,与M-CSF和干细胞因子(stem cell factor)属于同一家族[16]。哺乳动物IL-34整体结构由6个α螺旋和2个反平行β折叠组成。其中4个较长的螺旋αA、αB、αC和αD形成典型的反平行四螺旋束构像。折叠β1和短螺旋α1位于αA和αB之间,短螺旋α2和折叠β2位于αC和αD之间,这两部分呈交错构像位于αB和αD的外侧[12, 17]。IL-34和M-CSF均形成同型二聚体发挥生物活性,M-CSF同型二聚体由二硫键连接,而IL-34同型二聚体则以共价键连接形成[17]。研究[18]表明IL-34和M-CSF的D2和D3结构域之间的区段与M-CSFR结合。此外,IL-34螺旋α1中存在保守的N-糖基化位点,该位点占据α1和αC之间的空腔,对IL-34在溶液中的稳定性至关重要[12]。
硬骨鱼类IL-34是单拷贝基因。IL-34已经在虹鳟(Oncorhynchus mykiss)、斑马鱼(Danio rerio)、河豚(Fugu rubripse)[19]、石斑鱼(Epinephelus coioides)[20]、大黄鱼(Pseudosciaena crocea)[21]、草鱼(Ctenopharyngodon idella)[22]和日本牙鲆(Paralichthys olivaceus)[23]中被发现。硬骨鱼类IL-34基因编码204~226个氨基酸,其编码蛋白具有较高同源性,其中斑马鱼与草鱼氨基酸序列同源性高达77.6%,与虹鳟和河豚的氨基酸序列同源性也达到了51.5%和47.3%。WANG等[19]发现LPS、Poly (I∶ C)、IFN-γ、IL-1β以及凝集素(phytohemagglutinin,PHA)均上调IL-34在虹鳟细胞系(RTS-11、RTL、RTG-2和RTGill)和虹鳟原代巨噬细胞中的表达,而IL-6和免疫抑制剂DM(Dexamethasone)则抑制IL-34的表达;此外,在鳗弧菌(Vibrio anguillarum)感染的大黄鱼中,IL-34转录本在鳃和皮肤中明显增加[20];嗜水气单胞菌(Aeromonas hydrophila)感染的草鱼脾和头肾中IL-34表达量也显著升高[22],这些研究表明IL-34参与了宿主应答细菌感染的免疫反应。本研究分析了IL-34在健康斑马鱼组织和胚胎中的常量表达,以及LPS、Poly (I∶ C)、迟缓爱德华氏菌(Edwardsiella tarda,E. tarda)和鲤春病毒血症病毒(spring viremia of carp virus,SVCV)对斑马鱼IL-34表达的影响。
1 材料与方法 1.1 实验动物野生型斑马鱼(约5 g)购自中国科学院水生生物研究所。将斑马鱼置于(25±2)℃的循环养殖系统中暂养2周,早晚各投喂丰年虫1次。实验前1天停止投喂,在注射和解剖取样前用质量分数为0.4%的MS-222麻醉斑马鱼。所有实验均按照国家实验动物法规进行,获得上海海洋大学实验室动物伦理委员会批准(批准号:SHOU-DW-2019-003)。
1.2 实验试剂实验试剂包括:3-氨基苯甲酸乙酯甲磺酸(3-Aminobenzoic acid ethyl ester methanesulfonate,MS-222,Sigma)、TRIzolⓇ Reagent(Invitrogen)、无水乙醇(国药)、异丙醇(国药)、氯仿(国药)、DEPC水(生工)、琼脂糖H(生工)、琼脂糖凝胶回收试剂盒(Omega)、小型质粒抽提试剂盒(Omega)、去内毒素质粒提取试剂盒(Omega)、LB液体培养基(生工)、琼脂(生工)、限制性内切酶(Thermo)、逆转录试剂盒(HifairⓇ Ⅱ 1st Strand cDNA Synthesis SuperMix for qPCR,翊圣)、qPCR试剂盒(SYBRⓇ Green PreMix ExTaqTM Ⅱ,翊圣)、ExTaq Mix(TaKaRa)、pMD19-T(TaKaRa)、DNA marker(TaKaRa)、氨苄青霉素(Ampicilin,生工)、异丙基硫代半乳糖苷(IPTG,VWR)、Tris(VWR)、DTT(VWR)、EDTA(VWR)、氧化型谷胱甘肽和还原型谷胱甘肽(VWR)、盐酸胍(VWR)、考马斯亮蓝(BiofRoxx)、10 × TBS漂洗液(生工)、甘油(生工)、Tween 20(生工)、咪唑(生工)、DMEM培养基(Gibco)、胎牛血清(FBS,Gibco)、青霉素-链霉素(Gibco)、脂多糖(Lipopolysaccharide,LPS,Sigma)、聚肌苷酸-聚胞苷酸[Polyinosinic acid-polycytidylic acid,Poly (I∶ C),Sigma]和磷酸缓冲盐溶液(Phosphate buffer saline,PBS,Sigma)。
1.3 实验仪器实验仪器包括:组织匀浆仪TissueLyserⅡ(Qiagen)、荧光定量PCR仪LightCyclerⓇ480(Roche)、PCR扩增仪(Thermo Scientific)、电泳仪POWERPAC BASIC(BioRad)、凝胶成像系统GelDocTMXR+ (BioRad)、高速冷冻离心机(Eppendorf)、分光光度计Nanodrop 2000(Thermo)、水浴锅XMTD-8222(上海精宏实验设备有限公司)、电子天平YP10002(上海佑科仪器仪表有限公司)、高压灭菌锅MLS-3781L(Panasonic)、超纯水系统MILLI-Q DIRTCT-8(Millipore)、恒温金属浴HX-20TL(上海沪析实业有限公司)、超净工作台(Esco)和AKTA Purifiers(GE Healthcare)。
1.4 IL-34基因在胚胎和成鱼组织中的表达分析采集斑马鱼胚胎,检测胚胎发生过程中IL-34基因的表达。在斑马鱼受精后10、24、48和72 h,收集胚胎并置于含1 mL TRIzol试剂的Eppendorf(EP)离心管中,每个时间点收集5管,每管30个胚胎。用Trizol试剂提取总RNA,按照HifairⓇ Ⅱ 1st Strand cDNA Synthesis Kit说明书制备cDNA模板,qPCR检测IL-34基因在胚胎中的表达情况。
用0.4% MS-222麻醉斑马鱼后,取鳃、肠、脾脏、肾脏、肝脏、肌肉和皮肤,并置于含有1 mL TRIzol试剂的EP离心管中,设3个平行组,每组含10尾斑马鱼组织的混合样品。用组织匀浆仪破碎组织,置于-80 ℃冰箱保存备用。使用有机溶剂法提取总RNA,qPCR模板制备严格按照HifairⓇ Ⅱ 1st Strand cDNA Synthesis Kit说明书,qPCR检测IL-34基因在各个组织中的表达情况。
1.5 LPS和Poly (I∶ C) 刺激实验将360尾健康斑马鱼随机分成3组(1组对照组和2组实验组),每组120尾斑马鱼。腹腔注射斑马鱼:10 μL LPS(100 μg/mL)、Poly (I∶ C)(100 μg/mL)或等体积PBS(对照组)。注射后12、24、48和72 h分别取脾和肠放入1 mL TRIzol试剂中用于RNA提取,每个时间点设置3个平行,每个平行组10尾鱼。按照HifairⓇ Ⅱ 1st Strand cDNA Synthesis Kit说明书制备cDNA模板,qPCR检测IL-34基因的表达情况。
1.6 迟缓爱德华氏菌感染实验迟缓爱德华氏菌(E. tarda)由中国科学院水生生物研究所谢海霞提供,具体制备方法参照田佳音等[24]。将240尾健康斑马鱼随机分成2组,每组120尾斑马鱼。实验组斑马鱼腹腔注射10 μL迟缓爱德华氏菌(1×105 CFU/mL),对照组注射等体积的PBS。在注射3、6、9、24和72 h后分别取脾和肠放入1 mL TRIzol试剂中,用于RNA提取,每个时间点设置3个平行。按照HifairⓇ Ⅱ 1st Strand cDNA Synthesis Kit说明书制备cDNA模板,qPCR检测IL-34基因的表达情况。
1.7 鲤春病毒血症病毒感染实验与细菌攻毒实验相似,分别用10 μL DMEM培养基(对照)和10 μL的1 × 105 TCID50 /mL SVCV溶液腹腔注射斑马鱼。注射后1、3、5、7和14 d取脾和肠提取RNA,每个时间点设置3个平行。用Trizol试剂提取总RNA,按照HifairⓇ Ⅱ 1st Strand cDNA Synthesis Kit说明书制备cDNA模板。用qPCR检测IL-34基因的表达情况。
1.8 SVCV感染斑马鱼胚胎成纤维细胞系(ZF4)实验将冻存的ZF4细胞从液氮罐中取出,放置于28 ℃水浴锅中1 min解冻,然后将细胞悬液迅速转移至装有10 mL DMEM/F12培养基(100 U/mL青霉素和100 μg/mL链霉素,P/S)的离心管中,室温200 r/min离心10 min,弃去离心后的上清,用含有10% FBS和1% P/S的DMEM/F12培养基重悬细胞,将细胞悬液转移至25 cm2的细胞培养瓶中,在28 ℃、5% CO2细胞培养箱中培养,待细胞密度达到5 × 106细胞/mL时,消化细胞并均分到六孔细胞培养板中。待细胞贴壁后弃掉培养基,实验组加入100 μL 1 × 107 TCID50/mL SVCV病毒液,对照组加入等体积的DMEM培养基,置于5% CO2、22 ℃培养箱1 h,吸弃病毒液并加入2 mL含2% FBS的DMEM培养基。以上实验操作均在无菌条件下进行。感染12、24和48 h时收集细胞用于RNA提取,所有时间点设置4个平行。用Trizol试剂提取总RNA,按照HifairⓇ Ⅱ 1st Strand cDNA Synthesis Kit说明书制备cDNA模板。用qPCR检测IL-34基因的表达情况。
1.9 LPS和Poly (I∶ C) 感染ZF4细胞和脾原代细胞实验ZF4细胞实验前处理详见1.8节。待细胞在六孔细胞培养板中贴壁后,加入50 μg/mL LPS或50 μg/mL Poly (I∶ C),对照组加入等体积PBS,每个处理组设置4个平行。刺激12 h后收集细胞,用Trizol试剂提取总RNA,按照HifairⓇ Ⅱ 1st Strand cDNA Synthesis Kit说明书制备cDNA模板。用qPCR检测IL-34基因的表达情况。
斑马鱼脾原代细胞的分离: 在无菌条件下解剖40尾斑马鱼,取脾放入装有20 mL DMEM培养基的50 mL离心管中,将组织置于70 μm尼龙网研磨过滤,收集滤过的细胞悬液,200 r/min离心10 min,弃上清,用含有10% FBS、1% P/S的DMEM完全培养基重悬细胞沉淀并均分至六孔细胞培养板中。在28 ℃,5% CO2细胞培养箱中培养4 h,加入50 μg/mL LPS或50 μg/mL Poly (I∶ C),对照组加入等体积的PBS,每个处理组设置4个平行。12 h后收集细胞,用Trizol试剂提取总RNA,按照HifairⓇ Ⅱ 1st Strand cDNA Synthesis Kit说明书制备cDNA模板。用qPCR检测IL-34基因的表达情况。
1.10 重组蛋白的表达及纯化从美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)获取斑马鱼IFNφ1和IFNφ4的序列(登录号:NM_207640.1、NM_001161740.1),设计引物扩增目的基因序列(表 1)。采用限制性核酸内切酶(Nco Ⅰ和Hind Ⅲ)双酶切目的片段及空载体(pEHISTEV-b)并进行连接,将连接后的产物转化至大肠杆菌DH5α感受态细胞中,挑取含目的片段的单阳性菌落,测序验证后进行质粒提取,将重组表达质粒转化至BL21菌中,进行诱导表达。重组蛋白诱导具体方法步骤详见QIN等[25]。采用稀释复性法复性蛋白,用分子筛层析柱法(Superdex 75/200 column)进行纯化,纯化步骤按照AKTA pure仪器纯化说明书进行操作。

|
表 1 基因引物信息 Tab.1 Information of gene primers |
从斑马鱼脾cDNA模板中扩增出IL-1β(登录号:NM_212844.2)的开放阅读框(ORF)。采用限制性核酸内切酶(Hind Ⅲ和BamH Ⅰ)双酶切目的片段并连接到pcDNA3.1载体上,将连接产物转化至大肠杆菌DH5α感受态细胞中,挑取单阳性菌落检测及测序成功后根据去内毒素质粒提取试剂盒操作说明进行质粒(pcDNA3.1-IL-1β)提取。
转染前将HEK293细胞接种于六孔细胞培养板中,按照Lipofectamine 3000转染试剂盒使用说明进行转染。从加有125 μL Opti-MEMTM培养基和7 μL LipofectamineTM 3000试剂的混合液中与加有125 μL Opti-MEMTM培养基,5 μL P3000TM试剂和2.5 μg重组质粒(对照组加入等质量的pcDNA3.1载体)的混合液中各吸取125 μL液体,混匀,室温放置15 min后加入到细胞培养基中。48 h后收集细胞上清,400 g离心10 min后保留上清。纯化Il-1β重组蛋白:用PBS平衡亲和柱(Ni-NTA柱),将收集的细胞上清加入亲和柱,收集过柱穿透液,重复上样1次,用10 mL PBS洗涤亲和柱,加入10 mL不同浓度(30、60和150 mmol/L)的咪唑进行洗脱并分别收集洗脱液,洗脱结束后分别用10 mL 0.5 mol/L NaOH和10 mL去离子水清洗纯化柱,最后用10 mL体积分数为20%乙醇平衡并4 ℃保存纯化柱。采用免疫印迹法(Western blotting)和His抗体检测蛋白溶液。用于Western blotting的一抗为His标签鼠单克隆抗体(1∶ 1 000稀释,华安生物),二抗为HRP荧光标记的羊抗鼠抗体(1∶ 10 000稀释,华安生物)。
1.11 IL-1β、IFNφ1及IFNφ4刺激ZF4细胞和脾原代细胞实验ZF4细胞实验前处理详见1.8节,脾原代细胞实验前处理详见1.9节。ZF4细胞和脾原代细胞在细胞培养箱中静置4 h,用终浓度为50 ng/mL的IL-1β、IFNφ1或IFNφ4重组蛋白刺激细胞,对照组加入等体积的PBS,12 h后收集细胞,用Trizol试剂提取总RNA,按照HifairⓇ Ⅱ 1st Strand cDNA Synthesis Kit说明书制备cDNA模板。用qPCR检测IL-34基因的表达情况。
1.12 统计分析采用SPSS 17.0软件对实时荧光定量PCR生成的数据进行统计分析。对实验组采用单因素方差分析,进行LSD事后检验,实验组与对照组差异有统计学意义,P < 0.05(用*表示)和P < 0.01(用**表示)分别表示差异显著和极显著。
2 结果 2.1 重组蛋白表达及纯化参照田佳音[26]进行IFNφ1和IFNφ4蛋白表达及纯化。将真核质粒pcDNA3.1-IL-1β转染HEK293细胞,48 h后收集细胞上清,利用亲和层析柱法纯化重组蛋白,纯化结果如图 1所示。

|
1.Marker; 2.穿透液; 3.洗涤液;4.洗脱液1(30 mmol/L咪唑);5.洗脱液2(60 mmol/L咪唑);6.洗脱液3(150 mmol/L咪唑);7.对照组(转染pcDNA3.1载体收集的细胞上清)。 1.Marker; 2.Flow-through fraction; 3. Washing fraction; 4.Elution 1 (30 mmol/Limidazole); 5.Elution 2 (60 mmol/L imidazole); 6. Elution 3 (150 mmol/L imidazole); 7.Control (supernatant of cells transfection with pcDNA3.1 vector). 图 1 HEK293细胞中表达IL-1β的Western blot验证 Fig. 1 Western blot validation of IL-1β |
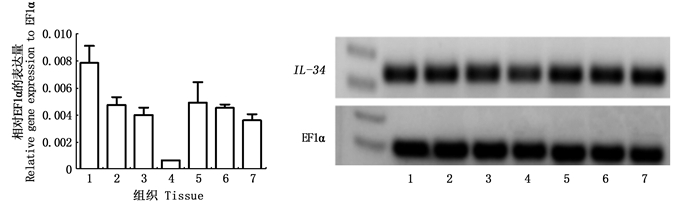
对斑马鱼IL-34基因在成鱼组织中的表达进行了实时荧光定量PCR分析。由图 2可知,IL-34基因在健康斑马鱼各组织中呈组成型表达。其中IL-34基因在鳃中表达量最高,其次为肝、肠和脾,在肾脏中表达量最低。在检测IL-34基因在斑马鱼受精10、24、48和72 h胚胎中的表达分析中发现(图 3),IL-34基因在斑马鱼胚胎的各时间点均有表达,并且IL-34基因在胚胎中的表达量随着胚胎发育而逐步升高。
|
1.鳃; 2.肠; 3.脾脏; 4.肾脏; 5.肝脏; 6.皮肤; 7.肌肉。 1. Gills; 2. Intestine; 3. Spleen; 4. Kidney; 5. Liver; 6. Skin; 7. Muscle. 图 2 斑马鱼IL-34的组织表达 Fig. 2 Expression of zebrafish IL-34 in tissues |

|
图 3 斑马鱼IL-34在胚胎发育过程中的表达 Fig. 3 Expression of zebrafish IL-34 during embryogenesis |
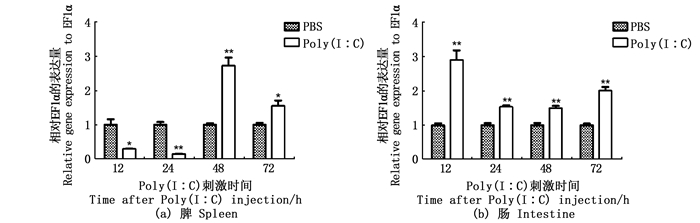
用10 μL LPS(100 μg/mL)和Poly (I∶ C)(100 μg/mL)分别腹腔注射斑马鱼,分析注射后12、24、48和72 h脾和肠中IL-34的表达情况(图 4和图 5)。结果显示,LPS刺激12和24 h后IL-34在脾中的表达无明显变化,在48和72 h显著上升;LPS刺激斑马鱼12、48和72 h后,肠中IL-34的表达呈现上调,在24 h出现显著下降。注射Poly (I∶ C) 后脾中IL-34表达在12和24 h显著减少,但在48和72 h有显著增加。与之相比,肠中IL-34在注射Poly (I∶ C) 后各个时间点均被上调。

|
*.P < 0.05; **.P < 0.01。 图 4 斑马鱼注射LPS后脾和肠中IL-34基因mRNA表达 Fig. 4 mRNA expression of IL-34 gene in zebrafish spleen and intestine after injection of LPS |
|
*.P < 0.05; **.P < 0.01。 图 5 斑马鱼注射Poly (I∶ C) 后脾和肠中IL-34基因mRNA表达 Fig. 5 mRNA expression of IL-34 in zebrafish spleen and intestine after injection of Poly (I∶ C) |
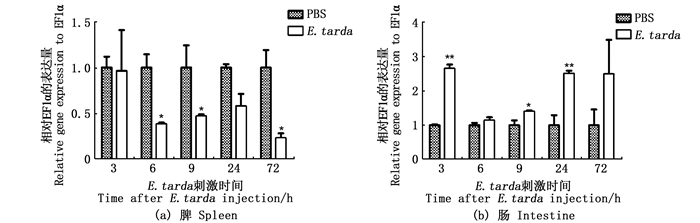
腹腔注射E. tarda后的斑马鱼在脾和肠中IL-34的表达情况如图 6所示。感染后6、9和72 h,脾中IL-34的表达水平显著下降,在3和24 h无明显变化。在肠中,感染后3、9和24 h IL-34表达均显著升高,在6和72 h无明显变化。
|
*.P < 0.05; **.P < 0.01。 图 6 斑马鱼在感染E. tarda后脾和肠中IL-34基因mRNA表达 Fig. 6 mRNA expression of IL-34 in zebrafish spleen and intestine after infection with E. tarda |
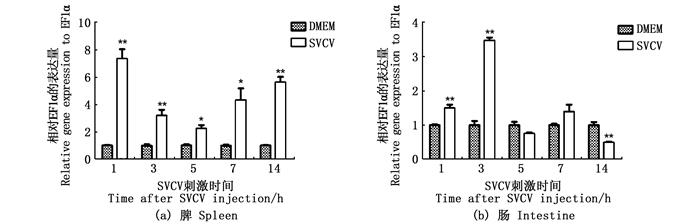
斑马鱼在腹腔注射SVCV后,脾中IL-34的表达在各个时间点均显著升高,肠中IL-34的表达在1和3 d上调,在5和7 d无明显变化,在14 d显著下降(图 7)。
|
*.P < 0.05; **.P < 0.01。 图 7 斑马鱼在感染SVCV后脾和肠中IL-34 mRNA表达 Fig. 7 mRNA expression of IL-34 in zebrafish spleen and intestine after infection with SVCV |
ZF4细胞为常用的斑马鱼成纤维细胞系,本研究用100 μL浓度为1 × 107 TCID50/mL SVCV感染ZF4细胞,荧光定量检测感染后IL-34的表达情况(图 8)。结果显示,感染后12和24 h,ZF4细胞中IL-34表达相对于对照组无明显变化,感染后48 h,ZF4细胞中IL-34表达与对照组相比显著增加。
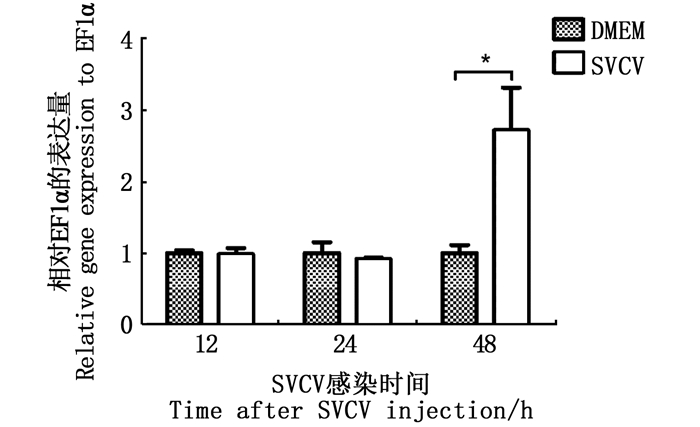
|
*.P < 0.05。 图 8 斑马鱼IL-34基因在SVCV感染ZF4细胞中的mRNA表达 Fig. 8 mRNA expression of zebrafish IL-34 in ZF4 cells after infection with SVCV |
LPS为革兰氏阴性菌产生的内毒素,Poly (I∶ C) 为人工合成的类似于病毒基因组的双链RNA。LPS和Poly (I∶ C) 能被宿主细胞的模式识别受体(pattern recognition receptor,PRR)识别,从而激活天然免疫反应。本研究用50 μg/mL LPS和50 μg/mL Poly (I∶ C) 分别刺激ZF4细胞和脾原代细胞,荧光定量检测IL-34的表达情况。结果如图 9所示,与对照组相比,LPS能诱导IL-34在ZF4细胞和脾原代细胞中的表达,Poly (I∶ C) 对ZF4细胞中IL-34的表达没有影响,上调脾原代细胞中IL-34的表达但差异不显著。

|
*.P < 0.05;**.P < 0.01。 图 9 LPS和Poly (I: C) 刺激ZF4细胞和脾原代细胞后IL-34 mRNA表达 Fig. 9 mRNA expression of zebrafish IL-34 in ZF4 cells and primary spleen cells after stimulation with LPS or Poly (I∶ C) |
本研究分析了ZF4细胞和脾原代细胞中IL-1β(50 ng/mL)、IFNφ1(50 ng/mL)及IFNφ4(50 ng/mL)重组蛋白对IL-34表达的调控,IL-1β重组蛋白对ZF4细胞中IL-34的表达没有影响,但可显著提高在脾原代细胞的表达量。在IFNφ1和IFNφ4重组蛋白刺激的ZF4细胞和脾原代细胞实验中,IFNφ1上调脾原代细胞IL-34表达但IFNφ4没有诱导作用;IFNφ1和IFNφ4对ZF4细胞中IL-34的表达没有影响。见图 10。
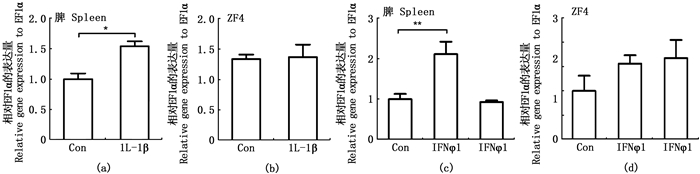
|
*.P < 0.05;**.P < 0.01。 图 10 斑马鱼IL-1β、IFNφ1和IFNφ4重组蛋白刺激ZF4细胞和脾原代细胞后IL-34 mRNA表达 Fig. 10 mRNA expression of zebrafish IL-34 in ZF4 cells and primary spleen cells after stimulation with recombinant IL-1β, IFNφ1 or IFNφ4 |
已有研究[19]表明,鱼类 IL-34基因在不同组织中的表达存在差异,例如,在虹鳟中IL-34在不同组织中常量表达且在组织间差异较小;石斑鱼IL-34在脑、鳃和脾中有较高表达[20]。本研究对健康斑马鱼7种组织中IL-34的表达进行了实时荧光定量PCR分析。结果显示,斑马鱼IL-34基因呈常量表达,在鳃中表达量最高,这一结果与虹鳟鱼中的发现十分类似[19]。鳃含有丰富的T细胞[27],是T细胞分化和成熟的主要器官之一,IL-34在鳃中高量表达暗示其在鱼类T细胞发育中可能发挥作用。此外,我们发现IL-34在肝、肠、皮肤和脾中也有较高表达,这说明IL-34可能与维护鱼类免疫系统稳态相关。
本研究发现斑马鱼在腹腔注射LPS和Poly (I∶ C) 后,IL-34基因在脾和肠中的表达呈现不同程度的变化。例如,脾在刺激48和72 h时,IL-34基因的表达显著上调;肠在刺激12、48和72 h时,IL-34基因表达也明显上升。这些结果跟大黄鱼中的研究基本吻合[21]。LPS是典型的细菌病原体相关分子模式(pathogen associated molecular pattern,PAMP)。在哺乳类中,Toll样受体4(Toll like receptor 4,TLR4)识别LPS后,激活细胞内信号通路,诱发炎症基因的表达[28]。跟哺乳类不同,鱼类TLR4跟LPS结合力较弱,不参与LPS介导的胞内信号通路的激活[29]。由此推论,鱼类中可能存在识别LPS的其他受体。Poly (I∶ C) 是病毒核酸双链RNA类似物,位于脊椎动物细胞内质网中的TLR3识别Poly (I∶ C),TLR3结合Poly (I∶ C) 后,诱发干扰素调节因子3/7(Interferon regulatory factor 3/7,IRF3/7)磷酸化,招募IRF9形成干扰素刺激基因因子9(Interferon-stimulated gene factor 9,ISGF9)复合体,进入细胞核作用于靶基因启动子,诱导基因表达[30]。在鱼类中,除TLR3外,TLR22亦可识别Poly(I∶ C)[31]。但与TLR3不同的是,TLR22位于细胞膜表面,能够与胞外Poly (I∶ C) 结合。因此,Poly (I∶ C) 可能通过激活TLR22介导的信号通路诱导IL-34的表达,当然,不能排除Poly (I∶ C) 通过结合其他细胞表面受体调控IL-34基因。
IL-34基因表达受到细菌和病毒的调控。迟缓爱德华氏菌是一种常见、非常重要的肠杆菌科细菌,是感染多种海洋和淡水鱼类的条件致病菌[32-33]。SVCV是一种单链RNA病毒,可感染鲤科鱼类,引发急性出血症[32]。本研究用E. tarda和SVCV感染斑马鱼,分析对IL-34基因在脾和肠中的表达变化。发现E. tarda感染3、9和24 h后肠中IL-34的表达升高,而脾中IL-34的表达在感染6、9和72 h后却受到抑制。研发发现细菌感染的石斑鱼脾中IL-34表达也呈现下调。此外,在感染刺激隐核虫(Cryptocaryon irritans)的石斑鱼中,IL-34表达在鳃和头肾中也显著升高。虹鳟鱼受到寄生虫感染时,IL-34的表达在受感染鱼的所有组织中均有适度增加,在受到鳗弧菌感染的大黄鱼中,IL-34的表达量在脾、肝脏和肾脏中均有显著上调。在感染过SVCV斑马鱼中,IL-34也同样受到上调,而且体外SVCV感染ZF4细胞时同样检测到了IL-34表达量的增加。我们观察到IFNφ1能在原代脾细胞中诱导IL-34表达,说明IL-34是IFNφ1刺激基因(Ifn stimulated gene,ISG)。这些研究结果表明鱼类IL-34可能参与抵御细菌和病毒感染过程。
EDA等[5]发现促炎细胞因子(如IL-1β,IL-6,IL-17和TNF-α)诱导人成骨细胞中氨基末端激酶(JNK)和p44/42 MAPK增强IL-1β和TNF-α表达。硬骨鱼类炎性细胞因子(如IL-1β和IFN-γ)能快速诱导IL-34在4种虹鳟细胞系(RTS-11、RTL、RTG-2和RTGill)和虹鳟原代巨噬细胞的表达[19]。同样,本研究发现斑马鱼IL-1β上调脾原代细胞中IL-34基因表达,说明IL-34参与调控炎症反应,但其机制有待深入研究。
综上所述,我们对斑马鱼IL-34 mRNA分布及表达进行了研究。结果显示,IL-34在健康成鱼组织中呈常量表达,在细菌和病毒感染后表达上调,表明斑马鱼IL-34参与抵御细菌和病毒感染。IL-34表达能够被细胞因子IL-1β和IFNφ1诱导,暗示其在炎症反应中具有调控作用。研究结果为阐析IL-34在鱼类免疫应答中的功能和作用机制奠定基础。
| [1] |
FOUCHER E D, BLANCHARD S, PREISSER L, et al. IL-34 induces the differentiation of human monocytes into immunosuppressive macrophages. Antagonistic effects of GM-CSF and IFNγ[J]. PLoS One, 2013, 8(2): e56045. DOI:10.1371/journal.pone.0056045 |
| [2] |
CICCIA F, ALESSANDRO R, RODOLICO V, et al. IL-34 is overexpressed in the inflamed salivary glands of patients with Sjogren's syndrome and is associated with the local expansion of pro-inflammatory CD14 bright CD16+ monocytes[J]. Rheumatology, 2013, 52(6): 1009-1017. DOI:10.1093/rheumatology/kes435 |
| [3] |
FOUCHER E D, BLANCHARD S, PREISSER L, et al. IL-34-and M-CSF-induced macrophages switch memory T cells into Th17 cells via membrane IL-1α[J]. European Journal of Immunology, 2015, 45(4): 1092-1102. DOI:10.1002/eji.201444606 |
| [4] |
YU Y Q, YANG D, QIU L H, et al. Tumor necrosis factor-α induces interleukin-34 expression through nuclear factor-κB activation in MC3T3-E1 osteoblastic cells[J]. Molecular Medicine Reports, 2014, 10(3): 1371-1376. DOI:10.3892/mmr.2014.2353 |
| [5] |
EDA H, SHIMADA H, BEIDLER D R, et al. Proinflammatory cytokines, IL-1β and TNF-α, induce expression of interleukin-34 mRNA via JNK-and p44/42 MAPK-NF-κB pathway but not p38 pathway in osteoblasts[J]. Rheumatology International, 2011, 31(11): 1525-1530. DOI:10.1007/s00296-010-1688-7 |
| [6] |
BAGHDADI M, ENDO H, TANAKA Y, et al. Interleukin 34, from pathogenesis to clinical applications[J]. Cytokine, 2017, 99: 139-147. DOI:10.1016/j.cyto.2017.08.020 |
| [7] |
汪洋, 邵建国, 卞兆连, 等. 白细胞介素-34及其在炎症性肠病中的作用[J]. 国际消化病杂志, 2016, 36(5): 264-268. WANG Y, SHAO J G, BIAN Z L, et al. Interleukin-34 and its role in inflammatory bowel disease[J]. International Journal of Digestive Diseases, 2016, 36(5): 264-268. DOI:10.3969/j.issn.1673-534X.2016.05.002 |
| [8] |
李静, 胡艳, 王丽红, 等. 白细胞介素-34的特点及其在肿瘤疾病中的作用[J]. 安徽医药, 2017, 21(12): 2139-2141. LI J, HU Y, WANG L H, et al. Characteristics of interleukin-34 and its role in tumor diseases[J]. Anhui Medical and Pharmaceutical Journal, 2017, 21(12): 2139-2141. DOI:10.3969/j.issn.1009-6469.2017.12.001 |
| [9] |
CHEMEL M, LE GOFF B, BRION R, et al. Interleukin 34 expression is associated with synovitis severity in rheumatoid arthritis patients[J]. Annals of the Rheumatic Diseases, 2012, 71(1): 150-154. DOI:10.1136/annrheumdis-2011-200096 |
| [10] |
WEI S W, NANDI S, CHITU V, et al. Functional overlap but differential expression of CSF-1 and IL-34 in their CSF-1 receptor-mediated regulation of myeloid cells[J]. Journal of Leukocyte Biology, 2010, 88(3): 495-505. DOI:10.1189/jlb.1209822 |
| [11] |
EDA H, ZHANG J, KEITH R H, et al. Macrophage-colony stimulating factor and interleukin-34 induce chemokines in human whole blood[J]. Cytokine, 2010, 52(3): 215-220. DOI:10.1016/j.cyto.2010.08.005 |
| [12] |
LIU H L, LEO C, CHEN X Y, et al. The mechanism of shared but distinct CSF-1R signaling by the non-homologous cytokines IL-34 and CSF-1[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2012, 1824(7): 938-945. DOI:10.1016/j.bbapap.2012.04.012 |
| [13] |
CHIHARA T, SUZU S, HASSAN R, et al. IL-34 and M-CSF share the receptor Fms but are not identical in biological activity and signal activation[J]. Cell Death & Differentiation, 2010, 17(12): 1917-1927. |
| [14] |
NANDI S, CIOCE M, YEUNG Y G, et al. Receptor-type protein-tyrosine phosphatase ζ is a functional receptor for interleukin-34[J]. Journal of Biological Chemistry, 2013, 288(30): 21972-21986. DOI:10.1074/jbc.M112.442731 |
| [15] |
SEGALINY A I, BRION R, MORTIER E, et al. Syndecan-1 regulates the biological activities of interleukin-34[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 2015, 1853(5): 1010-1021. DOI:10.1016/j.bbamcr.2015.01.023 |
| [16] |
GARCEAU V, SMITH J, PATON I R, et al. Pivotal advance: avian colony-stimulating factor 1(CSF-1 ), interleukin-34(IL-34), and CSF-1 receptor genes and gene products[J]. Journal of Leukocyte Biology, 2010, 87(5): 753-764. DOI:10.1189/jlb.0909624 |
| [17] |
MA X L, LIN W Y, CHEN Y M, et al. Structural basis for the dual recognition of helical cytokines IL-34 and CSF-1 by CSF-1R[J]. Structure, 2012, 20(4): 676-687. DOI:10.1016/j.str.2012.02.010 |
| [18] |
FELIX J, ELEGHEERT J, GUTSCHE I, et al. Human IL-34 and CSF-1 establish structurally similar extracellular assemblies with their common hematopoietic receptor[J]. Structure, 2013, 21(4): 528-539. DOI:10.1016/j.str.2013.01.018 |
| [19] |
WANG T H, KONO T, MONTE M M, et al. Identification of IL-34 in teleost fish: differential expression of rainbow trout IL-34, MCSF1 and MCSF2, ligands of the MCSF receptor[J]. Molecular Immunology, 2013, 53(4): 398-409. DOI:10.1016/j.molimm.2012.09.008 |
| [20] |
MO Z Q, LI Y W, ZHOU L, et al. Grouper (Epinephelus coioides) IL-34/MCSF2 and MCSFR1/MCSFR2 were involved in mononuclear phagocytes activation against Cryptocaryon irritans infection[J]. Fish & Shellfish Immunology, 2015, 43(1): 142-149. |
| [21] |
WANG L P, JIANG L H, WU C W, et al. Molecular characterization and expression analysis of large yellow croaker (Larimichthys crocea) interleukin-12A, 16 and 34 after poly I: C and Vibrio anguillarum challenge[J]. Fish & Shellfish Immunology, 2018, 74: 84-93. |
| [22] |
XUE Y J, JIANG X Y, GAO J D, et al. Functional characterisation of interleukin 34 in grass carp Ctenopharyngodon idella[J]. Fish & Shellfish Immunology, 2019, 92: 91-100. |
| [23] |
YU C, ZHANG P, ZHANG T F, et al. IL-34 regulates the inflammatory response and anti-bacterial immune defense of Japanese flounder Paralichthys olivaceus[J]. Fish & Shellfish Immunology, 2020, 104: 228-236. |
| [24] |
田佳音, 陈康勇, 张畅, 等. 斑马鱼肿瘤坏死因子(tnfα )及其受体(tnfrsf1a )应答细菌和病毒感染的表达[J]. 上海海洋大学学报, 2020, 29(2): 171-179. TIAN J Y, CHEN K Y, ZHANG C, et al. Expression analysis of zebrafish tumor necrosis factor (tnfα ) and its receptor (tnfrsf1a ) in response to bacterial and viral infections[J]. Journal of Shanghai Ocean University, 2020, 29(2): 171-179. |
| [25] |
QIN Y T, SUN Z S, WANG W, et al. Characterization of CD3γ/δ+ cells in grass carp (Ctenopharyngodon idella)[J]. Developmental & Comparative Immunology, 2021, 114: 103791. |
| [26] |
田佳音. 斑马鱼Ⅰ型干扰素和肿瘤坏死因子(TNFα)的表达和功能研究[D]. 上海: 上海海洋大学, 2019. TIAN J Y. Expression and function of zebrafish type I interferon and tumor necrosis factor (TNFα)[D]. Shanghai: Shanghai Ocean University, 2019. |
| [27] |
HAUGARVOLL E, BJERKÅS I, NOWAK B F, et al. Identification and characterization of a novel intraepithelial lymphoid tissue in the gills of Atlantic salmon[J]. Journal of Anatomy, 2008, 213(2): 202-209. |
| [28] |
GUIJARRO-MUÑOZ I, COMPTE M, ÁLVAREZ-CIENFUEGOS A, et al. Lipopolysaccharide activates Toll-like receptor 4 (TLR4)-mediated NF-κB signaling pathway and proinflammatory response in human pericytes[J]. Journal of Biological Chemistry, 2014, 289(4): 2457-2468. |
| [29] |
SEPULCRE M P, ALCARAZ-PÉREZ F, LÓPEZ-MUÑOZ A, et al. Evolution of lipopolysaccharide (LPS) recognition and signaling: fish TLR4 does not recognize LPS and negatively regulates NF-κB activation[J]. The Journal of Immunology, 2009, 182(4): 1836-1845. |
| [30] |
HOLLAND J W, BIRD S, WILLIAMSON B, et al. Molecular characterization of IRF3 and IRF7 in rainbow trout, Oncorhynchus mykiss: functional analysis and transcriptional modulation[J]. Molecular Immunology, 2008, 46(2): 269-285. |
| [31] |
PALTI Y. Toll-like receptors in bony fish: from genomics to function[J]. Developmental & Comparative Immunology, 2011, 35(12): 1263-1272. |
| [32] |
PARK S B, AOKI T, JUNG T S. Pathogenesis of and strategies for preventing Edwardsiella tarda infection in fish[J]. Veterinary Research, 2012, 43(1): 67. |
| [33] |
ASHRAF U, LU Y A, LIN L, et al. Spring viraemia of carp virus: recent advances[J]. Journal of General Virology, 2016, 97(5): 1037-1051. |
 2022,
Vol. 31
2022,
Vol. 31

