2. 三门县农业农村局,浙江 台州 317100;
3. 上海海洋大学 水产动物遗传育种中心上海市协同创新中心,上海 201306
缢蛏(Sinonovacula constricta),俗称蛏子、蜻子,是一种埋栖型的双壳贝类,广泛分布于中国、日本、朝鲜等国的沿海地区,是我国四大海产经济贝类之一[1]。
盐度是海洋贝类生活环境的一个重要环境因子,决定着贝类的地理分布和养殖区域,对贝类的生长发育具有重要影响[2]。由于潮汐、蒸发和季节性降雨等影响,海水盐度通常呈现周期性变化,近岸潮间带的海洋生物需要不断调整生理活动以适应盐度的改变[3]。缢蛏主要栖息于淡咸水交汇的河口附近和沿海滩涂中,适宜盐度为15~25[4],容易受到高盐度海水的影响。
水产动物在非等渗环境下需要消耗额外的能量用于自身渗透压调节活动[5-7]。当盐度超过21时,青蛤(Cyclina sinensis)耗氧率随着盐度上升而增加,其体内呼吸代谢水平提高[8]。缢蛏在低盐胁迫下会出现全身性的能量上调,其中最显著上调的基因是磷酸烯醇丙酮酸羧激酶,暗示低盐胁迫下缢蛏体内葡萄糖可能被大量消耗[9]。皱纹盘鲍(Haliotis discus hannai)在受到急性盐度胁迫时其肝胰腺中己糖激酶、丙酮酸激酶和琥珀酸脱氢酶的活性均显著上升,表明皱纹盘鲍在进行渗透压调节活动时增加了能量消耗[10]。本实验以缢蛏为对象,从渗透调节和能量代谢的角度研究长期高盐养殖对缢蛏生理代谢的影响,并统计了缢蛏的生长存活数据,旨在为缢蛏高盐耐受性生理机制以及进一步培育缢蛏耐高盐新品系提供参考资料。
1 材料与方法 1.1 实验材料实验所用缢蛏取自浙江台州市三门县贝类育苗基地。采集后的缢蛏在室内暂养7 d,盐度为20。暂养后随机挑选健康有活力的缢蛏用于养殖实验。实验在长方体塑料水箱中进行(长×宽×高=65 cm×45 cm×68 cm),底铺30 cm厚新鲜滩涂海泥,实验水体为100 L。饵料为牟氏角毛藻(Chaetoceros mulleri),藻水盐度为20±2,密度为(3~8)×105 ind./mL。高盐度水用生化海水晶(台州市盐业有限公司,浙江,中国)配制,盐度使用精密数字盐度仪(MASTER-α,ATAGO)测定。
1.2 实验设计实验设置对照组和高盐组,其中盐度20为对照组,盐度30为高盐组(经3 d盐度驯化,盐度由20上升到30)。高盐组和对照组各设3个实验重复,每个重复分别养殖80粒缢蛏,壳长、壳宽、壳高和体质量分别为(38.96±0.54) mm、(9.54±0.26) mm、(12.75±0.33) mm和(3.58±0.28) g。养殖期间每天8:00和18:00换水,换水量100%。换水时预先将适量藻水盐度调至20,先投喂对照组,然后再将余下藻水盐度调至30投喂高盐组,从而保证两组饵料浓度一致。静水充气养殖,养殖周期为60 d。
1.3 样品采集实验开始后分别在0、10、30、60 d对每个重复组养殖缢蛏进行采挖,测量其壳长、壳高、壳宽和体质量,计算其生长指标。另外,每个重复组在各时间点随机采集9粒缢蛏,用于鳃组织、肝胰腺组织和血清的取样。采集的样本首先放入液氮中,再转至-80 ℃冻存。
1.4 测定指标及计算公式鳃组织Na+/K+-ATPase(NKA)活性、肝胰腺组织己糖激酶(HK)和琥珀酸脱氢酶(SDH)活性,血清葡萄糖(GLU)含量、乳酸(LA)含量和乳酸脱氢酶(LDH)活性,均采用北京索莱宝科技有限公司所生产的试剂盒测定。
采用游标卡尺(精确度0.01 mm)测量壳长、壳宽和壳高,用电子天平(精确度0.001 g)称量体质量。存活率为各时间点缢蛏存活粒数与前一时间点采样后的存活粒数的比值。存活率(survival rate,SR)和特定生长率(specific growth rate,SGR)的计算公式[11]:
 (1)
(1)
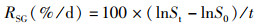 (2)
(2)
式中:RS为存活率;RSG为特定生长率;NS代表各时间点存活粒数;NT为前一时间点采样后的存活粒数;St为实验结束时缢蛏的平均末壳长、壳宽、壳高和体质量;S0为实验开始时缢蛏的初始平均壳长、壳宽、壳高和体质量;t为实验持续时间,d。
1.5 统计分析实验数据用平均值±标准差(Mean±SD)表示,利用SPSS 22.0统计软件进行独立样本t检验比较检验数据差异的显著性,以P < 0.05为差异显著。
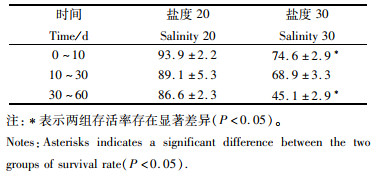
2 结果 2.1 高盐对缢蛏存活率的影响由表 1可知,0~10 d内对照组缢蛏存活率在90%以上,高盐组存活率保持在70%以上。随着养殖时间的延长,对照组和高盐组存活率呈下降趋势。30~60 d内对照组存活率为86.6%±2.3%,高盐组存活率为45.1%±2.9%。0~10 d和30~60 d 2个时间段内高盐组存活率显著低于对照组(P < 0.05)。
|
表 1 缢蛏在不同时间段的存活率
Tab.1 Survival rate of razor clam in different periods |
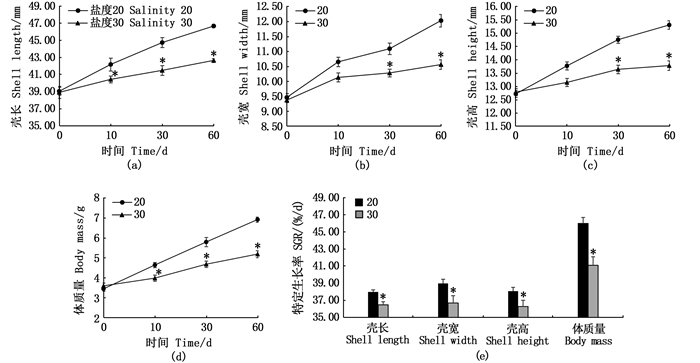
由图 1可知:实验进行到第10天时,高盐组缢蛏壳长和体质量已显著小于对照组[P < 0.05,图 1(a)和(d)];实验进行到第30天时,高盐组缢蛏壳宽和壳高显著小于对照组[P < 0.05,图 1(b)和(c)]。实验结束时,高盐组壳长、壳宽、壳高和体质量特定生长率分别为0.15%/d、0.17%/d、0.13%/d和0.61%/d,4项指标均显著低于对照组[P < 0.05,图 1(e)]。
|
a、b、c、d分别表示不同盐度组缢蛏壳长、壳宽、壳高和体质量60 d内的生长趋势,*表示同一时间点不同盐度组间存在显著差异(P < 0.05)。e表示60 d内不同盐度组缢蛏壳长、壳宽、壳高和体质量的特定生长率,*表示不同盐度组间存在显著差异(P < 0.05)。 Figures a, b, c and d respectively show the growth trend of shell length, shell width, shell height and body mass of razor clam in different salinity groups within 60 d, and the asterisks indicates a significant difference among different salinity groups at the same time point (P < 0.05). Figure e shows the SGR of shell length, shell width, shell height and body weight of razor clam in different salinity groups within 60 days, and the asterisks indicates a significant difference among different salinity groups (P < 0.05). 图 1 不同盐度对缢蛏生长的影响 Fig. 1 Effects of different salinities on the growth of razor clam |
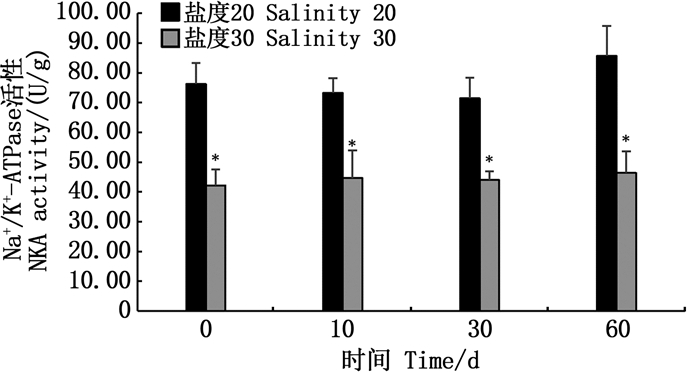
由图 2可知:高盐组和对照组鳃组织NKA活性均相对稳定,且各时间点高盐组NKA活性均显著低于对照组(P < 0.05)。
|
*表示不同盐度组之间存在显著差异(P < 0.05)。 Asterisks indicates a significant difference among different salinity groups (P < 0.05). 图 2 不同盐度对缢蛏鳃组织Na+/K+-ATPase活性的影响 Fig. 2 Effects of different salinities on Na+/K+-ATPase activity in gill of razor clam |
由图 3可知:对照组HK活性呈下降趋势,60 d出现最低值。高盐组波动较大,呈先降低后升高再下降趋势,60 d出现最低值。对照组HK活性在各时间点均高于高盐组,10和60 d两组HK活性差异显著[P < 0.05,图 3(a)]。对照组SDH活性相对稳定,高盐组呈先上升后下降的趋势。0、10和30 d高盐组SDH活性均显著高于对照组(P < 0.05),但是高盐组60 d的SDH活性相对0、10和30 d的活性有一个明显的下降且显著低于对照组[P < 0.05,图 3(b)]。

|
*表示不同盐度组之间存在显著差异(P < 0.05)。 Asterisks indicates a significant difference among different salinity groups (P < 0.05). 图 3 不同盐度对缢蛏肝胰腺组织能量代谢相关指标的影响 Fig. 3 Effects of different salinities on related indexes of energy metabolism in liver of razor clam |
由图 4可知:对照组血清GLU含量呈先上升后下降再上升的趋势,10 d含量最高。高盐组呈现先上升后下降的趋势,30 d含量最高。对照组10和60 d血清GLU含量显著高于高盐组(P < 0.05),30 d高盐组显著高于对照组[P < 0.05,图 4(a)]。高盐组和对照组血清LA含量都呈先下降后上升再下降的趋势,0 d为最高值。高盐组0、10和60 d血清LA含量显著低于对照组(P < 0.05),30 d显著高于对照组[P < 0.05,图 4(b)]。对照组血清LDH的变化呈先上升后下降再上升的趋势,60 d出现最高值。高盐组呈先下降后上升再下降的趋势,30 d出现最高值。0、10和60 d对照组血清LDH活性显著高于高盐组(P < 0.05),30 d显著低于高盐组[P < 0.05,图 4(c)]。

|
*表示不同盐度组之间存在显著差异(P < 0.05)。 Asterisks indicates a significant difference among different salinity groups (P < 0.05). 图 4 不同盐度对缢蛏血清能量代谢相关指标的影响 Fig. 4 Effects of different salinities on related indexes of energy metabolism in serum of razor clam |
盐度能够显著影响海洋贝类的生长和存活。谢玺等[12]研究了盐度(15、20、25、30、35和40)对宽壳全海笋(Barnea dilatata)稚贝生长和存活的影响,发现: 其最适生存盐度为20~30,在此盐度范围内,稚贝28 d平均存活率高于90.0%且显著高于其他盐度组;稚贝湿质量增长的最适盐度为20~35,28 d平均特定生长率为2.963~3.028 %/d,显著高于15和40组。对缢蛏稚贝盐度耐受性的研究[13-15]表明,适宜其生长和存活的盐度为8.2~25.8,苗种最适盐度为20.6。相关研究[16-20]表明,栖息地盐度变化幅度比较大的海洋贝类耐盐能力更强,如生活在潮间带的海洋贝类要比潮下带的贝类耐受的盐度范围更宽。本研究高盐组缢蛏生长和存活表现都显著低于低盐组,但缢蛏在30~60 d的高盐养殖阶段仍能维持40%以上存活率且保持一定的生长速度。分析认为,缢蛏主要栖息于盐度较低的河口附近和沿海滩涂中,生存环境的海水盐度波动幅度较大,因此缢蛏盐度耐受能力较强。从缢蛏成贝在长期高盐养殖下的生长和存活表现看,缢蛏成贝高盐耐受性较强。
3.2 高盐对缢蛏鳃组织NKA活性的影响NKA是广泛分布在机体内生物膜酶系统的一种蛋白质,具有载体和酶的功能,能催化ATP水解供能,驱动Na+和K+于细胞膜两侧的对向运输,对维持细胞的正常生理功能以及细胞内环境的稳定起着极其重要的作用[21]。海洋无脊椎动物主要通过调节血淋巴渗透压来应对环境中盐度的变化,该过程主要由鳃等组织中的NKA发挥作用[22]。蔡星媛等[3]研究表明,魁蚶(Anadara broughtonii)在急性盐度胁迫下鳃NKA酶活性的响应方式不同,呈现低盐胁迫时活性上升,高盐胁迫时活性降低的规律。林听听等[23]发现盐度骤升(23~26),青蛤鳃NKA酶活性在第15天达到最小值后逐渐回升趋于平稳,但仍低于初始值。本研究,高盐组缢蛏鳃NKA活性在0、10、30和60 d均显著低于对照组,高盐下缢蛏鳃NKA活性受到抑制,结果与文献[23]相似。分析认为,当外界渗透压升高时,缢蛏血淋巴中的离子呈输入趋势,因此鳃组织NKA活性降低,降低了细胞膜的通透性以阻止过多的Na+、Cl-的流入,从而维持细胞内外渗透压平衡[24]。
3.3 高盐对缢蛏能量代谢相关指标的影响机体的日常生命活动需要消耗能量,机体内主要供能物质是ATP。ATP的形成主要有两条途径[25]: 一条是由葡萄糖彻底氧化为CO2和水,从中释放出大量自由能形成大量ATP; 另一条是没有氧分子参加的糖酵解途径,葡萄糖降解为丙酮酸,并在此过程中形成2分子的ATP。HUANG等[26]和ERN等[27]研究表明,水生生物用于调节渗透压的能量占总能耗的20%~50%。
HK是糖酵解途径中起调节作用的关键酶。HK可以和细胞膜上葡萄糖转运蛋白功能相互偶联,对机体细胞内葡萄糖流量和代谢产生一定影响[28-29]。血糖是机体内葡萄糖主要运输形式,LA为葡萄糖厌氧代谢产物,两者通过血液循环完成组织间能量的再分配[25]。在生物体内,LDH可催化糖无氧代谢的最终产物LA脱去全部吸附的氢原子,实现LA与丙酮酸之间的逆转化[30]。SDH不仅在三羧酸循环中起关键作用,而且还参与氧化磷酸化,其活性在一定程度上反映了生物体内的需氧代谢水平[10]。
从糖酵解途径分析来看,本研究10和60 d时高盐组缢蛏肝胰腺HK活性显著低于对照组,血清中GLU含量、LA含量和LDH活性也显著低于对照组,表明在这两个时间点高盐抑制了缢蛏的无氧代谢。30 d时高盐组血清GLU含量、LA含量和LDH活性显著高于对照组,表明在此时间点高盐组缢蛏无氧代谢比对照组更加旺盛。另外,0 d时对照组和高盐组HK活性和血清GLU含量无显著性差异,但是高盐组血清LA含量和LDH活性显著低于对照组,并没有形成对应的关系。分析认为,糖酵解途径涉及一系列的生化酶促反应,反应的底物和产物浓度、酶的活性是时刻处于动态平衡的[25],综合分析表明0 d时高盐组缢蛏体内糖酵解是受到抑制的。以上分析表明,缢蛏为了应对高盐胁迫,体内无氧代谢水平在不同时间段都有所调整,这也表明缢蛏在长期高盐环境下具有一定的代谢调节能力。
从肝胰腺SDH活性来分析高盐下缢蛏的需氧代谢水平。本研究0、10和30 d时高盐组SDH显著高于对照组。孔宁[31]研究表明,皱纹盘鲍在应对高盐和低盐胁迫时消耗了更多的能量用于自身的渗透压调节,从而导致其生长速度变慢。结合缢蛏的生长速度来看,高盐下缢蛏生长速度相比对照组显著下降,这表明缢蛏为了应对高渗环境需要消耗更多能量用于渗透压调节,以致用于生长的能量减少,生长速度变慢。另外,本研究60 d时缢蛏肝胰腺SDH活性显著低于对照组,这表明在此时间点高盐组缢蛏的需氧代谢水平低于对照组。相关研究[4, 32-33]表明,盐度能够显著影响贝类的摄食率和同化率。本研究养殖后期时,高盐组缢蛏的摄食率明显降低,高盐组可供缢蛏用于呼吸代谢的能量物质来源不足,从而导致了需氧代谢水平的下降。
综上所述,在长期高盐养殖下,缢蛏渗透调节活动增加了能量消耗,但仍具有一定的生长能力和存活率,表现出较强的高盐耐受性,表明缢蛏在高盐条件下具备一定的选育潜力。
| [1] |
徐凤山, 张素萍. 中国海产双壳类图志[M]. 北京: 科学出版社, 2008: 211-213. XU F S, ZHANG S P. An illustrated bivalvia mollusca fauna of China seas[M]. Beijing: Science Press, 2008: 211-213. |
| [2] |
王劭雯. 皱纹盘鲍幼鲍对海水盐度的耐受性分析[D]. 青岛: 中国科学院研究生院(海洋研究所), 2012. WANG S W. Analysis of the toleration to different salinities in Haliotis discus hannai Ino[D]. Qingdao: Institute of Oceanology, University of Chinese Academy of Sciences, 2012. |
| [3] |
蔡星媛, 张秀梅, 田璐, 等. 盐度胁迫对魁蚶稚贝血淋巴渗透压及鳃Na+/K+-ATP酶活力的影响[J]. 南方水产科学, 2015, 11(2): 12-19. CAI X Y, ZHANG X M, TIAN L, et al. Effect of salinity stress on hemolymph osmolality and gill Na+/K+-ATPase activity of juvenile ark shell (Anadara broughtonii)[J]. South China Fisheries Science, 2015, 11(2): 12-19. DOI:10.3969/j.issn.2095-0780.2015.02.002 |
| [4] |
吕昊泽, 刘健, 陈锦辉, 等. 盐度对长江口3种滤食性贝类滤水率、摄食率、同化率的影响[J]. 海洋科学, 2016, 40(8): 10-17. LYU H Z, LIU J, CHEN J H, et al. Effects of salinity on filtration, ingestion, and assimilation rates of three filter-feeding bivalves in the Yangtze River estuary[J]. Marine Sciences, 2016, 40(8): 10-17. |
| [5] |
YIN S J, ZHANG L M, ZHANG L L, et al. Metabolic responses and arginine kinase expression of juvenile cuttlefish (Sepia pharaonis) under salinity stress[J]. International Journal of Biological Macromolecules, 2018, 113: 881-888. DOI:10.1016/j.ijbiomac.2018.03.036 |
| [6] |
李二超, 陈立侨, 曾嶒, 等. 盐度对凡纳滨对虾体组织蛋白质积累、氨基酸组成和转氨酶活性的影响[J]. 水生生物学报, 2009, 33(3): 532-538. LI E C, CHEN L Q, ZENG C, et al. Protein accumulation, amino acid profile and amino transferase activities of the white shrimp Litopeneaus vannamei, at different salinities[J]. Acta Hydrobiologica Sinica, 2009, 33(3): 532-538. |
| [7] |
邢晓丹. 大弹涂鱼适应盐度胁迫的糖代谢模式及葡萄糖和二甲双胍的调控作用研究[D]. 舟山: 浙江海洋大学, 2018. XING X D. Study on the glucose metabolism of Boleophthalmus pectinirosris adapted to salinity stress and regulation by glucose and metformin[D]. Zhoushan: Zhejiang Ocean University, 2018. |
| [8] |
范建勋. 文蛤能量代谢的研究[D]. 宁波: 宁波大学, 2010. FAN J X. Studies on metabolism of Meretrix meretrix Linnaeus[D]. Ningbo: Ningbo University, 2010. |
| [9] |
彭茂潇. 缢蛏对内陆水域重要水环境因子耐受性研究[D]. 上海: 上海海洋大学, 2020. PENG M X. Study on tolerance of Chinese razor clam (Sinonovacula constricta) to important water environmental factors in inland waters[D]. Shanghai: Shanghai Ocean University, 2020. |
| [10] |
GAO X L, LI Y, LI X, et al. The response and osmotic pressure regulation mechanism of Haliotis discus hannai (Mollusca, Gastropoda) to sudden salinity changes[J]. Hydrobiologia, 2017, 795(1): 181-198. DOI:10.1007/s10750-017-3129-z |
| [11] |
刘颖, 刘怡南, 刘汉鹏, 等. 饵料钙磷水平对七彩神仙鱼生长、体组成及消化酶活性的影响[J]. 上海海洋大学学报, 2018, 27(6): 833-843. LIU Y, LIU Y N, LIU H P, et al. Effects of dietary phosphorus and calcium levels on growth, body composition and digestive enzyme activities of juvenile discus fish (Symphysodon haraldi)[J]. Journal of Shanghai Ocean University, 2018, 27(6): 833-843. |
| [12] |
谢玺, 王庆志, 赵希纯, 等. 盐度对宽壳全海笋稚贝存活与生长的影响[J]. 生态学杂志, 2017, 36(6): 1622-1627. XIE X, WANG Q Z, ZHAO X C, et al. Effects of salinity on the growth and survival of Barnea dilatata juveniles[J]. Chinese Journal of Ecology, 2017, 36(6): 1622-1627. |
| [13] |
林笔水, 吴天明. 温度和盐度同缢蛏稚贝存活及生长的关系[J]. 水产学报, 1986, 10(1): 41-50. LIN B S, WU T M. The relations of temperature and salinity to the survival and growth of the spat of Sinonovacula constricta[J]. Journal of Fisheries of China, 1986, 10(1): 41-50. |
| [14] |
林笔水, 吴天明. 温度与盐度和缢蛏幼体生存、生长及发育的关系[J]. 水产学报, 1990, 14(3): 171-178. LIN B S, WU T M. Temperature and salinity in relating to the survinal, growth and development of the larvae and spat of Sinonovacula constricta[J]. Journal of Fisheries of China, 1990, 14(3): 171-178. |
| [15] |
吕昊泽. 缢蛏、光滑河蓝蛤和河蚬对盐度的适应性及碳、氮收支研究[D]. 上海: 上海海洋大学, 2014. LYU H Z. Study on the adaptability to salinity, the budgets of carbon and nitrogen of Sinonovacula constricta, Potamocorbula laevis, Corbicula fluminea[D]. Shanghai: Shanghai Ocean University, 2014. |
| [16] |
袁有宪, 陈聚法, 陈碧娟, 等. 栉孔扇贝对环境变化适应性研究—盐度、pH对存活、呼吸、摄食及消化的影响[J]. 中国水产科学, 2000, 7(4): 73-77. YUAN Y X, CHEN J F, CHEN B J, et al. Study on adaptability of scallop Chlamys farreri to environment—effects of salinity and pH on survival, respiration, ingestion and digestion[J]. Journal of Fishery Sciences of China, 2000, 7(4): 73-77. DOI:10.3321/j.issn:1005-8737.2000.04.017 |
| [17] |
施祥元, 尤仲杰, 沈伟良, 等. 盐度对毛蚶稚贝生长和存活的影响[J]. 水产科学, 2007, 26(10): 554-556. SHI X Y, YOU Z J, SHEN W L, et al. Effects of salinity on growth and survival in juvenile clam Scapharca subcrenata[J]. Fisheries Science, 2007, 26(10): 554-556. DOI:10.3969/j.issn.1003-1111.2007.10.006 |
| [18] |
曹伏君, 刘志刚, 罗正杰. 文蛤稚贝盐度适应性的研究[J]. 海洋通报, 2010, 29(2): 156-160. CAO F J, LIU Z G, LUO Z J. Study on adaptability of juveniles of Meretrix meretrix Linnaeus to salinity[J]. Marine Science Bulletin, 2010, 29(2): 156-160. DOI:10.3969/j.issn.1001-6392.2010.02.006 |
| [19] |
张伟, 刘志刚, 章启忠. 方斑东风螺对盐度适应性的研究[J]. 南方水产科学, 2008, 4(3): 20-26. ZHANG W, LIU Z G, ZHANG Q Z. Study on adaptability of Babylonia areolata to salinity[J]. South China Fisheries Science, 2008, 4(3): 20-26. DOI:10.3969/j.issn.2095-0780.2008.03.004 |
| [20] |
陈昌生, 钟幼平, 吴永沛, 等. 盐度对九孔鲍摄食、生长及存活的影响[J]. 水产学报, 2000, 24(1): 41-45. CHEN C S, ZHONG Y P, WU Y P, et al. The effect of salinity on food intake, growth and survival of Haliotis diversicolor supertexta[J]. Journal of Fisheries of China, 2000, 24(1): 41-45. |
| [21] |
叶博. 缢蛏三个群体在不同盐度应激下的响应机制[D]. 上海: 上海海洋大学, 2020. YE B. Response mechanism of three populations of Sinonovacula constricta under different salinity stress[D]. Shanghai: Shanghai Ocean University, 2020. |
| [22] |
李磊, 蒋玫, 王云龙, 等. 在低盐度胁迫下鲻幼鱼鳃丝Na+/K+-ATP酶活性及其β亚基mRNA表达与显微结构变化[J]. 浙江大学学报(农业与生命科学版), 2014, 40(2): 223-230. LI L, JIANG M, WANG Y L, et al. Effects of low salinity stress on Na+/K+-ATPase activities, expression of Na+/K+-ATPase β-subunit mRNA and microscopical structure in gill filaments of juvenile Mugil cephalus[J]. Journal of Zhejiang University (Agriculture and Life Sciences), 2014, 40(2): 223-230. DOI:10.3785/j.issn.1008-9209.2014.02.015 |
| [23] |
林听听, 来琦芳, 陆建学, 等. 盐度突变对青蛤(Cyclina sinensis)鳃Na+/K+-ATPase活性的影响[J]. 广东海洋大学学报, 2012, 32(1): 54-58. LIN T T, LAI Q F, LU J X, et al. Effects of abrupt variations in salinity on the Na+/K+-ATPase activity in gills of Cyclina sinensis[J]. Journal of Guangdong Ocean University, 2012, 32(1): 54-58. DOI:10.3969/j.issn.1673-9159.2012.01.009 |
| [24] |
RODRÍGUEZ A, GALLARDO M A, GISBERT E, et al. Osmoregulation in juvenile Siberian sturgeon (Acipenser baerii)[J]. Fish Physiology and Biochemistry, 2002, 26(4): 345-354. |
| [25] |
王镜岩, 朱圣庚, 徐长法. 生物化学(下册)[M]. 3版. 北京: 高等教育出版社, 2002. WANG J Y, ZHU S G, XU C F. Biochemistry (Vol. 2)[M]. 3rd ed. Beijing: Higher Education Press, 2002. |
| [26] |
HUANG Y H, ZHANG M, LI Y M, et al. Effects of salinity acclimation on the growth performance, osmoregulation and energy metabolism of the oriental river prawn, Macrobrachium nipponense (De Haan)[J]. Aquaculture Research, 2019, 50(2): 685-693. DOI:10.1111/are.13950 |
| [27] |
ERN R, HUONG D T T, CONG N V, et al. Effect of salinity on oxygen consumption in fishes: a review[J]. Journal of Fish Biology, 2014, 84(4): 1210-1220. DOI:10.1111/jfb.12330 |
| [28] |
ALLERT S, ERNEST I, POLISZCZAK A, et al. Molecular cloning and analysis of two tandemly linked genes for pyruvate kinase of Trypanosoma brucei[J]. European Journal of Biochemistry, 1991, 200(1): 19-27. DOI:10.1111/j.1432-1033.1991.tb21043.x |
| [29] |
汪玉松, 邹思湘, 张玉静. 现代动物生物化学[M]. 3版. 北京: 高等教育出版社, 2005. WANG Y S, ZOU S X, ZHANG Y J. Modern animal biochemistry[M]. 3rd ed. Beijing: Higher Education Press, 2005. |
| [30] |
郭志雄, 曾泽乾, 黄建盛, 等. 急性低氧胁迫对大规格军曹鱼幼鱼肝脏氧化应激、能量利用及糖代谢的影响[J]. 广东海洋大学学报, 2020, 40(3): 134-140. GUO Z X, ZENG Z Q, HUANG J S, et al. Effects of acute hypoxia on oxidative stress, energy utilization and carbohydrate metabolism in liver of large-sized juvenile cobia (Rachycentron canadum)[J]. Journal of Guangdong Ocean University, 2020, 40(3): 134-140. |
| [31] |
孔宁. 温度、盐度对皱纹盘鲍"97"选群生长发育的影响[D]. 青岛: 中国科学院研究生院(海洋研究所), 2016. KONG N. Effects of temperature and salinity on growth and development of "97" selective breeding population of Haliotis discus hannai Ino[D]. Qingdao: Institute of Oceanology, University of Chinese Academy of Sciences, 2016. |
| [32] |
范嗣刚, 黄桂菊, 刘宝锁, 等. 盐度与温度对大珠母贝和合浦珠母贝滤水率及摄食率的影响[J]. 水生态学杂志, 2014, 35(3): 61-65. FAN S G, HUANG G J, LIU B S, et al. Effects of salinity and temperature on the filtration rate and ingestion rate of Pinctada maxima and Pinctada fucata[J]. Journal of Hydroecology, 2014, 35(3): 61-65. |
| [33] |
CHANG G O J L, INN L V, HWAI A T S, et al. The effects of salinity on the filtration rates of juvenile tropical oyster Crassostrea iredalei[J]. Tropical Life Sciences Research, 2016, 27(s1): 45-51. |
2. Sanmen Agricultural and Rural Bureau, Taizhou 317100, Zhejiang, China;
3. Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


