2. 中国水产科学研究院南海水产研究所 广东省渔业生态环境重点实验室,广东 广州 510300
海陵湾(111°41′E~111°54′E、21°34′N~21°45′N),位于广东省阳江市西南端,海陵岛以西,面积约180 km2,包括内湾和外湾2个部分,外湾为开阔海域,内湾北有丰头河、九姜河、织篢河等河流注入,南有散头嘴和海陵岛的遮蔽,风浪平缓,水产养殖条件优越。海陵湾内有以闸坡旧澳湾网箱养殖基地和海陵湾浅海桩架吊养牡蛎基地等为代表的广东省著名的规模化水产养殖区,水产养殖业已经成为当地的支柱产业之一。
浮游植物作为自然水体中的初级生产者,是食物链的基础环节。其种群和群落的波动直接影响着水生生物的群落结构和水生生态系统的稳定性。学者们[1-3]先后在分类学、生活史、生理生态特征、群落分布与初级生产力、与其他群落的交互作用等方面对浮游植物开展研究,并取得了丰硕的成果。由于浮游植物个体较小、生命周期短,其群落结构对生态系统中环境因子的改变较敏感[4]。在非生物因子和生物因子的单独或交互作用下,浮游植物群落结构会产生明显的变化或演替现象,从而表征水环境的状态。在浮游植物生态学上,人们往往通过对浮游植物群落结构变化及其与环境因子的关系的研究,探究远洋、近岸、内陆水域乃至室内养殖系统生态环境的特点并对生态环境的状态进行评价,为生态环境的保护和有效利用提供重要参考。
近年来,学者们[5-8]先后对海陵湾海域的浮游动物、水环境、底栖动物、水体激素含量开展了调查研究,但关于海陵湾浮游植物的研究仅见于齐雨藻等[9]于1987年秋季对海区调查的报道。海水鱼类网箱养殖是一种依赖外源投饵的高度集约化养殖模式,在水动力条件相对较弱的海湾易引起水体的富营养化[10]。作为环境依赖型产业,鱼类养殖引起的养殖环境恶化也会对养殖鱼类产生不利影响。本研究于2019年冬、春、秋3个季节对海陵湾鱼类养殖区的浮游植物及主要水质因子进行调查分析,探讨海陵湾浮游植物群落结构对环境因子和鱼类网箱养殖活动的响应,以期为海陵湾鱼类网箱养殖结构优化和生态环境评价提供一定的参考。
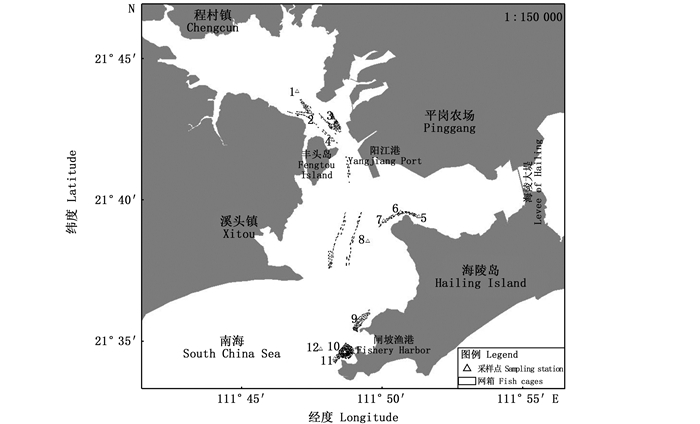
1 材料与方法 1.1 采样站位点的设定分别于2019年1月(冬季)、4月(春季)和11月(秋季)对海陵湾内湾的12个采样站进行3个航次的采样调查。采样站位如图 1所示。1~4号采样站位于海陵湾上游的溪头镇网箱养殖基地及其周边水域,5~8号位于海陵湾中游的北洋网箱养殖基地及其周边水域,9~12号位于湾口处的闸坡网箱养殖基地及其周边水域。其中2~4、5~7、9~11号采样站位于鱼排边,由于2019年阳江市对海陵湾非法渔业设施及碍航物进行清理整治,4号采样站鱼排在春季已无养殖活动并在秋季被移除。1、8、12号采样站则位于距网箱养殖区较远的周边水域。
|
图 1 海陵湾鱼类网箱养殖布局及采样站位图 Fig. 1 Fish farming structure layout and sampling stations in Hailing Bay, Guangdong Province |
浮游植物样品的采集与定量参照《海洋监测规范第4部分:海水分析(GB17378.4—2007)》。定性样品采用浅水Ⅲ型浮游生物网,自底至表向水面垂直拖曳,定量样品则用有机玻璃采水器收集表底层各1 L水样,现场用鲁戈氏液固定后带回实验室,用浮游生物计数框镜检及计数。浮游植物种类鉴定参考《中国海洋生物图集》、《中国海洋浮游生物图谱》和《中国近海赤潮生物图谱》等。
1.3 环境因子的测定海水溶解氧(DO)、水温(T)、盐度(S)和pH采用便携式水质分析仪(YSI ProPlus型)现场测定,透明度(SD)采用萨式盘法测定。水样中化学需氧量(COD)采用碱性高锰酸钾法测定,活性磷酸盐(PO43--P)采用磷钼蓝分光光度法测定,氨氮(NH4+-N)采用靛酚蓝法,亚硝酸盐(NO2--N)采用萘乙二胺分光光度法,硝酸盐(NO3--N)采用锌镉还原法,颗粒有机物(POM)和悬浮颗粒物(TPM)的采用称重法测定。均按照《海洋监测规范第4部分:海水分析(GB17378.4—2007)》指定方法进行。
1.4 多样性分析方法多样性指数(Shannon and Wiener)H′、均匀度(Pielou) J和优势度Y计算公式:
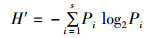 (1)
(1)
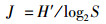 (2)
(2)
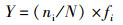 (3)
(3)
式中:s为物种数;Pi为第i物种在全部采样中的比例;ni为第i种的个体数;N为所有种的个体总数;S为样品种类总数;fi为第i种在各站点的监测频率。Y≥0.02为优势种。
1.5 数据处理和分析采用PRIMER 6.0软件对浮游植物丰度进行lg(x+1)转换,建立Bray-Curtis相似性聚类分析,并进行非度量多维尺度(nMDS)排序。用Canoco 4.5软件分析环境因子对浮游植物物种分布的影响,相关数据除pH外,经过lg(x+1)转换。筛选出现频率大于12.5 %,且在任意一个采样站的相对密度大于等于1%的浮游植物作为排序物种[11]。对排序物种数据进行趋势对应分析(DCA),发现4个轴中梯度最大值小于3,故选择RDA进行物种-环境相关性分析。不同采样区域的水质因子的比较采用单因素方差分析法。为实现方差齐性,对除pH外的水质因子数据进行ln转换并采用Turkey HSD进行多重比较,差异显著性设置为P<0.05。数据的分析处理采用SPSS 19.0统计软件。采样站位平面图用ArcMap 10.2软件绘制。
2 结果 2.1 浮游植物种类组成及优势种的时空变化特征海陵湾2019年冬、春、秋季3个航次共鉴定出浮游植物3门39属96种(含变种)。其中: 硅藻门29属76种,占总种数的79.17%;甲藻门8属16种,占总种数的16.67%;蓝藻门2属4种,占总种数的4.16%。冬季种类最多,春季最少(表 2)。海陵湾鱼类养殖区浮游植物优势种见表 3。调查期间检出浮游植物优势种共8种,其中,中肋骨条藻在3个季节都为优势种,细弱海链藻是冬季和春季的优势种,佛氏海毛藻和柔弱伪菱形藻为冬季和秋季的优势种。

|
表 2 2019年3个季节海陵湾浮游植物的种类组成 Tab.2 Seasonal phytoplankton composition in Hailing Bay in 2019 |

|
表 3 海陵湾浮游植物优势种 Tab.3 Dominant species of phytoplankton in Hailing Bay, Guangdong Province |
海陵湾冬、春、秋季平均丰度分别为0.67×103、7.98×103、57.01×103 cells/L,季节变化趋势为秋>春>冬。各采样站浮游植物丰度的范围:冬季0.022×103~2.83×103 cells/L、春季1.00×103~27.46×103 cells/L、秋季0.02×104~30.54×104 cells/L。在冬、秋两季,海陵湾内湾湾口9~12采样站处浮游植物丰度远高于内湾上游、中游的1~8站位(图 2)。甲藻丰度在冬、春、秋季各占总丰度的1.16%、1.66%、0.06%,硅藻丰度在冬、春、秋季各占总丰度的97.73%、98.34%、99.86%。冬季蓝藻丰度占总丰度的1.10%,主要为出现在上游的淡水种大颤藻(Oscillatoria maxima),在秋季蓝藻丰度仅占总丰度的0.08%。

|
图 2 海陵湾各采样站位浮游植物丰度 Fig. 2 Abundance of phytoplankton at different sampling stations in the Hailing Bay, Guangdong Province |
海陵湾浮游植物群落的季节性差异显著(Global R=0.539,P=0.001)。在52%的相似度水平上,从上游到下游冬季被分为9个类群。上游1、2、3号采样站各独立为1个类群,上游4号与中游5号站为1个类群。中游6号独立为1个类群,7、8号站为1个类群。下游9、10号站为1个类群,11、12号各自单独为1个类群。在40%的相似度水平上,冬季上、中、下游各相邻站位的浮游植物聚类效果较好,被分为上游1号采样站、2号采样站、上中游3~8号采样站以及下游9~12号采样站4个类群。春季各站位在52%的相似度水平上被分为6个类群:1、4、12号采样站各独立为1个类群,中游的5、6号采样站聚为一类,湾口的9、10、11号与上游2号采样站聚为一类,上游3号和中游7号采样站聚为一类。秋季上、中、下游各相邻采样站相似度较高,共被分为3个类群:位于上中游的1~6、8号采样站,位于内湾湾口处的9~12号采样站,以及7号采样站(图 3)。
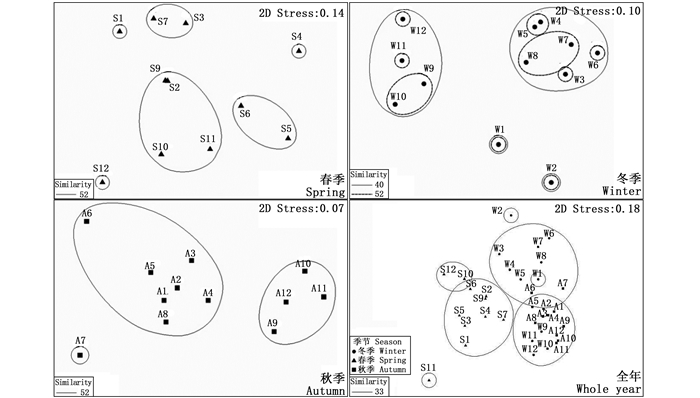
|
图 3 海陵湾浮游植物群落的多维尺度分析 Fig. 3 The nMDS of phytoplankton communitiesin Hailing Bay, Guangdong Province |
海陵湾冬季多样性指数H′和均匀度指数J最高、春季最低(图 4)。冬季各站多样性指数为1.44~4.11,其中,10号站最高、4号站最低。春季各站的浮游植物多样性指数为0.66~2.39,其中,4号站最高,3、10号站H′分别为0.91和0.67。秋季,各站的浮游植物多样性指数为1.62~3.10,其中,4、2、3号站较高,分别为3.10、2.88和2.80,11、12号站较低,分别为1.62和1.71。J分别为冬季0.540~0.960,春季0.328~0.946,秋季0.334~0.736。
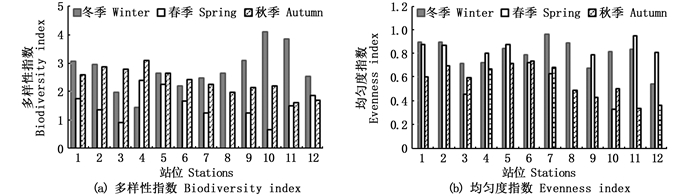
|
图 4 海陵浮游植物多样性指数和均匀度指数 Fig. 4 Biodiversity index and evenness index of phytoplankton in Hailing Bay, Guangdong Province |
调查期间,海陵湾上游、中游、下游网箱养殖区环境因子的平均值见表 4。在冬季,下游养殖区的盐度和pH高于上游及中游且差异显著(P<0.05),中游养殖区的水温和溶解氧最高且与上游差异显著(P<0.05),亚硝酸盐、硝酸盐与氨氮含量在中游最低,其中与亚硝酸盐、硝酸盐与上游、下游差异显著(P<0.05),氨氮含量与上游差异显著(P<0.05)。春季海陵湾网箱养殖区的透明度、盐度、溶解氧、pH在下游最高,亚硝酸盐、硝酸盐和氨氮则在下游最低,与上游及中游差异显著(P<0.05)。在秋季,下游养殖区的水温、盐度、pH、悬浮颗粒物以及悬浮颗粒有机物高于上游及中游且差异显著,硝酸盐含量则低于上游及中游且差异显著(P<0.05),氨氮则为下游高于中游且差异显著(P<0.05)。

|
表 4 海陵湾主要水质参数 Tab.4 Main parameters for water quality in HailingBay, Guangdong Province |
对海陵湾浮游植物与环境因子进行冗余分析(Redundancy analysis, RDA)及Monte Carlo置换检验。如图 5所示,冬季盐度(F=3.78,P=0.002)、pH(F=2.10,P=0.05),春季氨氮(F=2.65,P=0.008)、pH(F=2.01,P=0.044),秋季硝酸盐(F=3.78,P=0.002)、溶解氧(F=2.21,P=0.01)与海陵湾鱼类养殖区浮游植物优势种密切相关并影响显著。冬季盐度和pH对浮游植物物种变化的解释度分别为24%和14%;氨氮和pH对春季浮游植物物种变化的解释度分别为23%和15%;秋季硝酸盐、溶解氧对浮游植物物种变化的解释度分别为27%和13%。

|
B.mob为活动盒形藻;B.obt为钝头盒形藻;B.reg为高盒形藻;B.sin为中华盒形藻;C.aff为窄隙角毛藻;C.ast为星脐圆筛藻;C.con为整齐圆筛藻;C.cur为旋链角毛藻;C.deb为柔弱角毛藻;C.dec为并基角毛藻;C.fur为叉角藻;C.fus为纺锤角藻;C.gig为巨圆筛藻;C.jon为琼氏圆筛藻;C.lor为洛氏角毛藻;C.mac为大角角藻;C.tri为三角角藻;D.sol为太阳双尾藻;F.oce为大洋脆杆藻;G.acu为尖布纹藻;H.har为哈德半盘藻;H.sin为中华半管藻;L.abb为短纹楔形藻;L.bor为北方劳德藻;N.clo为新月菱形藻;N.dir为直舟形藻;N.lon为长菱形藻;N.lor为洛伦菱形藻;N.pao为奇异菱形藻;O.max为大颤藻;P.aff为近缘斜纹藻;P.del为柔弱伪菱形藻;P.dep为扁平多甲藻;P.for为美丽斜纹藻;P.pel为海洋斜纹藻;R.ala为翼根管藻;R.del为柔弱根管藻;R.fra为脆根管藻;R.set为刚毛根管藻;R.sty为笔尖形根管藻;S.cos为中肋骨条藻;S.del为优美施罗藻;S.pal为掌状冠盖藻;S.tha为扭鞘藻;S.tro为热带骨条藻;T.ery为红海束毛藻;T.fra为佛氏海毛藻;T.lon为长海毛藻;T.nit为菱形海线藻;T.sub为细弱海链藻;T.thi为铁氏束毛藻。 B.mob indicated Biddulphia mobiliensis; B.obt indicated Biddulphia obtusa; B.reg indicated Biddulphia regia; B.sin indicated Biddulphia sinensis; C.aff indicated Chaetoceros affinis; C.ast indicated Coscinodiscus asteromphalus; C.con indicated Coscinodiscus concinnus; C.cur indicated Chaetoceros curvisetus; C.deb indicated Chaetoceros debilis; C.dec indicated Chaetoceros decipiens; C.fur indicated Ceratium furca; C.fus indicated Ceratium fusus; C.gig indicated Coscinodiscus gigas; C.jon indicated Coscinodiscus jonesianus; C.lor indicated Chaetoceros lorenzianus; C.mac indicated Ceratium macroceros; C.tri indicated Ceratium tripos; D.sol indicated Ditylum sol; F.oce indicated Fragilaria oceanica; G.acu indicated Gyrosigma acuminatum; H.har indicated Hemidiscus hardmannianus; H.sin indicated Hemiaulus sinensis; L.abb indicated Licmophora abbreviata; L.bor indicated Lauderia borealis; N.clo indicated Nitzschia closterium; N.dir indicated Navicula directa; N.lon indicated Nitzschia longissima; N.lor indicated Nitzschia lorenziana; N.pao indicated Nitzschia paradoxa; O.max indicated Oscillatoria maxima; P.aff indicated Pleurosigma affine; P.del indicated Nitzschia delicatissima; P.dep indicated Peridinium depressum; P.for indicated Pleurosigma formosum; P.pel indicated Pleurosigma pelagicum; R.ala indicated Rhizosolenia alata; R.del indicated Rhizosolenia delicatula; R.fra indicated Rhizosolenia fragilissima; R.set indicated Rhizosolenia setigera; R.sty indicated Rhizosolenia styliformis; S.cos indicated Skeletonema costatum; S.del indicated Schroederella delicatula; S.pal indicated Stephanopyxis palmeriana; S.tha indicated Streptothece thamesis; S.tro indicated Skeletonema tropicum; T.ery indicated Trichodesmium erythraeum; T.fra indicated Thalassiothrix frauenfeldii; T.lon indicated Thalassiothrix longissima; T.nit indicated Thalassionema nitzschioides; T.sub indicated Thalassiosira subtilis; T.thi indicated Trichodesmium thiebautii. 图 5 海陵湾浮游植物与环境因子冗余分析排序图 Fig. 5 RDA ordination of phytoplankton community composition and environmental factors in Hailing Bay |
海陵湾上、中、下游各鱼类养殖片区距离较远,上游养殖区的盐度、硝酸盐质量浓度和pH普遍高于下游养殖区,下游的水温和悬浮颗粒物在秋冬季则普遍高于上游,这与钦州湾、三沙湾、三门湾、湛江湾等大多数河口和海湾的研究结果相似[12-15]。作为影响浮游植物生长的重要环境因子之一,盐度在河口生态系统中往往能够控制浮游植物的活动和多样性[16-17]。JIANG等[18]在对珠江口至南海北部浮游植物生物量与理化因子的调查中发现,水体中营养物浓度可以改变珠江口的浮游植物群落结构,而盐度对南海沿岸至北部开阔水域的所有地点的浮游植物群落结构都有显著的影响。在营养丰富的淡水和河口区海水中,较高的pH环境更利于藻类利用水中的可溶性无机碳进行光合作用[19-20]。MAJEWSKA等[21]在婆罗洲河口区的调查中发现,随着pH的降低,浮游植物的种数和多样性随之降低,此外,相比于甲藻,硅藻对pH的降低更加不耐。任辉等[22]在珠江口南沙河涌的浮游植物调查中发现硅藻门浮游植物受pH影响较大,其中,直链藻适合碱性环境生长。本次调查中盐度和pH对海陵湾浮游植物影响显著这一结果符合河口区浮游植物对环境因子的响应规律。
春季,海陵湾各采样站的氨氮含量为0.04~0.18 mg/L,平均为(0.14±0.05) mg/L,远高于秋、冬两季。RDA结果显示氨氮在春季对海陵湾浮游植物影响显著。氨氮长期以来被认为是浮游植物吸收氮的首选形式[23]。丁光茂等[24]研究发现中肋骨条藻在氨氮培养条件下生长速率高于在硝酸盐氮培养条件下;徐宁等[25]对大亚湾藻类水华开展动力学分析,发现细弱海链藻选择吸收氨氮而对硝酸盐氮吸收不明显。细弱海链藻和中肋骨条藻作为春季优势种,二者的丰度之和占调查区域总丰度的85.25%,远远高于其他种。同时与冬季和秋季相比,春季海陵湾上、中游浮游植物丰度与下游相差不大,可能是由于海陵湾较高的氨氮水平对细弱海链藻和中肋骨条藻生长的促进作用。
齐雨藻等[9]在1987年秋季对海陵湾海区的调查结果显示洛氏角毛藻、假弯角毛藻等角毛藻是该海域浮游植物的优势种。本次调查结果则显示除了窄隙角毛藻外,中肋骨条藻、柔弱伪菱形藻、菱形海线藻等成为30年后海陵湾内湾秋季浮游植物的优势种。学者们在藻华与环境因子关系的研究中发现,角毛藻的代谢以硝酸盐氮为主[25-26]。王艳等[27]在对广东湛江、大亚湾和汕头海域角毛藻进行调查分析后认为,中肋骨条藻和菱形海线藻、拟菱形藻等常常成为养殖水域的优势种,这些藻类的大量繁殖加强了种间竞争,从而影响角毛藻的生长。在1987年秋季的调查中,各调查采样站硝酸盐浓度均值为0.10~0.12 mg/L,亚硝酸盐为0.009 5~0.011 0 mg/L,本次秋季的调查中,各采样站硝酸盐浓度范围为0.08~0.38 mg/L,亚硝酸盐为0.025~0.066 mg/L,氨氮为0.004 7~0.081 0 mg/L,较30年前的水平有了明显的上升。内湾浮游植物优势种的变化体现了浮游植物对当前环境下营养条件变化的一种响应。秋季,硝酸盐与溶解氧对海陵湾鱼类养殖区的浮游植物影响显著。本研究中,秋季海陵湾鱼类养殖区浮游植物优势种与硝酸盐含量呈负相关,这与刘璐等[28]于2013年秋季(11月)在钦州湾的调查结果相似。王小平等[29]对红海湾养殖水域中营养盐消长与温度、盐度、浮游植物量的关系的研究中发现,在春季营养盐含量随着浮游植物的生长而减少。RDA结果显示,秋季海陵湾鱼类养殖区溶解氧与硝酸盐含量呈负相关。秋季海陵湾浮游植物丰度最高,硝酸盐含量最低,下游鱼类养殖区溶解氧含量高于上中游,浮游植物丰度远高于上中游,硝酸盐、亚硝酸盐和磷酸盐含量低于上游和中游。溶解氧与硝酸盐的负相关关系可能与秋季浮游植物大量增殖对营养盐的快速消耗,同时光合作用增加水中的溶解氧有关。
3.2 鱼类网箱养殖对浮游植物的影响传统的鱼类网箱主要分布在水动力条件相对较弱的近岸浅水海域,养殖产生的残饵、粪便以及鱼类排泄物等向环境输入大量有机物和氮磷等营养物质,容易诱发富营养化等问题[10]。浮游植物多样性指数和均匀度指数是反映水生态稳定性的重要指标,也是评价群落是否成熟和稳定的特征之一[30]。罗艳等[31]在珠海横琴岛海域浮游植物调查中,将浮游植物H′<1时表示为水体重污染;吴雪等[32]认为一般H′<1时,表明浮游植物群落可能受到其他环境因素的干扰。在本次调查中,春季3号站和10号站的H′为0.905和0.655,表明鱼类养殖在春季引起了局部的水体污染。4—8月为海陵湾鱼类网箱养殖的旺季,以海陵湾主要养殖鱼类卵形鲳鲹(Trachinotus ovatus)为例,其网箱养殖主要在每年4月放苗,8月生长至0.5 kg左右开始大批上市,并在第2年春节之前基本完成收获,其余少量鱼越冬后在第2年3月底前全部收获。海陵湾鱼类养殖区冬季多样性指数H′的均值为2.76,高于秋季(2.36)和春季(1.53),即在鱼类养殖旺季最低,淡季最高。周龙龙等[33]调查发现各项浮游植物群落结构指数显示大陈岛铜围网养殖附近海域秋季和冬季最高,春季次之,夏季最差,与本研究结果相似。此外,海陵湾4号站位在冬、春、秋季的多样性指数分别为1.44、2.39、3.10,并在春季和秋季中高于上游的1~3站位。该点在鱼类养殖设施移除前后多样性指数的变化也证明了鱼类网箱养殖对水域环境和浮游植物群落的扰动作用。
3.3 海陵湾网箱养殖区浮游植物群落结构特征及空间异质性在本次调查中,共检出8个浮游植物优势种,其中,除了热带骨条藻为高温高盐种外,其余都为广温广盐类群或广温近岸种,nMDS排序结果显示海陵湾浮游植物群落的季节差异显著。海陵湾内湾南北长25 km左右,外有散头嘴和海陵岛的遮蔽,盐度及营养盐等环境因子受北部的多个河流以及南部外湾海水的交互影响,具有明显的区域性和季节性变化,其环境状况适宜广温近岸种以及广温广盐种为主体的浮游植物的生长和演替。
由水体理化特性和生态学过程造成的浮游植物空间异质性被认为是水生生态系统中的一个普遍特征[34]。骆鑫等[13]在钦州湾春、夏季浮游植物群落特征的研究中认为,夏季钦州湾受较强入海径流和外海水团作用,导致内、外湾水文环境更为单一,更易聚为相似性浮游植物类群,而在春季二者影响都十分有限,从而为浮游植物提供了不同的生境,使浮游植物群落呈离散型分布。孙雪梅等[35]在青岛崂山近海海域浮游植物调查过程中发现,8月流清河湾各站之间的群落结构相似性不高,并认为这种现象是潮水扰动的结果。海陵湾鱼类养殖区浮游植物在秋季和冬季主要分为上中游和下游区的两大类群,其中秋季聚类效果好于冬季,而春季上游和中游各相邻站位间多呈离散型分布。在秋季,影响浮游植物优势种的主要环境因子硝酸盐和溶解氧表现为下游大于上中游,冬季的主要环境因子盐度、pH在下游显著大于上中游(P<0.05)。调查站位环境的区域性差异与浮游植物区域性聚类相符。在冬季,海陵湾受河流径流的影响较小,同时上中游牡蛎养殖筏架密布、水动力条件较差,水文环境的区域差异较秋季大,因而与秋季相比,冬季相邻站位的浮游植物类群的相似性较差。在春季,海陵湾上、中游氨氮及pH差异不显著,相邻采样站的浮游植物群落也较难聚为相似性类群,其中无养殖活动的1、4、12则单独聚类,在一定程度上表明了养殖活动对环境的扰动。
| [1] |
RYNEARSON T A, PALENIK B. Learning to read the oceans genomics of marine phytoplankton[J]. Advances in Marine Biology, 2011, 60: 1-39. |
| [2] |
JI R, EDWARDS M, RUNGE J A. Marine plankton phenology and life history in a changing climate: current research and future directions[J]. Journal of Plankton Research, 2010, 32: 1355-1368. DOI:10.1093/plankt/fbq062 |
| [3] |
ABONYIA, DESCY J P, BORIC S G, et al. From historical backgrounds towards the functional classification of river phytoplankton sensu Colin S. Reynolds: what future merits the approach may hold?[J]. Hydrobiologia, 2021, 848: 131-142. DOI:10.1007/s10750-020-04300-3 |
| [4] |
宫相忠, 马威, 田伟, 等. 2009年夏季南海北部的网采浮游植物群落[J]. 中国海洋大学学报(自然科学版), 2012, 42(4): 48-54. GONG X Z, MA W, TIAN W, et al. Netz-phytoplankton community in the northern South China Sea in summer 2009[J]. Periodical of Ocean University of China, 2012, 42(4): 48-54. |
| [5] |
龚玉艳, 肖雅元, 徐姗楠, 等. 海陵湾浮游动物群落结构及其与主要环境因子的关系[J]. 南方水产科学, 2019, 15(6): 49-55. GONG Y Y, XIAO Y Y, XU S N, et al. Zooplankton community structure in Hailing Bay and its relationship with primary environmental factors[J]. South China Fisheries Science, 2019, 15(6): 49-55. |
| [6] |
李婷, 朱长波, 李俊伟, 等. 海陵湾口海水水质的综合分析与评价[J]. 南方水产科学, 2018, 14(3): 49-57. LI T, ZHU C B, LI J W, et al. Water quality assessment for Hailing Bay estuary, China[J]. South China Fisheries Science, 2018, 14(3): 49-57. DOI:10.3969/j.issn.2095-0780.2018.03.006 |
| [7] |
李亚芳, 杜飞雁, 王亮根, 等. 粤西海陵湾养殖区邻近海域大型底栖动物生态学特征[J]. 海洋与湖沼, 2018, 49(6): 1294-1307. LI Y F, DU F Y, WANG L G, et al. Ecology of macrobenthic fauna community in aquaculture zones of Hailing Bay and adjacent waters along the western Guangdong coast, China[J]. Oceanologia et Limnologia Sinica, 2018, 49(6): 1294-1307. |
| [8] |
LIU S, CHEN H, ZH OU, G J, et al. Occurrence, source analysis and risk assessment of androgens, glucocorticoids and progestagens in the Hailing Bay region, South China Sea[J]. Science of the Total Environment, 2015, 536: 99-107. DOI:10.1016/j.scitotenv.2015.07.028 |
| [9] |
齐雨藻, 吕颂辉, 钱宏林, 等. 南海港湾(海陵湾)浮游植物与赤潮生物研究[J]. 暨南大学学报(自然科学与医学版), 1994, 15(1): 150-155. QI Y Z, LYU S H, QIAN H L, et al. Studies on phytoplankton and red tide organisms in embayments on west Guangdong coast V. Hailing Bay[J]. Journal of Jinan University(Natural Science & Medicine Edition), 1994, 15(1): 150-155. |
| [10] |
梁庆洋, 齐占会, 巩秀玉, 等. 大亚湾鱼类深水网箱养殖对环境的影响[J]. 南方水产科学, 2017, 13(5): 25-32. LIANG Q Y, QI Z H, GONG X Y, et al. Impact of deep-water net cage fish farming in Daya Bay, southern China on environment[J]. South China Fisheries Science, 2017, 13(5): 25-32. DOI:10.3969/j.issn.2095-0780.2017.05.004 |
| [11] |
叶海新, 上官欣欣, 毕子昊, 等. 长江口北支贝类放流滩涂区潮下带水域浮游植物分析[J]. 上海海洋大学学报, 2019, 28(5): 699-707. YE H X, SHANGGUAN X X, BI Z H, et al. Analysis of phytoplankton in the subtidal waters of the north branch of the Yangtze River estuary[J]. Journal of Shanghai Ocean University, 2019, 28(5): 699-707. |
| [12] |
郑钦华. 三沙湾重点水产养殖水域理化变化特征及富营养化状况[J]. 应用海洋学学报, 2017, 36(1): 24-30. ZHENG Q H. Physical and che mical variations and eutrophication status in important aquaculture waters of Sansha Bay[J]. Journal of Applied Oceanography, 2017, 36(1): 24-30. DOI:10.3969/J.ISSN.2095-4972.2017.01.004 |
| [13] |
骆鑫, 蓝文陆, 李天深, 等. 钦州湾春、夏季浮游植物群落特征及其与环境因子的关系[J]. 生态学报, 2019, 39(7): 2603-2613. LUO X, LAN W L, LI T S, et al. Distribution of phytoplankton and its relationship with environmental factors in the Qinzhou Bay in spring and summer[J]. Acta Ecologica Sinica, 2019, 39(7): 2603-2613. |
| [14] |
刘晶晶, 江志兵, 陈悦, 等. 三门湾春季网采浮游植物群落特征[J]. 海洋学研究, 2015, 33(1): 74-80. LIU J J, JIANG Z B, CHEN Y, et al. Community characteristics of net-phytoplankton in spring in Sanmen Bay, China[J]. Journalof Marine Sciences, 2015, 33(1): 74-80. DOI:10.3969/j.issn.1001-909X.2015.01.011 |
| [15] |
施玉珍, 张瑜斌, 孙省利. 湛江湾富营养化分布特征及与环境因子的关系[J]. 环境科学与技术, 2015, 38(12): 90-96, 122. SHI Y Z, ZHANG Y B, SUN S L. Spatiotemporal distribution of eutrophication and its relationship with environmental factors in Zhanjiang Sea Bay area[J]. Environmental Science and Technology, 2015, 38(12): 90-96, 122. |
| [16] |
WANG R, LIU X, WU J, et al. Long-term variations of phytoplankton community in relations to environmental factors in Deep Bay, China, from 1994 to 2016[J]. Marine Pollution Bulletin, 2020, 153: 111010. DOI:10.1016/j.marpolbul.2020.111010 |
| [17] |
杨旖祎, 李轶, 叶属峰. 乐清湾盐度环境梯度下浮游植物生态阈值研究[J]. 海洋环境科学, 2018, 37(4): 499-504. YANG Y Y, LI Y, YE S F. Studies on the ecological threshold of phytoplankton to the environmental gradient of salinity in the Yueqing Bay, Zhejiang Province, China[J]. Marine Environmental Science, 2018, 37(4): 499-504. |
| [18] |
JIANG Z Y, WANG Y S, CHENG H, et al. Variation of phytoplankton community structure from the Pearl River estuary to South China Sea[J]. Ecotoxicology, 2015, 24(7/8): 1442-1449. |
| [19] |
HAMMER K J, KRAGH T, SAND-JENSEN K. Inorganic carbon promotes photosynthesis, growth, and maximum biomass of phytoplankton in eutrophic water bodies[J]. Freshwater Biology, 2019, 64(11): 1956-1970. DOI:10.1111/fwb.13385 |
| [20] |
ZHANG Y, GAO Y, KIRCHMAN D L, et al. Biological regulation of pH during intensive growth of phytoplankton in two eutrophic estuarine waters[J]. Marine ecology progress series, 2019, 609: 87-99. DOI:10.3354/meps12836 |
| [21] |
MAJEWSKA R, ADAM A, MOHAMMAD-NOOR N, et al. Spatio-temporal variation in phytoplankton communities along a salinity and pH gradient in a tropical estuary (Brunei, Borneo, South East Asia)[J]. Tropical Ecology, 2017, 58(2): 251-269. |
| [22] |
任辉, 田恬, 杨宇峰, 等. 珠江口南沙河涌浮游植物群落结构时空变化及其与环境因子的关系[J]. 生态学报, 2017, 37(22): 7729-7740. REN H, TIAN T, YANG Y F, et al. Spatial and temporal distribution of phytoplankton community and its relationship with environment factors in Nansha's Rivers, Pearl River estuary[J]. Acta Ecologica Sinica, 2017, 37(22): 7729-7740. |
| [23] |
GLIBERT P M, WILKERSON F P, DUGDALE R C, et al. Pluses and minuses of ammonium and nitrate uptake and assimilation by phytoplankton and implications for productivity and community composition, with emphasis on nitrogen-enriched conditions[J]. Limnology and Oceanography, 2016, 61(1): 165-197. DOI:10.1002/lno.10203 |
| [24] |
丁光茂. 中国近海三种典型赤潮生物氮营养生理研究[D]. 福建: 厦门大学, 2009. DING G M. Nitrogen nutrient physiology of three harmful algal bloomsspecies in the coastal waters of China[D]. Fujian: Xiamen University, 2009. |
| [25] |
徐宁, 陈菊芳, 王朝晖, 等. 广东大亚湾藻类水华的动力学分析Ⅱ.藻类水华与营养元素的关系研究[J]. 环境科学学报, 2001, 21(4): 400-404. XU N, CHEN J F, WANG C H, et al. Dynamic analyses on algal bloom events in Daya Bay of Guangdong Province Ⅱ. A study of relationship between algal bloom and nutrients[J]. Acta Scientiae Circumstantiae, 2001, 21(4): 400-404. DOI:10.3321/j.issn:0253-2468.2001.04.004 |
| [26] |
费岳军, 蒋红. 舟山朱家尖海域角毛藻赤潮与环境因子关系的研究[J]. 海洋环境科学, 2008, 27(s1): 40-43. FEI Y J, JIANG H. Study on correlation of Chaetoceros red tide and environmental factors in Zhujiajian area[J]. Marine Environmental Science, 2008, 27(s1): 40-43. |
| [27] |
王艳, 聂瑞, 李扬, 等. 广东沿海角毛藻(Chaetoceros)的种类多样性及其地理分布[J]. 海洋科学进展, 2010, 28(3): 342-352. WANG Y, NIE R, LI Y, et al. Species diversity and geographical distribution of Chaetoceros in Guangdong coastal waters[J]. Advances in Marine Science, 2010, 28(3): 342-352. DOI:10.3969/j.issn.1671-6647.2010.03.010 |
| [28] |
刘璐, 姜美洁, 李艳, 等. 钦州湾海域网采浮游植物群落结构季节变化[J]. 海洋科学进展, 2017, 35(1): 83-95. LIU L, JIANG M J, LI Y, et al. Seasonal changes of netz-phytoplankton community structure in Qinzhou Bay[J]. Advances in Marine Science, 2017, 35(1): 83-95. DOI:10.3969/j.issn.1671-6647.2017.01.009 |
| [29] |
王小平, 贾晓平, 林钦, 等. 红海湾养殖水域营养盐消长与温度、盐度、浮游植物量的关系[J]. 湛江海洋大学学报, 1999, 19(2): 18-24. WANG X P, JIA X P, LIN Q, et al. Relationship between nutrients, temperature, salinity and phytoplankton in the aquaculture waters of Honghai Bay[J]. Journal of Zhanjiang Ocean University, 1999, 19(2): 18-24. |
| [30] |
陈露, 李纯厚, 魏小岚, 等. 南沙群岛海域夏季氮磷添加模拟实验中浮游植物群落的变化[J]. 南方水产科学, 2015, 11(5): 56-66. CHEN L, LI C H, WEI X L, et al. Influence of nitrogen and phosphorus enrichment on phytoplankton community structure in Nansha area in summer[J]. South China Fisheries Science, 2015, 11(5): 56-66. DOI:10.3969/j.issn.2095-0780.2015.05.007 |
| [31] |
罗艳, 粟丽, 林丽华, 等. 珠海横琴岛海域浮游植物的生态特征[J]. 海洋环境科学, 2017, 36(2): 192-201. LUO Y, SU L, LIN L H, et al. Ecological characteristics of phytoplankton in Hengqin island sea area of Zhuhai City[J]. Marine Environmental Science, 2017, 36(2): 192-201. |
| [32] |
吴雪, 李希磊, 杨俊丽, 等. 莱州湾扇贝养殖区浮游藻类的生态特征[J]. 水产科学, 2017, 36(3): 347-352. WU X, LI X L, YANG J L, et al. Ecological characteristics of phytoplankton in scallop culture area in Laizhou Bay[J]. Fisheries Science, 2017, 36(3): 347-352. |
| [33] |
周龙龙, 平仙隐, 李磊, 等. 铜围网大黄鱼养殖海域浮游植物群落结构特征及其环境效应研究[J]. 海洋渔业, 2018, 40(4): 413-423. ZHOU L L, PING X Y, LI L, et al. On characteristics and environmental effects of phytoplankton community structure in the coast of Pseudosciaena crocea copper seine net cage culture[J]. Marine Fisheries, 2018, 40(4): 413-423. DOI:10.3969/j.issn.1004-2490.2018.04.004 |
| [34] |
江志兵, 朱旭宇, 高瑜, 等. 象山港春季网采浮游植物的分布特征及其影响因素[J]. 生态学报, 2013, 33(11): 3340-3350. JIANG Z B, ZHU X Y, GAO Y, et al. Distribution of net-phytoplankton and its influence factors in spring in Xiangshan Bay[J]. Acta Ecologica Sinica, 2013, 33(11): 3340-3350. |
| [35] |
孙雪梅, 夏斌, 过锋, 等. 青岛崂山近岸海域浮游植物群落结构及其与环境因子的关系[J]. 渔业科学进展, 2013, 34(3): 46-53. SUN X M, XIA B, GUO F, et al. Structure characteristics of phytoplankton community and the relationship with environmental factors in offshore area of Laoshan, Qingdao[J]. Progress In Fishery Sciences, 2013, 34(3): 46-53. DOI:10.3969/j.issn.1000-7075.2013.03.006 |
2. Guangdong Provincial Key Laboratory of Fishery Ecology and Environment, South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510300, Guangdong, China
 2022,
Vol. 31
2022,
Vol. 31


