海湾扇贝(Argopecten irradians)属瓣鳃纲(Lamellibranchia)异柱目(Anisomyaria)扇贝科(Pecten)海湾扇贝属(Argopecten)[1],又称大西洋扇贝,肉质鲜美,营养物质丰富,产量高,养殖周期短,自1982年引入中国[2],现已成为我国扇贝养殖主要品种之一,目前在山东、河北以及辽宁均有大面积养殖[3]。随着市场需求量的不断增大,海湾扇贝的养殖面积以及苗种的需求量也逐年增加。经过近40年的不断探索,海湾扇贝的人工育苗技术已经相当成熟,每年可进行春季和秋季两次育苗, 以春季质量较好[4],春季育苗一般在3月中下旬至5月,其中扇贝促熟的质量尤为关键。但目前,单胞藻仍是扇贝促熟期间的主要饵料,配合饲料普及率低下,其主要原因一方面是海湾扇贝营养需求研究基础薄弱,另一方面是扇贝特殊的滤食性进食方式给配合饲料的研发带来巨大困难。生产中单胞藻的培养不仅占用大量水体设施,而且受各种因素的影响,早春扩种海水和气温都比较低,单胞藻的繁殖速度较慢且周期较长,需要投入更大的能源和人力[5],此外敌害生物的侵害、天气阴暗、光照不足等导致单胞藻的培养失败,直接影响生产。近年来,随着扇贝产业的迅猛发展,开发适合促熟期间扇贝性腺发育的替代性饵料显得尤为迫切。目前,研究人员[6]尝试用新鲜大型藻类磨碎液、微藻干粉、鸡蛋黄等代替部分生物饵料,并已取得巨大进展。王如才等[7]和于瑞海等[8]用海藻磨碎液(鼠尾藻、马尾藻、石莼)投喂海湾扇贝亲贝,结果表明摄食海藻磨碎液的海湾扇贝性腺指数与单胞藻组差异不显著。殷旭旺等[9]分别以微绿球藻、孔石莼碎屑、孔石莼碎屑+微绿球藻、角叉菜碎屑、角叉菜碎屑+微绿球藻、裙带菜碎屑、裙带菜碎屑+微绿球藻投喂栉孔扇贝和虾夷扇贝,结果显示摄食孔石莼磨碎液与微绿球藻混合组的栉孔扇贝(Chlamys farreri)和虾夷扇贝(Patinopecten yessoensis)的性腺发育和体质量增长明显优于其他饵料处理组。但BURLE等[10]分别以鳟鱼粉和单胞藻投喂海湾扇贝,结果表明摄食单胞藻的海湾扇贝生长明显优于鳟鱼粉组。童圣英等[5]以动、植物蛋白质、脂肪、维生素和矿物质等按一定比例配合, 制成基础饲料混以海带干粉投喂海湾扇贝,结果显示海湾扇贝的性腺可以发育至育苗要求,第1次产卵时间和有效积温与对照组相同,且孵化后扇贝幼虫可变态至稚贝。综上,滤食性贝类养殖过程中人工饵料替代部分单胞藻是可行的,但仍旧面临较大困难,相对于甲壳类、鱼类饲料依旧落后很多。
脂类是水产动物重要的营养物质和能量来源,为水产动物的生长发育提供所需的磷脂、胆固醇和必需脂肪酸[11],脂类也是多种激素合成的前体,对水产动物性腺发育至关重要[12-13]。HURTADO等[14]研究发现添加9%的ARA乳制剂可以显著提高牡蛎(Crassostrea corteziensis)的性成熟和免疫力。DELAPORTE等[15]比较了10%和50%的EPA乳制剂对长牡蛎(Crassostrea gigas)生化成分和血细胞功能的影响,结果显示添加50%的EPA乳制剂可以促进长牡蛎的性腺发育,且在促熟末期牡蛎可以正常排卵。李广[16]发现饲料中不同脂肪源能够显著影响中间球海胆(Strongylocentrotus intermedius)性腺指数,鱼油组性腺指数显著高于豆油组和海带处理组。彭迪等[17]研究发现饲料中脂肪含量为7.89%可以显著提高克氏原螯虾(Procambarus clarkii)亲虾性腺指数、抱卵率、抱卵量。然而,有关海湾扇贝对脂肪的营养需求还未有报道,因此,本研究探讨了饲料中添加不同含量的脂肪对海湾扇贝性腺发育及其营养成分的影响,以期为开发扇贝促熟专用配合饲料提供理论依据,从而早日实现单胞藻的部分或全部替代。
1 材料与方法 1.1 材料试验用海湾扇贝由大连市庄河市玉洋集团金殿水产育苗厂提供,体质量为(40.79±1.70)g,壳长为(59.63±1.16) mm,壳高为(55.31±1.02) mm,壳宽为(26.90±0.50) mm,挑选贝壳完整无附着物,健康活力好,规格均匀的海湾扇贝暂养于育苗厂科研车间,水温10 ℃。
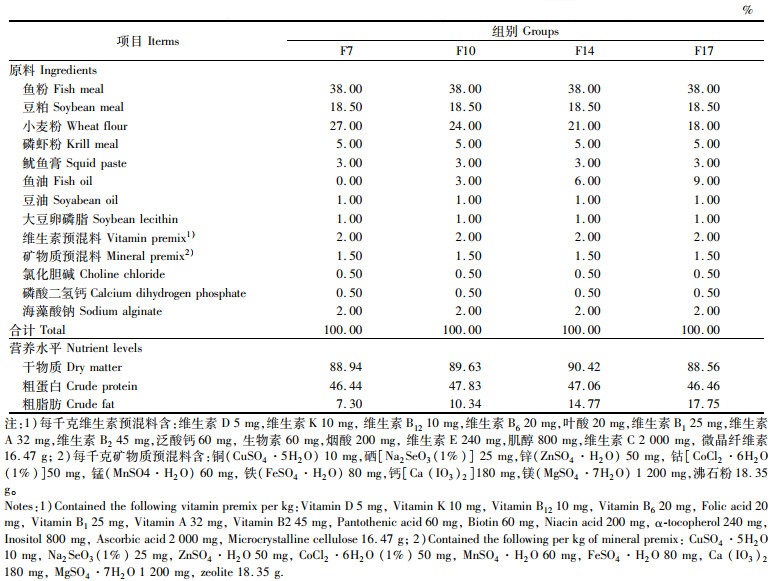
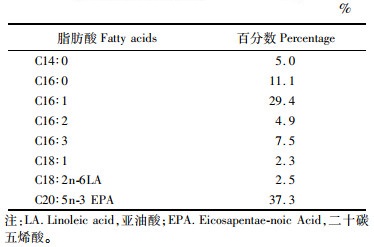
1.2 方法 1.2.1 试验设计与饲料制作本试验以小新月菱形藻(Nitzschia closterium f. minutissima)为对照组,实验组以鱼粉和豆粕作为实验饲料的主要蛋白源,鱼油和豆油作为脂肪源,通过梯度添加质量分数为0%、3%、6%和9%的鱼油,配置4种不同脂肪含量(质量分数为7.30%、10.34%、14.77%和17.75%)的等氮(质量分数为47%粗蛋白)饲料,分别命名为F7、F10、F14和F17,饲料配方及营养组成详见表 1和表 2。小新月菱形藻粗脂肪含量(质量分数)参照石娟等[18]大约为25%~35%,脂肪酸组成参照石娟等[19],详见表 3。
|
表 1 试验饲料组成及营养水平(干物质) Tab.1 Composition and nutrient levels of experimental diets (dry matter) |

|
表 2 试验饲料脂肪酸的组成及含量(干物质) Tab.2 Fatty acids composition and contentof experimental diets (dry matter) g/kg |
|
表 3 小新月菱形藻的脂肪酸组成 Tab.3 Fatty acids composition ofNitzschia closterium f. minutissima |
所有原料均粉碎过100目网筛,按配方比例准确称取各种固体原料,按照逐级放大的原则将原料充分混匀,然后加入油混合物搅拌均匀,最后加入30%的水再次混匀,用双螺旋制粒机(DES-TS1280, 济南鼎润机械设备有限公司)压制成直径为3 mm的饲料,自然风干后,用塑料袋包装并封好口,放进-20 ℃冰箱保存。
1.2.2 饲养管理养殖试验在大连市庄河市玉洋集团金殿水产育苗厂科研车间进行,根据试验设计共分为5组,每组3个重复,每个重复30只扇贝,对照组仅以小新月菱形藻进行喂养,日投饵量40万cell/mL, 分4次投喂,试验组每天投喂15~20 g的饲料,混以单胞藻20万cell/mL, 分4次投喂,投喂时间为06:00、12:00、18:00、24:00。试验所用水槽为1立方水体的玻璃钢水槽,每个水槽放有两个气石,24 h不间断充氧。饲养期间每天升温1 ℃,当温度升至17 ℃时恒温饲养,每日倒池1次。试验组所用饲料提前1 d将饲料用打粉机打成粉末,每次投喂前将饲料过300目筛绢网。试验期间水体盐度为28~32,pH为7.8~8.2,溶氧7 mg/L以上,氨氮质量浓度不超过0.10 mg/L,亚硝酸盐质量浓度不超过0.07 mg/L。试验周期为30 d。
1.2.3 样品采集实验结束前24 h停止投喂,捞取各个网框中的扇贝,称质量,测量壳长、壳宽、壳高并记录剩余数量,以计算扇贝的增重率和成活率。分别从各个网框中随机挑选7只扇贝,解剖,称量性腺质量和软体质量,将性腺部分切开,分别保存,将取得的样品一部分装在加有波恩试剂的离心管,另一部分经液氮速冻后于-80 ℃保存。
1.2.4 样品分析采用AOAC[20]的方法分析测定饲料和扇贝性腺的营养成分:水分含量的测定采用失重法,105 ℃烘干至恒重;粗脂肪采用索氏抽提法,抽提剂为乙醚。
石蜡组织切片,采用常规脱水和H.E染色,具体操作:首先,将保存于波恩氏固定液的组织用手术刀修至合适大小,然后使用自动脱水机(Leica HistoCore PEARL,徕卡显微系统上海有限公司)进行组织脱水,待脱水完成,用温镊子轻夹取组织,放入石蜡包埋盒中,调整组织位置,注入石蜡,然后将包埋好的样本进行冷却处理,将冷却凝固后的样品组织包埋盒放置在旋转组织切片机上进行连续切片,切片厚度调成5 μm,然后将切好的组织进行H.E染色,最后使用中性树胶封片,在智能显微镜(Leica DM 4 B)下进行组织形态的观察并及时拍照做好标记。
脂肪酸的测定参照左然涛[21]的方法,将样品冷冻干燥后,称取约100 mg磨碎样品放入带盖玻璃瓶中,加入3 mL氢氧化钾甲醇溶液(1 moL/L),72 ℃水浴20 min,冷却至室温,加入3 mL氯化氢甲醇溶液(2 moL/L),水浴20 min,冷却至室温,加入1 mL正己烷(色谱纯)后加入适量水,轻轻振荡并室温放置8 h使下层的脂肪酸甲酯充分萃取到正己烷中。吸取上层正己烷和脂肪酸甲酯溶液于1.5 mL离心管,5 000 r/min离心2 min,过0.45 μm有机滤膜,用正己烷定容至1 mL,装入气相瓶上机待测,气相色谱仪(SHIMADZU GC-2010),色谱柱为石英毛细管柱(SH-Rtx-1),采用火焰电离检测器,柱温先以25 ℃/min升至200 ℃,再以3 ℃/min升至230 ℃。
1.2.5 数据处理和统计分析实验结果用平均数±标准误(Mean±SE)表示,所有数据使用SPSS 23.0软件进行统计分析,在单因素方差分析(one-way ANOVA)的基础上,采用Duncan氏多重比较检验组间差异显著性,P < 0.05表示差异显著。
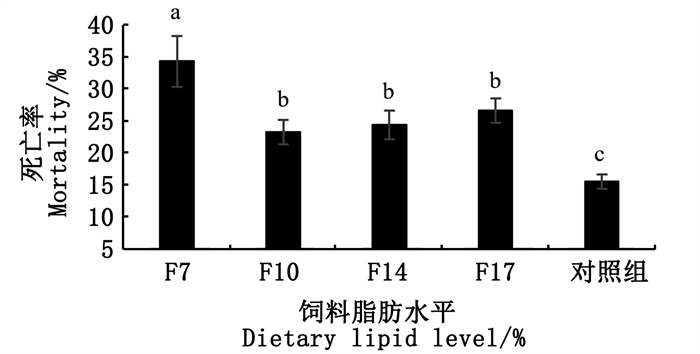
2 结果 2.1 死亡率由图 1可知,除F7组外,饲料中脂肪含量未显著影响扇贝死亡率,F7组死亡率显著高于其他各组(P < 0.05),对照组死亡率显著低于饲料处理组(P < 0.05)。
|
标注不同小写字母表示差异显著(P < 0.05),标注相同小写字母表示差异不显著(P>0.05)。 Different lowercase letters mean significant difference (P < 0.05), and with same letter mean no significant difference (P>0.05). 图 1 饲料中脂肪水平对扇贝死亡率的影响 Fig. 1 Effects of dietary lipid levelson the mortality rate of scallop |
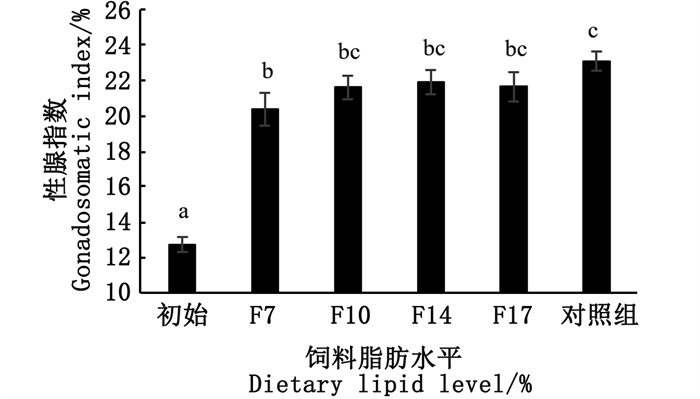
由图 2可知,饲料中脂肪含量未显著响扇贝性腺指数,F14组性腺指数最高,与对照组差异不显著(P>0.05),F7组性腺指数显著低于对照组(P < 0.05),初始时期扇贝性腺指数显著低于其他组(P < 0.05)。
|
标注不同小写字母表示差异显著(P < 0.05),标注相同小写字母表示差异不显著(P>0.05)。 Different lowercase letters mean significant difference (P < 0.05), and with same letter mean no significant difference (P>0.05). 图 2 饲料中脂肪水平对扇贝性腺指数的影响 Fig. 2 Effects of dietary lipid on the gonadosomatic index of scallop |
由图 3可知,饲料脂肪含量显著影响性腺中雌性部分含水量,F10组含水量显著高于F17组(P < 0.05)。饲料脂肪含量未显著影响性腺中雄性部分含水量,其中F7组含水量最高,F10组含水量最低。饲料处理组性腺中雌性部分与雄性部分含水量均显著高于对照组(P < 0.05)。
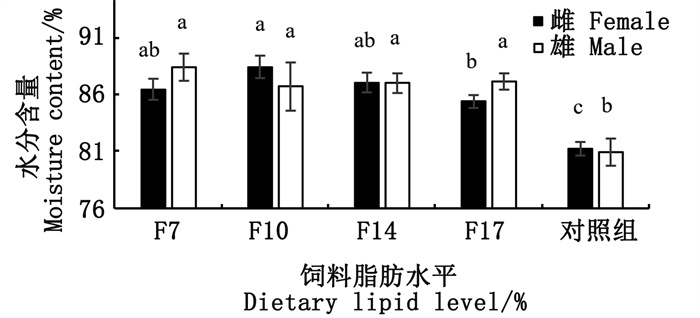
|
相同性腺组织标注不同小写字母表示差异显著(P < 0.05),标注相同小写字母表示差异不显著(P>0.05)。 Different lowercase letters within the same gonad mean significant difference (P < 0.05), and with same letter mean no significant difference (P>0.05). 图 3 饲料中脂肪水平对扇贝性腺水分含量的影响 Fig. 3 Effects of dietary lipid on the gonad moisture content of scallop |
由图 4可知,饲料脂肪含量未显著影响性腺粗脂肪含量,雌性部分F17组粗脂肪含量最高,雄性部分对照组粗脂肪含量最高。雌性部分的粗脂肪含量均显著高于雄性部分(P < 0.05)。
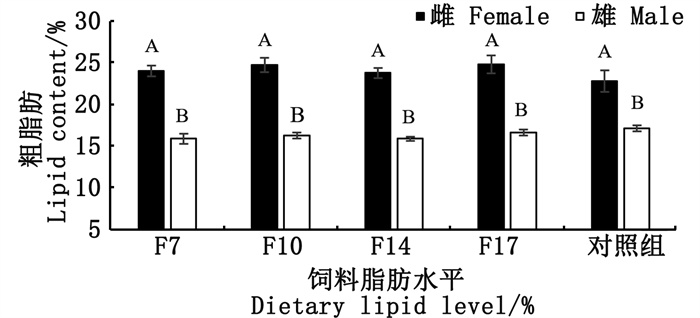
|
相同脂肪饲料下标注不同大写字母表示雌雄个体间差异显著(P < 0.05)。 Different capital letter within the same lipid diet mean significant difference (P < 0.05). 图 4 饲料中脂肪水平对扇贝性腺粗脂肪含量的影响 Fig. 4 Effects of dietary lipid on the gonad lipid content of scallop |
由表 4可知,此次试验共检测了11种主要脂肪酸的含量,包含3种饱和脂肪酸(Saturated fatty acids, SFA)、3种单不饱和脂肪酸(Monounsaturated fatty acids, MUFA),以及5种多不饱和脂肪酸(Polyunsaturated fatty acids, PUFA)包含2种高不饱和脂肪酸(High unsaturated fatty acids, HUFA),按脂肪酸的含量排列依次为PUFA>MUFA>SFA。性腺中SFA、MUFA、n-3 PUFA和n-3 HUFA的含量随着饲料中脂肪含量的增加呈先上升后下降的趋势,在F14组达到最高,SFA和n-3HUFA含量显著高于F7组(P < 0.05),但与对照组无显著性差异(P>0.05),MUFA和n-3PUFA含量显著高于F7组和对照组(P < 0.05)。n-6 PUFA含量随着饲料中脂肪含量的增加而逐渐增加,F17组显著高于F7、F10和对照组(P < 0.05)。EPA的含量随着饲料中脂肪含量的增加呈现先上升后下降的趋势,在F14组达到最高,显著高于F7组(P < 0.05), 但显著低于对照组(P < 0.05)。油酸、亚油酸和DHA的含量随着饲料中脂肪含量的增加逐渐增加,F17组显著高于F7组和对照组(P < 0.05)。∑n-3/∑n-6和EPA/ARA均随着饲料中脂肪含量的增加逐渐降低,显著低于对照组(P < 0.05)。DHA/ EPA的比值随着饲料中脂肪含量的增加而增加,饲料处理组显著高于对照组(P < 0.05)。
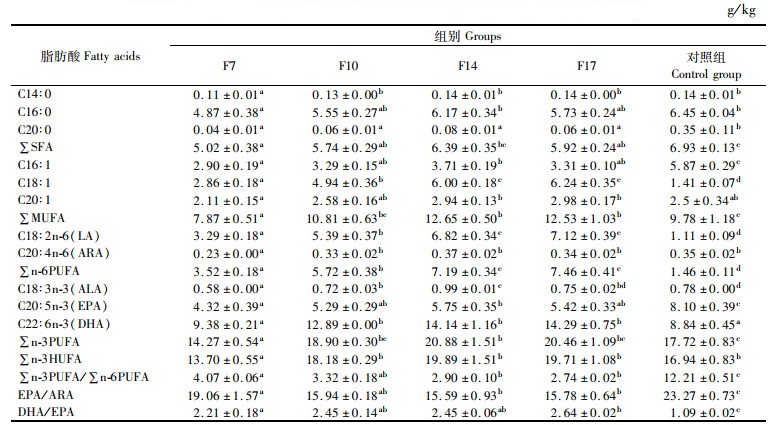
|
表 4 性腺中雌性部分脂肪酸含量(干物质) Tab.4 Fatty acid composition and content of female gonad part (dry matter) |
由表 5可知,雄性性腺中SFA、MUFA、n-6 PUFA、n-3PUFA和n-3HUFA含量随着饲料中脂肪含量的增加呈现先增加后降低的趋势,在F14组达到最高,SFA、MUFA和n-6PUFA含量显著高于F7组和对照组(P < 0.05),n-3PUFA和n-3HUFA含量显著高于对照组(P < 0.05)。油酸、亚油酸、EPA和DHA含量随着饲料中脂肪含量的增加呈现先增加后降低的趋势,在F14组达到最高,油酸和亚油酸含量显著高于F7组和对照组(P < 0.05),EPA含量显著低于对照组(P < 0.05),所有饲料处理组DHA的含量显著高于对照组(P < 0.05)。∑n-3PUFA/∑n-6PUFA、EPA/ARA和DHA/EPA均随着饲料中脂肪含量的增加逐渐降低,显著低于对照组(P < 0.05)。
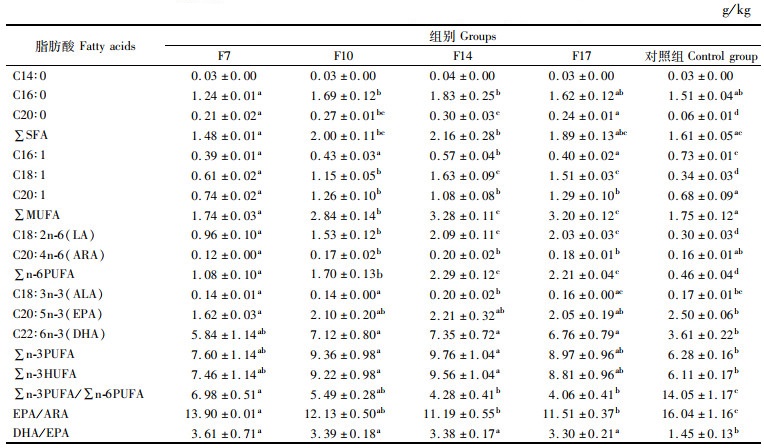
|
表 5 性腺中雄性部分脂肪酸含量(干物质) Tab.5 Fatty acid content of male part in gonad (dry matter) |
各处理组性腺中雌性部分充满了滤泡,滤泡密集,滤泡之间的空隙基本消失,卵母细胞充满了整个滤泡腔,卵母细胞核区透明(图版-1, 3, 5, 7, 9)。雄性部分,滤泡内精原细胞不断分裂增殖,滤泡壁上精原细胞排列密集,滤泡腔内生殖细胞呈放射状多层排列(图版-2, 4, 6, 8, 10)。图版-11, 12为试验初始时卵巢与精巢切片,滤泡腔内多为空腔,并有原始的生殖细胞在滤腔壁上堆积,滤泡之间空隙较大。
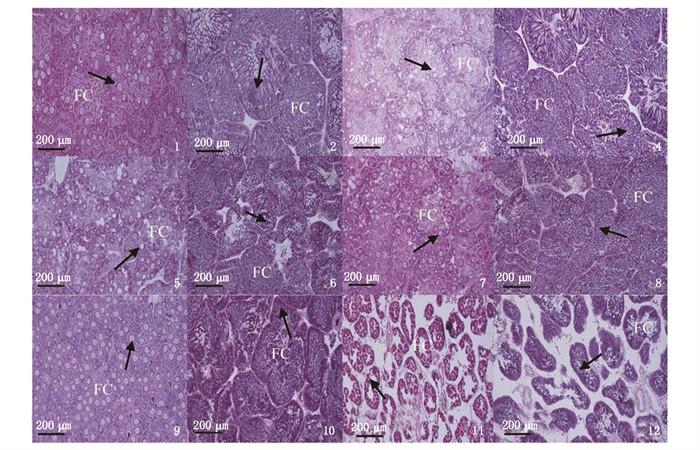
|
1~12.依次为F7卵巢、F7精巢、F10卵巢、F10精巢、F14卵巢、F14精巢、F17卵巢、F17精巢、对照卵巢、对照精巢、初始卵巢和初始精巢; →生殖细胞; FC.滤泡和滤泡腔。 1-12 are F7 ovary, F7 testis, F10 ovary, F10 testis, F14 ovary, F14 testis, F17 ovary, F17 testis, control ovary, control testis, initial ovary and initial testis; →. germ cells; FC. follicle and follicular cavity. 图版 性腺组织切片观察 Plate Plate Histological observation of gonad |
海湾扇贝是滤食性海洋贝类,对食物的种类无选择能力,水体中粒径合适的有机颗粒、藻类和浮游生物等都可能成为其潜在的饵料基础[5, 22]。单胞藻一直以来都是贝类育苗中不可或缺的饵料,其富含不饱和脂肪酸,是水产动物获取脂肪酸的最简单的饵料[23-24],对水产动物的生长发育繁殖具有重要的作用。童圣英等[5]、殷旭旺等[9]、HURTADO等[14]和DELAPORTE等[15]分别以人工配合饲料、大型藻类磨碎液、ARA和EPA乳制剂投喂海湾扇贝、栉孔扇贝、虾夷扇贝和牡蛎,均已证明只要人工配制饵料营养平衡,颗粒大小合适,饲喂滤食性贝类是可行的。本研究将含有不同脂肪的饲料在打粉机里反复打磨并过120目网筛,投喂前在双层325目筛绢网里进行揉搓,使其大部分粒径小于45 μm,适宜海湾扇贝滤食。结果显示,随着饲料中脂肪含量的增加,扇贝性腺中脂肪酸含量也随之变化,其中F14组性腺中MUFA、n-6PUFA和n-3PUFA的含量显著高于对照组,说明饲料中脂肪含量可以显著影响扇贝性腺中脂肪酸的积累,也证明了此次试验配合饲料饲喂海湾扇贝是可行的。
3.2 不同脂肪含量饲料对海湾扇贝死亡率的影响本研究显示,除F7组死亡率较高外,其他各饲料处理组间并无显著性差异,说明饲料中脂肪含量未显著影响扇贝的死亡率。F7组死亡率较高可能与种贝的质量有关,虽然此次试验所用扇贝是经过层层筛选出来的,且在试验开始之前种贝已经在10 ℃环境中饲养半月有余,但此次育苗厂育苗所用种贝整体质量较差,育苗期间种贝死亡率在30%以上,而此次试验所用扇贝虽然是优中选优的,但仍不能避免个别种贝被病菌感染,在试验期间出现双壳错开现象,最终导致扇贝死亡。此次试验饲料处理组的死亡率均显著高于对照组,这可能是饲料溶失导致饲料处理组与对照组相比,水中含有更高的氨氮和亚硝酸盐,水质较差,另一方面可能是在投喂饲料过后,水中悬浮饲料颗粒较多,不可避免会有一些大颗粒饲料被吸附在扇贝鳃上,对扇贝呼吸和摄食产生影响,扇贝状态较差,从而导致扇贝容易死亡。
3.3 不同脂肪含量饲料对海湾扇贝性腺发育的影响海湾扇贝为雌雄同体,性腺位于足的腹脊部,外形为新月形,在性腺尚未发育成熟之时,性腺表面包有一层黑色薄膜,不能区分雌雄部分,待性腺发育成熟,黑膜褪去,可见腹脊外周缘乳白色雄性部分和位于内侧的桔红色雌性部分[25]。随着饲料中脂肪含量的增加,性腺指数先增加后降低,在F14组达到最高,显著高于初始时期,与对照组无显著性差异。从性腺组织切片观察,经过30天的促熟后各处理组性腺中雌性部分充满了滤泡,滤泡密集,滤泡之间的空隙基本消失,卵母细胞充满了整个滤泡腔,雄性部分滤泡内精原细胞不断分裂增殖,滤泡壁上精原细胞排列密集,说明此次试验饲料饲喂海湾扇贝可以促进扇贝性腺发育至育苗要求,在黄颡鱼[26](Pelteobagrus fulvidraco)、中华鲟[27](Acipenser sinensis)、巴西鲇鱼[28](Rhambia quelen)等的研究中也已表明,饲料中适宜的脂肪含量会促进鱼类卵巢的发育。脂肪不仅是水产动物重要的能量来源,而且所含的脂肪酸尤其是必需脂肪酸在动物正常生长、免疫、性腺发育和繁殖性能过程中发挥着重要作用[29]。另外,本次试验发现试验前后扇贝体质量并无明显变化,但扇贝性腺指数发生显著性变化,由此推测扇贝性腺在发育时脂蛋白等营养物质的合成可能优先利用来自内脏团和闭壳肌中的营养物质,食物中所获取的营养物质主要用于机体正常生活的能量代谢。
性腺中雌性部分脂肪酸的含量排列依次为PUFA>MUFA>SFA,饲料处理组SFA、MUFA、n-3PUFA和n-3HUFA的含量随着饲料中脂肪含量的上升呈先上升后下降的趋势,均在F14组达到最高,显著高于F7组,其中SFA和n-3HUFA含量与对照组无显著性差异,MUFA和n-3PUFA含量显著高于对照组。性腺在发育时,脂肪作为重要的细胞膜物质,为卵母细胞的生长提供物质基础,脂肪酸不仅可以调节一些类固醇激素的合成也可经氧化分解产生能量,为性腺发育提供必要的能量,马爱军等[30]研究发现饲料中高水平的n-3HUFA可以提高大菱鲆(Scophthalmus maximus)亲鱼的产卵量、所产卵子卵径大、孵化率高、仔稚鱼存活率强,FURUITA等[31]研究发现牙鲆(Paralichthys olivaceus)鱼卵中n-3HUFA的含量随着饲料中n-3HUFA含量的增加而逐渐增加,当饲料中n-3HUFA含量不足时,将显著影响孵化率和仔鱼成活率。性腺中DHA的含量和DHA/EPA随着饲料中脂肪含量的增加而逐渐增加,在F17组达到最高,显著高于F7组和对照组,DHA是促进性腺发育的重要n-3HUFA,LUO等[32]研究发现,饲料中提高DHA的含量能够提高西伯利亚鲟(Acipenser baeri)的产卵量和受精率,汪春玲[33]研究发现提高饲料中DHA/EPA,凡纳滨对虾(Litopenaeus vannamei)雌虾的性腺指数、血清中雌二醇的含量以及产卵量逐渐升高。性腺中EPA含量试验组均显著低于对照组,而DHA含量除F7组外,其他试验组含量显著高于对照组,这一结果与小新月菱形藻中脂肪酸组成相吻合,小新月菱形藻中富含丰富的EPA,占脂肪酸组成的37.5%[19]。
雌性部分粗脂肪以及大部分脂肪酸含量显著高于雄性部分,这与中间球海胆[34](Strongylocentrotus intermedius)、三斑海马[35](Hippocampus trimaculatus)、中华绒螯蟹[36](Eriocheir sinensis)等研究得到的结果一致。海湾扇贝在繁殖前卵巢中需要积累较多的卵黄蛋白,卵黄蛋白是一种脂类含量较高的脂蛋白,是幼体发育过程中重要的营养和能量来源,其含量高低是评价卵质量的重要指标[37]。雄性性腺中SFA、MUFA、n-6PUFA、n-3PUFA和n-3HUFA含量随饲料的变化与雌性部分基本相同,均在F14或F17组达到最高。雄性性腺中DHA/EPA随着饲料中脂肪含量的增加逐渐降低,而雌性性腺逐渐增加,说明性腺在发育过程中雌性部分可能需要更多的DHA,而雄性部分则需要更多的EPA,汪春玲[33]研究发现在饲料中DHA+EPA总量一定的情况下,促进凡纳滨对虾雌虾的生长和性腺发育的最适DHA/EPA高于促进雄虾生长和性腺发育的最适DHA/EPA。
综上所述,人工配合饲料替代部分单胞藻饲喂海湾扇贝是可行的,饲料中适宜的脂肪含量可以促进海湾扇贝性腺发育至育苗要求,饲料中脂肪含量质量分数为14.77%可以显著提高性腺中MUFA和PUFA的含量。
| [1] |
许红. 海湾扇贝育苗技术要点[J]. 河北渔业, 2014(8): 41-42. XU H. Key points of Argopecten irradians seedling raising technology[J]. Hebei Fisheries, 2014(8): 41-42. DOI:10.3969/j.issn.1004-6755.2014.08.016 |
| [2] |
KANG H Y, LEE Y J, LEE W C, et al. Gross biochemical and isotopic analyses of nutrition-allocation strategies for somatic growth and reproduction in the bay scallop Argopecten irradians newly introduced into Korean waters[J]. Aquaculture, 2019, 503: 156-166. DOI:10.1016/j.aquaculture.2018.12.092 |
| [3] |
方笑, 张福崇, 王六顺, 等. 海湾扇贝(Argopecten irradians)新品种"海益丰12"养殖效果评价[J]. 河北渔业, 2019(6): 1-3, 13. FANG X, ZHANG F C, WANG L S, et al. Evaluation on farming results of "Haiyifeng 12", a new strain of the bay scallop Argopecten irradians[J]. Hebei Fisheries, 2019(6): 1-3, 13. DOI:10.3969/j.issn.1004-6755.2019.06.001 |
| [4] |
李婉茹, 张玲玲, 张美溦, 等. 海湾扇贝促性腺激素释放激素基因克隆及表达分析[J]. 中国海洋大学学报, 2020, 50(2): 68-74. LI W R, ZHANG L L, ZHANG M W, et al. Cloning and expression analysis of gonadotropin-releasing hormone gene in the bay scallop[J]. Periodical of Ocean University of China, 2020, 50(2): 68-74. |
| [5] |
童圣英, 王子臣, 于淑敏, 等. 微细配合饲料代替单胞藻作为海湾扇贝亲贝及面盘幼虫食料的研究[J]. 大连水产学院学报, 1998, 13(1): 3-9. TONG S Y, WANG Z C, YU S M, et al. Utilization of micro pelleted diets as a substitute for unicellular algae fed to brood stocks and veligers of bay scallop (Argopecten irradian Lamarck)[J]. Journal of Dalian Fisheries University, 1998, 13(1): 3-9. |
| [6] |
杨创业, 杜晓东, 王庆恒, 等. 双壳贝类营养需求及人工饵料的研究进展[J]. 动物营养学报, 2016, 28(11): 3422-3428. YANG C Y, DU X D, WANG Q H, et al. Advances in nutritional requirements and artificial feed of bivalve mollusks[J]. Chinese Journal of Animal Nutrition, 2016, 28(11): 3422-3428. DOI:10.3969/j.issn.1006-267x.2016.11.008 |
| [7] |
王如才, 于瑞海. 海藻榨取液在海湾扇贝亲贝蓄养中的应用[J]. 海洋科学, 1989(6): 55-56. WANG R C, YU R H. The utilization of alga extraction in the processes of bay scallop parent stocking[J]. Marine Sciences, 1989(6): 55-56. |
| [8] |
于瑞海, 王如才, 张建中. 用海藻磨碎液进行海湾扇贝促熟的研究[J]. 海洋湖沼通报, 1991(1): 54-58. YU R H, WANG R C, ZHANG J Z. Study on conditioning culture of bay scallop by feeding of minced algae suspension[J]. Transactions of Oceanology and Limnology, 1991(1): 54-58. |
| [9] |
殷旭旺, 宋佳, 李文香, 等. 不同海藻磨碎液对两种扇贝生长发育的影响[J]. 渔业现代化, 2015, 42(3): 1-7. YIN X W, SONG J, LI W X, et al. Effects of different macroalgal detritus on growth and development of two kinds of scallops: Chlamys farreri and Patinopecten yessoensis[J]. Fishery Modernization, 2015, 42(3): 1-7. DOI:10.3969/j.issn.1007-9580.2015.03.001 |
| [10] |
BURLE E, KIRBY-SMITH W W. Growth of the Bay Scallop, Argopecten irradians, fes an artificial diet rich in protein[J]. Estuaries, 1979, 2(3): 206-208. DOI:10.2307/1351739 |
| [11] |
YU Z Y, WANG L M, SONG F B, et al. Effects of dietary shrimp extract on growth performance, muscle fatty acid composition, and lipid metabolism-related genes of juvenile red tilapia[J]. Journal of the World Aquaculture Society, 2020, 51(5): 1270-1284. DOI:10.1111/jwas.12705 |
| [12] |
IZQUIERDO M S, FERNÁNDEZ-PALACIOS H, TACON A G J. Effect of broodstock nutrition on reproductive performance of fish[J]. Aquaculture, 2001, 197(1/4): 25-42. |
| [13] |
谭星君. 饲料中脂肪成分对海水鱼生长发育的影响研究[J]. 河南农业, 2018(14): 57. TAN X J. Effects of fatty components in feed on growth and development of Marine fish[J]. Agriculture of Henan, 2018(14): 57. |
| [14] |
HURTADO M A, REZA M, IBARRA A M, et al. Arachidonic acid (20:4n-6) effect on reproduction, immunology, and prostaglandin E2 levels in Crassostrea corteziensis (Hertlein, 1951)[J]. Aquaculture, 2009, 294(3/4): 300-305. |
| [15] |
DELAPORTE M, CHU F L, LANGDON C, et al. Changes in biochemical and hemocyte parameters of the Pacific oysters Crassostrea gigas fed T-Iso supplemented with lipid emulsions rich in eicosapentaenoic acid[J]. Journal of Experimental Marine Biology and Ecology, 2006, 343(2): 261-275. |
| [16] |
李广. 饲料中蛋白源和脂肪源对中间球海胆生长、营养组成和脂肪酸合成相关基因表达的影响[D]. 大连: 大连海洋大学, 2018. LI G. Effects of protein sources and lipid sources in feed on growth, nutrition composition and transcription of fatty acid synthesis related genes in Strongylocentrotus intermedius[D]. Dalian: Dalian Ocean University, 2018. |
| [17] |
彭迪, 陈效儒, 文华, 等. 饲料脂肪水平对克氏原螯虾亲虾生长性能、肌肉成分、繁殖性能以及血淋巴生化指标的影响[J]. 水产学报, 2019, 43(10): 2175-2185. PENG D, CHEN X R, WEN H, et al. Effects of dietary lipid levels on growth performance, muscle composition, reproductive performance and hemolymph biochemical indices of Procambarus clarkii broodstock[J]. Journal of Fisheries of China, 2019, 43(10): 2175-2185. |
| [18] |
石娟, 潘克厚. 不同光照条件对小新月菱形藻和等鞭金藻8701生长及生化成分的影响[J]. 中国水产科学, 2004, 11(2): 121-128. SHI J, PAN K H. Effects of different light intensities on growth and biochemical composition of Nitzschia closterium f. minutissima and Isochrysis galbana Parke 8701[J]. Journal of Fishery Sciences of China, 2004, 11(2): 121-128. DOI:10.3321/j.issn:1005-8737.2004.02.007 |
| [19] |
石娟, 潘克厚, 王晓青, 等. 对小新月菱形藻(Nitzschia closterium f. minutissima)分类地位的重新认识[J]. 科学通报, 2008, 53(2): 197-202. SHI J, PAN K H, WANG X Q, et al. Hierarchical recognition on the taxonomy of Nitzschia closterium f. minutissima[J]. Chinese Science Bulletin, 2008, 53(2): 245-250. |
| [20] |
AOAC. Official methods of analysis association of official analytical chemists[S]. 16th ed. Arlington, VA: Association of Official Analytical Chemists International, 1995.
|
| [21] |
左然涛. 饲料脂肪酸调控大黄鱼免疫力和脂肪酸代谢的初步研究[D]. 青岛: 中国海洋大学, 2013. ZUO R T. Preliminary study about regulation of dietary fatty acid on immunity and fatty acid metabolism in large yellow croaker (Larmichthys crocea)[D]. Qingdao: Ocean University of China, 2013. |
| [22] |
贾秋红, 李晓春, 宋佳, 等. 不同海藻磨碎液对栉孔扇贝性腺发育及增重效果的比较[J]. 河北渔业, 2015(7): 9-10, 23. JIA Q H, LI X C, SONG J, et al. Comparison of different seaweed grinds on gonadal development and weight gain of Chlamys farreri[J]. Hebei Fisheries, 2015(7): 9-10, 23. DOI:10.3969/j.issn.1004-6755.2015.07.003 |
| [23] |
刘梅, 朱曦露, 苏艳秋, 等. 微藻和动物性生物饵料在水产养殖中的应用研究[J]. 海洋与渔业, 2016(4): 56-57. LIU M, ZHU X L, SU Y Q, et al. Study on the application of microalgae and animal feed in aquaculture[J]. Ocean and Fishery, 2016(4): 56-57. |
| [24] |
薛瑞萍, 蒋霞敏, 韩庆喜, 等. 温、光、盐对硅藻STR01生长、总脂、脂肪酸的影响[J]. 水生生物学报, 2019, 43(3): 670-679. XUE R P, JIANG X M, HAN Q X, et al. Effects of temperature, light intensity, salinity on the growth rate, total lipid content and fatty acid composition of STR01[J]. Acta Hydrobiologica Sinica, 2019, 43(3): 670-679. |
| [25] |
沈决奋, 杨爱国, 燕敬平. 海湾扇贝性腺发育的初步研究[J]. 海洋与湖沼, 1996, 27(6): 632-636. SHEN J F, YANG A G, YAN J P. A preliminary study on gonada development in the Bay Scallop Argopecten irradians[J]. Oceanologia et Limnologia Sinica, 1996, 27(6): 632-636. DOI:10.3321/j.issn:0029-814X.1996.06.010 |
| [26] |
卓梅琴, 杨水波, 凌仕诚, 等. 饲料脂肪对黄颡鱼卵巢脂类代谢以及PI3KCa甲基化和转录水平的影响[J]. 水产学报, 2019, 43(10): 2186-2196. ZHUO M Q, YANG S B, LING S C, et al. Effects of dietary lipid on lipid metabolism, methylation and expression of PI3KCa in the ovary of yellow catfish (Pelteobagrus fulvidraco)[J]. Journal of Fisheries of China, 2019, 43(10): 2186-2196. |
| [27] |
周海. 脂肪在中华鳄雌鱼性腺发育过程中的作用及其相关机制研究[D]. 武汉: 华中农业大学, 2018. ZHOU H. Studies on the function and the related mechanism of lipid on gonadal development of female Chinese sturgeon (Acipenser sinensis)[D]. Wuhan: Huazhong Agricultural University, 2018. |
| [28] |
COLDEBELLA I J, EMANUELLI T, VEIVERBERG C A, et al. Effect of different dietary lipid levels on the reproduction of Rhamdia quelen (Quoy and Gaimard, 1824)[J]. Aquaculture Nutrition, 2013, 19(5): 751-764. DOI:10.1111/anu.12022 |
| [29] |
侯受权, 左然涛, 常亚青, 等. 饲料脂肪水平对中间球海胆幼胆生长、消化酶和热胁迫后抗氧化酶活力的影响[J]. 大连海洋大学学报, 2016, 31(5): 538-543. HOU S Q, ZUO R T, CHANG Y Q, et al. Effects of dietary lipid level on growth performance, digestive enzyme activity and anti-oxidative capacity after heat stress in juvenile sea urchin Strongylocentrotus intermedius[J]. Journal of Dalian Ocean University, 2016, 31(5): 538-543. |
| [30] |
马爱军, 陈超, 雷霁霖, 等. 饲料蛋白质含量和n-3HUFA水平对大菱鲆亲鱼产卵的影响[J]. 海洋水产研究, 2005, 26(1): 7-12. MA A J, CHEN C, LEI J L, et al. The effect of protein and n-3HUFA on the reproduction of turbot (Scophthalmus maximus)[J]. Marine Fisheries Research, 2005, 26(1): 7-12. |
| [31] |
FURUITA H, TANAKA H, YAMAMOTO T, et al. Effects of high levels of n-3 HUFA in broodstock diet on egg quality and egg fatty acid composition of Japanese flounder, Paralichthys olivaceus[J]. Aquaculture, 2002, 210(1/4): 323-333. |
| [32] |
LUO L, AI L C, LI T L, et al. The impact of dietary DHA/EPA ratio on spawning performance, egg and offspring quality in Siberian sturgeon (Acipenser baeri)[J]. Aquaculture, 2015, 437: 140-145. DOI:10.1016/j.aquaculture.2014.11.036 |
| [33] |
汪春玲. 不同投喂频率和饲料中DHA/EPA比例对凡纳滨对虾亲虾繁殖性能及后代质量的影响[D]. 上海: 上海海洋大学, 2018. WANG C L. Effects of different feeding frequency and dietary DHA/EPA ration on the reproductive performance and offspring quality of Litopenaeus vannamei broodstock[D]. Shanghai: Shanghai Ocean University, 2018. |
| [34] |
李磊, 杨丹, 亓守冰, 等. 中间球海胆繁殖前后性腺中脂类和脂肪酸含量变化[J]. 大连海洋大学学报, 2018, 33(4): 423-429. LI L, YANG D, QI S B, et al. Changes in lipids and fatty acids in gonads of sea urchin Strongylocentrotus intermedius before and after reproduction[J]. Journal of Dalian Ocean University, 2018, 33(4): 423-429. |
| [35] |
闫珍珍, 张东, 林听听, 等. 雌雄灰海马和三斑海马营养价值与功能性成分对比分析[J]. 食品科学, 2019, 40(16): 206-212. YAN Z Z, ZHANG D, LIN T T, et al. A comparative analysis of functional components and nutritional values of female and male Hippocampus erectus and H. trimaculatus[J]. Food Science, 2019, 40(16): 206-212. DOI:10.7506/spkx1002-6630-20180920-234 |
| [36] |
陈志强, 郑月, 蔡洁琼, 等. 固城湖中华绒螯蟹可食部位氨基酸和脂肪酸组成[J]. 食品科学, 2016, 37(10): 122-127. CHEN Z Q, ZHENG Y, CAI J Q, et al. Amino acid and fatty acid compositions of edible parts of Chinese mitten crab in Gucheng Lake, Nanjing[J]. Food Science, 2016, 37(10): 122-127. DOI:10.7506/spkx1002-6630-201610021 |
| [37] |
ZUO R T, AI Q H, MAI K S, et al. Effects of dietary n-3 highly unsaturated fatty acids on growth, nonspecific immunity, expression of some immune related genes and disease resistance of large yellow croaker (Larmichthys crocea) following natural infestation of parasites (Cryptocaryon irritans)[J]. Fish & Shellfish Immunology, 2012, 32(2): 249-258. |
 2021,
Vol. 30
2021,
Vol. 30


