罗非鱼是我国重要的水产养殖鱼类,具有耐低氧、抗病能力强、适应能力强的特点。吉富罗非鱼(GIFT strain of Nile tilapia, Oreochromis niloticus)作为罗非鱼主要养殖品种之一,经过遗传性状改良后,具备了生长速度快、全雄率高、肉品质好等优点,现已在全国范围内推广养殖[1]。近年来,随着我国水产养殖业快速发展,养殖规模不断扩大,集约化养殖密度过大,各种病害日益增多,而长期过度使用抗生素和化学药物也引出药物残留和耐药性问题,严重影响行业发展,同时危害消费者的健康。中草药及其提取物具有安全低毒、抗菌、抗病毒、不易产生耐药性等特点[2-3],已成为替代抗生素饲料添加剂的首选。中草药通过影响动物机体蛋白质、酶的合成,从而促进个体生长发育,并影响非特异性免疫系统,影响吞噬细胞、溶菌酶、补体、细胞因子等,从而增强机体的免疫能力。现已证明有200余种中草药对水生动物有免疫活性[4]。
黄藤素,又称巴马汀,是大黄藤中生物碱主要化学成分,也是大黄藤主要活性成分,具有抗炎、抗菌、提高免疫能力等作用。有研究[5-6]表明黄藤素通过抑制肺内炎症相关NF-κB信号通路,有效减轻小鼠肺内组织炎性反应。于浩飞等[7]同样发现黄藤素具有明显的抗炎作用,能够增强小鼠非特异性免疫功能。ZHOU等[8]将黄藤素注射到兔膝关节,证明了黄藤素对兔关节炎软骨具有保护作用。黄藤素抑菌药理试验证实黄藤素对大肠埃希菌、金黄色葡萄球菌等细菌、真菌具有抑制作用,对嗜睡气单胞菌和副溶血性弧菌两种水产致病菌也表现出显著的抑制作用[9-10]。除此之外,黄藤素也被应用于防治外科感染、肠炎、呼吸道感染、菌痢等感染性疾病[11]。但目前尚未见黄藤素对水产动物免疫功能影响的报道。本试验在吉富罗非鱼饲料中添加不同水平的黄藤素,探讨该物质对吉富罗非鱼抗氧化能力和非特异性免疫的影响,为黄藤素防治鱼病方面提供理论依据。
1 材料与方法 1.1 试验饲料的制备以豆粕、菜粕和鱼粉为主要蛋白源,配制粗蛋白含量为31%,粗脂肪为4.5%的基础饲料。在此基础上分别添加0、0.01%、0.02%、0.04%、0.08%的黄藤素,配制成5组不同黄藤素含量的等氮等能饲料,饲料配方及营养组成见表 1。饲料原料粉碎过60目筛,充分混匀后,将饲料挤压成直径为1.2 mm的条状,干燥后破碎,并密封保存于-20 ℃条件下备用。本实验所用黄藤素购自上海源叶生物科技有限公司,含量为90%。

|
表 1 试验饲料配方和营养组成(%风干物质基础) Tab.1 Formulation and proximate composition of the experimental diets (% air-dry basis) |
养殖试验在云南农业大学动物科学技术学院水产养殖实验室中进行。试验鱼由西双版纳云博水产养殖开发有限公司提供,均为当年人工培育的同一批苗种,鱼均体质量为0.50 g。正式试验前,试验鱼投喂对照组饲料,暂养2周以适应养殖环境。试验开始前禁食24 h。选择大小均匀、健康无病的罗非鱼幼鱼,随机分为5组,每组3个重复,每个重复40尾鱼,幼鱼随机分配于15个玻璃水族缸(1.2 m×0.5 m×0.6 m)中。每天投喂3次(7:00、12:00、18:00),至饱食。养殖用水为曝气自来水,采用内循环流水系统,水流速5 L/min,养殖期间不间断充氧,自然光照,溶解氧质量浓度>5 mg/L,pH为7.4~7.8,氨氮质量浓度不超过0.5 mg/L,水温为(29±1)℃。养殖周期12周。
1.3 样品采集养殖试验结束禁食24 h后,称量每个鱼缸鱼体总质量,记录鱼体个数,计算罗非鱼生长性能。此外,每缸随机抽取6尾鱼,麻醉后尾静脉取血,血样在4 ℃冰箱静置4 h,离心分离(4 000 r/min,10 min),取上清,-80 ℃保存备用;将采血后的罗非鱼解剖,取出肝脏,剥去脂肪后装于密封袋中,-80 ℃保存。
在超净工作台上用乙醇对采血后的罗非鱼进行充分消毒。于罗非鱼心腹腔隔膜背前方取出头肾组织,将头肾组织放入盛有5 mL HBSS(X10)的研钵中,研磨后液体用100 μm尼龙网过滤,滤液盛放在无菌培养皿中。取2 mL滤液缓慢滴到装有34%/51%的Percoll分离液的离心管中,4 ℃下,4 000 r/min离心10 min,吸出34%/51%液面交汇处的头肾巨噬细胞转移至另1个离心管中,用2 mL HBSS充分冲洗,4 000 r/min离心10 min。最后加入2 mL RPMI-1640培养基,旋涡振荡成细胞悬液,并用培养基调整细胞浓度为107 cell/mL,用0.1%台盼蓝检测活细胞的数目,保证其存活率在95%以上。
1.4 分析测试方法鱼体、饲料原料及饲料常规成分分析参照AOAC法。其中,水分测定用105 ℃烘干恒重法;粗蛋白质含量的测定采用凯氏定氮法(JK9830,济南精密科学仪器仪表有限公司)测定;粗脂肪的测定采用索氏提取法(以石油醚为溶剂)测定;粗灰分的测定为550 ℃灼烧法(16 h,箱式电阻SX-410,北京市永光明医疗仪器有限公司)。总能的测定采用氧弹式能量仪(ZDHW-6,鹤壁市华泰仪器仪表有限公司)测定。
血清、肝脏、肠道和胃的生化指标均采用南京建成生物工程研究所生产的试剂盒,按照使用说明书进行操作。血清和肝脏中,溶菌酶(LZM)采用比浊法,过氧化氢酶(CAT)采用可见光法,谷胱甘肽过氧化氢酶(GSH-Px)及总抗氧化力(T-AOC)采用比色法,碱性磷酸酶(AKP)采用可见光比色法,补体C4采用免疫比浊法,超氧化物歧化酶(SOD)采用WST-1法,丙二醛(MDA)采用TBA法。
头肾巨噬细胞呼吸爆发活力测定参考SECOMBES等[12]的方法,巨噬细胞呼吸爆发活力用还原四氮唑蓝(NBT)的能力来衡量。取50 μL已制备好的头肾巨噬细胞悬液,加到96孔酶标板中,然后分别加入50 μL 1 mg/mL NBT[含1 μg/mL佛波醇肉豆蔻(PMA, Sigma)],在25 ℃反应40 min。然后加入无水甲醇终止反应并固定巨噬细胞,再用70%甲醇溶液冲洗2次,自然晾干后分别加入60 μL 2 mol/L KOH和70 μL DMSO,生成蓝色沉淀,在630 nm下检测吸光值(以KOH/DMSO为空白)。巨噬细胞吞噬活力用中性红检测,取100 μL头肾巨噬细胞悬液加到96孔酶标板中,每孔加入100 μL 0.01%中性红溶液,反应3 h后用PBS溶液冲洗3次,再加入细胞裂解液200 μL,室温静置1 h后,检测547 nm吸光度值(蒸馏水调零)。
根据GenBank中罗非鱼白细胞介素1β(interleukin 1β, IL-1β)和肿瘤坏死因子α(tumor necrosis factor α, TNF-α)的序列,设计引物。用罗非鱼的β -肌动蛋白(β-actin)作为内参基因,设计β-actin引物。所有引物经上海生工生物工程股份有限公司合成,引物序列见表 2。用TaKaRa公司试剂盒提取肝脏RNA,使用紫外分光光度计检测其浓度和纯度,1.0%琼脂糖电泳检测完整性。根据Fermentas公司ReverAidTM First Strand cDNA Synthesis Kit试剂盒说明书对提取RNA进行反转录。具体操作如下:取样本总RNA 55 μg,Oligo(dT)18 Primer 1 μL,加RNase Free dH2O至12 μL,混匀后,65 ℃下温育5 min取出置于冰上冷却,然后依次加入5×Reaction Buffer 4 μL,Ribo lockTM RNase Inhibitor 1 μL,dNTP Mixture 2 μL,RevertAidTM M-MμLV Reverse Transciptase 1 μL。混匀后,于PCR仪中:42 ℃,60 min;70 ℃,5 min进行反应,反应结束后获得cDNA作为荧光定量PCR模板。荧光定量PCR采用SYBR Green Ⅱ嵌合荧光法,PCR反应体系(20 μL): 包括SYBR Premix Ex TaqTM 10 μL,上下游引物各1 μL,cDNA 1 μL,Rnase/Dnase-free water 7 μL。荧光定量PCR反应程序如下:95 ℃预变性2 min;94 ℃变性30 s,60 ℃退火35 s,72 ℃延伸40 s,40个循环;95 ℃ 15 s,65 ℃ 15 s,95 ℃ 15 s。基因相对mRNA水平用2-ΔΔCt法检测。

|
表 2 引物序列 Tab.2 Primer sequences |
增重率、特定生长率、饲料系数的计算公式:
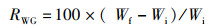 (1)
(1)
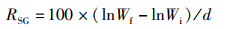 (2)
(2)
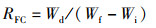 (3)
(3)
式中:RWG为增重率,%;RSG为特定生长率,%;RFC为饲料系数;Wf为试验结束时鱼末体质量,g;Wi为试验开始鱼初体质量,g;Wd为摄食干饲料重,g;d为养殖天数, d。
采用SPSS 17.0软件对数据进行单因素方差分析(ANOVA),当处理组之间差异显著(P < 0.05)时,用Duncan氏检验进行多重比较,试验结果以平均值±标准误(Means±SEM)表示。
2 结果 2.1 黄藤素对吉富罗非鱼生长性能的影响如表 3所示,黄藤素不同添加水平对各组罗非鱼末质量、增重率、特定生长率和饲料系数均无显著性差异(P>0.05)。随着饲料中黄藤素添加水平的提高,吉富罗非鱼体质量表现出逐渐上升的趋势。

|
表 3 黄藤素的不同添加水平对吉富罗非鱼生长指标的影响 Tab.3 Effects of different addition levels of palmatine on growth indexes of GIFT |
由表 4可知: 饲料中添加黄藤素对罗非鱼血清抗氧化能力有显著影响(P < 0.05);0.04%组SOD活性显著高于其他各组(P < 0.05);AKP、T-AOC活性随黄藤素添加水平的升高逐渐增加,在0.08%组达到最大值; GSH-Px和CAT活性未表现明显趋势,但在0.08%组达到最大值; MDA含量呈先下降后上升的趋势,在0.02%组为最低值。

|
表 4 黄藤素不同添加水平对吉富罗非鱼血清抗氧化能力的影响 Tab.4 Effects of different dietary palmatine levels on antioxidant capacity in serum of GIFT |
由表 5可知: 饲料中添加黄藤素对罗非鱼肝脏抗氧化能力有显著影响(P < 0.05);各试验组SOD、AKP和CAT活性显著高于对照组(P < 0.05),SOD和CAT在0.08%组中显著最高(P < 0.05),AKP在0.04%组显著最高(P < 0.05);0.08组GSH-Px活性显著高于对照组及其他处理组(P < 0.05);T-AOC随黄藤素添加水平的升高呈上升趋势,在0.04%组最高,显著高于对照组(P < 0.05);各试验组MDA含量均低于对照组。

|
表 5 黄藤素不同添加水平对吉富罗非鱼肝脏抗氧化能力的影响 Tab.5 Effects of different dietary palmatine levels on antioxidant capacity in liver of GIFT |
如表 6所示: 饲料中添加黄藤素能够提高吉富罗非鱼非特异性免疫能力; 各试验组LZM、补体C4水平均高于对照组; 黄藤素添加水平对罗非鱼头肾巨噬细胞呼吸暴发没有显著影响(P>0.05),但显著提高0.04%组巨噬细胞吞噬活性(P < 0.05);各试验组IL-1β和TNF -α基因表达量均高于对照组,IL-1β表达量在0.04%组最高(P < 0.05),TNF -α表达量在0.02%组达到最高。

|
表 6 黄藤素不同添加水平对吉富罗非鱼非特异性免疫能力的影响 Tab.6 Effects of different dietary palmatine levels on nonspecific immune capacity and immune related genes expression of GIFT |
植物生物碱是植物在生态适应过程中形成的代谢产物,具有生物活性多样性,但目前大多数学者主要关注生物碱的抑制和抵抗作用[13]。小檗碱与黄藤素均为异喹啉类生物碱,研究[14]表明在饲料中添加小檗碱能够显著提高团头鲂增重率和特定生长率,降低饲料系数。本实验中黄藤素未对吉富罗非鱼生长指标产生显著影响,但黄藤素添加量为0.08%时,其末质量与对照组相比升高了10%左右,且饲料系数有所降低, 推测黄藤素可能在促生长方面具有一定的作用,但由于添加剂量较小或试验时间较短不足以表现出其促生长作用。
鱼类作为变温、低等脊椎动物,与高等脊椎动物一样存在特异性免疫和非特异性免疫,但不同的是,由于免疫进化程度较低,鱼类免疫应答过程中主要依靠非特异性免疫发挥作用[15-16]。溶菌酶、补体C4、C4等免疫分子在免疫调节、介导炎症反应等方面发挥了至关重要的作用[17-19]。本试验中,随黄藤素添加量增加,LZM活性呈现出先升高后降低的趋势,补体C4含量随黄藤素添加量增加而上升,0.04%组头肾巨噬细胞吞噬活性显著高于对照组,表明适量添加黄藤素能够增强罗非鱼血清LZM活性,提高补体C4含量,提高头肾细胞的吞噬活性。曲木等[20]在饲料中添加党参、黄芪、野菊花,发现能够提高黄颡鱼血清补体含量。朱作金等[21]研究表明,黄藤素能提高大鼠中性粒细胞吞噬活性,提高非特异性免疫功能。虽然与本次试验对象不同,但相似的结果表明,黄藤素同样可以通过提高吉富罗非鱼巨噬细胞的吞噬活性,从而提高其非特异性免疫能力。
本试验中,0.04%组基因IL-1β表达量显著高于对照组,0.02%组基因TNF-α表达量显著高于对照组,表明饲料中添加适量的黄藤素可以通过促进吉富罗非鱼炎性细胞因子的表达来提高非特异性免疫。戴小连[22]试验结果表明饲料中添加黄芪能够显著提高石斑鱼头肾、肝脏、脾脏等器官中免疫相关基因的表达。王家敏[23]研究结果表明,添加一定剂量的复方中草药能够诱导吉富罗非鱼Hsp70、TNF-α和IL-1β基因在组织中表达,与本研究结果相似。
机体在正常状态下会产生一定量的自由基,并依靠自身抗氧化防御系统来维持自由基的动态平衡,当自由基生成增加或(和)清除能力降低,大量自由基在组织、器官中蓄积导致氧化损伤[24-26],而过量自由基刺激免疫细胞将导致免疫功能下降,从而影响免疫系统功能。目前,人类疾病领域研究发现,疾病的发生多与氧化应激及免疫功能低下相关,已初步明确机体抗氧化系统与免疫系统两者互相影响,其中,核转录因子-κB (NF-κB)信号通路是联系2个系统的重要途径。氧自由基(ROS)和NF-κB交联调控免疫系统和抗氧化系统:一方面,ROS活化NF-κB,诱导IL-1β、TNF-α等细胞因子表达,影响免疫系统;另一方面,免疫系统中NF-κB和细胞因子调节ROS积累,影响抗氧化系统。水产动物试验[27-28]结果表明,SOD、CAT和GSH-Px活性与IL-1β、TNF-α等细胞因子表达呈正相关。
抗氧化系统主要分为抗氧化酶系统和非酶抗氧化系统2种类型。T-AOC代表机体内总抗氧化系统功能状态,SOD、CAT、GSH-Px是抗氧化系统中主要的抗氧化酶,能够衡量机体抗氧化能力。孙裔雷等[29]对虹鳟的研究发现在饲料中添加中草药均能够提高SOD活性,显著降低MDA含量。梁拥军等[30]通过在宝石鲈饲料中添加复方中草药,发现复方中草药可显著提高宝石鲈血清和肝脏中SOD、LZM、CAT活性。本试验中,各试验组血清SOD、AKP、T-AOC均高于对照组,各试验组肝脏SOD、AKP、T-AOC、CAT均显著高于对照组,并与黄藤素添加量呈一定相关性。MDA作为自由基作用于脂质发生过氧化反应的产物,其含量的高低反映了脂质过氧化的速率和强度,间接反映机体清除自由基的能力和组织、器官损伤程度。本试验中,各处理组MDA含量均低于对照组。由此可知,饲料中添加适量黄藤素能够提高T-AOC及SOD和AKP活性,降低MDA含量,增强机体自由基清除能力,提高机体免疫力。
由上述试验结果可知,在试验添加范围内,添加黄藤素未对罗非鱼生长性能产生负面影响,能够增强罗非鱼巨噬细胞吞噬活性,提高炎症因子表达水平,介导炎症反应,发挥免疫系统功能,同时有效提高血清、肝脏中抗氧化酶活力,提高抗氧化能力。在本试验条件下,建议吉富罗非鱼饲料中黄藤素添加量为0.04%~0.08%。
| [1] |
高桂平. 日粮中添加4种传统中药方剂对吉富罗非鱼幼鱼的相关非特异性免疫和生长指标的影响[D]. 南宁: 广西大学, 2018. GAO G P. Effect of 4 traditional Chinese medicine formulas in diet on tilapla related non-specific immunity and growth index[D]. Nanning: Guangxi University, 2018. |
| [2] |
周疆, 郑凯妮, 朱斐. 中草药在水产动物免疫上的应用[J]. 浙江农林大学学报, 2019, 36(2): 406-414. ZHOU J, ZHENG K N, ZHU F. A review on application of Chinese herbal medicine additives in immunization of aquatic animals[J]. Journal of Zhejiang A & F University, 2019, 36(2): 406-414. |
| [3] |
陈融, 金清, 程磊, 等. 中草药对嗜水气单胞菌的抑制作用研究进展[J]. 水产养殖, 2019, 40(3): 11-15. CHEN R, JIN Q, CHENG L, et al. Research progress of inhibitory effect of Chinese herbal on Aeromonas hydrophila[J]. Journal of Aquaculture, 2019, 40(3): 11-15. DOI:10.3969/j.issn.1004-2091.2019.03.005 |
| [4] |
阿地拉·艾皮热, 张富春, 李金耀. 中草药免疫增强功能的研究进展[J]. 细胞与分子免疫学杂志, 2016, 32(3): 423-426. AIPIRE A D L, ZHANG F C, LI J Y. Advances in research on immune enhancement of Chinese herbal medicine[J]. Chinese Journal of Cellular and Molecular Immunology, 2016, 32(3): 423-426. |
| [5] |
王应霞, 杨桂梅, 胡艳文, 等. 黄藤素注射液抗脂多糖致小鼠急性肺损伤的作用[J]. 昆明医科大学学报, 2016, 37(12): 12-15. WANG Y X, YANG G M, HU Y W, et al. Protective effect of Fibrauretin injection against acute lung injury induced by lipopolysaccharide in mice[J]. Journal of Kunming Medical University, 2016, 37(12): 12-15. DOI:10.3969/j.issn.1003-4706.2016.12.003 |
| [6] |
李莉, 王应霞, 杨桂梅, 等. 黄藤素对急性肺损伤小鼠肺组织NF-κB蛋白表达和激活的影响[J]. 中国医药导报, 2019, 16(19): 7-10. LI L, WANG Y X, YANG G M, et al. Effect of Fibrauretin on the protein expression and activation of NF-κB in lung tissues of mice with acute lung injury[J]. China Medical Herald, 2019, 16(19): 7-10. |
| [7] |
于浩飞, 周敏, 吕小波, 等. 合成黄藤素与天然黄藤素药效对比实验研究[J]. 昆明医科大学学报, 2012, 33(9): 31-33, 46. YU H F, ZHOU M, LYU X B, et al. Comparative study of the efficacy of synthesized and natural Palmatine[J]. Journal of Kunming Medical University, 2012, 33(9): 31-33, 46. |
| [8] |
ZHOU X D, LIN X L, XIONG Y, et al. Chondroprotective effects of palmatine on osteoarthritis in vivo and in vitro: a possible mechanism of inhibiting the Wnt/β-catenin and Hedgehog signaling pathways[J]. International Immunopharmacology, 2016, 34: 129-138. DOI:10.1016/j.intimp.2016.02.029 |
| [9] |
董建英, 赵会兰. 黄藤素片微生物限度检查方法验证研究[J]. 中国执业药师, 2012, 9(5): 36-39. DONG J Y, ZHAO H L. The research on the method validation of microbial limit test for Huangtengsu tablets[J]. China Licensed Pharmacist, 2012, 9(5): 36-39. |
| [10] |
牛国一, 王秋举, 李珊珊, 等. 厚朴酚和黄藤素对鱼类3种常见致病菌的抑制效应[J]. 云南农业大学学报, 2015, 30(3): 402-407. NIU G Y, WANG Q J, LI S S, et al. Antibacterial effects of Magnolol and Palmatine on three common pathogenic bacteria in fish[J]. Journal of Yunnan Agricultural University, 2015, 30(3): 402-407. |
| [11] |
吕娜, 赵昱玮, 汲立伟, 等. 黄藤的研究进展[J]. 中国实验方剂学杂志, 2016, 22(19): 199-202. LYU N, ZHAO Y W, JI L W, et al. Review of Fibraurea recisa[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2016, 22(19): 199-202. |
| [12] |
SECOMBES C J, STOLEN J S, FLETCHER T C, et al. Isolation of salmoid macrophages and analysis of their killing activity[J]. Techniques in Fish Immunology, 1990(1): 137-154. |
| [13] |
高世虎, 徐辉筠, 王华光, 等. 生物碱对动植物生长促进作用的研究进展[J]. 江苏林业科技, 2013, 40(2): 39-42. GAO S H, XU H Y, WANG H G, et al. Research progress of the growth promoting effect of alkaloids[J]. Journal of Jiangsu Forestry Science & Technology, 2013, 40(2): 39-42. |
| [14] |
YU C B, ZHANG J, QIN Q, et al. Berberine improved intestinal barrier function by modulating the intestinal microbiota in blunt snout bream (Megalobrama amblycephala) under dietary high-fat and high-carbohydrate stress[J]. Fish & Shellfish Immunology, 2020, 102: 336-349. |
| [15] |
白姗姗, 贾智英, 石连玉. 鱼类免疫应答机制研究进展[J]. 水产学杂志, 2017, 30(4): 59-67. BAI S S, JIA Z Y, SHI L Y. Research progress of immune response mechanisms in fish[J]. Chinese Journal of Fisheries, 2017, 30(4): 59-67. |
| [16] |
张媛媛, 宋理平. 鱼类免疫系统的研究进展[J]. 河北渔业, 2018(2): 49-56. ZHANG Y Y, SONG L P. Research advances in fish immune system[J]. Hebei Fisheries, 2018(2): 49-56. |
| [17] |
SAURABH S, SAHOO P K. Lysozyme: an important defence molecule of fish innate immune system[J]. Aquaculture Research, 2008, 39(3): 223-239. |
| [18] |
DONG J J, WU F, YE X, et al. β-defensin in Nile tilapia (Oreochromis niloticus): sequence, tissue expression, and anti-bacterial activity of synthetic peptides[J]. Gene, 2015, 566(1): 23-31. |
| [19] |
CHEN Y Y, ZHAO H, ZHANG X S, et al. Identification, expression and bioactivity of Paramisgurnus dabryanus β-defensin that might be involved in immune defense against bacterial infection[J]. Fish & Shellfish Immunology, 2013, 35(2): 399-406. |
| [20] |
曲木, 黄成, 张宝龙, 等. 复方中草药对黄颡鱼生长、肉质及血清中补体C3、补体C4含量的影响[J]. 中国饲料, 2018(19): 74-79. QU M, HUANG C, ZHANG B L, et al. Effects of compound Chinese traditional drug on the growth performance, muscle quality and complement C3, complement C4 content in serum of Pelteobagrus fulvidraco[J]. China Feed, 2018(19): 74-79. |
| [21] |
朱作金, 柯美珍, 李逢春, 等. 黄藤素对大鼠免疫功能的影响[J]. 广西医科大学学报, 1995, 12(4): 518-519. ZHU Z J, KE M Z, LI F C, et al. Effects of Fibrauretinum on the immunological functions of rats[J]. Journal of Guangxi Medical University, 1995, 12(4): 518-519. |
| [22] |
戴小连. 褐点石斑鱼天然免疫增强剂筛选及黄芪对其免疫功能影响研究[D]. 海口: 海南大学, 2012. DAI X L. Selection of natural immune enhancer for Epinephelus fuscoguttatus and the effects of Astragalus membranaceus on its immune function[D]. Haikou: Hainan University, 2012. |
| [23] |
王家敏. 复方中草药对吉富罗非鱼免疫相关基因表达的影响[D]. 湛江: 广东海洋大学, 2011. WANG J M. Effects of a traditional Chinese medicine on the expression of immune related genes in GIFT strain of Nile tilapia (Oreochromis niloticus)[D]. Zhanjiang: Guangdong Ocean University, 2011. |
| [24] |
赵珂立. 氧化应激对动物自由基代谢、消化道损伤及抗氧化剂干预作用的研究[D]. 上海: 上海交通大学, 2011. ZHAO K L. Effects of composite antioxidants on oxidative stress and intestinal tract in animals[D]. Shanghai: Shanghai Jiao Tong University, 2011. |
| [25] |
刘淑兰, 翟少伟. 氧化应激对鱼类的影响及其模型的研究进展[J]. 饲料博览, 2012(2): 48-51. LIU S L, ZHAI S W. Research progress of effects of oxidative stress on fish and oxidative stress model[J]. Feed Review, 2012(2): 48-51. |
| [26] |
SOHAL R S, ALLEN R G. Oxidative stress as a causal factor in differentiation and aging: a unifying hypothesis[J]. Experimental Gerontology, 1990, 25(6): 499-522. |
| [27] |
SINGARAM G, HARIKRISHNAN T, CHEN F Y, et al. Modulation of immune-associated parameters and antioxidant responses in the crab (Scylla serrata) exposed to mercury[J]. Chemosphere, 2013, 90(3): 917-928. |
| [28] |
XU H, SHAO X L, ZHANG Z, et al. Oxidative stress and immune related gene expression following exposure to di-n-butyl phthalate and diethyl phthalate in Zebrafish embryos[J]. Ecotoxicology and Environmental Safety, 2013, 93: 39-44. |
| [29] |
孙裔雷, 王荻, 刘红柏. 复方中草药对虹鳟抗氧化能力的影响[J]. 大连海洋大学学报, 2015, 30(2): 170-174. SUN Y L, WANG D, LIU H B. Effects of dietary Chinese herbal medicine compounds on antioxidant capacity in rainbow trout[J]. Journal of Dalian Ocean University, 2015, 30(2): 170-174. |
| [30] |
梁拥军, 孙向军, 孙砚胜, 等. 复方中草药对宝石鲈抗氧化能力及免疫功能的影响[J]. 安徽农业科学, 2009, 37(15): 7026-7029. LIANG Y J, SUN X J, SUN Y S, et al. Effect of the compound Chinese herbal medicine on the antioxidant capacity and immune function of Perch[J]. Journal of Anhui Agricultural Sciences, 2009, 37(15): 7026-7029. |
 2021,
Vol. 30
2021,
Vol. 30


