2. 集美大学水产学院, 福建 厦门 361021;
3. 广东海洋大学水产学院, 广东 湛江 524088;
4. 中国海洋大学水产学院, 山东 青岛 266100;
5. 广东海洋大学南海渔业资源监测与评估中心, 广东 湛江 524088;
6. 广东省南海深远海渔业管理与捕捞工程技术研究中心, 广东 湛江 524088
头足类作为世界许多国家沿海手工渔业的目标物种和副渔获,是重要的经济渔业种类[1]。在近海渔业资源衰退的情况下,头足类资源仍能够保持较高的产量,因此其重要性也日益得到重视。由于头足类的生命周期短和生长率波动较大等特点,使得其资源具有脆弱性和波动性[2]。目前世界上针对头足类的评估方法有很多,但只有少数头足类种群得到良好的管理[3]。
鸢乌贼(Sthenoteuthis oualaniensis)属于暖水性较强的大洋性头足类[4], 分布于印度洋[5]、太平洋的赤道和亚热带等海域[6], 在南海和印度洋西北海域的资源量比较丰富[7-8]。其中,光诱资源量模型评估南海鸢乌贼资源量为204.94万t, 总可捕量为99.40万t, 具有较大开发潜力,是目前南海深远海开发的主要种类之一[8-9]。有学者利用耳石[10]、角质颚[11-13]和内壳[14]对鸢乌贼生长进行探讨。利用耳石研究年龄是一种估算生长参数的有效方法[15]。基于内壳研究发现,阿拉伯海域鸢乌贼生长周期约为1年,且雌性生长快于雄性[14]。CHEMBIAN等[16]利用长度转换渔获曲线方法估算死亡系数,并很好地反映了印度洋西北海域鸢乌贼的生长死亡状况。关于南海鸢乌贼死亡系数估计的研究,仅WANG等[17]估算了南海北部鸢乌贼自然死亡系数和开发率。目前南海鸢乌贼群体状况研究仍存不足,因此,本研究通过对生长参数和死亡系数进行评估,为南海鸢乌贼资源评估提供重要参考。
利用南海采集的鸢乌贼样本的胴长与体质量数据拟合鸢乌贼胴长与体质量关系方程,使用FisatⅡ软件中ELEFAN Ⅰ和长度转换渔获曲线方法分别估计VB生长方程参数和死亡系数。研究结果能更好地了解鸢乌贼在南海的生长情况和生物学特性,有助于该资源的可持续开发和管理。
1 材料与方法 1.1 样本采集及实验样本来源于南海的4艘灯光罩网渔船(琼儋州15029、桂防渔97819、桂北渔80208和桂北渔62182), 采样时间为2011—2015年,采样分为2个海域(北部海域:中西沙—东沙海域,16°N~20°N和109°E~117°E; 南部海域:中西沙—南沙海域,6°N~14°N和109°E~115°E), 样本共计7 757尾。样品保存于-25 ℃冷冻舱,返回陆地后带回实验室按《海洋调查规范》(GB/T 12763.6—2007)测量胴长(Mantle length, ML)和体质量(Body mass, BM), 胴长精确至0.1 cm, 体质量精确至0.1 g, 并判别雌雄。
1.2 数据分析根据胴长和体质量数据建立幂函数方程,估计胴长和体质量关系的生长参数。决定系数(R2)反映胴长和体质量关系方程的拟合程度。根据幂指数b判断生长类型,b=3为等速生长,b < 3为负异速生长,b > 3为正异速生长[18-19]。
胴长与体质量幂函数方程为
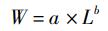 (1)
(1)
式中:W为体质量,g; L为胴长,cm。
根据2011—2015年南海2个海域的胴长频率数据估计von Bertalanffy生长方程,组距为1 cm, 用Fisat Ⅱ软件中的ELEFAN Ⅰ方法估计方程生长参数K和极限胴长L∞[20]。通过长度变换渔获曲线法(length-converted catch curve, LCCC)估算总死亡系数(Z)、自然死亡系数(M)、捕捞死亡系数(F)和开发率(E)[20]。根据经验估计年平均栖息水温(T), 北部海域为27 ℃, 南部海域为29 ℃, 整体为28 ℃。
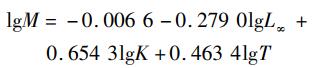 (2)
(2)
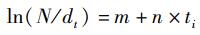 (3)
(3)
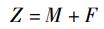 (4)
(4)
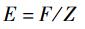 (5)
(5)
式中:N为胴长组i的尾数;t为通过胴长组i生长所需的时间,d; ti为胴长组i的相对日龄(计算值t0=0 d), d; m和n是总死亡系数估计参数。
对胴长和体质量参数进行显著性分析,包括独立样本t检验和非参数独立样本t检验方法。统计检验结果显示,性别和年份间南海鸢乌贼胴长和体质量存在显著性差异。
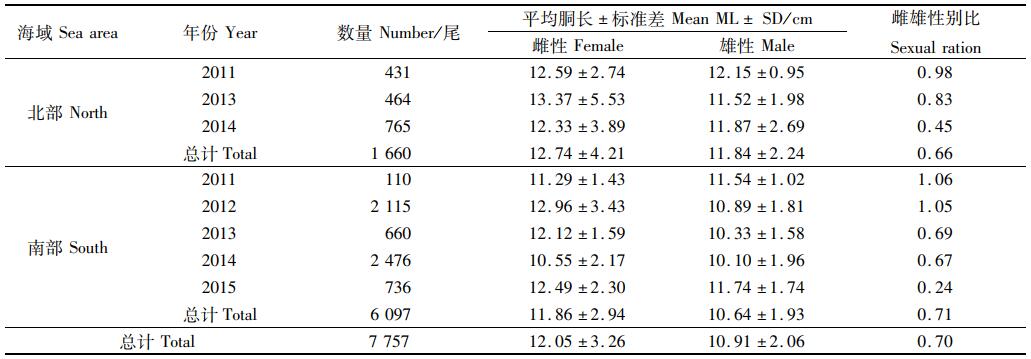
2 结果 2.1 不同海域胴长组成差异北部海域和南部海域雌雄性别比都出现逐年下降的趋势,其中2011和2012年接近1, 2014和2015年甚至低于0.5。雌性和雄性平均胴长北部海域比南部海域大,且雌性比雄性大,总平均胴长为12.05 cm(表 1)。
|
表 1 不同海域鸢乌贼胴长组成 Tab.1 Composition of mantle length of S. oualaniensis in different areas |
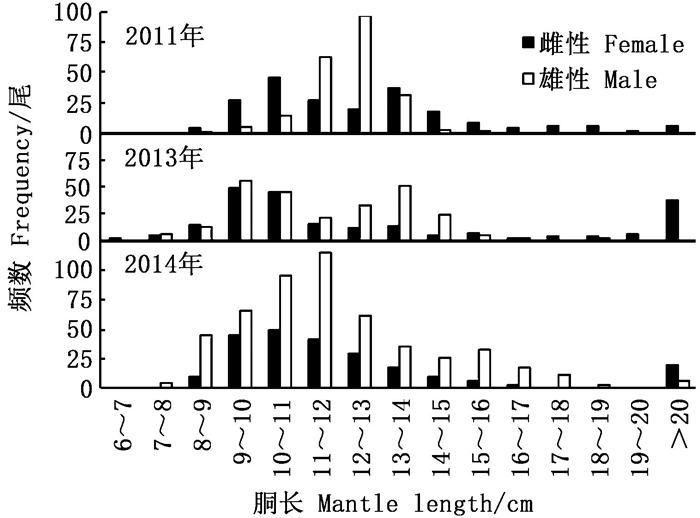
2011、2013和2014年北部海域雌性优势胴长组分别为9~14 cm(74.18%)、9~11 cm(44.55%)和9~13 cm(69.87%), 雄性优势胴长组分别为11~14 cm(88.07%)、9~14 cm(81.42%)和9~13 cm(64.45%), 见图 1。
|
图 1 2011、2013和2014年北部海域胴长组频数分布 Fig. 1 Frequency distribution of mantle length from the north sea area in 2011, 2013 and 2014 |
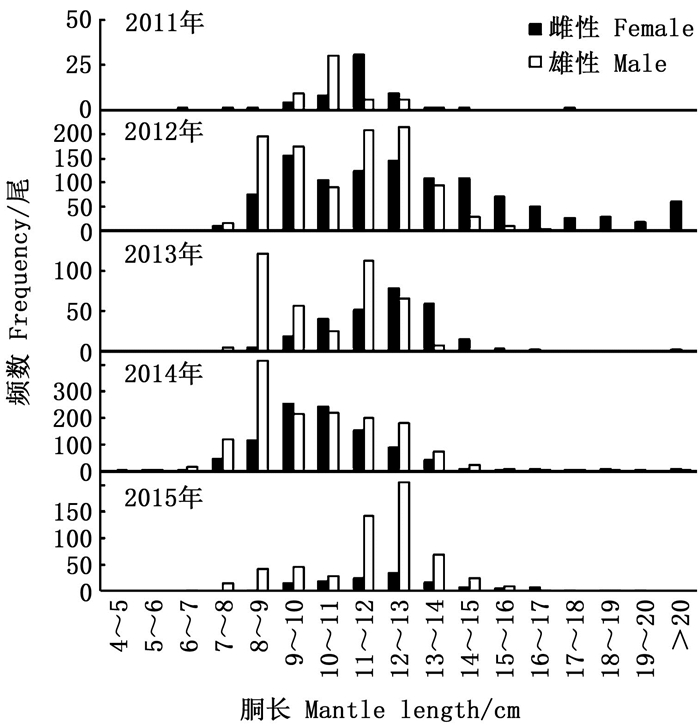
2011—2015年南部海域雌性优势胴长组分别为10~13 cm(84.21%)、9~15 cm(69.20%)、10~14 cm(84.44%)、8~12 cm(76.98%)和9~14 cm(79.17%), 雄性优势胴长组分别为9~13 cm(96.23%)、8~13 cm(85.59%)、8~13 cm(97.18%)、8~13 cm(83.25%)和11~14 cm(70.27%), 见图 2。
|
图 2 2011—2015年南部海域胴长组频数分布 Fig. 2 Frequency distribution of mantle length from the south sea area from 2011 to 2015 |
大部分决定系数(R2)大于0.9, 其中2011年北部和南部海域雄性鸢乌贼均达不到0.9, 且2013年北部海域达不到0.9。北部和南部海域雌性b值范围分别为3.440~3.649和3.394~3.836, 雄性b值分别为3.452~3.695和3.385~3.839(表 2)。
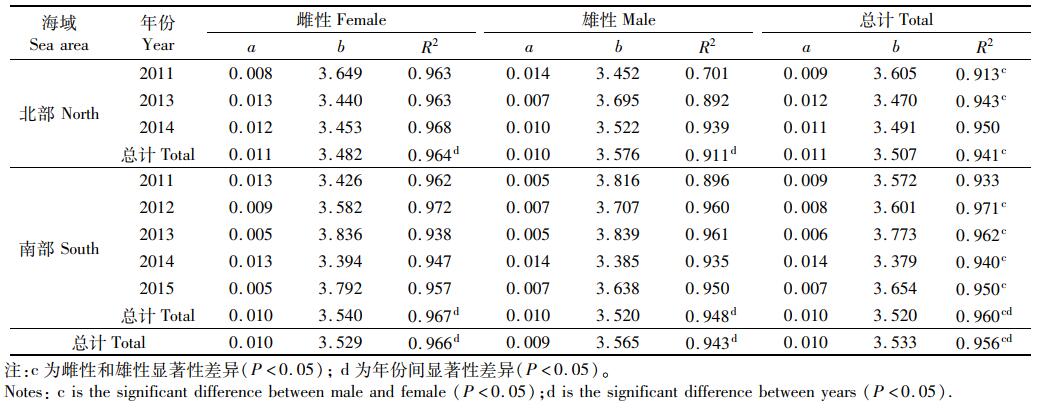
|
表 2 2011—2015年南海不同海域鸢乌贼胴长-体质量关系参数 Tab.2 Parameters of ML-BW relationship for S. oualaniensis from 2011 to 2015 |
根据LCCC方法估计死亡系数,开始阶段资源未充分开发利用和末尾阶段数量少且接近极限体长,不能用于回归分析。性别间总死亡系数、自然死亡系数、捕捞死亡系数和开发率有所不同。总死亡系数范围为0.60~4.83, 自然死亡系数范围为0.58~2.03, 捕捞死亡系数范围为0.02~2.80, 开发率范围为0.04~0.58(表 3)。
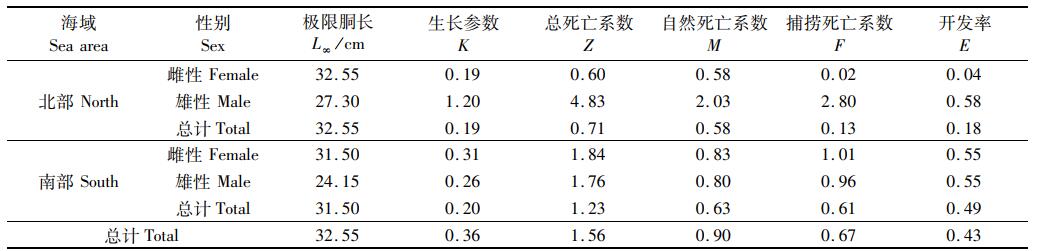
|
表 3 南海2个海域鸢乌贼死亡系数参数 Tab.3 Mortality parameter of the squid in two sea areas in the South China Sea |
本研究中鸢乌贼平均胴长北部海域比南部海域大,且雌性比雄性大(表 1)。不同海域个体大小存在差异,伯格曼法则表明低纬度的生物个体往往更小[21]。纬度上年平均海水表层温度差异是造成2个海域个体大小差异的原因之一,且一系列研究[22-23]表明,鱿鱼生长速度与水温存在相关关系。雌性平均胴长比雄性偏大,这是由于雄性性成熟比雌性早[1, 24], 且排精后死亡[25-26], 雌性性成熟比雄性迟,大个体中雌性占大部分,且存在同类相食现象[27]。
鸢乌贼种群划分为大型群、中型群、小型群和微型群,其中中型群根据内壳又可分为单轴群和双轴群[5]。中型群体在所有调查海域均有分布,微型群体仅分布在赤道附近海域[28], 中型群和微型群在南海南沙海域大量分布[29]。本研究鸢乌贼个体胴长范围为4.6~31.2 cm, 其中胴长大于20 cm的个体仅占1.80%。招春旭等[30]发现,南海未发现胴长超过35 cm的鸢乌贼个体。已有调查发现南海并没有大型群,且灯光罩网作业方式捕获的个体偏小。
3.2 生长关系大洋性头足类具有生长速率快,生命周期短的特点,鸢乌贼作为大洋性头足类的一种,生长速率较快[30-34]。本研究中个体生长参数b均大于3, 属于正异速生长类型,与南海的其他研究结果一致[17], 不同于印度洋鸢乌贼的负异速生长类型[35]。南海和印度洋出现不同的生长类型,其中栖息环境不同是造成差异的主要原因,且印度洋海域鸢乌贼个体较大,南海个体较小,仅代表一个阶段的生长状况[35]。von Bertalanffy生长方程参数K直接决定个体接近极限胴长的速度[19]。整体上生长参数K为0.36, 南部海域雌性和雄性生长参数K差别不大,北部海域雌性稍微比南部海域雌性小,且北部海域雄性异常大(表 3), 说明北部海域雄性群体的生长状况比较好,该海域较为适合雄性生长。比较胴长-体质量关系中与环境相关的生长参数a, 北部海域大于南部海域,同样说明北部海域的环境更适合于鸢乌贼生长。南海整体上属于贫营养海域,叶绿素浓度较低,但南海北部更靠近大陆架海域,饵料相对于南海南部海域更容易得到补充[36-37]。
3.3 死亡系数比较生长参数和死亡系数是影响群体资源变动的主要指标,死亡系数反映个体从资源群体中消失的状况[38]。长度变换渔获曲线法是估算死亡系数的常见方法,较好地反映了鱼类的真实情况[19, 39], 该方法在头足类的应用上也得到证实是可行的[16-17]。本研究中,整体上总死亡系数为1.56, 南部海域雌性和雄性Z差别不大,但北部海域雌性(0.60)远小于雄性(4.83), 且在北部海域雌性鸢乌贼捕捞死亡系数和开发率接近0(表 3)。除北部海域雌性外,其他群体自然死亡系数和捕捞死亡系数较为接近。北部海域雌性和雄性个体死亡系数的差异,可能与产卵活动有关,一方面西沙群岛附近海域可能存在鸢乌贼产卵场,另一方面该海域雌性个体可能栖息于更深的海域以致于灯光罩网的捕捞方式并不能较好的捕获,需要进一步验证。北部海域雄性鸢乌贼与南部海域鸢乌贼个体的开发率在0.5左右,但北部海域雌性鸢乌贼个体开发率远小于0.5, 仅为0.04(表 3)。这说明北部海域鸢乌贼资源尚未充分开发,且2个海域开发不均匀,这与渔业管理政策中“南沙作业补贴”有关,该政策在一定程度使渔民更偏向于在南海南部作业。
基于北斗星通渔业信息采集系统建立光诱资源评估模型,估计鸢乌贼总资源量为204.94万t和可捕量为99.40万t[9]。渔业声学和鱿钓采样相结合的方式评估的南海鸢乌贼的资源量是150万t[40]。由此可见,南海鸢乌贼资源开发潜力较大,合理安排作业时间和地点,降低成本和增加渔民的经济效益,在一定程度上能够解决近海捕捞压力大的问题[41]。
| [1] |
BOYLE P, RODHOUSE P. Cephalopods: ecology and fisheries[M]. Oxford: UK: Blackwell Science, 2005: 452.
|
| [2] |
PIERCE G J, ALLCOCK L, BRUNO I, et al. Cephalopod biology and fisheries in Europe[J]. ICES Cooperative Research Report 303, 2010, 175. |
| [3] |
PIERCE G J, GUERRA A. Stock assessment methods used for cephalopod fisheries[J]. Fisheries Research, 1994, 21(1/2): 255-285. |
| [4] |
陈新军, 钱卫国, 刘必林, 等. 主要经济大洋性鱿鱼资源渔场生产性调查与渔业概况[J]. 上海海洋大学学报, 2019, 28(3): 344-356. CHEN X J, QIAN W G, LIU B L, et al. Productive survey and fishery for major pelagic economic squid in the world[J]. Journal of Shanghai Ocean University, 2019, 28(3): 344-356. |
| [5] |
NESIS K N. Population structure of oceanic Ommastrephids, with particular reference to Sthenoteuthisoualaniensis: a review[M]//OKUTANI T, O'DOR RK, KUBODERA T. Recent Advances in Fisheries Biology. Tokyo: Tokai University Press, 1993: 375-383.
|
| [6] |
NIGMATULLIN C M. Resources and perspectives of the fisheries of nektonic epipelagic squids in the World Ocean[C]//All-USSR Conf: On Reserve Food Biological Resources of the Open Ocean and the USSR Seas. 1990: 11-13.
|
| [7] |
陈新军, 叶旭昌. 印度洋西北部海域鸢乌贼渔场与海洋环境因子关系的初步分析[J]. 上海水产大学学报, 2005, 14(1): 55-60. CHEN X J, YE X C. Preliminary study on the relationship between fishing ground of Symlectoteuthis oualaniensis and environmental factors in northwestern Indian Ocean[J]. Journal of Shanghai Fisheries University, 2005, 14(1): 55-60. |
| [8] |
张鹏, 杨吝, 张旭丰, 等. 南海金枪鱼和鸢乌贼资源开发现状及前景[J]. 南方水产, 2010, 6(1): 68-74. ZHANG P, YANG L, ZHANG X F, et al. The present status and prospect on exploitation of tuna and squid fishery resources in South China Sea[J]. South China Fisheries Science, 2010, 6(1): 68-74. |
| [9] |
冯波, 颜云榕, 张宇美, 等. 南海鸢乌贼(Sthenoteuthis oualaniensis) 资源评估的新方法[J]. 渔业科学进展, 2014, 35(4): 1-6. FENG B, YAN Y R, ZHANG Y M, et al. A new method to assess the population of Sthenoteuthis oualaniensis in South China Sea[J]. Progress in Fishery Sciences, 2014, 35(4): 1-6. |
| [10] |
刘必林, 陈新军, 钟俊生. 采用耳石研究印度洋西北海域鸢乌贼的年龄、生长和种群结构[J]. 大连水产学院学报, 2009, 24(3): 206-212. LIU B L, CHEN X J, ZHONG J S. Age, growth and population structure of squid Sthenoteuthis oualaniensis in northwest Indian Ocean by statolith microstructure[J]. Journal of Dalian Fisheries University, 2009, 24(3): 206-212. |
| [11] |
刘必林, 陈新军. 印度洋西北海域鸢乌贼角质颚长度分析[J]. 渔业科学进展, 2010, 31(1): 8-14. LIU B L, CHEN X J. Beak length analysis of the purpleback flying squid Sthenoeuthis oualaniensis in Northwest Indian Ocean[J]. Progress in Fishery Sciences, 2010, 31(1): 8-14. |
| [12] |
FANG Z, XU L L, CHEN X J, et al. Beak growth pattern of purpleback flying squid Sthenoteuthis oualaniensis in the eastern tropical Pacific equatorial waters[J]. Fisheries Science, 2015, 81(3): 443-452. DOI:10.1007/s12562-015-0857-8 |
| [13] |
LIU B L, CHEN X J, WANG X H, et al. Geographic, intraspecific and sexual variation in beak morphology of purpleback flying squid (Sthenoteuthis oualaniensis) throughout its distribution range[J]. Marine and Freshwater Research, 2019, 70(3): 417-425. DOI:10.1071/MF18078 |
| [14] |
BIZIKOV V A. Growth of Sthenoteuthis oualaniensis, using a new method based on gladius microstructure[J]. ICES Marine Science Symposia, 1995, 199: 445-458. |
| [15] |
马金, 刘必林, 陈新军, 等. 利用耳石鉴定头足类年龄与生长研究进展[J]. 海洋渔业, 2009, 31(3): 316-324. MA J, LIU B L, CHEN X J, et al. Advances on using statolith to study age and growth of cephalopod[J]. Marine Fisheries, 2009, 31(3): 316-324. |
| [16] |
CHEMBIAN A J, MATHEW S. Growth and mortality of the oceanic squid Sthenoteuthis oualaniensis (Lesson, 1830) off south-west coast of India[J]. Indian Journal of Fisheries, 2016, 63(1): 27-34. |
| [17] |
WANG X H, QIU Y S, ZHANG P, et al. Natural mortality estimation and rational exploitation of purpleback flying squid Sthenoteuthis oualaniensis in the southern South China Sea[J]. Chinese Journal of Oceanology and Limnology, 2017, 35(4): 902-911. DOI:10.1007/s00343-017-6115-4 |
| [18] |
SANTOS M N, GASPAR M B, VASCONCELOS P, et al. Weight-length relationships for 50 selected fish species of the Algarve coast (southern Portugal)[J]. Fisheries Research, 2002, 59(1/2): 289-295. |
| [19] |
WANG X H, QIU Y S, DU F Y, et al. Population parameters and dynamic pool models of commercial fishes in the Beibu Gulf, northern South China Sea[J]. Chinese Journal of Oceanology and Limnology, 2012, 30(1): 105-117. DOI:10.1007/s00343-012-1017-y |
| [20] |
GAYANILO JR F C, SPARRE P, PAULY D. FAO-ICLARM stock assessment tools Ⅱ (FiSAT Ⅱ). User's guide[M]. Rome: FAO, 2005: 53-56, 88-94.
|
| [21] |
BLANCHET S, GRENOUILLET G, BEAUCHARD O, et al. Non-native species disrupt the worldwide patterns of freshwater fish body size: implications for Bergmann's rule[J]. Ecology Letters, 2010, 13(4): 421-431. DOI:10.1111/j.1461-0248.2009.01432.x |
| [22] |
JACKSON G D, CHOAT J H. Growth in tropical cephalopods: an analysis based on statolith microstructure[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1992, 49(2): 218-228. DOI:10.1139/f92-026 |
| [23] |
BRODZIAK J K T, MACY III M K. Growth of long-finned squid, Loligo pealei, in the northwest Atlantic[J]. Fishery Bulletin, 1996, 94(2): 212-236. |
| [24] |
刘必林, 陈新军, 田思泉, 等. 西南大西洋公海阿根廷滑柔鱼性成熟的初步研究[J]. 上海水产大学学报, 2008, 17(6): 721-725. LIU B L, CHEN X J, TIAN S Q, et al. Sex maturity of Illex argentinus in the high sea waters of southwest Atlantic[J]. Journal of Shanghai Fisheries University, 2008, 17(6): 721-725. |
| [25] |
董正之. 中国动物志-软体动物门, 头足纲[M]. 北京: 科学出版社, 1988: 24. DONG Z Z. Fauna Sinica-phylum Mollusca-class Cephalopode[M]. Beijing: Science Press Beijing, 1988: 24. |
| [26] |
江淼. 南海鸢乌贼资源现状及发展对策研究[D]. 天津: 天津农学院, 2018. JIANG M. The current situation and countermoves on development and utilization of Sthenoteuthis oualaniensisin South China Sea[D]. Tianjin: Tianjin Agricultural University, 2018. |
| [27] |
张宇美, 颜云榕, 卢伙胜, 等. 西沙群岛海域鸢乌贼摄食与繁殖生物学初步研究[J]. 广东海洋大学学报, 2013, 33(3): 56-64. ZHANG Y M, YAN Y R, LU H S, et al. Study on feeding and reproduction biology of purple flying squid, Sthenoteuthis oualaniensis in the western South China Sea[J]. Journal of Guangdong Ocean University, 2013, 33(3): 56-64. |
| [28] |
NESIS K N. Cephalopods of the world: squids, cuttlefishes, octopusesand allies[M]. New Jersey: TFH Publications, 1987: 351-352.
|
| [29] |
张鹏, 晏磊, 杨炳忠, 等. 春季南沙海域鸢乌贼种群结构特征的研究[J]. 南方水产科学, 2015, 11(5): 11-19. ZHANG P, YAN L, YANG B Z, et al. Population structure of purpleback flying squid (Sthenoteuthis oualaniensis) in Nansha area in spring[J]. South China Fisheries Science, 2015, 11(5): 11-19. |
| [30] |
招春旭, 陈昭澎, 何雄波, 等. 基于耳石微结构的南海春季鸢乌贼日龄、生长与种群结构的研究[J]. 水生生物学报, 2017, 41(4): 884-890. ZHAO C X, CHEN Z P, HE X B, et al. Age, growth and population structure of purpleback flying squid, Sthenoteuthis oualaniensis in the South China Sea in spring based on statolith microstructure[J]. Acta Hydrobiologica Sinica, 2017, 41(4): 884-890. |
| [31] |
NESIS K N. Population structure in the squid Sthenoteuthis oualaniensis (Lesson, 1830) (Ommastrephidae) in the western tropical Pacific[J]. Trudy Instituta Okeanologii, 1977, 107: 15-29. |
| [32] |
ZUYEV G, NIGMATULLIN C, CHESALIN M, et al. Main results of long-term worldwide studies on tropical nektonic oceanic squid genus Sthenoteuthis: an overview of the Soviet investigations[J]. Bulletin of Marine Science, 2002, 71(2): 1019-1060. |
| [33] |
CHEN X J, LIU B L, TIAN S Q, et al. Fishery biology of purpleback squid, Sthenoteuthis oualaniensis, in the northwest Indian Ocean[J]. Fisheries Research, 2007, 83(1): 98-104. |
| [34] |
LIU B L, CHEN X J, LI J H, et al. Age, growth and maturation of Sthenoteuthis oualaniensis in the eastern tropical Pacific Ocean by statolith analysis[J]. Marine and Freshwater Research, 2016, 67(12): 1973-1981. |
| [35] |
CHEMBIAN A J, MATHEW S. Population structure of the purpleback squid Sthenoteuthis oualaniensis (Lesson, 1830) along the south-west coast of India[J]. Indian Journal of Fisheries, 2014, 61(3): 20-28. |
| [36] |
TANG D L, KAWAMURA H, LEE M A, et al. Seasonal and spatial distribution of chlorophyll-a concentrations and water conditions in the Gulf of Tonkin, South China Sea[J]. Remote Sensing of Environment, 2003, 85(3): 475-483. |
| [37] |
SHEN C Y, YAN Y R, ZHAO H, et al. Influence of monsoonal winds on chlorophyll-α distribution in the Beibu Gulf[J]. PLoS One, 2018, 13(1): e0191051. |
| [38] |
詹秉义. 渔业资源评估[M]. 北京: 中国农业出版社, 1995: 109-113. ZHAN B Y. Fishery resource assessment[M]. Beijing: China Agriculture Press, 1995: 109-113. |
| [39] |
耿平. 北部湾典型鱼类种群生长、死亡及开发状态的年际变化研究[D]. 上海: 上海海洋大学, 2019. GENG P. Study of inter-annual changes in growth, mortality and exploitation rate of representative fish stocks in Beibu gulf[D]. Shanghai: Shanghai Ocean University, 2019. |
| [40] |
范江涛, 张俊, 冯雪, 等. 南沙海域鸢乌贼渔场与海洋环境因子的关系[J]. 上海海洋大学学报, 2019, 28(3): 419-426. FAN J T, ZHANG J, FENG X, et al. Relationship between Sthenoteuthis oualaniensis fishing ground and marine environmental factors in Nansha area[J]. Journal of Shanghai Ocean University, 2019, 28(3): 419-426. |
| [41] |
招春旭, 邱星宇, 何雄波, 等. 南海春季月相、水深、作业时间与鸢乌贼CPUE的关系[J]. 水产学报, 2019, 43(11): 2372-2382. ZHAO C X, QIU X Y, HE X B, et al. Relationship between lunar phase, water depth and operation time andCPUE of purpleback flying squid (Sthenoteuthis oualaniensis) inSouth China Sea in spring[J]. Journal of Fisheries of China, 2019, 43(11): 2372-2382. |
2. Fisheries College, Jimei University, Xiamen 361021, Fujian, China;
3. Fisheries College, Guangdong Ocean University, Zhanjiang 524088, Guangdong, China;
4. Fisheries College, Ocean University of China, Qingdao 266100, Shandong, China;
5. Center of South China Sea Fisheries Resources Monitoring and Assessment, Guangdong Ocean University, Zhanjiang 524088, Guangdong, China;
6. Guangdong Provincial Engineering and Technology Research Center of Far Sea Fisheries Management and Fishing of South China Sea, Zhanjiang 524088, Guangdong, China
 2021,
Vol. 30
2021,
Vol. 30


