2. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
 肌间刺形成有一定的相关性。为了进一步探究MsxC基因在肌间刺形成中的作用, 利用CRISPR/Cas9基因编辑技术, 建立斑马鱼MsxC基因纯合突变体(MsxC-/-)。结果表明: 与野生型斑马鱼相比, MsxC-/-斑马鱼尾部的髓弓小骨和脉弓小骨平均缩短15%以上, 差异极显著, 而躯干部的肌间刺长度则无明显差异; MsxC-/-斑马鱼大侧肌肌隔周围白肌细胞分布疏松, 且排列混乱, 越靠近尾部差异越明显; MsxC-/-突变体红肌面积增大, 越靠近尾部, 红肌面积增大越明显, 尾部红肌面积增大2.22%(P < 0.01), 而躯干靠前部位面积增大0.97%(P < 0.05)。这表明, MsxC基因的缺失既影响了肌间刺的形成, 同时也影响了大侧肌的发育。
肌间刺形成有一定的相关性。为了进一步探究MsxC基因在肌间刺形成中的作用, 利用CRISPR/Cas9基因编辑技术, 建立斑马鱼MsxC基因纯合突变体(MsxC-/-)。结果表明: 与野生型斑马鱼相比, MsxC-/-斑马鱼尾部的髓弓小骨和脉弓小骨平均缩短15%以上, 差异极显著, 而躯干部的肌间刺长度则无明显差异; MsxC-/-斑马鱼大侧肌肌隔周围白肌细胞分布疏松, 且排列混乱, 越靠近尾部差异越明显; MsxC-/-突变体红肌面积增大, 越靠近尾部, 红肌面积增大越明显, 尾部红肌面积增大2.22%(P < 0.01), 而躯干靠前部位面积增大0.97%(P < 0.05)。这表明, MsxC基因的缺失既影响了肌间刺的形成, 同时也影响了大侧肌的发育。肌间刺又称肌间小骨、肌间骨,位于肌间隔中,由肌隔结缔组织骨化而成[1]。肌间刺仅存在于真骨鱼类中,尤其是低等真骨鱼类较为普遍存在肌间刺,如日本鳗鲡(Anguilla japonica)[2]、鲢(Hypophthalmichthys molitrix)[3]、鳙(Aristichthys nobilis)[4]、团头鲂(Megalobrama amblycephala)[5]、斑马鱼(Danio rerio)[6]等。肌间刺形成发生在鱼类胚后发育阶段,如斑马鱼、瓯江彩鲤(Cyprinus carpio)的肌间刺骨化时间在受精后32~53 d(days post fertilization, dpf)[6-7],鲢肌间刺骨化时间在43~55 dpf [3],唇
MsxC(muscle segment homeobox C)基因属于Hox基因家族。在脊椎动物中,其与骨形态发生蛋白、成纤维细胞生长因子及其受体、Dlx(distallessgene)、转化生长因子等共同参与上皮-间充质的相互作用[10]。那么,MsxC是否可能参与鱼类肌间刺形成的调控过程呢?已有研究[11]表明,唇
本研究利用CRISPR/Cas9技术,通过敲除MsxC,获得斑马鱼MsxC纯合突变体,调查MsxC缺失对斑马鱼肌间刺和大侧肌发育的影响,探究MsxC基因在肌间刺形成中的作用。
1 材料与方法 1.1 材料所用AB系野生型斑马鱼饲养于上海海洋大学实验室。饲养光周期为14 h明∶ 10 h暗,水温为26~28 ℃,斑马鱼亲鱼按雌雄比例1∶ 1进行交配产卵。pT3TS-nCas9质粒来自NIH Shawn Burgess实验室[13]。所有实验均符合上海海洋大学动物伦理委员会的规定。
1.2 方法 1.2.1 CRISPR/Cas9敲除斑马鱼MsxC基因在UCSC数据库中查询斑马鱼MsxC基因的基因组DNA序列(Gene ID: 30526)和MsxC内含子、外显子结构及其转录本信息。根据CRISPR/Cas9基因编辑技术原理和exon1序列,选择基因敲除的靶点。在设计好的靶位点序列前加上保护碱基T7启动子,靶位点之后加上sgRNA骨架上游序列作为正向引物,Oligo2作为反向引物进行扩增。MsxC靶点见表 1。利用HiScribe T7 High Yield RNA Synthesis Kit (NEB公司)进行体外转录,并用RNA Clean & Concentrator Kit(Zymo Research公司)纯化获得sgRNA。

|
表 1 gRNA靶序列及基因分型引物序列 Tab.1 gRNA target sequences and genotyping primer sequences |
将T3质粒pT3TS-nCas9n(7 330 bp)通过Xba Ⅰ(NEB),37 ℃,2 h酶切,使之线性化。之后用PCR Purification Kit(QIA-公司)进行回收线性化的质粒模板。参照mMessage mMachine T3 TranscriptionKit(Thermo Fisher)使用说明书进行体外转录。使用RNA纯化试剂盒(Zymo Research)对体外转录产物进行纯化回收。
将sgRNA和Cas9 mRNA一起注射到斑马鱼Ⅰ细胞期的胚胎中,按每个靶点25~50 pg sgRNA和150~300 pg Cas9 mRNA的比例混合,每个胚胎注射量为0.14 nL。
待注射后胚胎发育至24 h后,用碱裂解法获得胚胎的DNA,并用基因分型引物MsxC-F和MsxC-R(表 1)扩增包含敲除靶点的DNA序列,通过琼脂糖凝胶电泳和毛细管电泳检测基因编辑效果[14]。筛选成功编辑的F0和野生型杂交获得F1,剪尾毛细管电泳检测。将得到的有效个体尾鳍的PCR产物连接到pGEMT-EASY克隆载体,并转化感受态。通过挑取单克隆菌落培养,提取质粒,以MsxC-R作为测序引物送商业公司测序。
1.2.2 硬骨染色硬骨染色方法参考文献[15]。MsxC-/-突变体和AB野生型3月龄成鱼各10尾,经过4%多聚甲醛于4 ℃固定过夜,经过无菌水和TBST漂洗,将样品浸泡在1% KOH中,并滴加少许1% H2O2,强光下照射除去色素。用1%胰蛋白酶消化肌肉组织,再用1% KOH清洗后,滴加1%茜素红溶液染色过夜。最后用KOH/甘油混合液梯度脱色,在体式显微镜下观察、拍照。测量MsxC-/-和AB型斑马鱼29~33肌节髓弓小骨和脉弓小骨以及第6~10肌节髓弓小骨,将数据记录。
1.2.3 石蜡切片和H.E染色取MsxC-/-斑马鱼和AB野生型斑马3月龄鱼成鱼各10尾。用4%多聚甲醛于4 ℃固定过夜后,每尾鱼均去掉鳞片、头部和所有的鳍。1×PBS浸洗15 min,洗3次。再按照常规石蜡包埋、切片程序,将斑马鱼肌肉沿水平断面切片、沿横断面切片和沿纵断面切片。经常规的H.E染色,在显微镜下观察、拍照并进行相同部位等面积下的细胞计数。
1.2.4 冰冻切片和免疫组化取MsxC-/-和AB型斑马鱼3月龄成鱼各10尾,用4% PFA固定过夜。0.01 mol/L PBS清洗10 min后,先后经20%蔗糖溶液12 h、30%蔗糖溶液12 h和OCT浸泡2 h。在包埋盒中注入适量OCT后置于-80 ℃冰箱冻存。在冷冻切片机中沿肌肉横断面切片,烘片后置于-80 ℃冰箱保存。
将1 mL PBST滴于载玻片漂洗3次,每次5 min。5%山羊血清(PBST配)室温封闭15 min。滴加标记红肌的一抗Skeletal Muscle Myosin抗体F59(sc-32732 HRP),4 ℃冰箱中孵育12 h。室温下用PBST洗3次,每次5 min。滴加稀释后的二抗[HRP标记山羊抗小鼠lgG(H+L)],37 ℃孵育30 min。用PBST室温下漂洗3次,每次5 min。DAB显色试剂盒(20×)进行显色。显微镜观察拍照,并测量相同部位下的红肌面积。
1.2.5 数据分析所有长度面积变化指标的测量均使用image J软件进行。各组数据的统计学差异利用SPSS 21软件单因素方差分析(One-Way ANOVA)或t检验,P < 0.05则为有显著统计学差异。
2 结果 2.1 利用CRISPR/Cas9成功构建斑马鱼MsxC基因突变品系sgRNA的靶点位于MsxC基因的第一个外显子(Exon1)上[图 1(a)]。通过靶点上下游设计1对检测引物(MsxC-F和MsxC-R),扩增片段长度324 bp。毛细管电泳检测发现,注射组的PCR产物出现多个峰值,对照胚胎的PCR产物仅有1个较强的约345 bp野生型峰值。

|
sz.扩增产物大小, bp; ht.峰高。 sz. amplification product size, bp; ht. Peak height. 图 1 CRISPR/Cas9介导的斑马鱼MsxC基因敲除 Fig. 1 CRISPR/Cas9-mediated MsxC knockout in zebrafish |
为建立斑马鱼MsxC基因突变品系,筛选成功敲除的F0与野生型杂交获得F1。对40尾F1斑马鱼进行剪尾并毛细管电泳检测,得到28尾鱼的后代检测显示为嵌合体,即双峰。将这些后代养至成鱼,剪尾提取基因组,毛细管电泳测序分析基因型。分子克隆筛选出非3倍数基因突变F1斑马鱼[图 1(b)],插入突变2 bp。自交,毛细管电泳检测筛选纯合突变斑马鱼MsxC-/-[图 1(c),(d)]。
2.2 MsxC-/-突变体尾部肌间刺变短比较MsxC-/-和野生型斑马鱼成鱼的肌间刺形态,硬骨染色显示两者存在差异, 尤其尾部的肌间刺,MsxC-/-斑马鱼的肌间刺较野生型明显变短(图版-1、2), 而躯干部肌间刺长度无差异(图版-3、4)。经测量,MsxC-/-尾部第29~33肌节髓弓小骨依次平均比野生型短16.8%(P < 0.001)、15.5%(P < 0.01)、36.6%(P < 0.001)、34.4%(P < 0.001)和24.8%(P < 0.01),差异极显著[图 2(a)]。MsxC-/-尾部第29~33肌节脉弓小骨依次平均比野生型短26.9%(P < 0.001),16.6%(P < 0.01)、28.1%(P < 0.01)、22.6%(P < 0.01)和17.5%(P < 0.001),差异极显著[图 2(b)]。越靠近尾部,差异越明显。而MsxC-/-躯干第6~10肌节髓弓小骨与野生型无显著性差异[图 2(c)]。

|
1-2.MsxC-/-与野生型斑马鱼尾部肌间刺对比;3-4.斑马鱼躯干靠前部位肌间刺对比;5.斑马鱼切断示意图;6-7.5中①位置横断面H.E染色对比;8-9.5中①位置横断面H.E染色对比;10-11.5中④位置横断面H.E染色对比;12-13.垂直断面H.E染色对比;14~17.红肌标记蛋白F59抗体尾部肌肉标记对比;18~21.红肌标记蛋白F59抗体躯干靠前部位肌肉标记对比;len.左侧髓弓小骨;ren.右侧髓弓小骨;rep.右侧脉弓小骨。 1-2. Comparison of zebrafish tail intermuscular bones between MsxC-/- and wild-type group; 3-4; Comparison of zebrafish anterior trunk intermuscular bones between MsxC-/- and wild-type group; 5. Schematic of zebrafish severing; 6-7. Comparison of cross-sectional H.E staining at ① position in 5; 8-9. Comparison of vertical-sectional H.E staining at ① position in 5; 10-11. Comparison of cross-sectional H.E staining at ④ position in 5; 12-13. Comparison of vertical-sectional H.E. staining at ④ position in 5; 14-17. Comparison of slow muscle marker protein F59 antibody labeled tail muscle; 18-21. Comparison of slow muscle marker protein F59 antibody labeled anterior trunk muscle; len. epineurals on left side; ren. epineurals on right side; rep. epipleurals on right side. 图版 MsxC-/-和野生型斑马鱼肌间刺及大侧肌对比图 Plate Comparison of MsxC-/- and wild-type zebrafish intermuscular bone and axial muscle |

|
(a)第29~33肌节髓弓小骨长度比较;(b)第29~33肌节脉弓小骨长度比较;(c)第6~10肌节髓弓小骨长度比较;**P < 0.01,***P < 0.001。 (a) Comparisons of the lengths of epineurals between the 29th and 33th sarcomeres; (b) Comparisons of the lengths of epipleurals between the 29th and 33th sarcomeres; (c) Comparisons of the lengths of epineurals between the 6th and 10th sarcomeres; **P < 0.01, ***P < 0.001. 图 2 MsxC-/-和野生型斑马鱼肌间刺长度比较 Fig. 2 Comparison of the lengths of intermuscular bones between MsxC-/- and wild-type zebrafish |
相比正常斑马鱼,MsxC-/-突变体躯干靠前部位横断面大侧肌隔部位的白肌细胞数量要明显减少(图版-6、7),统计分析表明存在显著性差异[图 3(a),P < 0.05];MsxC-/-突变体躯干靠前部位水平断面的肌纤维排列(图版-5显示的①)较野生型细胞疏松(图版-8、9)。比较MsxC-/-突变体尾部横断面大侧肌隔部位相同面积下白肌细胞数量比野生型少(图版-10、11),差异极显著[图 3(b),P < 0.001];MsxC-/-突变体尾部的肌纤维排列(图版-5显示的④)较野生型明显疏松(图版-12、13),特别是在肌隔附近位置。

|
(a)躯干靠前部位相同面积白肌细胞数量对比;(b)尾部相同面积白肌细胞数量对比;*P < 0.05,***P < 0.001。 (a) Comparison of fast muscle cells counts in identical area in the top part of trunk; (b) Comparison of fast muscle cells counts in identical area in the tail part. *P < 0.05, ***P < 0.001. 图 3 MsxC-/-和野生型斑马鱼白肌细胞数量比较 Fig. 3 Comparison of the number of white muscle cells between MsxC-/- and wild-type zebrafish |
红肌特异性标记免疫组化检测显示,MsxC-/-尾部(图版-5显示的④)红肌区域明显增加(图版-14~17)。计算红肌面积占横截面总肌肉面积的比例,发现MsxC-/-突变体尾部红肌面积占比9.08%,比野生型斑马鱼增大2.22%,差异极显著[图 4(a),P < 0.01]。MsxC-/-躯干靠前部位(图版-5显示的①)红肌面积增加(图版-18~21)。测量计算后,MsxC-/-突变体躯干靠前部位红肌面积占比6.35%,比野生型斑马鱼增大0.94%,差异不显著[图 4(b),P>0.05]。

|
(a)尾部F59抗体红肌标记面积对比;(b)躯干靠前部位F59抗体红肌标记面积对比;**P < 0.01。 (a) Comparison of F59 antibody slow muscle labeled area in the tail; (b) Comparison of F59 antibody slow muscle labeled area in the top part of the trunk; **P < 0.01. 图 4 MsxC-/-和野生型斑马鱼红肌面积比较 Fig. 4 Comparison of red muscle area between MsxC-/- and wild-type zebrafish |
利用CRISPR/Cas9基因编辑技术,在MsxC基因靶位点位置成功插入了2 bp的碱基,导致MsxC移码突变。并通过自交得到纯合突变斑马鱼MsxC-/-。通过比较MsxC-/-和正常斑马鱼肌间骨形态,发现在斑马鱼尾部位置,MsxC-/-的肌间刺平均长度比野生型斑马鱼显著缩短,而且越靠近尾部差异越明显。MsxC基因的功能缺失导致斑马鱼尾部肌间刺的发育异常,这是首次在斑马鱼中发现该基因与肌间刺的发育有关。在唇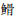
比较MsxC-/-和正常斑马鱼的大侧肌肌细胞的组成差异,发现MsxC-/-躯干及尾部大侧肌肌隔周围白肌细胞数量减少,排列疏松且乱序,特别在尾部更为明显;而红肌则相反,MsxC-/-红肌面积较正常斑马鱼增加明显,越靠近尾部差异越显著。这是首次发现MsxC基因影响肌纤维数量以及大侧肌红肌的分布。MsxC作为肌肉分节同源框分子,参与肌肉的发育分化[12]。在唇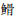
研究[16]认为,肌间刺可以支持肉质疏松鱼类的大侧肌强度,如鲤科鱼类的肌间刺出现了树枝状分叉。肌间刺还具有机械力传导的作用[17],例如有些鱼类肌肉中富含蛋白质,靠肌肉纤维传导力量,肌间刺的数量就会较少。在植食性鱼类中,肌肉的力量主要靠肌间刺支持,以增加其游泳性能并抵御危险环境甚至天敌的出现[18]。此外,不同游泳方式的鱼类,肌间刺形成顺序不同[2, 9]。因此,肌间刺的形成可能会受游泳过程中肌肉摆动产生的机械力的诱导。斑马鱼属于鲹型式游泳,主要依赖鱼体后部摆动。因此,斑马鱼MsxC基因功能被破坏后,尾部的白肌和红肌占比发生变化,尾部肌间刺长度缩短,而鱼体前半部的肌肉性质变化不明显,肌间刺长度未发生显著变化。推测在斑马鱼中,MsxC的缺失会引起肌肉强度不足,从而导致运动过程中肌纤维的机械力强度下降,而机械力强度的下降影响了肌间刺的骨组织的形态发生。
总之,采用了CRISPR/Cas9基因组编辑技术,首次构建了斑马鱼MsxC基因突变品系,首次发现MsxC缺失影响斑马鱼肌间刺和大侧肌的发育。研究结果为今后进一步理解肌肉发育如何影响肌间刺形成奠定一定的基础。
| [1] |
吕耀平, 鲍宝龙, 蒋燕, 等. 低等真骨鱼类肌间刺形态比较[J]. 水产学报, 2007, 31(5): 145-152. LYU Y P, BAO B L, JIANG Y, et al. Comparative analysis of intermuscular bones in lower teleosts[J]. Journal of Fisheries of China, 2007, 31(5): 145-152. |
| [2] |
姚文杰, 龚小玲, 吕耀平, 等. 日本鳗鲡肌间小骨的骨化过程[J]. 上海海洋大学学报, 2014, 23(6): 810-813. YAO W J, GONG X L, LYU Y P, et al. The ossificational process of the intermuscular bones in Anguilla japonica[J]. Journal of Shanghai Ocean University, 2014, 23(6): 810-813. |
| [3] |
柯中和, 张炜, 蒋燕, 等. 鲢肌间小骨发育的形态学观察[J]. 动物学杂志, 2008, 43(6): 88-96. KE Z H, ZHANG W, JIANG Y, et al. Developmental morphology of the intermuscular bone in Hypophthalmichthys molitrix[J]. Chinese Journal of Zoology, 2008, 43(6): 88-96. |
| [4] |
董在杰, 黄代中, 李丽娟, 等. 几种常见鲤科养殖鱼类肌间刺的初步研究[J]. 上海水产大学学报, 2006, 15(4): 425-429. DONG Z J, HUANG D Z, LI L J, et al. Preliminary study on intermuscular bones of several cultured cyprinids[J]. Journal of Shanghai Fisheries University, 2006, 15(4): 425-429. |
| [5] |
关柠楠, 聂春红, 陈宇龙, 等. 团头鲂雌核发育群体的肌间骨形态学分析[J]. 水产科学, 2017, 36(5): 596-600. GUAN N N, NIE C H, CHEN Y L, et al. Morphological characteristics of intermuscular bones in gynogenetic population of bluntnose black bream Megalobrama amblycephala[J]. Fisheries Science, 2017, 36(5): 596-600. |
| [6] |
BIRD N C, MABEE P M. Developmental morphology of the axial skeleton of the zebrafish, Danio rerio (Ostariophysi: Cyprinidae)[J]. Developmental Dynamics, 2003, 228(3): 337-357. DOI:10.1002/dvdy.10387 |
| [7] |
吕耀平, 周晨晨, 杨丽美, 等. 瓯江彩鲤肌间小骨的骨化模式[J]. 上海海洋大学学报, 2014, 23(1): 58-63. LYU Y P, ZHOU C C, YANG L M, et al. Ossification pattern of the intermuscular bone in Cyprinus carpio var. color[J]. Journal of Shanghai Ocean University, 2014, 23(1): 58-63. |
| [8] |
吕耀平, 陈洁, 鲍宝龙, 等. 唇 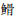 肌间小骨的骨化过程[J]. 上海海洋大学学报, 2012, 21(4): 549-553. 肌间小骨的骨化过程[J]. 上海海洋大学学报, 2012, 21(4): 549-553.LYU Y P, CHEN J, BAO B L, et al. The ossificational process of the intermuscular bones in Hemibarbus labeo[J]. Journal of Shanghai Ocean University, 2012, 21(4): 549-553. |
| [9] |
聂春红, 陈祖萱, 戴彩娇, 等. 不同鱼类肌间骨的骨化模式研究[J]. 水生生物学报, 2018, 42(1): 131-137. NIE C H, CHEN Z X, DAI C J, et al. Ossification patterns of intermuscular bones in different fish species[J]. Acta Hydrobiologica Sinica, 2018, 42(1): 131-137. |
| [10] |
BOUZAFFOUR M, DUFOURCQ P, LECAUDEY V, et al. Fgf and Sdf-1 pathways interact during zebrafish fin regeneration[J]. PLoS One, 2009, 4(6): e5824. |
| [11] |
LYU Y P, YAO W J, CHEN J, et al. Newly identified gene muscle segment homeobox C may play a role in intermuscular bone development of Hemibarbus labeo[J]. Genetics and Molecular Research, 2015, 14(3): 11324-11334. |
| [12] |
NOSE A, ISSHIKI T, TAKEICHI M. Regional specification of muscle progenitors in Drosophila: the role of the msh homeobox gene[J]. Development, 1998, 125(2): 215-223. |
| [13] |
VARSHNEY G K, CARRINGTON B, PEI W H, et al. A high-throughput functional genomics workflow based on CRISPR/Cas9-mediated targeted mutagenesis in zebrafish[J]. Nature Protocols, 2016, 11(12): 2357-2375. |
| [14] |
高磊, 黄亚娟, PENGLEE RACHIT, 等. 斑马鱼nos2a基因的生长调控作用[J]. 上海海洋大学学报, 2021, 30(4): 573-580. GAO L, HUANG Y J, PENGLEE R, et al. Role of nos2a in regulating the growth of zebrafish (Danio rerio)[J]. Journal of Shanghai Ocean University, 2021, 30(4): 573-580. |
| [15] |
姚文杰. 鱼类肌间小骨骨化模式的比较及相关信号调控通路[D]. 上海: 上海海洋大学, 2014. YAO W J. Comparison of the intermuscular bone ossification pattern in fishes and the molecular control of intermuscular bone development[D]. Shanghai: Shanghai Ocean University. 2014. |
| [16] |
林信伟, 熊全沫. 寡齿新银鱼骨骼系统的形态和组织学特征[J]. 动物学报, 1994, 40(2): 198-199, 227-228. LIN X W, XIONG Q M. Morphological and histological characteristics of skeletal system of Neosalanx oligodontis Chen[J]. Current Zoology, 1994, 40(2): 198-199, 227-228. |
| [17] |
DANOS N, STAAB K L. Can mechanical forces be responsible for novel bone development and evolution in fishes?[J]. Journal of Applied Ichthyology, 2010, 26(2): 156-161. |
| [18] |
马良骁, 董在杰, 苏胜彦, 等. 鱼类肌间刺的研究进展[J]. 江苏农业科学, 2012, 40(4): 234-235, 240. MA L X, DONG Z J, SU S Y, et al. Advances in research on fish intermuscular bone[J]. Jiangsu Journal of Agricultural Sciences, 2012, 40(4): 234-235, 240. |
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


