2. 上海海洋大学 水产种质资源发掘与利用教育部重点实验室, 上海 201306
氮磷等营养盐的过度输入使得水体富营养化已经成为世界上最受关注的水环境问题之一[1],湖泊富营养化可导致水体形成水华、透明度下降、生物多样性减少,生态系统结构和功能退化等。温带湖泊实验表明通过生物操纵可以减少食浮游生物鱼类,提高大型滤食性浮游动物特别是枝角类的密度,通过滤食作用有效控制浮游植物密度和生物量,从而控制浮游植物的生长。但在亚热带地区,浮游动物平均体长比温带要小许多[2],对浮游植物的控制力有限,使得温带湖泊的鱼类操纵在亚热带湖泊中是否适用存在争议[3-4]。
引起热带和亚热带地区浮游动物小型化的原因更复杂多样,下行效应在亚热带并不明显,对鱼类的控制是关键因素之一。刘正文等[5]在惠州西湖进行湖泊生态修复实验,其结果显示即使移除了浮游生物食性鱼类,浮游动物群落结构并未产生太大变化,枝角类丰度依旧很低,枝角类的体型很小,小型物种占优势,浮游动物/浮游植物比值仍然很低,下行效应并不明显,结果倾向于浮游动物小型化是因为存在较高的鱼类捕食压力(即使是很少的鱼,但捕食压力还是很高)。IGLESIAS等[6]和MAZZEO等[7]研究表明,在高温情况下,移除水体中的杂食性(浮游生物食性)鱼类,使大型枝角类成为了优势种,对藻类引起强烈的级联反应,可使水体透明度增加。但是长江中下游地区的湖泊中浮游动物群落优势种通常为小型浮游动物。鱼类的直接摄食使枝角类的种类组成发生变化是导致枝角类小型化的重要因素。但对于同一种枝角类,鱼类也可能通过利用利它素和视觉胁迫对其形态和生产产生影响。
早期研究[8]发现大型枝角类的表型的变异呈周期性,盔形溞(Daphnia galeata mendotae)的头盔长度最长的时期与常见的无脊椎动物捕食者幽蚊(Chaoborus)和透明薄皮溞(Leptodora)的峰值密度相吻合,因此推测捕食者的摄食压力是造成枝角类表型变化的原因。后续大量研究[9]证明,利它素一般由鱼类的代谢物直接产生,捕食者释放的利它激素确实会影响大型枝角类的形态,其中最具代表性的例子便是大型溞(Daphnia magna)和蚤状溞(Daphnia pulex),如幽蚊的利它激素能诱导大型溞成熟时体型略有增大,而仰蝽(Notonecta)和食浮游生物的鱼类释放的利它激素能诱导大型溞成熟时体型变小[9]。不同生长阶段响应摄食压力的反应也不同。壳刺是大型溞幼虫的重要防御手段,面对鲎虫(Triops cancriformis)的摄食压力时,大型溞呈现壳刺大大增长、体长和体宽增大、成熟快的特点,从幼体到成体,大型溞完成了单一的壳刺防御向体积和壳刺协同防御的转变,且捕食者的诱导效应,幼虫在育卵袋中就已呈现[10]。摄食压力对大型枝角类的影响是因捕食者种类而异的。有研究[11]表明,只有幽蚊能诱导长刺溞(Daphnia longispina)长出颈部齿突,而划蝽和仰蝽不能诱导其长出颈部齿突。除了捕食者种类之外,影响摄食压力对大型枝角类的效果的因素还有很多,如捕食者密度(即利它素浓度)[12-14],农药、寄生、摄食压力的协同作用等[15]。关于温度的影响,早期研究[16]早已发现许多大型枝角类都有季节变异的现象。
基于研究者在亚热带湖泊中通过生物操纵对改善水域生态环境的成败案例,大型枝角类对不同捕食者所施加的捕食压力会产生不同的生活史对策,以及对比亚热带水域与温带水域环境的条件差异,为探究小型鱼类的存在对大型枝角类存活的影响,本研究选取长江流域最为常见的小型鱼类麦穗鱼(Pseudorasbora parva)作为捕食者,在避免直接摄食的情况下与大型溞在同一水体中培养,研究其对大型溞生长、体型和繁殖的影响。麦穗鱼在全球分布较广,多栖息于流速缓慢的水体中,具有食性广、时代周期短、性成熟早、繁殖能力和环境适应能力强等特点[17]。用大型溞(Daphnia magna)代表大型枝角类,通过设置有无视觉胁迫以及有无利它素处理,探究在不同处理条件下麦穗鱼(捕食压力)对大型溞存活率、繁殖率、壳刺变化等指标的影响,旨在更直接地解释说明亚热带水体中小杂鱼对大型枝角类生长繁殖的影响,提高生物操纵技术的运用成效,为生物操纵技术和水生态环境治理提供参考依据。
1 材料与方法 1.1 捕食者直接摄食鱼类的直接摄食实验在圆柱形透明的3 L的玻璃样品瓶中进行,在样品瓶中注入2 L曝气水(无氨),挑选3条体长为(6.50±0.28) cm健康的麦穗鱼作为捕食者,被捕食者为实验室长期培养的大型溞, 培养饵料为小球藻及酵母,随机从实验室培养的大型溞中挑取100只大型溞,将其放入样品瓶中,实验设置3组平行,观察麦穗鱼的摄食行为并进行记录,直至所有大型溞全部被摄食,记录时间。
1.2 视觉胁迫及利它素对大型溞生长繁殖的影响实验实验装置为自行设计的30 cm×30 cm×20 cm玻璃缸,在玻璃缸中间为一块开口20 cm×10 cm的亚克力玻璃板(图 1)。开口处用120目的筛绢隔离,以保持玻璃缸两侧水体相通。用黑色有孔的塑料膜固定在亚格力板上阻挡两侧视野。容器内两侧各加入5 L曝气水,在一侧放入1条体长为(6.54±0.28) cm的麦穗鱼,另一侧放入50只新生幼溞,实验初始在两侧加入密度为13.15×106 cells/mL的小球藻液20 mL,之后每天用10 mL塑料移液管添加浓缩后的小球藻20滴(密度为1×108 cells/mL), 为控制变量,在鱼的一侧也添加等量的小球藻液,以补充大型溞生长繁殖所需要的食物, 每天为鱼类提供10粒鱼食,并将前一天未食用的食物捞出。
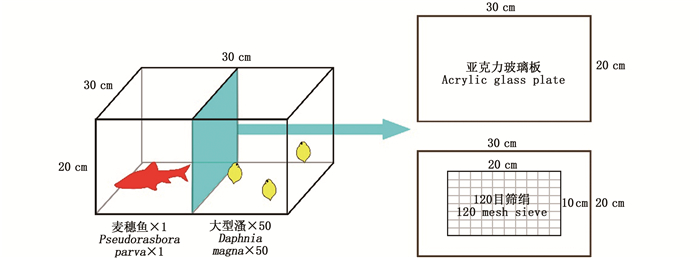
|
图 1 实验装置 Fig. 1 Experimental facility |
实验为1个对照组、3个实验组(图 2),玻璃缸隔间相通视为有利它素以字母K表示不相通为无利它素表示为NK,不遮挡视野视为有视觉胁迫以字母V表示,遮挡视野表示无视觉胁迫以字母NV表示,每组设置3个平行,对照组(C)为NK+NV,3个实验组分别是:第一组(T1)为K+NV,第二组(T2)为K+V,第三组(T3)为对照组NK+V,总共12个处理。培养水体的温度为(25±1) ℃,光暗比为12 h∶ 12 h,光强为2 000 lx。每天记录大型溞的出生、死亡、体长、壳刺长,并及时将新生的幼溞转移,如实验过程中麦穗鱼死亡,则以相似的麦穗鱼替换,实验共进行11 d。
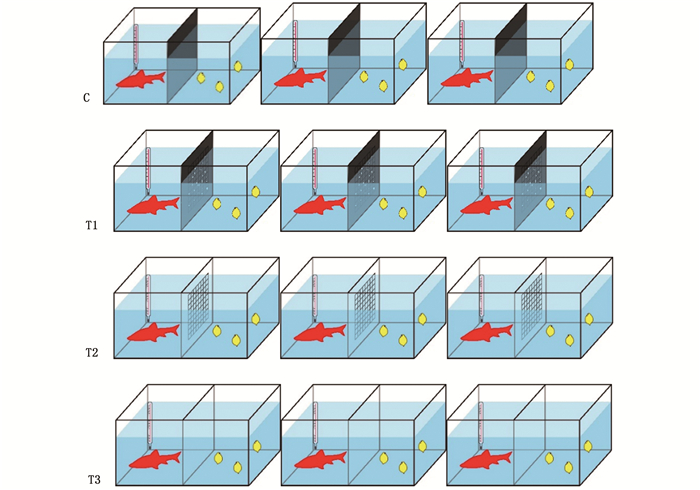
|
C.无视觉胁迫无利它素组;T1.无视觉胁迫有利它素组;T2.有视觉胁迫有利它素组;T3.有视觉胁迫无利它素组。 C.Non-visual stress non-kairomone group; T1.non-visual stress kairomone group; T2.visual stress kairomone group; T3.visual stress non-kairomone group. 图 2 实验设计 Fig. 2 Experiment design |
利用SPSS 16.0进行单因素方差分析(ANOVA)比较不同处理条件下,大型溞的体长、壳刺及繁殖量等指标的组间差异性,在进行方差分析前,对数据进行了方差齐性分析和正态分布分析,若方差齐性,选择LSD检验,反之使用Dunnett's检验(P<0.05)柱形图及折线图运用Origin 2017进行绘制,图中误差线均为标准差。
2 结果与分析 2.1 鱼类对大型溞直接摄食压力3个平行处理组中麦穗鱼对所投入的大型溞完全摄食所需时间分别为30、45和34 min。其捕食速率分别为3.33 ind./min、2.22 ind./min、2.94 ind./min,其平均摄食速率为(2.83±0.56) ind./min。
2.2 捕食者视觉胁迫与利它素对大型溞生长繁殖的影响 2.2.1 大型溞平均体长的变化比较分析11天内不同处理条件下大型溞体长变化可发现,在无利它素处理组的大型溞体长增长速度快于有利它素的大型溞,第11日龄时,4组设置的大型溞体长平均值分别为无视觉胁迫有利它素组为3.31 mm、有视觉胁迫有利它素为3.22 mm、无视觉胁迫无利它素为3.46 mm、有视觉胁迫无利它素组为3.52 mm。不同处理组之间的差异最早出现在第5日龄。在无利它素干扰的情况下,有视觉胁迫处理组的大型溞体长与无视觉胁迫的大型溞体长具有显著性差异,它们的平均体长分别为1.78 mm和1.52 mm。在第7日龄时,有视觉胁迫有利它素组与有视觉胁迫无利它素组的体长具有显著性差异,有视觉胁迫有利它素处理组的体长超过了有视觉胁迫无利它素组的体长,第7日龄的平均体长在4个处理组中依次为2.39、2.18、2.62和2.76 mm。在第9天时,有视觉胁迫有利它素处理组大型溞的体长与其他3组表现出明显的差异性,生长明显受到抑制。到第11日龄时,无利它素组是否具有视觉胁迫并未对大型溞体长造成显著差异,有利它素处理组因为视觉胁迫的差异则展现出显著性差异,且有利它素组与无利它素组也具有显著性差异。见图 3。
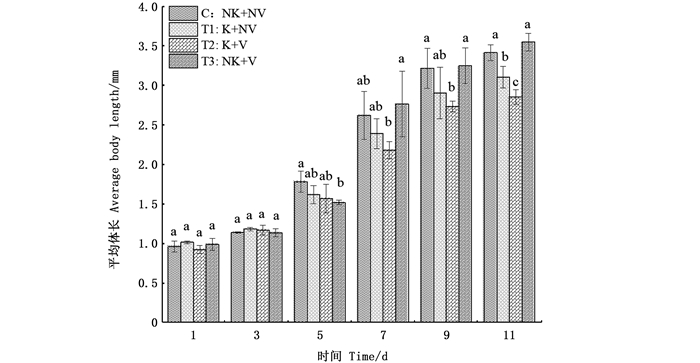
|
相同字母表示组间无显著差异,不同字母表示组间具有显著性差异(P<0.05)。 The same letter indicated that there was no significant difference between the groups, while different letters indicated that there was significant difference between the groups(P < 0.05). 图 3 不同处理组下大型溞体长变化 Fig. 3 Body length changes of D. magna in different treatment groups |
在4个处理组中,同样也观察大型溞壳刺的变化。在前9天的观察中,各个处理组的大型溞壳刺均呈增长的变化趋势,而第11天时有细微的逆生长,总体呈现出无利它素处理组的大型溞壳刺生长较快。在视觉胁迫的设置上表现出不同的反应:在无利它素的前提下,有视觉胁迫处理组的壳刺长度较无视觉胁迫来的长,而在有利它素组的前提下,无视觉胁迫的生长更好。在实验的11天中,4个处理组的大型溞壳刺最长依次分别为0.37、0.38、0.47、0.53 mm,有利它素有视觉胁迫组与无利它素处理的两组均产生显著性差异且壳刺最短(图 4)。
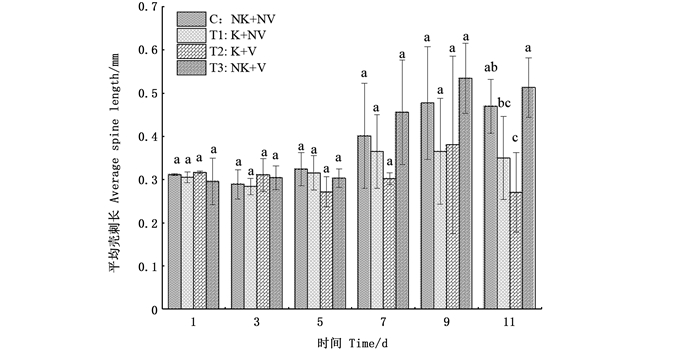
|
相同字母表示组间无显著差异,不同字母表示组间具有显著性差异(P<0.05)。 The same letter indicated that there was no significant difference between the groups, while different letters indicated that there was significant difference between the groups(P < 0.05). 图 4 不同处理组下大型溞壳刺变化 Fig. 4 Spines length changes of D. magna under different treatment groups |
从壳刺与体长的比例来看,每个处理组的大型溞壳刺长与体长的比例均在减少,前3天内,有视觉胁迫无利它素处理组的比例下降较慢,其他3组则表现出有视觉胁迫有利它素组下降速率最快,无视觉胁迫无利它素组下降速率次之,无视觉胁迫有利它素最慢;当实验进行到第11天时,有视觉胁迫有利它素处理组的壳刺与体长比值最小,为0.09,有视觉胁迫无利它素组为0.11,无视觉胁迫无利它素组为0.14,有视觉胁迫无利它素组最多,为0.14。同时,有视觉胁迫有利它素组与有视觉胁迫无利它素组在这一天的比值表现出明显差异(图 5)。
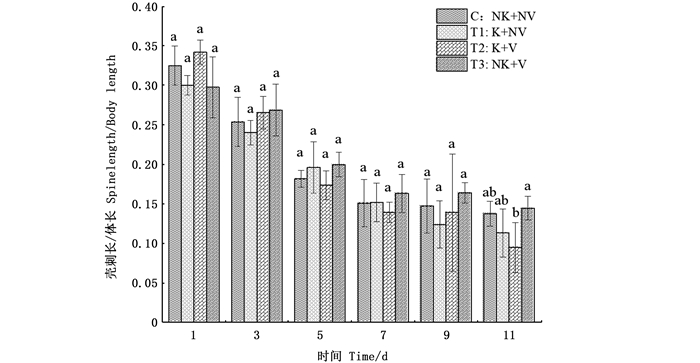
|
相同字母表示组间无显著差异,不同字母表示组间具有显著性差异(P<0.05)。 The same letter indicated that there was no significant difference between the groups, while different letters indicated that there was significant difference between the groups(P < 0.05). 图 5 不同处理组大型溞壳刺与体长比例变化 Fig. 5 Changes of ratio of spine length to body length of D. magna in different treatments groups |
在4个处理组中,可看出,无利它素处理组的后代平均总数比有利它素处理组的多,前者的后代数量平均值与有利它素组相比较,增加了2.89倍(图 6)。同时,它们在首次生殖时的体长在有视觉胁迫组和无视觉胁迫组之间产生了明显的差异,除了无视觉胁迫有利它素组的首次生殖时间是第6天以外,其他3个处理组的首次生殖时间均在第5天,有视觉胁迫组的体长较无视觉胁迫组体长较短,有视觉胁迫组的首次生殖体长分别为1.57和1.52 mm,而无视觉胁迫组的首次生殖体长为1.95和1.78 mm(图 7)。
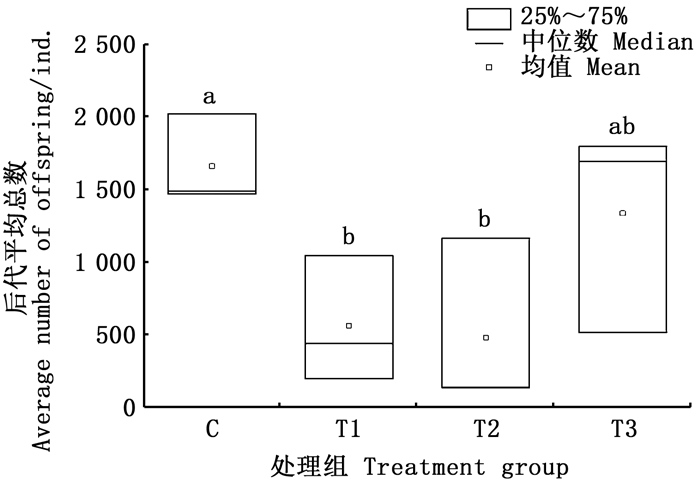
|
相同字母表示组间无显著差异,不同字母表示组间具有显著性差异(P<0.05)。 The same letter indicated that there was no significant difference between the groups, while different letters indicated that there was significant difference between the groups(P < 0.05). 图 6 不同处理下大型溞的后代总数 Fig. 6 The total number of offspring of D.magna in different treatment groups |
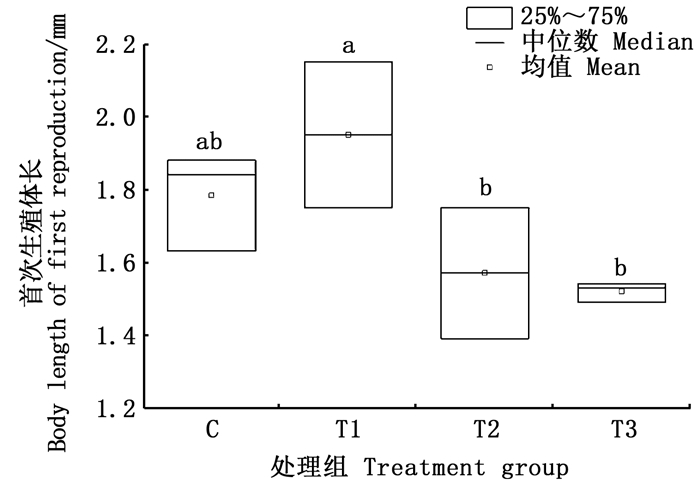
|
相同字母表示组间无显著差异,不同字母表示组间具有显著性差异(P<0.05)。 The same letter indicated that there was no significant difference between the groups, while different letters indicated that there was significant difference between the groups(P < 0.05). 图 7 不同处理组大型溞首次生殖体长 Fig. 7 The body length of first reproduction in different treatment groups |
从死亡率来看,有利它素有视觉胁迫组的死亡速率最高,有视觉胁迫无利它素组与无视觉胁迫有利它素组的死亡速率相近,无视觉胁迫无利它素的死亡速度在第5天后渐渐稳定,存活量在第11天时也剩余最多,存活率为70%,有视觉胁迫有利它素组最少,仅剩下20%(图 8)。
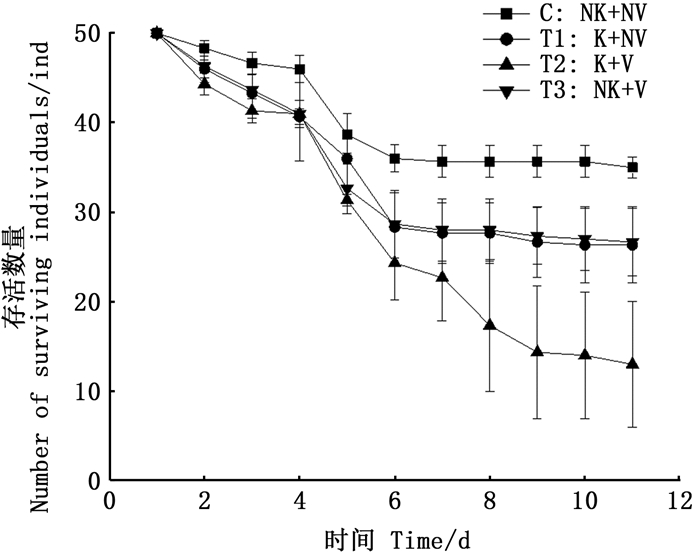
|
图 8 不同处理组大型溞存活情况 Fig. 8 The number of surviving individuals in different treatment groups |
亚热带地区,鱼类的密度、物种丰度相对于温带地区更高,其对浮游动物的捕食具有更强的捕食压力,热带和亚热带的鱼类优势种通常为小型杂食鱼类,鱼群优势种通常由大型捕食性鱼类转化为小型杂食性鱼类,鱼类个体较小,食浮游动物鱼类比例较高,幼鱼数量全年较多,浮游动物是其主要食物,尤其是大型浮游动物。枝角类或者大型水蚤在温暖的季节甚至全年都可能受到较强的捕食压力[18-19]。生物操纵技术也常常用于治理富营养化水体,其往往在浮游生物食性鱼类的移除后,很快会被剩余种群所补充,生物操纵的影响只是短期的效果。因此,在亚热带湖泊中要引起级联反应,并且维持级联反应要比在温带湖泊中更难[3]。
自然河流湖泊中经常栖息有大型枝角类和小杂鱼,捕食压力无处不在,然而捕食者扮演着水域生态系统中重要的角色,捕食者是自然选择的主要驱动力。研究[20]表明,虾能够在池塘中充当高捕食压力的角色,尤其是对桡足类和枝角类。更何况是行动更为灵敏,经常群居的麦穗鱼。众所周知,枝角类常常被用作鱼类的开口饵料,说明它们对大型溞施加了巨大的捕食压力[21]。枝角类会改变它们的滞育行为,或者形态,或者两者同时改变来应对较大的捕食压力[22]。我们的结果表明大型溞对这种较小鱼类捕食者的存在是通过不同日龄的转换防御特征维持有效的适应。
本文捕食压力实验也说明,麦穗鱼对大型溞的直接摄食压力非常大,大型溞首次生殖体长在视觉胁迫变量设置相同的情况下有利它素组的体长较无利它素组要长,导致防御个体的体积增加,这种快速的增长有利于躲避捕食者的捕食[23]。本实验比较了各处理组的大型溞,但是并未发现首次生殖时间上的显著差异。
由于麦穗鱼是一种杂食鱼类,相对而言被捕食者的范围很广,被捕食者会引起生活史的转变,例如转变刚出生时的体型大小。当捕食者在所有生境捕食大型枝角类使它们无处可躲时,它们通过垂直迁移来躲避被捕食。同时,诱导形态学防御的表现也是一种有效的方式去对抗捕食者。鲎虫属(Triops)诱导体型的有效性是基于捕食者的进食方式的,它们用九对前肢抓住猎物后进食。猎物通过食物槽被送进嘴里,被锋利的下颚碾碎[20]。但麦穗鱼捕食大型枝角类时,与这样的进食方式不同,口径的大小足以毫无压力地将大型溞吸入口中。在利它素与视觉胁迫的双重干扰下,大型溞的发育和生长都被抑制,本实验中,大型溞在此条件下的体长最小,繁殖量极低,由此可见,鱼类摄食压力对大型溞的生长繁殖的负面影响极大,MARTIN在观察盔形溞暴露于鱼类利它素的实验中也得到类似的结果,SARMA等[24]、JEPPENSEN等[24]、HAVENS等[26]的野外研究也倾向于鱼类捕食压力导致了枝角类体型减小[27],并得出较小的体型能够有效地避开捕食者。
我们还观察到,4个处理组的大型溞的体长变化在第5天时显示出利它素对其诱导的作用,但是在无利它素干扰情况下,有视觉胁迫处理组拥有更大的体长,已经明显增大,同时也拥有更大的壳刺长度,这表明视觉胁迫的刺激有助于诱导大型溞拥有更大的体长来防御捕食者。同时,防御特征随着时间和生命阶段在变化,导致了不同防御特征的连续变化,在幼年时期,生长身体的壳刺是最显著的防御结构。研究[28]表明,在这种已经被捕食者威胁的情况下,防御的形态学特征会在幼体被排出母体前被进化,由于孵育囊中的空间限制,在胎中无法形成大的形态学防御,在进化过程中壳刺是折在甲壳边缘的,接着快速孵化后,强化这个部位,形成完美的防御[28]。这也能解释本实验中在有视觉胁迫的情况下大型溞壳刺生长更快。另外,我们的实验结果与CARAMUJO等[29]的研究成果相似,他也发现了盔形溞也通过壳刺变长来防御捕食者。这种保护机制可以用以下事实来解释,较长的壳刺使得大型溞增加了整体长度,使它们不容易被口径有限的捕食者吞食。
同时,实验结果还显示,在有捕食者干扰下的体长和壳刺生长差异的保护功能会因为被利它素更剧烈的干扰所压制,也可以说明,单一的捕食者视觉胁迫对于大型溞体型的诱导具有暂时性,在短暂的干扰后,明确知道捕食者对自身安全不存在威胁,便会调整回相似的生长特征。在本实验中,视觉胁迫对大型溞体长的刺激优先与利它素处理组表现出来,而在第7天的时候,视觉胁迫处理组的差异已经不再明显,利它素的影响开始表现出差异,视觉胁迫处理组也表现出有无视觉胁迫组能够更好地生长。这或许也因为在食物充足的条件下,轻微的捕食者压力可以被食物质量和来源所抵消[30]。
施加捕食压力有助于不同阶段防御机制的表达。形态学防御的进化只在被捕食者威胁的阶段。诱导防御的基本特征是它们提供一种对捕食者有效的保护,在幼年时可能是依赖壳刺,较大时依赖体长。在4组处理实验中表现出的防御特征差异是连续的动态过程,很可能是细长的壳刺对巨大的捕食压力已经不起作用。这两种特征都有助于被诱导者不会被捕食者捕食,但巨大的捕食压力已经让它们的内稳态系统紊乱,无法进行正常的生长与防御。因此,我们猜想,麦穗鱼释放的利它素在与视觉胁迫同时干扰的情况下具有迟滞性,而这种迟滞性一旦发生,便能弱化捕食者视觉给予被捕食者的压力,在多重捕食压力下,大型枝角类的存活状况堪忧。我们总结为这个持续的转换是因为大型溞整个生活史都受到捕食者的威胁,在不同时期对不同程度的捕食压力有不同的响应。
生物操纵技术运用于湖泊富营养化治理的方式由来已久,人们通过化学毒杀、电捕、选择性网捕、垂钓、增加鱼食性鱼类控制或清除以浮游生物和底栖生物为食的鱼类来促进大型浮游动物发展[5-6, 31-34],其中,有的湖泊出现了大型枝角类,有的湖泊仍然以小型枝角类为主,这可能是因为虽然枝角类的捕食者减少了,但是水体中残留的鱼类利它素对水生态系统中的枝角类依旧存在抑制作用,本研究表明了小杂鱼对大型枝角类的捕食压力是生物操纵技术运用于富营养化水体治理中的失败原因之一,但是否具有广泛的代表性还要进一步深入探究。
4 结论(1) 单一的捕食者视觉胁迫能够快速促进大型溞壳刺防御机制的激发,但会随着时间弱化。(2) 充足的食物可以减少捕食压力对枝角类生长繁殖的影响。(3) 捕食者释放的利它素对大型溞生长繁殖起显著影响,虽然有迟滞性,但是对大型溞的影响是长期的,并且提高了大型溞的死亡率。
| [1] |
马进, 何文辉, 彭自然, 等. 大型溞-苦草配合处理富营养化水体的研究[J]. 上海海洋大学学报, 2018, 27(4): 515-521. MA J, HE W H, PENG Z R, et al. Study on water eutrophication treatment with Daphnia magna and Vallisneria natans control system[J]. Journal of Shanghai Ocean University, 2018, 27(4): 512-521. |
| [2] |
GILLOOLY J F, DODSON S I. Latitudinal patterns in the size distribution and seasonal dynamics of new world, freshwater cladocerans[J]. Limnology and Oceanography, 2000, 45(1): 22-30. DOI:10.4319/lo.2000.45.1.0022 |
| [3] |
JEPPESEN E, SØNDERGAARD M, LAURIDSEN T L, et al. Biomanipulation as a restoration tool to combat eutrophication: recent advances and future challenges[J]. Advances in Ecological Research, 2012, 47: 411-488. |
| [4] |
JEPPESEN E, SØNDERGAARD M, JENSEN J P, et al. Lake responses to reduced nutrient loading-an analysis of contemporary long-term data from 35 case studies[J]. Freshwater Biology, 2005, 50(10): 1747-1771. DOI:10.1111/j.1365-2427.2005.01415.x |
| [5] |
LIU Z W, HU J R, ZHONG P, et al. Successful restoration of a tropical shallow eutrophic lake: strong bottom-up but weak top-down effects recorded[J]. Water Research, 2018, 146: 88-97. DOI:10.1016/j.watres.2018.09.007 |
| [6] |
IGLESIAS C, MAZZEO N, GOYENOLA G, et al. Field and experimental evidence of the effect of Jenynsia multidentata, a small omnivorous-planktivorous fish, on the size distribution of zooplankton in subtropical lakes[J]. Freshwater Biology, 2008, 53(9): 1797-1807. DOI:10.1111/j.1365-2427.2008.02007.x |
| [7] |
MAZZEO N, IGLESIAS C, MELLO F T D, et al. Trophic cascade effects of Hoplias malabaricus (Characiformes, Erythrinidae) in subtropical lakes food webs: a mesocosm approach[J]. Hydrobiologia, 2010, 664(4): 325-335. |
| [8] |
MORT M A. Cyclomorphosis in Daphnia galeata mendotae: variation and stability in phenotypic cycles[J]. Hydrobiologia, 1989, 171(2): 159-170. DOI:10.1007/BF00008176 |
| [9] |
RIESSEN H P. Predator-induced life history shifts in Daphnia: a synthesis of studies using meta-analysis[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1999, 56(12): 2487-2494. DOI:10.1139/f99-155 |
| [10] |
RIESSEN H P, GILBERT J J. Divergent developmental patterns of induced morphological defenses in rotifers and Daphnia: ecological and evolutionary context[J]. Limnology and Oceanography, 2019, 64(2): 541-557. DOI:10.1002/lno.11058 |
| [11] |
SPERFELD E, NILSSEN J P, RINEHART S, et al. Ecology of predator-induced morphological defense traits in Daphnia longispina (cladocera, arthropoda)[J]. Oecologia, 2020, 192(3): 687-698. DOI:10.1007/s00442-019-04588-6 |
| [12] |
HAMMILL E, ROGERS A, BECKERMAN A P. Costs, benefits and the evolution of inducible defences: a case study with Daphnia pulex[J]. Journal of Evolutionary Biology, 2008, 21(3): 705-715. DOI:10.1111/j.1420-9101.2008.01520.x |
| [13] |
CARTER M J, LIND M I, DENNIS S R, et al. Evolution of a predator-induced, nonlinear reaction norm[J]. Proceedings of the Royal Society B: Biological Sciences, 2017, 284(1861): 20170859. DOI:10.1098/rspb.2017.0859 |
| [14] |
DENNIS S R, CARTER M J, HENTLEY W T, et al. Phenotypic convergence along a gradient of predation risk[J]. Proceedings of the Royal Society B: Biological Sciences, 2011, 278(1712): 1687-1696. DOI:10.1098/rspb.2010.1989 |
| [15] |
COORS A, DE MEESTER L. Synergistic, antagonistic and additive effects of multiple stressors: predation threat, parasitism and pesticide exposure in Daphnia magna[J]. Journal of Applied Ecology, 2008, 45(6): 1820-1828. DOI:10.1111/j.1365-2664.2008.01566.x |
| [16] |
HEBERT P D N. Cyclomorphosis in natural populations of Daphnia cephalata King[J]. Freshwater Biology, 1978, 8(1): 79-90. DOI:10.1111/j.1365-2427.1978.tb01429.x |
| [17] |
杨瑞斌, 边书京, 周洁, 等. 梁子湖麦穗鱼食性的研究[J]. 华中农业大学学报, 2004, 23(3): 331-334. YANG R B, BIAN S J, ZHOU J, et al. Study on food habits of Pseudorasbora parva in Liangzi Lake[J]. Journal of Huazhong Agricultural University, 2004, 23(3): 331-334. DOI:10.3321/j.issn:1000-2421.2004.03.013 |
| [18] |
JEPPESEN E, MEERHOFF M, HOLMGREN K, et al. Impacts of climate warming on lake fish community structure and potential effects on ecosystem function[J]. Hydrobiologia, 2010, 646(1): 73-90. DOI:10.1007/s10750-010-0171-5 |
| [19] |
LAZZARO X. Do the trophic cascade hypothesis and classical biomanipulation approaches apply to tropical lakes and reservoirs?[J]. SIL Proceedings, 1922-2010, 1997, 26(2): 719-730. DOI:10.1080/03680770.1995.11900811 |
| [20] |
RABUS M, LAFORSCH C. Growing large and bulky in the presence of the enemy: Daphnia magna gradually switches the mode of inducible morphological defences[J]. Functional Ecology, 2011, 25(5): 1137-1143. DOI:10.1111/j.1365-2435.2011.01840.x |
| [21] |
高菡. 食蚊鱼(Gambusia affinis)捕食与铜绿微囊藻(Microcystis aeruginosa)毒性对两种浮游动物抗性进化的作用[D]. 上海: 华东师范大学, 2016. GAO H. Effects of Gambusia affinis predation and Microcystis aeruginosa toxicity on rapid evolution of two aquatic grazers[D]. Shanghai: East China Normal University, 2016. |
| [22] |
DODSON S I. The ecology and evolution of inducible defenses[J]. Limnology and Oceanography, 1999, 44(6): 1597-1597. |
| [23] |
IMAI M, NARAKI Y, TOCHINAI S, et al. Elaborate regulations of the predator-induced polyphenism in the water flea Daphnia pulex: kairomone-sensitive periods and life-history tradeoffs[J]. Journal of Experimental Zoology Part A: Ecological and Integrative Physiology, 2009, 331A(10): 788-795. |
| [24] |
SARMA S S S, NANDINI S, GULATI R D. Life history strategies of cladocerans: comparisons of tropical and temperate taxa[J]. Hydrobiologia, 2005, 542(1): 315-333. DOI:10.1007/s10750-004-3247-2 |
| [25] |
JEPPESEN E, MEERHOFF M, JACOBSEN B A, et al. Restoration of shallow lakes by nutrient control and biomanipulation—the successful strategy varies with lake size and climate[J]. Hydrobiologia, 2007, 581(1): 269-285. DOI:10.1007/s10750-006-0507-3 |
| [26] |
HAVENS K E, BEAVER J R. Composition, size, and biomass of zooplankton in large productive Florida lakes[J]. Hydrobiologia, 2011, 668(1): 49-60. DOI:10.1007/s10750-010-0386-5 |
| [27] |
MACHÁČEK J. Inducibility of life history changes by fish kairomone in various developmental stages of Daphnia[J]. Journal of Plankton Research, 1995, 17(7): 1513-1520. DOI:10.1093/plankt/17.7.1513 |
| [28] |
LAFORSCH C, TOLLRIAN R. Embryological aspects of inducible morphological defenses in Daphnia[J]. Journal of Morphology, 2004, 262(3): 701-707. DOI:10.1002/jmor.10270 |
| [29] |
CARAMUJO M J, BOAVIDA M J. Induction and costs of tail spine elongation in Daphnia hyalina×galeata: reduction of susceptibility to copepod predation[J]. Freshwater Biology, 2000, 45(4): 413-423. DOI:10.1046/j.1365-2427.2000.00642.x |
| [30] |
ORCUTT D J JR, PORTER K G. Diel vertical migration by zooplankton: constant and fluctuating temperature effects on life history parameters of Daphnia[J]. Limnology and Oceanography, 1983, 28(4): 720-730. DOI:10.4319/lo.1983.28.4.0720 |
| [31] |
VANNI M J, FINDLAY D L. Trophic cascades and phytoplankton community structure[J]. Ecology, 1990, 71(3): 921-937. DOI:10.2307/1937363 |
| [32] |
BENNDOR J. Conditions for effective biomanipulation; conclusions derived from whole-lake experiments in Europe[J]. Hydrobiologia, 1990, 200(1): 187-203. |
| [33] |
SCHULZE P C, GILLESPIE J H, WOMBLE J R, et al. The effect of suspended sediments on lake Texoma Daphnia: field distributions and in situ incubations[J]. Freshwater Biology, 2006, 51(8): 1447-1457. DOI:10.1111/j.1365-2427.2006.01579.x |
| [34] |
MEIJER M L, RAAT A J P, DOEF R W. Restoration by biomanipulation of lake Bleiswijkse Zoom (The Netherlands): first results[J]. Hydrobiological Bulletin, 1989, 23(1): 49-57. DOI:10.1007/BF02286426 |
2. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China
 2022,
Vol. 31
2022,
Vol. 31


