2. 上海海洋大学 食品热加工工程技术研究中心, 上海 201306;
3. 蚌埠天成包装科技股份有限公司, 安徽 蚌埠 233000
包合技术是一种分子被包嵌于另一种分子的空穴结构内形成包合物的技术[1]。β-环糊精(β- Cyclodextyin, β-CD) 是由7个葡萄糖分子连续结合而成的环状结构化合物, 其立体结构类似空心圆台, 内部以氧原子为主, 具有疏水性; 外部以羟基为主, 具有亲水性, 能与很多物质形成包合物, 包括稀有气体、卤素、染料、香料、药物、食品、农药和防腐剂等。包接后, 其稳定性、挥发性、溶解性、反应性都有所改善。环糊精的这种特殊作用,使它成为具有广泛应用价值的包接材料[2-4]。
佛手柑精油(Citrus bergamia Essential oil, CBO)与山苍子精油(Litsea cubeba Essential oil, LCO)是天然的抗菌剂,具有健胃、消炎、解热和镇痛等多种医学功效,因而在食品工业生产中获得了应用,被公认为是安全无毒[5](generally recognized as safe, GRAS)的食品添加剂。佛手柑精油的主要成分是柠檬烯,山苍子精油的主要成分为柠檬醛和柠檬烯,柠檬醛和柠檬烯具有良好的抑菌性能[6],且作用迅速。研究[7-8]表明,添加佛手柑精油和山苍子精油的食品具有良好的抑菌活性,能够抑制食品表面的微生物,降低其腐败率。
近年来,由于用天然产品替代合成添加剂的需求不断增加,精油的使用量有所增加。作为合成添加剂的替代品,精油因其抗菌和抗氧化特性可用于食品保存。精油的挥发性限制了它们作为食品防腐剂的应用,因其热不稳定且需要封装,而β-环糊精具有良好包合特性,可将具有抗菌性能的精油微胶囊化,使其均匀稳定释放,在使用的过程中通过释放到食品的表面而发挥功效[9]。因此,将精油包封到微囊中是克服精油不稳定、易挥发等缺点的有效替代方法[10]。
本实验采用微囊化技术,用β-环糊精包埋佛手柑精油和山苍子精油制得抗菌微囊,将β-环糊精-精油微囊均匀分散在吸水垫中,并将吸水垫封合,制备出负载微胶囊的活性保鲜垫。微囊化增强了精油保鲜垫中的稳定性,在吸水垫中,微囊遇水缓释,使精油可以缓慢释放用于草鱼保鲜。以菌落总数、挥发性盐基氮、硫代巴比妥酸、pH及质构指标,分析β-环糊精-精油微囊应用于草鱼冷藏保鲜,考察具有β-环糊精-精油微胶囊的保鲜垫对草鱼鱼肉品质变化的影响。
1 材料与方法 1.1 材料与仪器 1.1.1 材料佛手柑精油,山苍子精油,吉安市中香天然植物有限公司生产;草鱼(Ctenopharyngodon idella)和佳好合生鲜吸水垫购自上海市浦东新区古棕路农工商超市;β-环糊精,无水乙醇GR,氯化钠,无菌均质袋,轻质氧化镁AR、硼酸AR、甲基红指示剂、溴甲酚绿指示剂,国药集团化学试剂有限公司生产。
1.1.2 主要仪器设备FA1104A型电子天平,上海精密科学仪器有限公司;CJJ-931型恒温磁力搅拌器;DHP-9082电热恒温培养箱,上海一恒化学仪器有限公司;GZX-GF101-3-S-2电热恒温鼓风干燥箱,上海贺德实验设备有限公司;,SANYO*MLS-3750高压灭菌锅,日本三洋生物有限公司;Labconco超净工作台,美国Labconco公司;全自动凯氏定氮仪,美国FOSS公司;PHSJ-4F pH计,上海仪电科学仪器股份有限公司;捣碎机,均质机,上海标本模型厂;高速冷冻离心机,湘仪离心机仪器有限公司。
1.2 试验方法 1.2.1 β-环糊精-精油微囊的制备将佛手柑精油及山苍子精油与乙醇按质量体积比为1 g∶20 mL的比例充分混合搅拌,得到连续相稳定溶液[11]。β-CD与去离子水质量体积比为1 g∶10 mL,在恒温水浴磁力搅拌器(转速120 r/min)中,恒温60 ℃搅拌60 min[12]。待β-CD完全溶解至澄清溶液后,加入已溶解的佛手柑精油及山苍子精油并迅速搅拌4 h。冷凝至室温后,在4 ℃下保存,静置24 h,真空抽滤。用无水乙醇和去离子水分别洗涤3次,在45 ℃下,真空干燥至恒定质量,干燥时间为4 h,将干燥后的β-环糊精-佛手柑精油微囊(β-CD-CBO)与β-环糊精-山苍子精油微囊(β-CD-LCO)密封好备用[13]。
1.2.2 β-环糊精-精油微囊活性保鲜垫制备称量干燥后的β-CD-CBO与β-CD-LCO微囊粉末2 g置于吸水垫内,分散均匀并热封。每组保鲜垫制备30个,共3组,备用。
1.2.3 草鱼前处理将购买的新鲜草鱼运输至经臭氧杀菌后的实验室内,于实验操作台上将草鱼去皮、剔骨、分割,分别称取50 g的鱼肉至放置有β-CD-CBO与β-CD-LCO微囊活性保鲜垫内和无活性的吸水垫的托盒并热封,贴标签后将3组装有草鱼的吸水垫托盒置于(4 ± 1)℃条件下冷藏。同时留有新鲜草鱼肉样品用于测试当天理化指标,记录草鱼的初始理化值;此外,每天定时从每组分别取3袋样品(取样至第7天)进行平行试验,分析草鱼各鲜度指标。
1.2.4 菌落总数的测定参考GB 4789.2—2016[14]平板计数法测定冷藏草鱼片中微生物的菌落总数(total viable counts, TVC),菌落计数单位log(CFU/g),每组平行3次,记录数据。
1.2.5 挥发性盐基氮的测定参考GB 5009.228—2016[15],利用全自动凯氏定氮仪测定草鱼肉的挥发性盐基氮(total volatile base nitrogen, TVB-N)含量。
1.2.6 pH的测定从每种保鲜垫中准确称取草鱼肉5.0 g,切碎放入装有50 mL蒸馏水的烧杯,高速匀浆机匀浆1 min并静置30 min后,PHSJ-4F pH计测定,记录数据[16]。
1.2.7 硫代巴比妥酸的测定参考HU等[17]的检测方法,测定活性保鲜垫冷藏的草鱼硫代巴比妥酸(Thiobarbituric acid reactive substances, TBARS),记录数据。
1.2.8 质构的测定参考杨辉等[18]的检测方法,略作修改。采用TA-XT plus质构分析仪测定草鱼肉的质构结果。鱼肉切片的平均厚度为15 mm。采用直径为5 mm的P5探头,利用TPA模式,测试速率为1 mm/s,压缩程度为30%,触发力为0.049 N。每个样品表面各测试6个点。分析活性保鲜垫冷藏草鱼片的硬度、弹性、回复性等物理性质变化。
1.3 数据处理使用SPSS Statistics进行方差分析,最小显著差数法(LSD)进行显著性分析(P<0.05)。采用Origin 8.0作图。
2 结果与分析 2.1 草鱼的菌落总数测定由图 1可知,冷藏保鲜期间,3组保鲜垫下冷藏草鱼片样品的TVC值均随着冷藏时间的延长出现不同程度的增长趋势。新鲜草鱼肉初始TVC值为3.40 log CFU/g,冷藏过程中,空白组保鲜垫冷藏保鲜的草鱼TVC增长变化显著高于有β-CD-CBO微囊及β-CD-LCO微囊的实验组保鲜垫包装的草鱼TVC值(P<0.05)。国际微生物规格委员会(ICMSF)食品微生物限量规定[19]鱼的TVC值接受上限是5×105CFU/g (约5.69 log CFU/g),而冷藏至第4天时,空白组包装的草鱼片样品,其TVC已达到接受上限值,为5.88 log CFU/g,这也表明空白组在冷藏条件下能贮藏至4 d发生腐败。结果表明,随着涂有β-CD-CBO微囊和β-CD-LCO微囊保鲜垫中CBO和LCO在鱼肉中的缓慢释放的积累,CBO与LCO抑制草鱼片中腐败微生物生长的作用显著增强,相较于空白组而言,实验组活性保鲜垫包装延长了草鱼片货架期2~3 d。
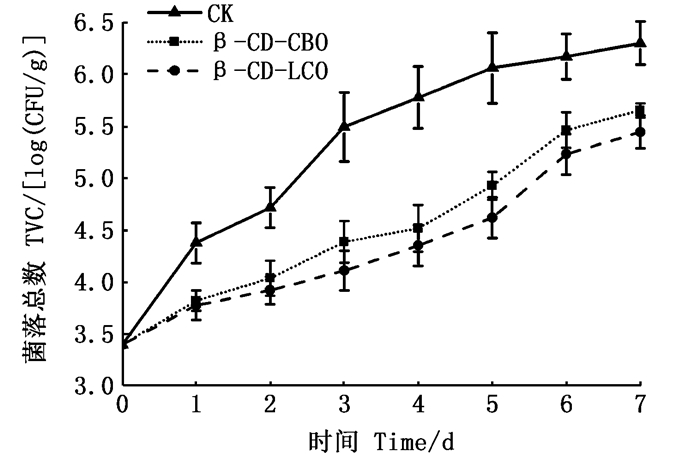
|
图 1 冷藏条件下草鱼细菌总数的变化 Fig. 1 Change in total bacterial count of grass carp slice during cold storage |
CBO和LCO具有极强的杀菌、抑菌作用,涂有β-CD-CBO微囊及β-CD-LCO微囊的保鲜垫,其活性成分柠檬烯和柠檬醛在吸水垫接触鱼肉通过释放方式累积到草鱼肉表面,通过破坏细胞壁和细胞质膜渗入细胞内导致细胞裂解死亡,从而破坏了微生物完整的结构,抑制其繁殖速率[20]。因此实验组涂有β-CD-CBO微囊及β-CD-LCO微囊的保鲜垫在一定程度上有效地抑制了草鱼片内腐败菌的生长,进而更好地保持了冷藏过程中草鱼的品质[21]。
2.2 草鱼TVB-N检测分析图 2显示了(4±1)℃条件下3组保鲜垫包装对冷保鲜草鱼片TVB-N值的影响。新鲜草鱼肉的TVB-N初始值为9.34 mg/100 g。在贮藏过程中,TVB-N含量随贮藏时间的延长逐渐增长,说明随着贮藏时间的延长,草鱼肉品质逐渐下降。冷藏第7天,空白组保鲜垫、实验组涂有β-CD-CBO微囊及β-CD-LCO微囊的保鲜垫所包装的草鱼片的TVB-N含量分别为14.06、12.32和12.04 mg/100 g,空白组的TVB-N含量显著高于实验组保鲜垫包装的草鱼片样品(P<0.05),这说明CBO与LCO的存在抑制了微生物将蛋白质分解形成含氨物质的过程, 从而有效减缓草鱼的腐败速度随着贮藏时间的延长TVB-N值逐渐升高[22],这也与微生物结果也一致。
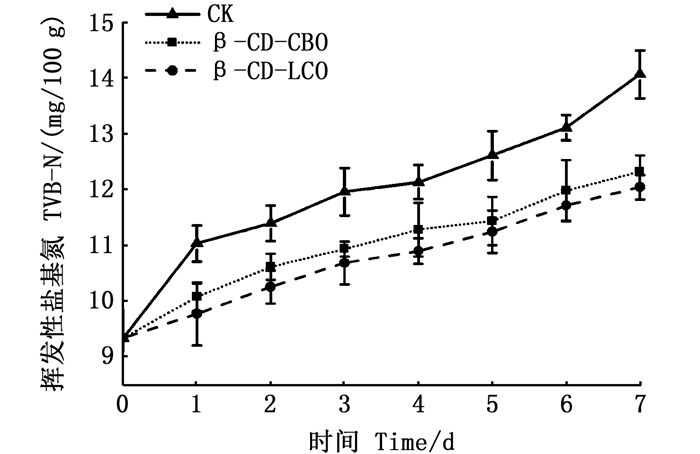
|
图 2 冷藏期间草鱼片的TVB-N值变化 Fig. 2 Changes in TVB-N values for grass carp slice during 7 days of storage at (4 ± 1) ℃ |
实验初期新鲜草鱼片的pH为6.72,与其他研究者[22]的结果相近。冷藏保鲜期间,3组保鲜垫中草鱼片样品的pH呈上升的趋势。这是由于鱼肉体内腐败微生物的生长导致挥发性成分的产生,如氨气和精乙胺等物质,造成草鱼自身的蛋白质发生分解,产生含氮的小分子物质,进而pH升高[23]。见图 3。
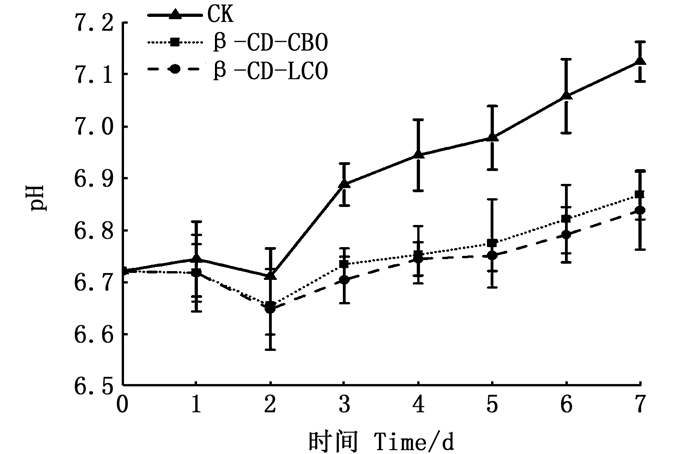
|
图 3 冷藏期间草鱼片的pH变化 Fig. 3 Changes in pH for grass carp slice during 7 days of storage at (4 ± 1) ℃ |
随着冷藏时间的延长,空白组草鱼片样品的pH持续上升,冷藏第7天时,其pH为7.12;由图 3可知,冷藏前中期,涂有β-CD-CBO微囊及β-CD-LCO微囊的保鲜垫所包装的草鱼片中pH曲线上升缓慢,这主要是由于冷藏过程中保鲜垫内的CBO和LCO分别从微胶囊中释放到包装袋内,并吸附累积到草鱼肉片表面,自身的抗菌抗氧化特性使得其在草鱼肉片表面有效抑制腐败微生物生长,减缓酶作用[24],延缓了鱼肉的腐败。冷藏后期,涂有β-CD-CBO微囊及β-CD-LCO微囊的实验组草鱼肉样品的pH曲线分别以不同速率上升,这可能是由于后期鱼肉内的微生物繁殖数量逐步超出CBO和LCO释放量发挥抗菌抗氧化作用的有效上限,加速了鱼肉的腐败,pH曲线上升[25]。该现象也与鱼肉中菌落总数的变化趋势相符。
2.4 草鱼TBA的检测分析草鱼片中TBA值越大,说明脂质氧化程度越高,草鱼肉的腐败程度越高[26]。鱼肉中的脂肪氧化会产生一些不愉快的味道,同时还对鱼肉的质构结果产生影响[22]。冷藏期间,草鱼肉的TBA值变化如图 4所示。草鱼肉的初始TBA值为0.214 mg MDA/kg;在不同保鲜垫包装冷藏保鲜草鱼肉过程中,3组鱼肉样品的TBA值均随着冷藏时间的延长出现不同程度的增长趋势。空白组保鲜垫包装的草鱼样品的TBA值上升趋势显著高于涂有β-CD-CBO和β-CD-LCO微囊的实验组(P<0.05)。在贮藏第7天时,3组的TBA值分别为0.883、0.664和0.623 mg MDA/kg,此时空白组的TBA值高于实验组,且涂有β-CD-LCO微囊的实验组的TBA值最低。这一结果与其他保鲜指标的变化情况相一致。随着冷藏时间的延长,精油从微囊释放到草鱼肉中,释放到鱼肉中的精油利用自身抗菌抗氧化特性在一定程度上抑制了草鱼肉中的微生物生长及脂质氧化,从而减缓了鱼肉的氧化腐败,保持了草鱼肉的品质[26-27]。
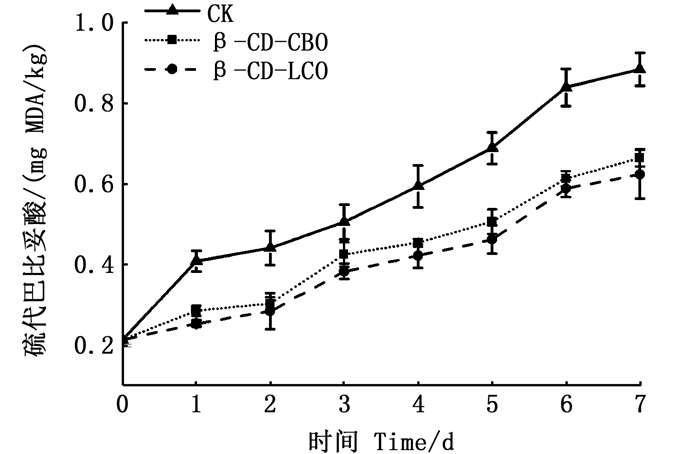
|
图 4 冷藏期间草鱼片的TBA值变化 Fig. 4 Changes in TBA values for grass carp slice during 7 days of storage at (4 ± 1) ℃ |
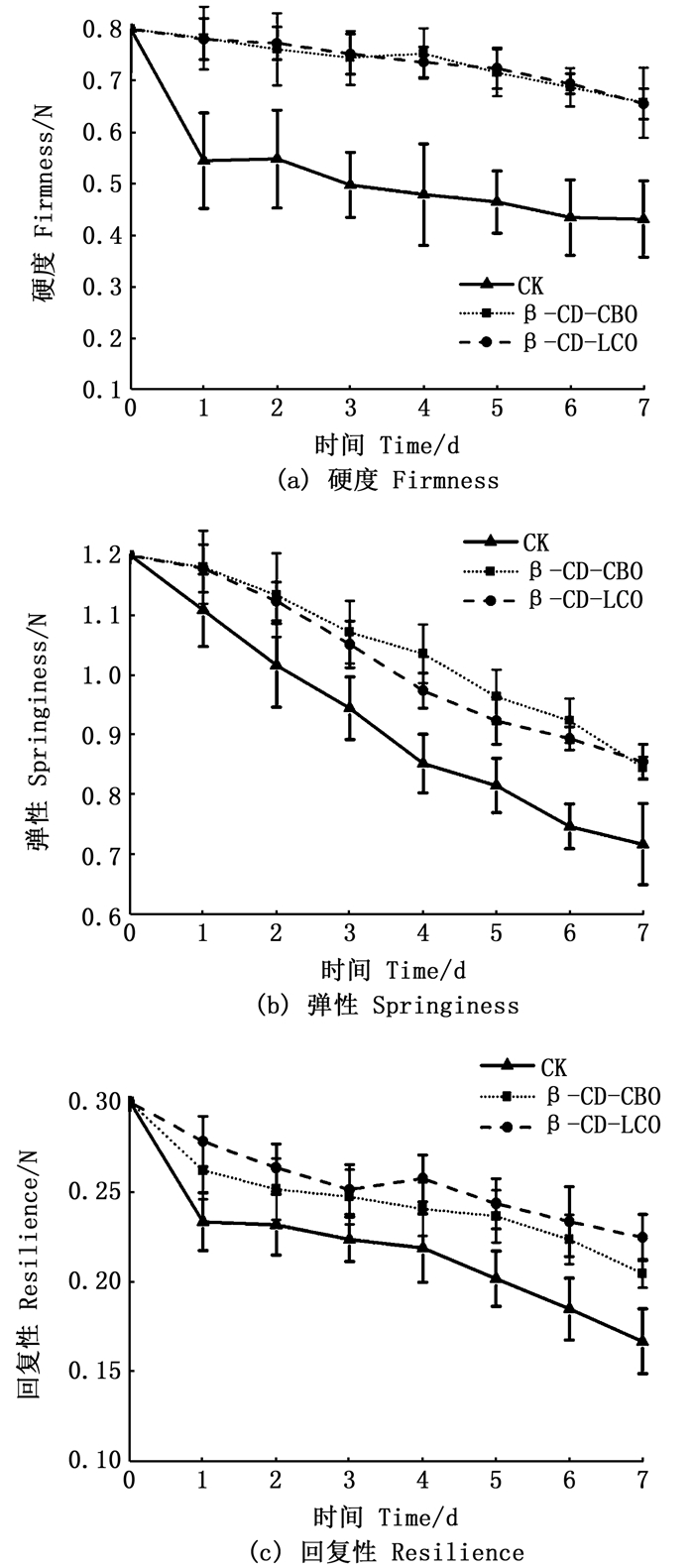
冷藏保鲜草鱼肉的质构检测,本实验研究主要分析了草鱼肉的硬度。弹性,回复性指标的变化。图 5显示,冷藏保鲜的空白组和实验组草鱼样品的硬度、弹性,回复性指标在贮藏期间均呈下降趋势,鱼肉逐渐失去新鲜的质构特征,逐渐变软。鱼死亡后,由于自溶和微生物分解导致的肌原纤维蛋白的变化,是肌肉变软和失去弹性的重要原因[28-29]。
|
图 5 冷藏期间草鱼片的硬度,弹性和回复性的变化 Fig. 5 Changes of firmness, springiness and resilience of grass carp slice during 7 days of storage at (4 ± 1) ℃ |
与实验组相比,空白组保鲜垫中草鱼片的质地指数下降较快。贮藏期间,涂有微囊实验组中草鱼的硬度、弹性、回复性平均值均显著高于空白组。在贮藏第7天时,两组实验组间草鱼肉的硬度、弹性和回复性无显著差异,但涂有β-CD-CBO和β-CD-LCO微囊的实验组中草鱼肉的硬度、弹性和回复性分别达到空白组鱼肉的1.59、1.18和1.35倍(P<0.05)。细菌的生长和草鱼的脱水,使得鱼肉中的蛋白质发生了变性,破坏了肌肉蛋白中的二硫键。随后,鱼的肌肉变软,弹性和回复性变差[30]。很显然,由于活性保鲜垫中有精油的抗菌和抗氧化作用,实验组鱼类的纹理降解速度减慢,也说明活性保鲜垫在草鱼的保鲜方面具有良好的优势。
3 结论本研究以β-环糊精为壁材,佛手柑精油与山苍子精油为芯材,通过环糊精包埋的方法制备β-CD-CBO与β-CD-LCO微胶囊。将微胶囊粉末均匀分散在保鲜垫中,封装,制备负载微胶囊的活性保鲜垫,并应用于草鱼肉片的冷藏保鲜研究。对草鱼保鲜指标进行表征,结果表明,分散有β-CD-CBO与β-CD-LCO微胶囊的保鲜垫对草鱼肉片有着较为理想的保鲜效果,草鱼片中CBO与LCO的释放量累积,增强了精油在冷藏草鱼片保鲜中的抗菌抗氧化特性,有效抑制了腐败微生物的生长,减缓了脂质氧化,在一定程度上维持了草鱼的品质;空白组保鲜垫包装的草鱼片样品在冷藏第4天时,理化指标逐渐达到接受上限,鱼肉出现腐败;实验组保鲜垫包装的草鱼片在第7天开始腐败,且有β-CD-LCO微胶囊的保鲜垫保鲜效果最好。相较于空白组保鲜垫,本研究制备的含有β-CD-CBO与β-CD-LCO微胶囊保鲜垫有效减缓了草鱼的腐败变质,维持了草鱼品质,延长了草鱼货架期2~3 d。
| [1] |
娄兴维, 罗志军, 胡鹏刚, 等. 四种β-环糊精制备鞣花酸包合物的抗氧化性研究[J]. 中国酿造, 2020, 39(4): 114-120. LOU X W, LUO Z J, HU P G, et al. Antioxidant property of Ellagic acid inclusion complex prepared by four β-cyclodextrins[J]. China Brewing, 2020, 39(4): 114-120. |
| [2] |
黄健榕, 杨凤, 仲雨叶, 等. 环糊精包合物的研究进展[J]. 广东化工, 2015, 42(19): 87-88. HUANG J R, YANG F, ZHONG Y Y, et al. Research on Cyclodextrin inclusion complex[J]. Guangdong Chemical Industry, 2015, 42(19): 87-88. DOI:10.3969/j.issn.1007-1865.2015.19.042 |
| [3] |
胡伊力格其. β-环糊精包合技术在中药制剂中的应用概述[J]. 山东中医杂志, 2015, 34(11): 892-894. HU Y L G Q. An overview on the appliciation of β-cyclodextrin inclusion technology in traditional Chinese medicine preparations[J]. Shandong Journal of Traditional Chinese Medicine, 2015, 34(11): 892-894. |
| [4] |
李娜, 刘德旺, 赵红梅, 等. 四味土木香散挥发油的β-环糊精包合工艺[J]. 中成药, 2020, 42(3): 558-563. LI N, LIU D W, ZHAO H M, et al. β-Cyclodextrin inclusion process for volatile oils of Siwei Tumuxiang Powder[J]. Chinese Traditional Patent Medicine, 2020, 42(3): 558-563. DOI:10.3969/j.issn.1001-1528.2020.03.002 |
| [5] |
RUIZ-NAVAJAS Y, VIUDA-MARTOS M, SENDRA E, et al. In vitro antibacterial and antioxidant properties of chitosan edible films incorporated with Thymus moroderi or Thymus piperella essential oils[J]. Food Control, 2013, 30(2): 386-392. DOI:10.1016/j.foodcont.2012.07.052 |
| [6] |
杨荣华. 佛手柑精油化学成分的分析[J]. 分析化学, 2002, 30(9): 1149. YANG R H. Analysis of chemical constituents of essential oil in fingered citron[J]. Chinese Journal of Analytical Chemistry, 2002, 30(9): 1149. DOI:10.3321/j.issn:0253-3820.2002.09.035 |
| [7] |
吴均, 杨钦滟, 赵晓娟, 等. 山苍子油的抑菌活性及机理研究[J]. 食品工业科技, 2013, 34(17): 119-121, 125. WU J, YANG Q Y, ZHAO X J, et al. Study on antimicrobial activities and antimicrobial mechanism of essential oil from Litsea cubeba[J]. Science and Technology of Food Industry, 2013, 34(17): 119-121, 125. |
| [8] |
吕飞. 天然植物精油的抑菌活性及其作用机理研究[D]. 北京: 北京化工大学, 2011. LYU F. Antimicrobial effects and mechanism of action of selected plant essential oils[D]. Beijing: Beijing University of Chemical Technology, 2011. |
| [9] |
李娅男, 吕飞, 梁浩, 等. 4种植物精油体外抑菌活性及其稳定性的研究[J]. 北京化工大学学报(自然科学版), 2012, 39(3): 81-85. LI Y N, LYU F, LIANG H, et al. The antimicrobial activity of four essential oils and their stabilities[J]. Journal of Beijing University of Chemical Technology (Natural Science Edition), 2012, 39(3): 81-85. DOI:10.3969/j.issn.1671-4628.2012.03.016 |
| [10] |
DORMAN H J D, DEANS S G. Antimicrobial agents from plants: antibacterial activity of plant volatile oils[J]. Journal of Applied Microbiology, 2000, 88(2): 308-316. DOI:10.1046/j.1365-2672.2000.00969.x |
| [11] |
DENIS-ROHR A, BASTARRACHEA L J, GODDARD J M. Antimicrobial efficacy of N-Halamine coatings prepared via dip and spray layer-by-layer deposition[J]. Food and Bioproducts Processing, 2015, 96: 12-19. DOI:10.1016/j.fbp.2015.06.002 |
| [12] |
DURANGO A M, SOARES N F F, ANDRADE N J. Microbiological evaluation of an edible antimicrobial coating on minimally processed carrots[J]. Food Control, 2006, 17(5): 336-341. DOI:10.1016/j.foodcont.2004.10.024 |
| [13] |
周瑜芳, 李亚, 甄卫军. 环糊精与聚合物包合物的制备、性能及应用[J]. 塑料科技, 2016, 44(8): 97-101. ZHOU Y F, LI Y, ZHEN W J. Review on preparation, properties and application of cyclodextrin-polymer inclusion complexes[J]. Plastics Science and Technology, 2016, 44(8): 97-101. |
| [14] |
中华人民共和国国家卫生和计划生育委员会, 国家食品药品监督管理总局. GB 4789.2-2016食品安全国家标准食品微生物学检验菌落总数测定[S]. 北京: 中国标准出版社, 2016. National Health and Family Planning Commission of PRC, China Food and Drug Administration. GB 4789.2-2016 National food safety standard food microbiological examination: aerobic plate count[S]. Beijing: Standards Press of China, 2016. |
| [15] |
中华人民共和国国家卫生和计划生育委员会. GB 5009.228-2016食品安全国家标准食品中挥发性盐基氮的测定[S]. 北京: 中国标准出版社, 2016. National Health and Family Planning Commission of PRC. GB 5009.228-2016 National food safety standard -Determination of volatile base nitrogen in food[S]. Beijing: Standards Press of China, 2016. |
| [16] |
SUMAN S P, MANCINI R A, JOSEPH P, et al. Packaging-specific influence of chitosan on color stability and lipid oxidation in refrigerated ground beef[J]. Meat Science, 2010, 86(4): 994-998. DOI:10.1016/j.meatsci.2010.08.006 |
| [17] |
HU S F, WANG H L, HAN W Y, et al. Development of double-layer active films containing pomegranate peel extract for the application of pork packaging[J]. Journal of Food Process Engineering, 2017, 40(2): e12388. DOI:10.1111/jfpe.12388 |
| [18] |
杨辉, 杨福馨, 欧丽娟, 等. 植物精油-EVOH活性包装膜对草鱼鱼肉保鲜效果的研究[J]. 食品科学, 2014, 35(22): 320-324. YANG H, YANG F X, OU L J, et al. Evaluation of active EVOH packaging films incorporated with essential oils for quality preservation of grass carp during cold storage[J]. Food Science, 2014, 35(22): 320-324. DOI:10.7506/spkx1002-6630-201422062 |
| [19] |
PAPADOPOULOS V, CHOULIARA I, BADEKA A, et al. Effect of gutting on microbiological, chemical, and sensory properties of aquacultured sea bass (Dicentrarchus labrax) stored in ice[J]. Food Microbiology, 2003, 20(4): 411-420. DOI:10.1016/S0740-0020(02)00148-X |
| [20] |
彭湘莲, 付红军. 山苍子精油的提取及其抑菌研究现状[J]. 林产工业, 2018, 45(11): 51-54. PENG X L, FU H J. The extraction of Litsea cubeba essential oil and its antibacterial research status[J]. China Forest Products Industry, 2018, 45(11): 51-54. |
| [21] |
WANG Z, HU S F, GAO Y P, et al. Effect of collagen-lysozyme coating on fresh-salmon fillets preservation[J]. LWT- Food Science and Technology, 2017, 75: 59-64. DOI:10.1016/j.lwt.2016.08.032 |
| [22] |
QUITRAL V, DONOSO L, ORTIZ J, et al. Chemical changes during the chilled storage of Chilean jack mackerel (Trachurus murphyi): effect of a plant-extract icing system[J]. LWT-Food Science and Technology, 2009, 42(8): 1450-1454. DOI:10.1016/j.lwt.2009.03.005 |
| [23] |
TUCKEY N P L, FORSTER M E, GIESEG S P. Effects of rested harvesting on muscle metabolite concentrations and K-values in chinook salmon (Oncorhynchus tshawytscha) Fillets during Storage at 15℃[J]. Journal of Food Science, 2010, 75(5): C459-C464. DOI:10.1111/j.1750-3841.2010.01648.x |
| [24] |
DEL MAR CASTRO LÓPEZ M, DE DICASTILLO C L, VILARIÑO J M L, et al. Improving the capacity of polypropylene to be used in antioxidant active films: incorporation of plasticizer and natural antioxidants[J]. Journal of Agricultural and Food Chemistry, 2013, 61(35): 8462-8470. DOI:10.1021/jf402670a |
| [25] |
杨春香. 活性PLA-PBSA包装薄膜中功能性成分的释放及对三文鱼片冷藏保鲜的研究[D]. 上海: 上海海洋大学, 2018. YANG C X. Release of functional compounds from active PLA-PBSA packaging film and its application in salmon slice preservation[D]. Shanghai: Shanghai Ocean University, 2018. |
| [26] |
户帅锋, 于洁, 赵碧洁, 等. 负载山梨酸的壳聚糖微囊-EVOH抗菌薄膜对黑鱼鱼肉保鲜的影响[J]. 食品科学, 2017, 38(15): 237-243. HU S F, YU J, ZHAO B J, et al. Effect of Antimicrobial Ethylene-Vinyl Alcohol (EVOH) copolymer film based on Sorbic acid-loaded chitosan microcapsules on the preservation of snakehead[J]. Food Science, 2017, 38(15): 237-243. DOI:10.7506/spkx1002-6630-201715038 |
| [27] |
姜杨, 李婷婷, 晋高伟, 等. 草鱼冷藏过程中新鲜度的综合评价[J]. 食品科学, 2014, 35(20): 281-285. JIANG Y, LI T T, JIN G W, et al. Comprehensive freshness evaluation of grass carp (Ctenopharyngodon idellus) during refrigerated storage[J]. Food Science, 2014, 35(20): 281-285. DOI:10.7506/spkx1002-6630-201420055 |
| [28] |
HATAE K, YOSHIMATSU F, MATSUMOTO J J. Role of muscle fibers in contributing firmness of cooked fish[J]. Journal of Food Science, 1990, 55(3): 693-696. DOI:10.1111/j.1365-2621.1990.tb05208.x |
| [29] |
周然, 刘源, 谢晶, 等. 电解水对冷藏河豚鱼肉质构及品质变化的影响[J]. 农业工程学报, 2011, 27(10): 365-369. ZHOU R, LIU Y, XIE J, et al. Effects of electrolyzed water on texture and quality of obscure puffer fish (Takifugu obscurus) during cold storage[J]. Transactions of the CSAE, 2011, 27(10): 365-369. DOI:10.3969/j.issn.1002-6819.2011.10.064 |
| [30] |
SINGH S, LEE M H, PARK I, et al. Antimicrobial seafood packaging: a review[J]. Journal of Food Science and Technology, 2016, 53(6): 2505-2518. DOI:10.1007/s13197-016-2216-x |
2. Engineering Research Center of Food Thermal-Processing Technology, Shanghai Ocean University, Shanghai 201306, China;
3. Bengbu Tiancheng Packaging Technology Co., Ltd., Bengbu 233000, Anhui, China
 2021,
Vol. 30
2021,
Vol. 30


