2. 上海海洋大学水产养殖工程研究中心, 上海 201306;
3. 上海海洋大学水产科学国家级实验教学示范中心, 上海 201306
随着水产养殖业的迅速发展,养殖水体的污染和生态环境的破坏等问题日益严重,对养殖鱼类的健康造成了潜在威胁。鱼类的健康是建立在其自身器官健康、组织结构和功能完整的基础上的,养殖鱼类的健康容易受水环境[1]和饲料成分[2]的影响,这些影响会通过器官的组织学状态进行体现[3]。同时,鱼类的肠道不仅是消化吸收营养物质的主要场所,还具有免疫的功能,在鱼类的生长发育中起着至关重要的作用[4]。国内外学者对鱼类的肠道进行了大量的研究,根据组织形态的不同,将鱼类的肠道分为前肠、中肠和后肠[5]。前肠肠腔大,肠绒毛长且排列密集,有利于储存食物,增加肠黏膜的表面积,促进食物的消化吸收;后肠肠腔小,肠绒毛短,对大分子抗原有很强的吸收能力[6]。TAMOTSU等[7]研究发现金鱼(Carassius auratus Linnaeus)的前肠是吸收脂质的主要场所,前肠黏膜上皮细胞内存在脂质包含物,被认为是脂质的临时储存处。谢碧文等[8]发现瓦氏黄颡鱼(Pelteobagrus vachelli)后肠杯状细胞密度极高,在促进粪便的排出及水分、盐分的重吸收过程中起着重要作用。
青鱼(Mylopharyngodon piceus)是我国淡水养殖的“四大家鱼”之一,以软体动物为食,由于其具有产量大、风味好、营养价值高等特点,深受广大消费者的喜爱。2016年青鱼的养殖产量达到632万t, 是联合国粮食及农业组织数据库中的重要水产养殖物种。消化酶活性与鱼类消化系统的功能相适应[9], 抗氧化酶活性和总抗氧化能力(total antioxidant capacity, T-AOC)与机体的免疫水平密切相关,对于增强吞噬细胞的防御能力和机体免疫功能有重要作用[10]。因此,使用酶活检测方法分析了青鱼不同肠段的淀粉酶、脂肪酶、胰蛋白酶、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽还原酶(glutathione reductase, GR)、过氧化氢酶(catalase, CAT)的活性和T-AOC, 以期探讨青鱼不同肠段消化和免疫功能的差异。本研究结果丰富了青鱼健康养殖和肠道功能的特异性分化的生物学资料,为青鱼的消化生理和机体免疫提供了一定的基础数据。
1 材料与方法 1.1 实验用鱼实验所用青鱼均来自上海海洋大学滨海养殖基地,养殖过程中全程投喂青鱼配合饲料(通威股份有限公司), 主要营养成分见表 1。养殖期间每天(8:00, 17:00)投喂配合饲料2次,日投喂量为池塘鱼体质量的5%, 并于2019年4月随机挑选40尾体质量为(35±2) g, 体长为(15±2) cm的青鱼,暂养于规格400 L的水箱中1周。暂养期间,投喂时间和日投喂量与池塘养殖时一致,日换水量为水箱总体积的20%。

|
表 1 青鱼配合饲料主要营养成分 Tab.1 Main nutritional components of black carp compound feed |
随机选取30尾青鱼用质量浓度为100 mg/L的MS-222麻醉,使用游标卡尺称量体长,电子天平称量体质量和肝质量。将每尾鱼的鳃、肝、脾、肠取样并放入装有体积分数为4%的多聚甲醛离心管中固定48 h, 用于后续制作各个组织的冰冻切片。另取5尾青鱼用质量浓度为100 mg/L的MS-222麻醉,取前肠段和后肠段,置于离心管中,快速液氮冷冻,-80 ℃保存,用于后续酶活检测。Fulton状态指数(fulton’s conditional factor, CF)和肝体指数(hepatic somatic index, HSI)计算公式如下:
 (1)
(1)
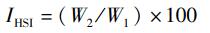 (2)
(2)
式中:FCF为Fulton状态指数;W1为青鱼体质量,g; L为青鱼体长,cm; IHSI为肝体指数;W2为青鱼肝质量,g。
1.2.2 组织切片制作固定好的组织用浓度为0.01 mol/L的磷酸缓冲盐溶液(PBS)清洗,然后放入质量分数为25%的蔗糖溶液中脱水24 h, 冰冻切片机中包埋并切片(8 μm), 苏木精-伊红(H.E)染色试剂盒染色,中性树脂封片后置于光学显微镜下观察记录并拍照。
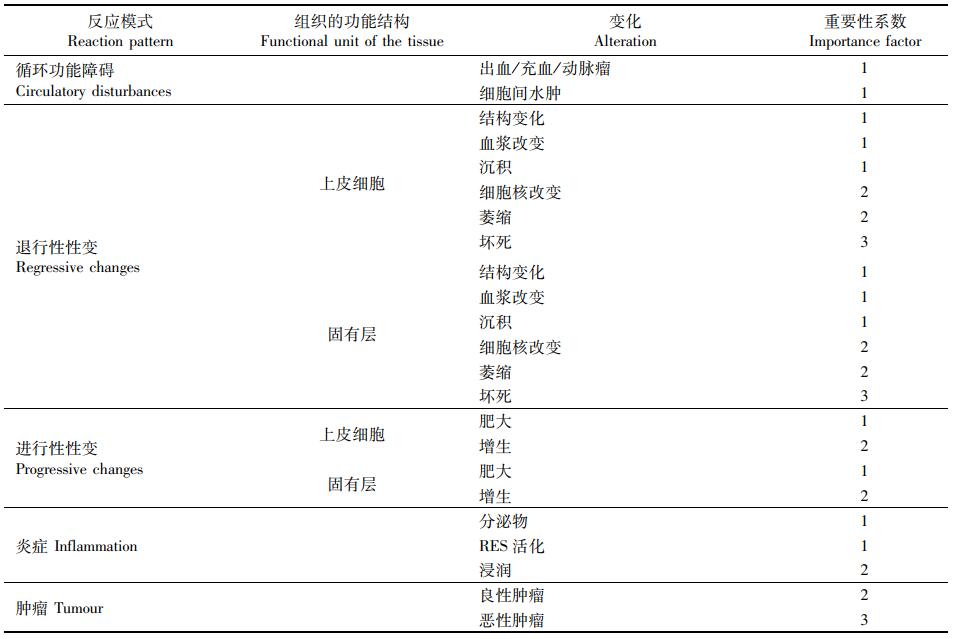
1.2.3 组织学评估根据BERNET等[11]提出的组织学半定量系统评估组织变化。包括:循环功能障碍、退行性性变、进行性性变、炎症和肿瘤5种反应模式。每种反应模式包含几种不同的组织变化,组织变化的程度用0~6的数值进行评分,重要性系数范围为1~3(表 2)。组织变化的最终值等于该变化的分值乘以重要性系数。将不同反应模式包含的最终值相加,得出该反应模式指数,即:循环功能障碍指数(circulatory disturbance index, IC)、退行性性变指数(regressive changes index, IR)、进行性性变指数(progressive changes index, IP)、炎症指数(inflammation index, II)和肿瘤指数(tumour index, IT), 各个器官所包含的最终值相加,得出该器官的器官指数(organ index, IO)。根据ZIMMERLI等[12]的分类系统,使用器官指数将组织损伤的程度从正常到严重划分为5级,Ⅰ级(指数小于11): 轻微至正常的组织学改变;Ⅱ级(指数11~20): 正常至中等的组织学改变;Ⅲ级(指数21~30): 中等的组织学改变;Ⅳ级(指数31~40): 显著的组织学改变;Ⅴ级(指数大于40): 严重的组织学改变。
|
表 2 组织病理学评估工具 Tab.2 Tools for histopathological assessment |
准确称取每条青鱼的前后肠组织各0.1 g, 然后加入0.9 mL 0.9%的生理盐水,使用低温匀浆仪和高速冷冻离心机制成质量分数为10%的组织匀浆。采用考马斯亮蓝法(coomassie blue staining)测定组织匀浆的蛋白质量浓度[13]。使用南京建成生物工程研究所的相关试剂盒对脂肪酶、淀粉酶、胰蛋白酶、SOD、GR、CAT的活性和T-AOC的含量进行测定,用紫外可见分光光度计测定酶液的吸光度(测定波长:脂肪酶为420 nm, 淀粉酶为660 nm, 胰蛋白酶为253 nm, SOD为550 nm, GR为340 nm, CAT为405 nm, T-AOC为405 nm), 然后根据试剂盒说明书中的公式分别计算脂肪酶、淀粉酶、胰蛋白酶、SOD、GR、CAT的活性和T-AOC。
1.3 数据分析数据分析采用SPSS 20.0软件进行,结果以平均值±标准差(Mean±SD)来表示,采用非参数Kruskal-Wallis检验各器官的组织学反应指标差异,并进行多重比较,使用t检验的方法来判断青鱼前肠和后肠消化酶和抗氧化能力的分布有无统计学意义上的差异,P < 0.05表示差异显著。
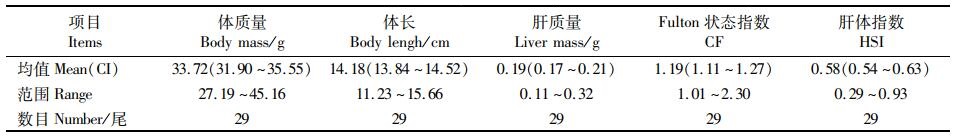
2 结果 2.1 青鱼总体的健康指数Fulton状态指数和肝体指数用于评估青鱼总体的健康指数,CF介于1.01到2.30之间,均值为1.19;HSI介于0.29到0.93之间,均值为0.58(表 3)。
|
表 3 青鱼体况参数均值及范围 Tab.3 Mean and range of body condition parameters of black carp |
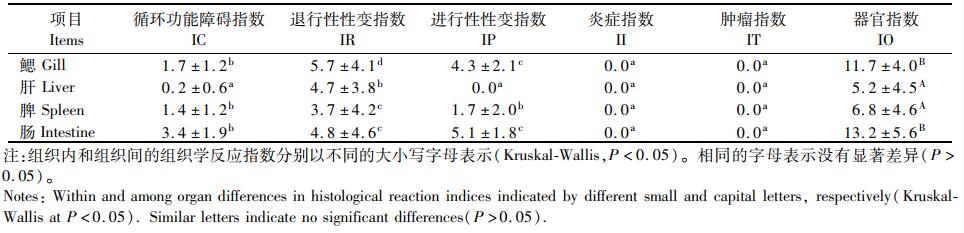
由表 4可以看出,青鱼鳃、肝、脾和肠的器官指数依次为11.7、5.2、6.8和13.2, 鳃和肠的器官指数显著大于肝和脾(P < 0.05), 肠的器官指数大于鳃,但并未达到显著水平(P > 0.05), 同时,在青鱼的鳃、肝、脾和肠中都未检测到炎症指数和肿瘤指数。
|
表 4 青鱼组织学反应指数 Tab.4 Histological response index of black carp |
在本实验中,青鱼的鳃、肝和脾均处于Ⅰ级和Ⅱ级变化,肠道达到了Ⅲ级变化(图 1)。光学显微镜下可观察到鳃上皮细胞增生和坏死,肝组织轻微扩张的正弦曲线变化和点状坏死,脾脏组织坏死以及肠黏膜上皮细胞增生和固有层易碎坏死(图版)。

|
图 1 青鱼组织变化的严重程度 Fig. 1 Severity of black carp tissue change |
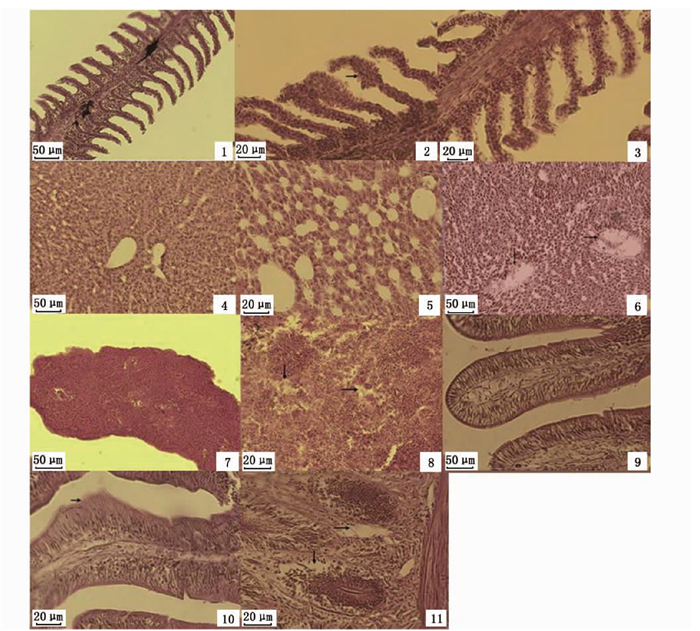
|
1.正常鳃组织; 2.鳃上皮细胞增生(箭头); 3.鳃组织坏死; 4.正常肝组织; 5.肝脏轻微扩张的正弦曲线变化; 6.肝组织点状坏死(箭头); 7.正常脾组织; 8.脾组织坏死(箭头); 9.正常肠道组织; 10.肠黏膜上皮增生(箭头); 11.肠固有层易碎坏死(箭头)。 1.Normal gill tissue; 2.Epithelial hyperplasia of gill (arrow); 3.Necrosis of gill tissue; 4.Normal liver tissue; 5.Slightly dilated sinusoid of liver; 6.Spotty necrosis of liver (arrow); 7.Normal spleen tissue; 8.Necrosis of spleen tissue (arrow); 9.Normal intestine tissue; 10.Mucosal epithelial hyperplasia of intestinal (arrow); 11.Intestinal lamina propria friable and necrotic (arrow). 图版 青鱼组织变化特征的代表性切片 Plate Representative images of histological change of black carp |
由表 5可知,前肠中与消化相关的淀粉酶、脂肪酶和胰蛋白酶的活性显著高于后肠(P < 0.05), 消化酶中,胰蛋白酶的活性最高,脂肪酶的活性次之,淀粉酶的活性最低。后肠中与抗氧化能力相关的SOD、GR、CAT的活性和T-AOC显著高于前肠(P < 0.05)。

|
表 5 青鱼前肠和后肠中的消化酶与抗氧化指标 Tab.5 Digestive enzymes and antioxidant index in the foregut and hindgut intestines of black carp |
通过分析养殖青鱼的CF、HSI和鳃、肝、脾、肠的组织学反应指数及消化酶和抗氧化能力在不同肠段的分布,可以更好地了解养殖青鱼的健康状态和不同肠段的功能分化。
CF是反映鱼类能量储存状况和健康状态的参考指标,相关研究[14]表明,CF较高的动物其运动能力和存活率显著高于CF较低的动物。LLORET等[15]在海洋鱼类资源状况及健康指标的研究中指出,CF大于1表明鱼类健康状态良好,CF小于1表明鱼类健康状态欠佳。本研究结果显示:青鱼的CF介于1.01到2.30之间,均值为1.19, 表明被检测的青鱼健康状态良好。HSI是衡量动物营养状况的参考指标,HSI随着饲料的营养程度和投喂的充足程度的增加而变大,本实验检测到的HSI介于0.29到0.93之间,均值为0.58, 这与营养实验研究中观察到的数据相比较低,可能是由于在营养实验研究中,需要对目标鱼类投喂不同的饲料,从而使营养物质积累于肝脏,增大了HSI的值。例如:汪开毓等[16]在研究草鱼(Ctenopharyngodon idella)肝脏对高脂饲料的代谢调控机制中发现,投喂8.1%脂肪的饲料时,草鱼的HSI为2.51, 显著高于投喂4.6%脂肪的饲料组;原居林等[17]研究发现,投喂配合饲料组乌鳢(Channa argus)的HSI为2.59, 显著高于投喂冰鲜鱼组乌鳢的HSI。
组织学分析显示,青鱼的鳃、肝和脾正常,处于Ⅰ级和Ⅱ级变化,肠道达到了Ⅲ级变化。在对肠道的组织学分析中发现肠黏膜上皮细胞有增生和固有层易碎坏死的现象。SARAIVA等[18]的研究中也发现了相似情况。肠道是鱼类消化和吸收营养的主要场所,与鱼类的生长、发育和繁殖等生命活动直接相关,也会参与免疫反应[19]。因此,进一步研究青鱼不同肠段消化酶及抗氧化能力的分布,从而分析青鱼不同肠段功能的差异。
淀粉酶、脂肪酶和蛋白酶可以作为评估肠道消化吸收功能的重要指标[20]。淀粉酶将淀粉催化分解成单糖[21], 脂肪酶能够将食物中的脂肪分解为脂肪酸和甘油分子[22], 胰蛋白酶是肠道中最丰富的蛋白酶,它将食物中的蛋白质水解为可供机体吸收的氨基酸[23]。AGRAWAL等[24]在比较草食性、肉食性和杂食性鱼类的淀粉酶和脂肪酶活性差异的研究中发现,脂肪酶活性在肉食性鱼类中较高,淀粉酶活性在草食性鱼类中较高。在青鱼肠道中我们发现类似的结果,即:胰蛋白酶活性 > 脂肪酶活性 > 淀粉酶活性。同时,前肠中淀粉酶活性、脂肪酶活性和胰蛋白酶活性均显著大于后肠。付新华等[25]在大菱鲆(Scophthalmus maximus)消化酶活性的研究中得到了相同的结果。以上结果表明青鱼的前肠可能是其消化吸收营养物质的主要部位。
抗氧化酶(SOD、GR、CAT)的活性和T-AOC与机体的免疫水平密切相关,对于增强吞噬细胞的防御能力和机体的免疫功能有重要作用,其作用机理是清除机体中多余的氧自由基,从而保护机体免受损伤[26-28]。T-AOC反映了机体抗氧化系统的功能状况[29]。SOD是机体内重要的抗氧化酶和机体内清除自由基的首要物质,在催化过氧化物歧化成过氧化氢和氧气的过程中发挥着重要的作用[30]。研究发现,黑斑蛙(Rana nigromaculata)在受到草甘膦染毒后,其肝脏和肾脏中的SOD活性和CAT活性增大[31]。CAT能够清除SOD催化活性氧自由基所产生的H2O2, 从而促使它转化为对机体无害的H2O和O2[32]。孙虎山等[33]发现栉孔扇贝(Chamys farreri)在受到大肠杆菌感染后,其血清中的CAT活性在15 h后显著提高。GR是一种核黄素蛋白,它可以利用还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide phosphate, NADPH)将氧化型谷胱甘肽(glutathiol, GSSG)催化反应成还原型谷胱甘肽(glutathione, GSH)[34], 对于维持生物体GSH/GSSG的稳定和保持机体氧自由基的平衡起着关键作用[35]。研究结果显示,SOD、GR、CAT的活性和T-AOC在青鱼的后肠中显著高于前肠,JIANG等[36]在维生素A对草鱼肠道影响的研究中也得到了相似的结果。这在一定程度上表明后肠在抵御机体氧化损伤、抗应激和保护肠道健康中起着关键的作用。
通过组织学和酶活检测的方法对养殖青鱼的组织状态及消化酶和抗氧化能力在肠道的分布进行研究,为青鱼的健康养殖和不同肠段在消化和免疫机制上的差异提供了一定的基础资料。
| [1] |
HARIMANA Y, TANG X, LE G W, et al. Quality parameters of black carp (Mylopharyngodon piceus) raised in lotic and lentic freshwater systems[J]. LWT-Food Science & Technology, 2018, 90: 45-52. |
| [2] |
陈书健, 吴成龙, 叶金云, 等. 饲料中维生素A对青鱼幼鱼生长、血清生化指标和肝脏糖脂代谢酶活性及基因表达的影响[J]. 水产学报, 2020, 44(1): 85-98. CHEN S J, WU C L, YE J Y, et al. Effect of dietary vitamin A on growth, serum biochemical index, digestive enzyme activities and glucose and lipid metabolism in juvenile Mylopharyngodon piceus[J]. Journal of Fisheries of China, 2020, 44(1): 85-98. |
| [3] |
VAN DER OOST R, BEYER J, VERMEULEN N P E. Fish bioaccumulation and biomarkers in environmental risk assessment: a review[J]. Environmental Toxicology and Pharmacology, 2003, 13(2): 57-149. DOI:10.1016/S1382-6689(02)00126-6 |
| [4] |
URÁN P A, GONCALVES A A, TAVERNE-THIELE J J, et al. Soybean meal induces intestinal inflammation in common carp (Cyprinus carpio L.)[J]. Fish & Shellfish Immunology, 2008, 25(6): 751-760. |
| [5] |
倪达书. 草鱼消化道组织学研究[J]. 水生生物学集刊, 1963(3): 12-25. NI D S. Histological study of grass carp digestive tract[J]. Acta Hydrobiologica Sinica, 1963(3): 12-25. |
| [6] |
涂永锋, 宋代军. 鱼类肠道组织结构及其功能适应性[J]. 江西饲料, 2004(4): 16-19. TU Y F, SONG D J. The structure and function of fish digestive system and the distribution and characteristics of digestive enzymes[J]. Jiangxi Feed, 2004(4): 16-19. DOI:10.3969/j.issn.1008-6137.2004.04.007 |
| [7] |
TAMOTSU I. The comparative study of the digestive tract of teleost larvae-V: Fat absorption in the gut epithelium of goldfish larvae[J]. Bull Japanese Society Science Fishiery, 1968, 34(1): 46-61. |
| [8] |
谢碧文, 王志坚. 瓦氏黄颡鱼消化系统组织学的初步研究[J]. 内江师范学院学报, 2002, 17(2): 22-27. XIE B W, WANG Z J. Studies on histology of digestive system of Pelteobagrus vachelli[J]. Journal of Neijiang Teachers College, 2002, 17(2): 22-27. DOI:10.3969/j.issn.1671-1785.2002.02.005 |
| [9] |
刘峰, 吕小康, 刘阳阳, 等. 禁食对大黄鱼幼鱼消化酶活性的影响研究[J]. 中国海洋大学学报, 2018, 48(s1): 16-22. LIU F, LYU X K, LIU Y Y, et al. Effect of fast on digestion enzyme activity of juvenile large Yellow Croaker (Larimichthys crocea)[J]. Periodical of Ocean University of China, 2018, 48(s1): 16-22. |
| [10] |
李京昊, 成永旭, 王海锋, 等. 利用生物絮团技术对克氏原螯虾的养殖效果初探[J]. 水产学报, 2019, 43(4): 968-977. LI J H, CHENG Y X, WANG H F, et al. A preliminary study on the feeding effect of the red swamp crayfish (Procambarus clakii) using biofloc technology[J]. Journal of Fisheries of China, 2019, 43(4): 968-977. |
| [11] |
BERNET D, SCHMIDT H, MEIER W, et al. Histopathology in fish: proposal for a protocol to assess aquatic pollution[J]. Journal of Fish Diseases, 1999, 22(1): 25-34. DOI:10.1046/j.1365-2761.1999.00134.x |
| [12] |
ZIMMERLI S, BERNET D, BURKHARDT-HOLM P, et al. Assessment of fish health status in four Swiss rivers showing a decline of brown trout catches[J]. Aquatic Sciences, 2007, 69(1): 11-25. DOI:10.1007/s00027-006-0844-3 |
| [13] |
赵峰, 庄平, 章龙珍, 等. 施氏鲟不同组织抗氧化酶对水体盐度升高的响应[J]. 海洋水产研究, 2008, 29(5): 65-69. ZHAO F, ZHUANG P, ZHANG L Z, et al. Responses of antioxidases in different tissues of Acipenser schrenckii to increased salinity in water[J]. Marine Fisheries Research, 2008, 29(5): 65-69. |
| [14] |
LOWE W H, LIKENS G E, COSENTINO B J. Self-organisation in streams: the relationship between movement behaviour and body condition in a headwater salamander[J]. Freshwater Biology, 2006, 51(11): 2052-2062. DOI:10.1111/j.1365-2427.2006.01635.x |
| [15] |
LLORET J, SHULMAN G, MALCOLM L R. Condition and health indicators of exploited marine fishes[M]. Hoboken: John Wiley & Sons, Ltd, 2014.
|
| [16] |
汪开毓, 苗常鸿, 黄锦炉, 等. 投喂高脂饲料后草鱼主要生化指标和乙酰辅酶A羧化酶1 mRNA表达的变化[J]. 动物营养学报, 2012, 24(12): 2375-2383. WANG K Y, MIAO C H, HUANG J L, et al. Changes in main biochemical indices and acetyl-CoA carboxylase 1 mRNA expression of crass carp fed a high-fat diet[J]. Chinese Journal of Animal Nutrition, 2012, 24(12): 2375-2383. DOI:10.3969/j.issn.1006-267x.2012.12.012 |
| [17] |
原居林, 郭建林, 刘梅, 等. 不同饲料类型和放养密度对乌鳢生长特性及营养品质的影响[J]. 大连海洋大学学报, 2017, 32(5): 534-543. YUAN J L, GUO J L, LIU M, et al. Comparison of growth performances and nutritional quality of muscle in snakehead Channa argus fed different diets at different stocking densities[J]. Journal of Dalian Fisheries University, 2017, 32(5): 534-543. |
| [18] |
SARAIVA A, COSTA J, SERRÁO J, et al. A histology-based fish health assessment of farmed seabass (Dicentrarchus labrax L.)[J]. Aquaculture, 2015, 448: 375-381. DOI:10.1016/j.aquaculture.2015.06.028 |
| [19] |
SONG X H, ZHAO J, BO Y X, et al. Aeromonas hydrophila induces intestinal inflammation in grass carp (Ctenopharyngodon idella): An experimental model[J]. Aquaculture, 2014, 434: 171-178. DOI:10.1016/j.aquaculture.2014.08.015 |
| [20] |
梅景良, 马燕梅, 张红星, 等. 夏、冬两季黑鲷消化酶活力的比较及反应温度和pH对酶活力的影响[J]. 海洋学报, 2006, 28(4): 167-171. MEI J L, MA Y M, ZHANG H X, et al. Comparison between digestive enzyme activities of Sparus macrocephalus in summer and winter and study on the effects of reactive temperature and pH on these activities[J]. Acta Oceanologica Sinica, 2006, 28(4): 167-171. DOI:10.3321/j.issn:0253-4193.2006.04.022 |
| [21] |
叶元土, 林仕梅, 罗莉, 等. 温度、pH对南方大口鲶、长吻蛋白酶和淀粉酶活力的影响[J]. 大连水产学院学报, 1998, 13(2): 17-23. YE Y T, LIN S M, LUO L, et al. The effect of temperature and pH value on activiies of proteases and amylases from Silurus meridionalis and Leiocassis longirostris[J]. Journal of Dalian Fisheries University, 1998, 13(2): 17-23. |
| [22] |
李瑾, 何瑞国, 王学东. 中华鲟消化系统内消化酶活性分布[J]. 中国饲料, 2002(21): 18-20. LI J, HE R G, WANG X D. The distributrition of digestive enzyme activities in digestive system of Chinese sturgeon[J]. China Feed, 2002(21): 18-20. |
| [23] |
黄耀桐, 刘永坚. 草鱼肠道肝胰脏蛋白酶活性初步研究[J]. 水生生物学报, 1988, 12(4): 328-334. HUANG Y T, LIU Y J. Study on protease activity in the intestine and hepatopancreas of grass carp, Ctenopharyngodon Idellus (C. ET V.)[J]. Acta Hydrobiologica Sinica, 1988, 12(4): 328-334. |
| [24] |
AGRAWAL V P, SASTRY K V, KAUSHAB S K. Digestive enzymes of three teleost fishes[J]. Acta Physiologica Academiae Scientiarum Hungaricae, 1975, 46(2): 93-98. |
| [25] |
付新华, 孙谧, 孙世春. 大菱鲆消化酶的活力[J]. 中国水产科学, 2005, 12(1): 26-32. FU X H, SUN M, SUN S C. Activity of digestive enzymes in Scophthalmus maximus[J]. Journal of Fishery Sciences of China, 2005, 12(1): 26-32. |
| [26] |
王宝维, 隋丽, 岳斌, 等. 发酵葡萄籽粕对5-12周龄五龙鹅消化生理、免疫器官指数和抗氧化指标的影响[J]. 动物营养学报, 2016, 28(1): 163-171. WANG B W, SUI L, YUE B, et al. Effects of zymotic grape seed meal on digestive physiology, immune organ indices and antioxidant indices of Wulong geese aged from 5 to 12 Weeks[J]. Chinese Journal of Animal Nutrition, 2016, 28(1): 163-171. |
| [27] |
邹慧, 李丹丹, 陈静, 等. 富硒女贞子对热应激乳腺上皮细胞增殖、凋亡及抗氧化功能的影响[J]. 畜牧兽医学报, 2015, 46(6): 1047-1054. ZOU H, LI D D, CHEN J, et al. Influence of se-enriched Ligustrum lucidium fruit on proliferation, Apoptosis and antioxidant activity of mammary epithelial cells under heat stress[J]. Acta Veterinaria et Zootechnica Sinica, 2015, 46(6): 1047-1054. |
| [28] |
刘旺景, 敖长金, 丁赫, 等. 不同饲料添加剂对杜寒杂交肉羊体脂脂肪酸组成和氧化稳定性的影响[J]. 动物营养学报, 2018, 30(9): 3759-3771. LIU W J, AO C J, DING H, et al. Effects of different feed additives on fatty acid composition and oxidation stability of body fat in dorper thin-Tailed Han crossbred mutton lambs[J]. Chinese Journal of Animal Nutrition, 2018, 30(9): 3759-3771. |
| [29] |
汪水平, 王文娟, 左福元, 等. 中药复方对夏季肉牛的影响: Ⅱ. 血气指标、血清代谢产物浓度及免疫和抗氧化功能参数[J]. 畜牧兽医学报, 2011, 42(5): 734-741. WANG S P, WANG W J, ZUO F Y, et al. Effect of Chinese medicine prescription on beef cattle in summer: Ⅱ. the blood gas analysis, the concentration of metabolites and the parameters of the immune and antioxidant capability in the serum[J]. Acta Veterinaria et Zootechnica Sinica, 2011, 42(5): 734-741. |
| [30] |
ANDREYEV A Y, KUSHNAREVA Y E, STARKOV A A. Mitochondrial metabolism of reactive oxygen species[J]. Biochemistry(Moscow), 2005, 70(2): 200-214. |
| [31] |
高爱保. 草甘膦对黑斑蛙主要器官中抗氧化酶的影响[J]. 江苏农业科学, 2020, 48(1): 278-281. GAO A B. Effects of glyphosate on antioxidant enzymes in main organs of Rana nigromaculata[J]. Jiangsu Agricultural Sciences, 2020, 48(1): 278-281. |
| [32] |
SARKAR S, YADAV P, TRIVEDI R, et al. Cadmium-induced lipid peroxidation and the status of the antioxidant system in rat tissues[J]. Journal of Trace Elements in Medicine and Biology, 1995, 9(3): 144-149. |
| [33] |
孙虎山, 李光友. 大肠杆菌感染后栉孔扇贝血淋巴中7种酶活力的变化[J]. 海洋科学, 1999, 23(5): 40-43. SUN H S, LI G Y. Activity change of seven enzymes in haemolymph in scallop Chlamys farreri after challenge with Escherichia coli[J]. Marine Sciences, 1999, 23(5): 40-43. |
| [34] |
赵妍, 马丹丹, 姜威, 等. 草菇谷胱甘肽还原酶基因受低温影响的表达研究[J]. 生物学杂志, 2015, 32(1): 44-47. ZHAO Y, MA D D, JIANG W, et al. The relative expression of glutathione reductase gene in Volvariella volvacea during low temperature stress[J]. Journal of Biology, 2015, 32(1): 44-47. |
| [35] |
张兵, 杨细飞, 王晓梅, 等. 纳米二氧化硅对HaCaT细胞谷胱甘肽还原酶表达及活力的影响[J]. 环境与健康杂志, 2010, 27(7): 581-584. ZHANG B, YANG X F, WANG X M, et al. Effects of SiO2 nanoparticles on expression and activity of glutathione reductase in HaCaT cells[J]. Journal of Environment and Health, 2010, 27(7): 581-584. |
| [36] |
JIANG W D, ZHOU X Q, LIU Y, et al. Vitamin A deficiency impairs intestinal physical barrier function of fish[J]. Fish & Shellfish Immunology, 2019, 87: 546-558. |
2. Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


