2. 农业农村部水产品贮藏保鲜质量安全风险评估实验室, 上海 201306;
3. 上海水产品加工及贮藏工程技术研究中心, 上海 210306
副溶血性弧菌(Vibrio parahaemolyticus)是革兰氏阴性嗜盐细菌,广泛存在于世界各地的海洋和河口环境中,并且通过被污染的水或者未煮熟的海鲜进入人体,从而导致急性胃肠炎[1-3]。作为一种重要的肠道病原体,副溶血性弧菌必须克服多种宿主因子的挑战才能成功定殖于人体胃肠道并引起胃肠炎,其中胆汁是副溶血性弧菌在感染期间遇到的一种宿主因子。胆汁由多种成分组成,包括蛋白质、离子、色素、胆固醇和胆汁盐,它们对人体的消化和营养吸收至关重要。在这些成分中,胆汁盐已被证明可以保护人体免受致病菌的伤害。研究[4-6]表明,当小肠内胆汁盐含量高时,细菌的生长受到抑制,而当胆汁分泌减少后,患者的小肠内又会出现细菌的过度生长。因此,胆汁盐不仅有助于脂肪的消化,还具有杀菌作用。然而,包括副溶血性弧菌在内的肠道致病菌不仅进化出了对胆汁杀菌特性的抵抗能力,而且还可以利用胆汁来诱导毒力基因的表达,从而在胃肠道中定殖并进行有效感染[7-8]。因此,具有对胆汁的抵抗能力是副溶血性弧菌在宿主细胞中长期存活的关键因素之一。
VtrB(V. parahaemolyticus T3SS2 regulator B)是在神奈川现象(KP)阳性副溶血性弧菌的致病岛(Vp-PAI)上的一种新型ToxR样转录调节蛋白。在副溶血性弧菌感染宿主时,转录调节子ToxR有助于副溶血性弧菌对胆汁的抵抗[9-11]。VtrB与ToxR的N末端具有同源性,研究表明其在胆汁存在时能被诱导表达,进而增强副溶血性弧菌TDH和T3SS2介导的细胞毒性和肠毒性。因此,VtrB被认为是胆汁诱导的Vp-PAI中毒力基因表达的关键调控因子[12-14]。然而作为胆汁依赖性转录调节蛋白,VtrB在副溶血性弧菌抵抗胆汁中的作用以及在胆汁诱导下对毒力基因的整体调控功能还不明确。
基因敲除又叫基因打靶,是建立在同源重组基础上以达到细胞内某一目的基因敲除的一种新型分子生物学技术。多年来,基因敲除技术已成为研究微生物中特定基因功能最重要的手段之一,在生物学等科研领域中都具有非常重要的价值[15-16]。基于自杀载体的同源重组法是基因敲除技术中的一种,其基本原理是构建含目的基因同源臂的重组自杀质粒,利用宿主自身的重组系统在同源重组序列间交换,由于自杀性载体在两次重组过程中可丢失上述重组质粒而完成重组,最终实现目的基因的敲除。该方法操作简单,重组效率高,被广泛应用于基因功能研究中[17]。因此,为了解VtrB在副溶血性弧菌抵抗胆汁中的作用,采用pDS132自杀载体同源重组的方法对副溶血性弧菌vtrB基因进行敲除,原理见图 1,随后利用表达载体pBAD33对vtrB基因进行回补,并研究突变株在胆汁盐胁迫下的生长特性,为深入了解vtrB基因功能、解析副溶血性弧菌的胆汁抵抗机理奠定基础,为由副溶血性弧菌引起的疾病的预防和控制提供新靶点。
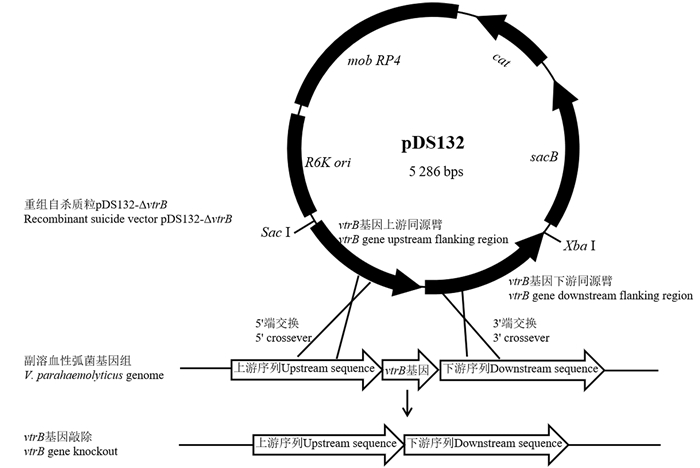
|
图 1 同源重组敲除副溶血性弧菌vtrB基因原理图 Fig. 1 Diagram showing homologous knockout of vtrB gene in V. parahaemolyticus |
副溶血性弧菌Vp6菌株(Wild Type Strain,WT)(O3;K6血清型,KP+,tdh+,Smr)由本实验室保存;pDS132自杀质粒(Cmr)由法国格勒诺布尔大学Dominique Schneider教授惠赠,pBAD33质粒(Cmr)为华东理工大学吴辉教授赠送,感受态细胞E. coli DH5α购自上海唯地生物技术有限公司,E. coli S17-1 λpir菌株由江苏大学张义全教授馈赠。
1.1.2 主要试剂LB培养基和TCBS培养基购自陆桥技术有限责任公司;Premix Taq (Ex Taq Version 2.0 plus dye),高保真DNA聚合酶,限制性内切酶XbaⅠ、SacⅠ和Hind Ⅲ及其缓冲液购自TaKaRa公司;T4 DNA连接酶及其缓冲液、DNA marker、质粒提取试剂盒和总RNA提取试剂盒购自天根生化科技(北京)有限公司;NaCl、蔗糖、L-阿拉伯糖、链霉素(Sm)和氯霉素(Cm)购自生工生物工程(上海)股份有限公司;PCR产物以及胶回收试剂盒和反转录试剂盒购自诺唯赞生物科技有限公司;脱氧胆酸钠购自Sigma公司。
1.2 方法 1.2.1 vtrB基因上下游同源臂及融合片段的扩增根据GenBank上公布的副溶血性弧菌中vtrB基因(BA000032.2)及其上下游核苷酸序列,利用生物学软件Primer Premier 5.0设计引物(表 1),并由生工生物有限公司合成。以副溶血性弧菌Vp6菌株基因组DNA为模板,用vtrB-up-F、vtrB-up-R和vtrB-down-F、vtrB-down-R两对引物分别扩增vtrB基因上下游同源臂片段。PCR反应条件:94 ℃ 5 min;94 ℃ 40 s、56 ℃ 40 s、72 ℃ 1 min,30个循环;72 ℃ 5 min。用2%琼脂糖凝胶电泳检测PCR产物,并回收纯化。将回收获得的上下游同源臂片段等比例混合,以混合的DNA片段为模板,引物vtrB-up-F和vtrB-down-R进行融合PCR扩增同源臂融合片段,用1.5%琼脂糖凝胶电泳检测。

|
表 1 vtrB基因突变株构建及鉴定用引物 Tab.1 Primers used in this study |
采用限制性内切酶XbaⅠ和SacⅠ对融合片段进行双酶切,经酶切产物回收后与相同内切酶双酶切并胶回收的pDS132自杀质粒连接。连接产物转化入E. coli S17-1 λpir感受态细胞中,在含有30 μg/mL氯霉素的LB固体培养基上筛选阳性克隆。随后分别以引物对vrtB-up-F、vrtB-down-R和pDS132-F、pDS132-R进行PCR检测和测序鉴定。
1.2.3 副溶血性弧菌vtrB突变株的构建通过接合转移将自杀质粒pDS132-ΔvtrB从供体菌E. coli S17-1 λpir导入副溶血性弧菌Vp6中。在含5 μg/mL Cm的TCBS平板上挑选阳性重组克隆,接种在含10%蔗糖的LB平板上进行同源重组。挑取单菌落分别转接于不含Cm抗性和含Cm抗性(5 μg/mL)的LB固体培养基上,37 ℃培养。挑选能在前者生长但不能在后者生长的单克隆,用外侧引物vrtB-up-F、vrtB-down-R和内部引物vrtB-F、vrtB-R对单克隆进行PCR鉴定。
1.2.4 vtrB基因回补株的构建以副溶血性弧菌Vp6基因组DNA为模板进行vtrB基因的PCR扩增。PCR反应条件:98 ℃ 10 s;55 ℃ 15 s、72 ℃ 10 s,30个循环;72 ℃ 5 min。对扩增回收后的片段利用XbaⅠ和Hind Ⅲ进行双酶切,与pBAD33表达载体连接。连接产物转入E. coli DH5α感受态细胞中,在含有30 μg/mL氯霉素的LB培养板上进行筛选,并用vrtB-HB-F和vrtB-HB-R引物进行PCR扩增鉴定。正确的阳性克隆经测序验证无误后电转化入ΔvtrB突变株感受态细胞中,并用引物pBAD33-F和pBAD33-R对阳性质粒进行PCR检测。
1.2.5 ΔvtrB突变株和C-ΔvtrB回补株中vtrB基因转录水平检测用Trizol法提取WT、ΔvtrB和C-ΔvtrB菌株的总RNA。利用反转录试剂盒去除总RNA中残留的DNA后反转录为cDNA。以cDNA为模板,用引物vtrB-RT-F和vtrB-RT-R进行PCR扩增。通过比较野生型、vtrB突变株和回补株的RT-PCR扩增结果来判定ΔvtrB和C-ΔvtrB菌株中vtrB基因的转录情况。
1.2.6 WT、ΔvtrB和C-ΔvtrB菌株在脱氧胆酸盐胁迫下的存活率测定将WT和ΔvtrB菌株接种于5 mL的含Sm的LB液体培养基中,同时将C-ΔvtrB菌株接种于5 mL的补充有0.2%阿拉伯糖的含Sm和Cm的LB液体培养基中,培养至对数中期。离心获得菌体后重悬于补充或未补充2%脱氧胆酸盐(DOC)[18]的LB液体培养基中,37 ℃分别孵育20、40和60 min后进行菌落计数。
2 结果 2.1 vtrB基因的上下游同源臂扩增及融合PCR以副溶血性弧菌WT菌株基因组DNA为模板,利用特异性引物vtrB-up-F、vtrB-up-R和vtrB-down-F、vtrB-down-R分别对vtrB基因上、下游同源臂进行PCR扩增,结果见图 2a,成功扩增得到vtrB基因上游同源臂片段(大小为542 bp)和下游同源臂片段(大小为497 bp)。随后以等比例混合的上下游同源臂片段作为模板,用引物vtrB-up-F和vtrB-down-R进行融合PCR,扩增得到长度为1 000 bp左右的融合片段,电泳结果与预期大小相符(图 2b)。
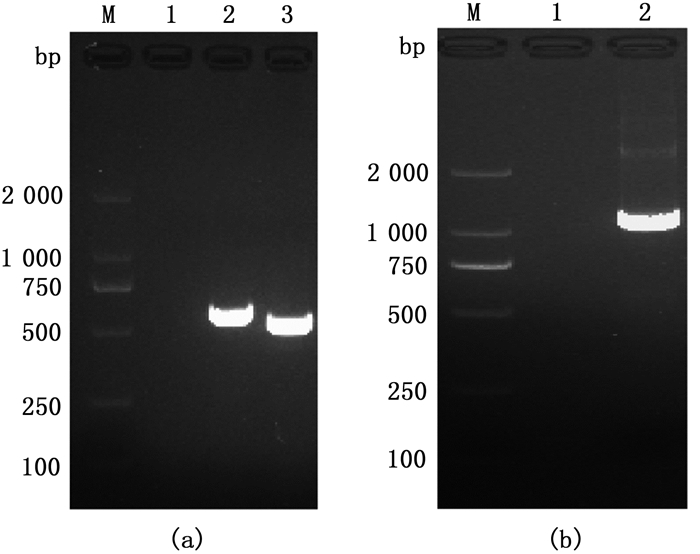
|
(a)vtrB上下游同源臂PCR扩增结果。M. D2 000 DNA marker;1.阴性对照(以ddH2O为模板);2.上游同源臂;3.下游同源臂;(b)融合片段PCR扩增结果。M.D2 000 DNA marker;1.阴性对照(以ddH2O为模板);2.融合片段。 (a)Amplification flanking regions of vtrB. M. D2 000 DNA marker; 1. ddH2O; 2. Upstream flanking region; 3. Downstream flanking region; (b) Fusion of flanking regions. M. D2 000 DNA marker; 1. ddH2O; 2.Fusion fragment. 图 2 vtrB基因上下游同源臂及融合片段扩增结果 Fig. 2 Amplification and fusion of flanking regions of vtrB gene |
用限制性内切酶XbaⅠ和SacⅠ分别对vtrB基因上下游同源臂融合片段和质粒pDS132进行双酶切,连接后转入E. coli S17-1 λpir感受态细胞中,用含Cm的LB平板筛选阳性克隆,采用引物vrtB-up-F和vrtB-down-R对目的重组自杀质粒进行鉴定,结果见图 3。以空质粒pDS132为模板未扩增出条带,以重组自杀质粒pDS132-ΔvtrB为模板扩增出长度为1 000 bp的片段,结果与预期相符。测序后序列比对结果也与预期序列信息完全相符,表明vtrB基因上下游同源臂已成功插入pDS132的XbaⅠ和SacⅠ酶切位点之间,获得重组自杀质粒pDS132-ΔvtrB。
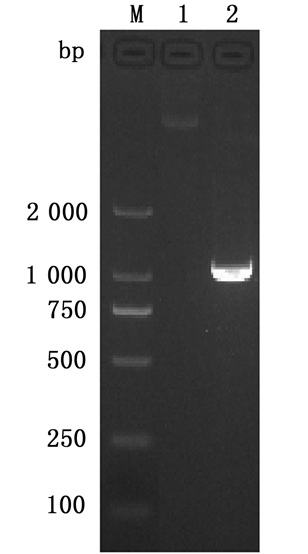
|
M.D2 000 DNA marker;1.空质粒(pDS132);2.敲除质粒pDS132-ΔvtrB的阳性克隆。 M. D2 000 DNA marker; 1. pDS132 plasmid; 2. Positive clones carrying knockout vector pDS132-ΔvtrB. 图 3 重组自杀质粒的PCR鉴定 Fig. 3 PCR identification of the recombinant suicide vectors |
将含有pDS132-ΔvtrB的E. coli S17-1 λpir与副溶血性弧菌Vp6菌株进行接合转移,在含10%蔗糖的LB平板上进行同源重组。随后在不含和含Cm的LB平板上筛选单克隆,结果见图 4,在含Cm平板上不能生长而在不含Cm的平板上生长的菌落即为vtrB突变株的疑似菌落。选取疑似菌株采用vtrB基因外侧引物和内部引物进行PCR鉴定,结果如图 5所示,当引物为vtrB基因外侧引物vrtB-up-F和vrtB-down-R时,以WT菌株的基因组DNA为模板扩增的片段大小为1 550 bp,以重组自杀质粒pDS132-ΔvtrB和突变株DNA为模板扩增的片段大小为1 000 bp,与预期结果一致(图 5a)。当引物为vtrB基因内侧引物vrtB-F和vrtB-R时,WT扩增片段大小为500 bp,pDS132-ΔvtrB与突变株不能扩增出条带,与预期结果一致(图 5b)。这表明副溶血性弧菌成功缺失了vtrB基因,获得vtrB基因突变株ΔvtrB。
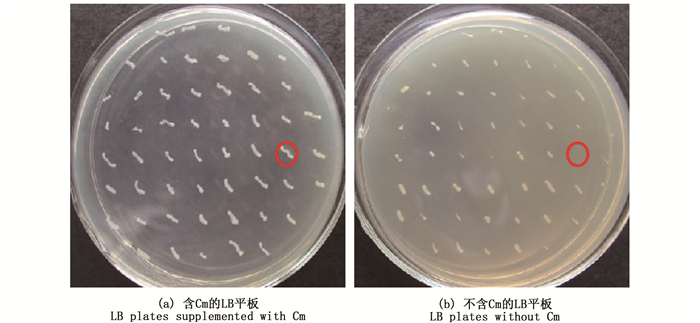
|
图 4 Vp6-ΔvtrB菌株的筛选照片(红圈表示疑似菌落) Fig. 4 Screen of Vp6-ΔvtrB strains(red circles indicate suspected colonies) |

|
(a)以vrtB-up-F/vrtB-down-R为外侧引物对的PCR扩增结果; (b)以vrtB-F/R为内引物对的PCR扩增结果。M.D 2000 DNA marker;1.WT株;2.pDS132-ΔvtrB;3.突变株。 (a)The flanking primers of vtrB were used for PCR amplification; (b) The internal primers of vtrB were used for PCR amplification. M. D 2000 DNA marker; 1. WT strain; 2. pDS132-ΔvtrB; 3. ΔvtrB mutant. 图 5 vtrB突变株的PCR鉴定 Fig. 5 PCR identification of the vtrB mutant |
以WT菌株基因组DNA为模板,采用引物vrtB-HB-F和vrtB-HB-R扩增vtrB基因全长,将PCR产物纯化后与表达载体pBAD33在体外进行连接,然后转入E. coli DH5α感受态细胞中,采用引物vrtB-HB-F和vrtB-HB-R进行PCR鉴定,以空质粒为模板未扩增出条带,以重组质粒pBAD33-vrtB为模板扩增的片段大小为500 bp左右,结果与预期相符,测序结果也与vtrB基因序列一致,证实重组质粒pBAD33-vtrB构建成功,可用于副溶血性弧菌vtrB回补株的构建。见图 6。
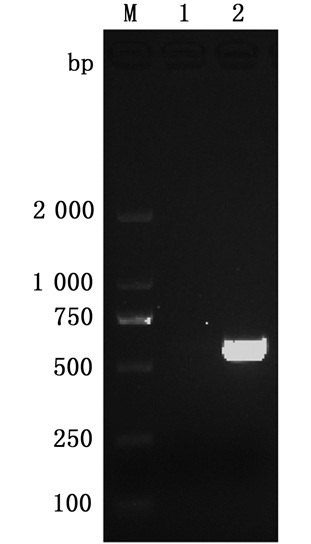
|
M.D2 000 DNA marker;1.pBAD33空质粒;2.重组质粒pBAD33-vtrB。 M. D2 000 DNA marker; 1. pBAD33 plasmids; 2. pBAD33-vtrB. 图 6 重组质粒PCR鉴定电泳图 Fig. 6 Agarose gel electrophoresis of the PCR products of recombinant plasmid |
将重组质粒pBAD33-vtrB电转入副溶血性弧菌ΔvtrB突变株中,采用引物pBAD33-F和pBAD33-R进行PCR扩增,结果见图 7,以重组质粒pBAD33-vtrB和vtrB基因回补株DNA为模板扩增的片段大小约为750 bp,而以pBAD33空质粒、WT/pBAD33和ΔvtrB/pBAD33菌株DNA为模板扩增的片段大小约为200 bp,表明成功构建副溶血性弧菌vtrB基因回补株C-ΔvtrB。
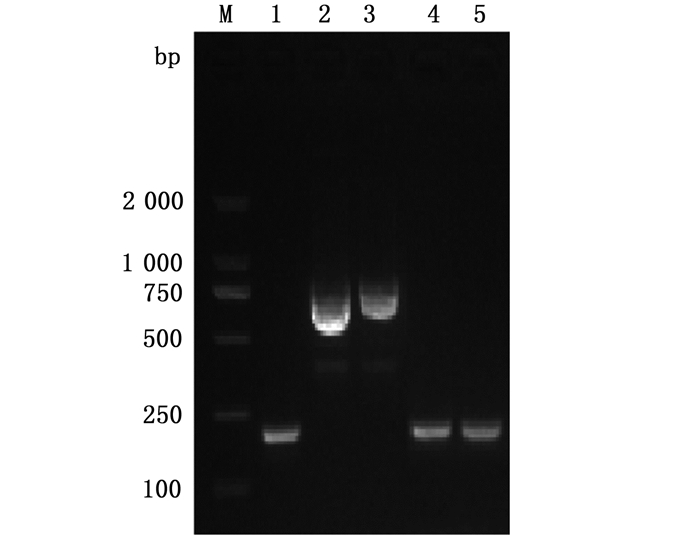
|
M.D2 000 DNA marker;1.pBAD33空质粒;2.pBAD33-vtrB;3.回补株(C-ΔvtrB);4.WT/pBAD33;5.ΔvtrB/pBAD33。 M. D2 000 DNA marker; 1. pBAD33 plasmid; 2. pBAD33-vtrB; 3. C-ΔvtrB; 4. WT/pBAD33; 5. ΔvtrB/pBAD33 图 7 vtrB基因回补株的鉴定 |
分别提取WT、ΔvtrB和C-ΔvtrB菌株总RNA,采用引物vtrB-RT-F和vtrB-RT-R进行RT-PCR扩增以验证ΔvtrB和C-ΔvtrB菌株中vtrB基因的转录活性。以ΔvtrB突变株cDNA为模板未扩增出条带,以WT和C-ΔvtrB菌株cDNA为模板扩增的片段大小为500 bp左右,与vtrB基因大小一致。这表明ΔvtrB突变株中无vtrB基因的mRNA,而C-ΔvtrB中vtrB基因具有转录活性,进一步证明成功构建副溶血性弧菌vtrB基因突变株与回补株。见图 8。
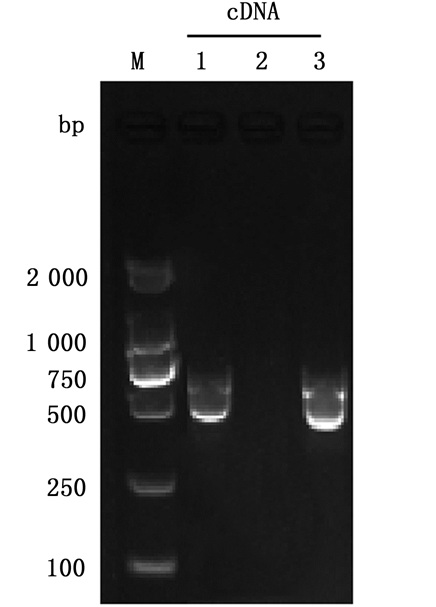
|
M.D2 000 DNA marker;1-3.WT、ΔvtrB和C-ΔvtrB菌株的cDNA。 M. D2 000 DNA marker; 1-3. cDNA (WT, ΔvtrB and C-ΔvtrB strains). 图 8 突变株和回补株中vtrB转录水平检测 Fig. 8 Detection of vtrB transcription levels in mutant and complement strains |
为了确定VtrB在副溶血性弧菌抵抗胆汁中的作用,将WT、ΔvtrB和C-ΔvtrB菌株在含有2%脱氧胆酸盐(DOC)的培养基中分别培养20、40和60 min,然后测定WT、ΔvtrB和C-ΔvtrB的菌落数。结果如图 9所示,WT菌株在2% DOC处理20、40和60 min后的存活率分别为84%、33%和9%,ΔvtrB突变株的存活率下降至17%、4%和1%,与野生型菌株相比,ΔvtrB突变株的存活水平极显著降低(P < 0.001),表现出存活能力的缺陷。C-ΔvtrB菌株在2% DOC处理后的存活率为71%、26%和9%,与WT菌株的存活率无显著差异,表明回补的vtrB基因能够恢复副溶血性弧菌ΔvtrB菌株在胆盐中的存活能力。
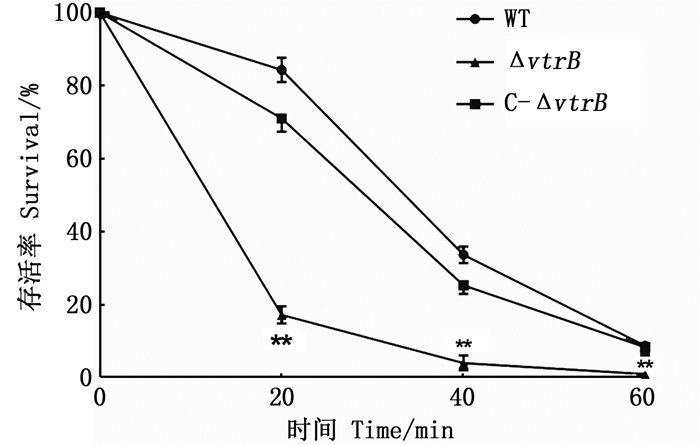
|
“**”代表差异极显著(P < 0.001)。 "**" shows very significant difference(P < 0.001). 图 9 脱氧胆酸盐对WT、ΔvtrB和C-ΔvtrB菌株存活的影响 Fig. 9 Effects of DOC on survival of WT, ΔvtrB and C-ΔvtrB strains |
同源重组法可以实现基因的无痕突变,敲除精准度高并且较易实施,是研究微生物中基因功能的常用手段[15, 19]。本研究选用自杀质粒pDS132作为突变载体敲除vtrB基因,其含有反向筛选基因sacB,此基因可以编码分解蔗糖的产物,进而产生能够杀死细菌的有毒物质。因此,只有发生双交换将自杀质粒pDS132上的目的基因同源臂的DNA片段整合到副溶血性弧菌染色体后的突变株才能够在含有蔗糖的平板上生长。但值得注意的是,sacB很容易发生突变,因此才需要在2次重组时进行大量筛选[19-20]。并且,为了保证第2次重组的效率,可将接合转移与第1次重组生长出的单克隆菌落再划线于含5 μg/mL Cm的弧菌选择性平板TCBS上进行筛选。与以往构建副溶血性弧菌相关基因突变株不同,由于本研究所使用的野生型菌株为链霉素抗性菌株,而作为供体菌的E.coli S17-1 λpir也含有链霉素抗性[21-22],因此在接合转移后选择含氯霉素的弧菌选择性平板进行筛选可以有效地抑制供体菌的生长与干扰,提高阳性率。
转录调节因子VtrB是副溶血性弧菌发挥毒力的关键因素,其与跨膜毒力调节因子ToxR的N末端具有同源性。已有研究表明毒力调节因子ToxR有助于霍乱弧菌、河流弧菌和副溶血性弧菌等病原体抵抗胆汁的杀菌作用。对于霍乱弧菌toxR基因突变株,其胆汁和脱氧胆酸盐的最小杀菌浓度(MBC)均低于亲本野生型。在胆汁和胆汁盐的存在下,ToxR对于提高霍乱弧菌存活率和生长都是必需的[23]。此外,与经胆汁盐处理40 min后野生型24%的存活率相比,副溶血性弧菌toxR缺失株的存活率为0.04%,其表现出对胆汁盐更高的敏感性[24]。本研究通过对WT、ΔvtrB和C-ΔvtrB菌株在脱氧胆酸盐存在下的存活率测定发现,与野生株相比,脱氧胆酸盐处理20 min后的副溶血性弧菌ΔvtrB突变株表现出存活能力的急剧降低,而回补的VtrB又在一定程度上恢复ΔvtrB突变株在胆盐中的存活能力,说明ΔvtrB突变株对脱氧胆酸盐的敏感性升高。此结果与ToxR有助于副溶血性弧菌抵抗胆汁的研究结果相似,表明在胆汁盐的存在下VtrB是副溶血性弧菌存活和生长所必需的因子。
4 结论采用同源重组法,成功敲除副溶血性弧菌的vtrB基因,构建获得vtrB基因缺失突变株和回补株。通过脱氧胆酸盐处理发现vtrB基因有助于提高副溶血性弧菌在脱氧胆酸盐胁迫下的存活能力,为深入探讨VtrB是如何参与对其他毒力因素的协调来促进副溶血性弧菌对胆汁的抵抗,进而成功定殖并在宿主生态位中继发疾病奠定了基础。
| [1] |
RIVERA-CANCEL G, ORTH K. Biochemical basis for activation of virulence genes by bile salts in Vibrio parahaemolyticus[J]. Gut Microbes, 2017, 8(4): 366-373. DOI:10.1080/19490976.2017.1287655 |
| [2] |
PETRONELLA N, RONHOLM J. The mechanisms that regulate Vibrio parahaemolyticus virulence gene expression differ between pathotypes[J]. Microbial Genomics, 2018, 4(6): e000182. |
| [3] |
DE JEŚUS HERNÁNDEZ-DÍAZ L, LEON-SICAIROS N, VELAZQUEZ-ROMAN J, et al. A pandemic Vibrio parahaemolyticus O3:K6 clone causing most associated diar555rhea cases in the Pacific Northwest coast of Mexico[J]. Frontiers in Microbiology, 2015, 6: 221. |
| [4] |
LETCHUMANAN V, CHAN K G, KHAN T M, et al. Bile sensing: the activation of Vibrio parahaemolyticus virulence[J]. Frontiers in Microbiology, 2017, 8: 728. DOI:10.3389/fmicb.2017.00728 |
| [5] |
INAGAKI T, MOSCHETTA A, LEE Y K, et al. Regulation of antibacterial defense in the small intestine by the nuclear bile acid receptor[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(10): 3920-3925. DOI:10.1073/pnas.0509592103 |
| [6] |
MERRITT M E, DONALDSON J R. Effect of bile salts on the DNA and membrane integrity of enteric bacteria[J]. Journal of Medical Microbiology, 2009, 58(12): 1533-1541. DOI:10.1099/jmm.0.014092-0 |
| [7] |
SISTRUNK J R, NICKERSON K P, CHANIN R B, et al. Survival of the fittest: how bacterial pathogens utilize bile to enhance infection[J]. Clinical Microbiology Reviews, 2016, 29(4): 819-836. DOI:10.1128/CMR.00031-16 |
| [8] |
HAY A J, ZHU J. In sickness and in health: the relationships between bacteria and bile in the human gut[J]. Advances in Applied Microbiology, 2016, 96: 43-64. |
| [9] |
HUBBARD T P, CHAO M C, ABEL S, et al. Genetic analysis of Vibrio parahaemolyticus intestinal colonization[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(22): 6283-6288. DOI:10.1073/pnas.1601718113 |
| [10] |
PETERSON K M, GELLINGS P S. Multiple intraintestinal signals coordinate the regulation of Vibrio cholerae virulence determinants[J]. Pathogens and Disease, 2018, 76(1): ftx126. |
| [11] |
ANTE V M, BINA X R, HOWARD M F, et al. Vibrio cholerae leuO transcription is positively regulated by ToxR and contributes to bile resistance[J]. Journal of Bacteriology, 2015, 197(22): 3499-3510. DOI:10.1128/JB.00419-15 |
| [12] |
KODAMA T, GOTOH K, HIYOSHI H, et al. Two regulators of Vibrio parahaemolyticus play important roles in enterotoxicity by controlling the expression of genes in the Vp-PAI region[J]. PLoS One, 2010, 5(1): e8678. DOI:10.1371/journal.pone.0008678 |
| [13] |
GOTOH K, KODAMA T, HIYOSHI H, et al. Bile acid-induced virulence gene expression of Vibrio parahaemolyticus reveals a novel therapeutic potential for bile acid sequestrants[J]. PLoS One, 2010, 5(10): e13365. DOI:10.1371/journal.pone.0013365 |
| [14] |
LIVNY J, ZHOU X H, MANDLIK A, et al. Comparative RNA-Seq based dissection of the regulatory networks and environmental stimuli underlying Vibrio parahaemolyticus gene expression during infection[J]. Nucleic Acids Research, 2014, 42(19): 12212-12223. DOI:10.1093/nar/gku891 |
| [15] |
王丽, 多丽波. 基因敲除技术在肺炎克雷伯菌基因功能研究中的应用进展[J]. 临床检验杂志, 2015, 33(5): 376-377. WANG L, DUO L B. Application progress of gene knockout technology in the study of gene function of Klebsiella pneumoniae[J]. Chinese Journal of Clinical Laboratory Science, 2015, 33(5): 376-377. |
| [16] |
王雪, 黄建忠, 李力. 基因敲除技术在微生物中的应用[J]. 微生物学杂志, 2019, 39(4): 100-106. WANG X, HUANG J Z, LI L. Advances in gene knockout techniques in microbiology[J]. Journal of Microbiology, 2019, 39(4): 100-106. DOI:10.3969/j.issn.1005-7021.2019.04.016 |
| [17] |
羊燕燕, 裘娟萍, 余志良. 假交替单胞菌遗传操作系统的研究进展[J]. 发酵科技通讯, 2017, 46(2): 100-106. YANG Y Y, QIU J P, YU Z L. Advances in genetic manipulation on Pseudoalteromonas[J]. Bulletin of Fermentation Science and Technology, 2017, 46(2): 100-106. |
| [18] |
KRISTOFFERSEN S M, RAVNUM S, TOURASSE N J, et al. Low concentrations of bile salts induce stress responses and reduce motility in Bacillus cereus ATCC 14570[J]. Journal of Bacteriology, 2007, 189(14): 5302-5313. DOI:10.1128/JB.00239-07 |
| [19] |
刘霞, 高鹤, 杨琳, 等. 副溶血性弧菌基因敲除方法的建立及应用[J]. 中国实验动物学报, 2011, 19(3): 188-192. LIU X, GAO H, YANG L, et al. Establishment of a suicide vector-based gene knockout method in studies of Vibrio parahaemolyticus[J]. Acta Laboratorium Animalis Scientia Sinica, 2011, 19(3): 188-192. |
| [20] |
PHILIPPE N, ALCARAZ J P, COURSANGE E, et al. Improvement of pCVD442, a suicide plasmid for gene allele exchange in bacteria[J]. Plasmid, 2004, 51(3): 246-255. DOI:10.1016/j.plasmid.2004.02.003 |
| [21] |
李迎丽, 张义全, 闫小娟, 等. 副溶血弧菌生物膜相关基因突变株的构建[J]. 中华预防医学杂志, 2013, 47(5): 439-443. LI Y L, ZHANG Y Q, YAN X J, et al. Construction of biofilm formation related mutants in Vibrio parahaemolyticus[J]. Chinese Journal of Preventive Medicine, 2013, 47(5): 439-443. DOI:10.3760/cma.j.issn.0253-9624.2013.05.013 |
| [22] |
FERRIÈRES L, HÉMERY G, NHAM T, et al. Silent mischief: bacteriophage mu insertions contaminate products of Escherichia coli random mutagenesis performed using suicidal transposon delivery plasmids mobilized by Broad-Host-Range RP4 conjugative machinery[J]. Journal of Bacteriology, 2010, 192(24): 6418-6427. DOI:10.1128/JB.00621-10 |
| [23] |
PROVENZANO D, SCHUHMACHER D A, BARKER J L, et al. The virulence regulatory protein ToxR mediates enhanced bile resistance in Vibrio cholerae and other pathogenic Vibrio species[J]. Infection and Immunity, 2000, 68(3): 1491-1497. DOI:10.1128/IAI.68.3.1491-1497.2000 |
| [24] |
WHITAKER W B, PARENT M A, BOYD A, et al. The Vibrio parahaemolyticus ToxRS regulator is required for stress tolerance and colonization in a novel orogastric streptomycin-induced adult murine model[J]. Infection and Immunity, 2012, 80(5): 1834-1845. DOI:10.1128/IAI.06284-11 |
2. Laboratory of Quality & Safety Risk Assessment for Aquatic Products on Storage and Preservation, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


