养殖密度是决定水产动物生长速度和养殖产量的重要影响因子,生产者往往采用高密度养殖的方法提高养殖产量,以获取更高的经济效益[1-2]。但过高的养殖密度不仅增加了鱼类对养殖空间和生物饵料的竞争,导致养殖鱼类生长减慢,体质量和体长出现显著差异[3-5], 还易引起水质败坏和鱼体的胁迫反应,导致鱼体新陈代谢紊乱、生理机能下降、免疫防御功能损坏,甚至造成鱼类发病和死亡,大大降低成活率[6-8]。因此,在实际养殖生产过程中,需要选择合适的养殖密度,以保障在安全养殖条件下获取最大渔产量和经济效益。因此,探究鱼类在不同养殖密度下的生长性能、消化能力和免疫防御能力变化情况,对确定该养殖鱼类的合理养殖密度十分必要。
刀鲚(Coilia nasus), 又称长颌鲚,俗称长江刀鲚,属鲱形目(Clupeiformes)鳀科(Engraulidae)鲚属(Coilia), 是一种典型的江海洄游鱼类,主要遍布于长江流域、东海海域和环黄、渤海一带,以长江中下游数量最多[9]。刀鲚与长江鲥鱼(Tenualosa reevesii)、河豚(Tetraodon fluviatilis)并称为“长江三鲜”, 因其肉质鲜嫩、丰腴肥美,成为人们喜爱的美味佳肴[10]。但近年来,由于生态环境变化以及过度捕捞等原因导致刀鲚数量一再衰减,产量急剧下降,现已很难捕捞到野生刀鲚,同时刀鲚价格也在节节攀升,甚至出现“有价无市”的窘境。所以,开展刀鲚的人工养殖解决市场供应不平衡问题已迫在眉睫。随着上海市水产研究所于2011年取得刀鲚室内人工繁殖技术和养殖技术的成功[9, 11], 刀鲚逐步成为一种养殖前景广阔的新型经济鱼类,同时,在规模化人工养殖中面临着确定刀鲚适宜养殖密度的问题。目前,关于中高养殖密度对刀鲚生长性能、存活率、消化和非特异性免疫指标影响的相关报道较少,大部分研究主要集中于刀鲚的苗种繁育[11-12]、生长特性[9, 13]和肌肉营养[10, 14]等方面。因此开展对刀鲚中高养殖密度的研究具有十分重要的现实意义。本实验探究了中高养殖密度对刀鲚当年鱼种生长性能、消化及非特异性免疫能力等的影响,以期为刀鲚苗种培育及人工养殖提供参考依据。
1 材料与方法 1.1 实验材料实验于2018年7—11月,在上海市水产研究所奉贤科研基地(30°51′20″N, 121°44′11″E)内的露天养殖池塘中进行,分别为56# (2 336 m2) 和62# (1 200 m2) 塘,均为南北长方形,平均水深2 m, 每口池塘各配1台1.5 kW功率的叶轮式增氧机,实验之前进行清塘并消毒,清除野杂鱼。实验用刀鲚为上海市水产研究所奉贤科研基地于2018年5—6月全人工繁育而成,并在室内水泥池经30~45 d强化培育后的同批次当年鱼种。56#塘规格:平均体长(6.48±0.63)cm, 平均体质量(0.88±0.26)g; 62#塘规格:平均体长(5.28±0.72)cm, 平均体质量(0.55±0.20)g。实验养殖用水为经过60目筛网过滤的当地内河水。
1.2 实验方法与养殖管理本实验分为2种不同密度进行养殖,即中密度(62#塘)和高密度(56#塘), 中密度塘放养6尾/m2, 高密度塘放养11尾/m2。鱼种放养前,先进行生物饵料的培养,在放苗前7 d向池塘进水(水深约1 m), 晴天中午开增氧机1 h, 其他时间不开,7 d后水体中出现枝角类(Cladocera)和桡足类(Copepods)幼虫等生物饵料,待生物量达到30个/L时开始放苗;放苗后每5天进水0.25 m, 逐渐加至2 m进行养殖实验。
养殖实验期间,不投喂其他人工饲料,均以本池塘中的活生物饵料为食,每天晚上6点开增氧机至第2天早上6点关增氧机(阴雨天气,适当调整开机时间)。每7天检测养殖塘中饵料生物(桡足类、枝角类等)1次,保证水体中的饵料生物量大于2个/L, 当不足时,及时从其他养殖池塘中捞取活体生物饵料进行补给。实验过程中2周换水1次,1次换1/3。实验期间,自然水温为23.0~32.0 ℃, pH为7.85~8.52, ρ(DO)≥7.57 mg/L, ρ(TAN)≤0.22 mg/L, ρ(NO2-N)≤0.19 mg/L。
1.3 取样与测定养殖实验期间,于7月26日开始,对62#和56#塘进行全池拉网,随机取30尾刀鲚测量体质量和体长,另随机取30尾鱼,平均分为3个重复,每个重复10尾,保存于-80 ℃冰箱中,用于酶活测定。之后每24天全池拉网1次,测量刀鲚规格并取样,每次拉网时间均为上午8:00~9:00。
养殖结束后,取出-80 ℃冰箱中刀鲚样品进行酶活测定。首先将样品放入4 ℃冰柜中解冻,解冻好的刀鲚用清水洗净后放于冰盘上,解剖并小心取出内脏团,用质量浓度为0.86%生理盐水(4 ℃)进行冲洗,之后放于滤纸上吸干水分,移入冰浴的离心管中(5 mL), 按照质量比为1∶9注入4 ℃的质量浓度为0.86%生理盐水,于冰浴条件下进行研磨匀浆,制成10%匀浆液,并放入4 ℃的离心机中(2 500 r/min)离心10 min, 吸取上清液进行分装,保存于-80 ℃冰箱中,用于消化酶和非特异性免疫酶的活性及其总蛋白含量的测定。
1.3.1 生长性能指标测定计算生长性能参数计算公式[15]为
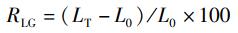 (1)
(1)
 (2)
(2)
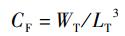 (3)
(3)
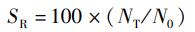 (4)
(4)
式中:RLG为体长相对增长率,%; RWG为体质量相对增长率,%; CF为肥满度,g/cm3; SR为存活率,%; L0为实验开始时刀鲚幼鱼体长,cm; LT为实验结束时刀鲚的体长,cm; W0为实验开始时刀鲚幼鱼体质量,g; WT为实验结束时刀鲚体质量,g; N0为实验初始时刀鲚幼鱼数量,尾;NT为实验结束时刀鲚存活数量,尾。
1.3.2 消化酶与非特异性免疫酶活性测定方法本实验中消化酶和非特异性免疫酶的测定均采用南京建成生物工程研究所提供的C016-1-1淀粉酶(amylase, AMS) 试剂盒(碘-淀粉比色法)、A054-1-1脂肪酶(lipase, LPS) 试剂盒(比色法)、A080-1-1胃蛋白酶(pepsin, PPS)试剂盒、A080-2胰蛋白酶(trypsin, TPS)试剂盒、A001-1超氧化物歧化酶(superoxide dismutase, SOD) 试剂盒(羟胺法)、A007-2过氧化氢酶(catalase, CAT) 试剂盒(可见光法)和A005谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)试剂盒。使用考马斯亮蓝法测定内脏团中总蛋白质含量。所有酶活测试和计算方法均严格按照试剂盒说明书进行。
1.4 数据处理和统计利用Excel 2007整理实验数据,运用SPSS 17.0对不同养殖时间点间进行单因素One-Way ANOVA方差分析以及Duncan氏法多重比较,对两口不同养殖密度塘间进行独立样本t检验(independent samples t-test)及方差分析,比较中高密度养殖条件下刀鲚鱼种的生长速度、存活率、消化酶和非特异性免疫酶活性大小及差异显著性。所得结果均以平均值±标准差(Mean±SD)来表示,P < 0.05为显著性差异,P < 0.01为极显著性差异。
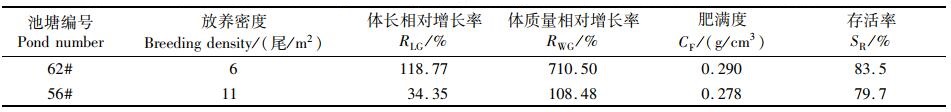
2 结果 2.1 中高密度养殖下刀鲚1龄鱼种的生长和存活情况如图 1所示,经过96 d养殖,62#塘刀鲚的体长和体质量增长速度随时间均大于56#塘,养殖实验开始时,62#塘刀鲚的体长和体质量均显著小于56#塘(P < 0.05), 而养殖至24 d时,其体长和体质量均显著大于56#塘(P < 0.05), 且随养殖时间延长差异逐渐增大,72 d时,62#塘刀鲚的体长、体质量均极显著大于56#塘(P < 0.01)。其他生长指标如表 1所示,可以看出62#塘刀鲚的生长性能指标以及存活率均大于56#塘,其中62#塘的体长相对增长率是56#塘的3.4倍,体质量相对增长率是56#塘的6.5倍,表明中密度养殖塘刀鲚鱼种较高密度养殖塘的生长速度更快,存活率更高。

|
同时间中标有不同大写字母则表示两种密度间有极显著性差异(P < 0.01), 标有不同小写字母则表示两种密度间有显著性差异(P < 0.05)。 The means with different capital letters within the same time are significant differences extremely at the 0.01 probability level, and the means with different lowercase letters within the same time are significant differences at the 0.05 probability level. 图 1 中高密度养殖塘中刀鲚幼鱼体长、体质量变化曲线 Fig. 1 Body length and mass change curve of juvenile Coilia nasus in medium and high density culture |
|
表 1 中高密度养殖对刀鲚幼鱼生长性能的影响 Tab.1 Effect of medium and high density culture on growth performance of juvenile Coilia nasus |
从图 2中可看出,62#和56#塘刀鲚幼鱼的AMS活性均随养殖时间延长表现出先显著升高后又显著降低的变化,62#塘AMS活性在24 d时开始明显大于56#塘(P < 0.05)。62#塘PPS活性在0 d时明显大于56#塘(P < 0.01), 随养殖时间延长而明显降低,至实验结束时显著低于56#塘(P < 0.05);而56#塘PPS活性在养殖期间无明显变化。62#塘LPS活性随养殖时间延长逐渐升高,至96 d时显著大于0 d(P < 0.05), 而56#塘LPS无规律性变化,但均大于62#塘,其中在24 d和72 d时均明显大于62#塘(P < 0.05)。62#和56#塘TPS活性呈相反的变化趋势,62#塘TPS活性随养殖时间延长先明显降低后逐渐升高,而56#塘呈先明显升高后明显降低趋势,并于48 d时两塘间无显著差异(P > 0.05), 其他时间内62#塘TPS活性均明显大于56#塘(P < 0.05)。这表明高密度养殖可对刀鲚鱼种的消化能力产生负面影响。

|
图中标有不同大写字母则表示养殖时间之间有显著性差异(P < 0.05), 标有不同小写字母则表示两池塘间有显著性差异(P < 0.05)。 The means with different capital letters within the same figure are significant differences extremely in breeding time at the 0.05 probability level, and the means with different lowercase letters within the same time are significant differences between the two ponds at the 0.05 probability level. 图 2 中高密度养殖对刀鲚幼鱼内脏团中消化酶活性影响 Fig. 2 Effect of medium and high density culture on digestive enzyme activities in viscera mass of juvenile Coilia nasus |
图 3显示:62#和56#塘SOD活性均随养殖时间呈降低变化,均于96 d时显著低于0 d(P < 0.05);62#塘和56#塘SOD活性在0 d时存在显著差异(P < 0.05), 而其他养殖时间均无显著差异(P > 0.05)。62#塘CAT活性随养殖时间延长显著升高,而56#塘CAT活性先升高后降至与初始无明显差异(P < 0.05);在养殖期间62#塘CAT活性均大于56#塘,其中在24 d和96 d时,62#塘CAT活性明显大于56#塘(P < 0.05), 其他时间均无显著差异(P > 0.05)。62#塘GSH-Px活性随养殖时间延长无显著变化,而56#塘GSH-Px活性随养殖时间延长呈显著降低变化,并在48、72和96 d时,62#塘GSH-Px活性显著大于56#塘(P < 0.05), 其他养殖时间均无显著差异(P > 0.05)。这表明高密度养殖可对刀鲚鱼种的机体免疫性能产生负面影响。

|
图中标有不同大写字母则表示养殖时间之间有显著性差异(P < 0.05), 标有不同小写字母则表示两池塘间有显著性差异(P < 0.05)。 The means with different capital letters within the same figure are significant differences extremely in breeding time at the 0.05 probability level, and the means with different lowercase letters within the same time are significant differences between the two ponds at the 0.05 probability level. 图 3 中高密度养殖对刀鲚幼鱼内脏团中非特异性免疫酶活性影响 Fig. 3 Effect of medium and high density culture on nonspecific immunity enzyme activities in viscera mass of juvenile Coilia nasus |
水产养殖过程中,放养密度是影响鱼类生长速率和成活率的重要外界因素之一,当达到一定密度后,随放养密度的增加,养殖鱼类生长速率和肥满度会明显降低,成活率下降[16-17]。CHRISTIANSEN等[18]发现随着放养密度增加,北极红点鲑(Salvelinus alpinus)的增重率和肥满度明显减小,生长速度明显减慢。王跃斌等[19]对日本黄姑鱼(Nibea japonica)研究发现最高密度养殖组的增重率、存活率和肥满度明显降低。通常情况高密度养殖抑制鱼类生长的原因主要有3点:(1)增加了群内竞争,过高的养殖密度直接加剧了鱼类对水体空间和生物饵料的竞争,从而降低了个体摄食量[20]。(2)养殖密度过高会导致养殖鱼类机体的应激反应,为维持正常的生理机能,鱼体需要消耗大量的能量,因此用于生长的能量减少,造成生长缓慢[21]。(3)由于养殖密度过高,鱼类的排泄物增多,若不定期换水,极易造成养殖水体中总氨氮和亚硝酸盐过高,严重威胁鱼类的生长和存活。本研究中,高密度养殖塘中刀鲚鱼种的体长和体质量增长明显慢于中密度养殖塘,体质量相对增长率、体长相对增长率、肥满度和存活率也均小于中密度养殖塘,高密度养殖刀鲚鱼种的生长受到明显抑制。造成这种结果的主要原因一方面是高密度增加了刀鲚群内的竞争:无人工配合饲料可投喂,目前刀鲚养殖主要食用活体生物饵料,如枝角类、桡足类及糠虾等,虽有关于利用人工配合饲料投喂刀鲚的报道,但都仅处于实验阶段,尚未应用于实践生产中[9, 22], 高密度养殖增加了刀鲚群体内活生物饵料的竞争,这也是探究刀鲚养殖密度的关键。另一方面是高密度导致了刀鲚机体的应激反应,导致机体消耗大量能量维持正常的生理机能,造成生长缓慢。而水质对刀鲚的生长和存活影响不大,因为高密度养殖刀鲚当年鱼种,虽然鱼的个体数量多,但总质量很低,养殖水面大,且不投喂人工饲料,在水质上并没有威胁。相似的研究结果还出现在虹鳟(Oncorhynchus mykiss)[23]、罗非鱼(Oreochromis spilurus)[24]和银鲈(Bidyanus bidyanus)[25]上。本研究中中高密度养殖刀鲚鱼种的肥满度未出现明显差异,可能是因为刀鲚幼鱼的体型所致,因为刀鲚当年鱼种非常纤细,体质量和体长之间的比率差距较大[9], 容易屏蔽两个塘之间的差异。
3.2 中高密度养殖对刀鲚当年鱼种消化酶活性的影响消化酶作为鱼体消化和吸收外界营养物质的重要参与者,其活性大小在一定程度上直接反映了鱼类机体的消化生理情况[26]。影响消化酶活性大小的外界因素除温度、盐度、酸碱度等外,养殖密度对其也有显著影响。研究[27]表明养殖鱼类在合适的养殖密度内,其机体会呈现出最佳的消化生理状态,其体内组织中的消化酶呈现较大活性。也有研究[28]表明在人工养殖过程中,鱼体中消化酶活性大小会受放养密度高低而改变,因此养殖鱼类的消化酶活性大小与其养殖密度的高低有直接关系。本研究中,中密度养殖塘刀鲚在养殖期间的淀粉酶活性均显著大于高密度养殖塘,并随养殖时间延长而呈现先升高后降低的变化趋势,但在养殖结束时两塘的淀粉酶活性均显著小于初始酶活性,一方面是由于养殖密度不同导致不同池塘中刀鲚所摄食的生物量不同,另一方面随着养殖进行,中密度养殖塘中刀鲚生长较快,个体较大,可摄食较大活饵料糠虾(Mysidacea), 而高密度养殖塘生长较慢,只能摄食适口的小活饵料枝角类和桡足类等,而活糠虾体内的淀粉酶可直接参与食物的消化[6], 因此中密度养殖塘中的淀粉酶显著高于高密度塘。研究[6, 29]表明鱼类机体中蛋白酶活性大小与其所摄食饵料种类和摄食量有密切关系,进而间接影响鱼体的生长速度。本研究中两池塘初始的胃蛋白酶和胰蛋白酶均存在显著差异,中密度养殖塘均高于高密度养殖塘,这可能是因为放养刀鲚鱼种时池塘水体中生物饵料丰富,而中密度池塘中由于苗种数量少,每尾刀鲚幼鱼所捕获含高蛋白的生物饵料量就多,从而刺激其体内胃蛋白和胰蛋白酶分泌的增加,这点已在对黄鳝(Monopterus albus)的研究[29]中得到证实。随着养殖时间推移,中密度养殖塘中胃蛋白酶和胰蛋白酶活性均显著低于实验初始时的蛋白酶活性,而高密度养殖塘中蛋白酶活性基本保持不变,一方面是由于养殖水体中活生物饵料数逐渐减少而导致的,另一方面高密度养殖塘中刀鲚幼鱼处于应激状态,影响了胃蛋白酶的合成与分泌[30]。在本研究中,整个养殖期间中密度养殖塘中的淀粉酶和蛋白酶活性整体上均大于高密度养殖塘,此与前面所得出中密度养殖塘刀鲚幼鱼生长速度较快的结果相对应,也再次验证了鱼类机体中蛋白酶活性大小与其生长呈正相关关系[9]。
鱼体中脂肪酶活性变化较为复杂,研究[29]表明这不仅与其所摄食的生物饵料有关,还与所受外界刺激所产生的应激反应有密切关系[27]。本实验期间,高密度塘中脂肪酶活性明显大于中密度塘,随着中密度塘酶活性的逐渐升高,至养殖实验结束时两养殖塘无显著差异。其原因可能是高密度对刀鲚有一定的胁迫影响,刀鲚幼鱼产生应激反应,鱼体需要产生更多的能量抵御密度胁迫,由于密度高、摄食蛋白饵料少,鱼体就分泌更多脂肪酶分解脂肪产生更多的能量以供机体需求。但由于本实验未设置养殖密度梯度等级,具体原因仍需有待进一步的研究分析。
3.3 中高密度养殖对刀鲚当年鱼种非特异性免疫酶活性的影响SOD、CAT和GSH-Px是生物机体内重要的3种抗氧化酶,在机体自我防护系统中起关键性作用,其活性大小常被用来指示鱼体自身免疫能力的强弱[31], 其中SOD功能是机体利用歧化反应将有害的超氧阴离子自由基(O2-)反应成H2O2和O2, 而H2O2又可通过CAT、GSH-Px两种酶转化成水,进而保护生物机体细胞不受O2-自由基与H2O2伤害[32]。有研究[33-34]表明高养殖密度造成养殖鱼类的胁迫状态,进而对鱼类免疫系统和抗氧化能力造成一定损伤。本研究中:中密度和高密度两个池塘中的SOD活性无显著差异,但随养殖时间延长显著降低;而中密度塘CAT活性随时间均逐渐升高,且CAT活性明显大于高密度塘;高密度塘的GSH-Px活性随养殖时间显著降低,而中密度塘无明显变化,但均显著大于高密度塘。这说明高密度养殖未对刀鲚幼鱼的SOD活性造成影响,但对CAT和GSH-Px活性产生了抑制作用,在一定程度上影响了刀鲚幼鱼的免疫性能,相似的结果还出现在俄罗斯鲟(Acipenser gueldenstaedtii)幼鱼[34]和虹鳟[35]上。
| [1] |
倪嘉豪, 朱晓静, 季益平, 等. 养殖密度对银鲳幼鱼生长、代谢酶活力及其相关基因表达的影响[J]. 热带海洋学报, 2020, 39(2): 54-64. NI J H, ZHU X J, JI Y P, et al. Effects of breeding density on the growth, metabolic enzyme activity and related gene expression level of juvenile Pampus argenteus[J]. Journal of Tropical Oceanography, 2020, 39(2): 54-64. |
| [2] |
ZHU Y J, YANG D G, CHEN J W, et al. An evaluation of stocking density in the cage culture efficiency of amur sturgeon Acipenser schrenckii[J]. Journal of Applied Ichthyology, 2011, 27(2): 545-549. DOI:10.1111/j.1439-0426.2011.01675.x |
| [3] |
SALAS-LEITON E, ANGUIS V, MARTÍN-ANTONIO B, et al. Effects of stocking density and feed ration on growth and gene expression in the senegalese sole (Solea senegalensis): potential effects on the immune response[J]. Fish & Shellfish Immunology, 2010, 28(2): 296-302. |
| [4] |
DI MARCO P, PRIORI A, FINOIA M G, et al. Physiological responses of European sea bass Dicentrarchus labrax to different stocking densities and acute stress challenge[J]. Aquaculture, 2008, 275(1/4): 319-328. |
| [5] |
石小涛, 李大鹏, 庄平, 等. 养殖密度对史氏鲟消化率、摄食率和生长的影响[J]. 应用生态学报, 2006, 17(8): 1517-1520. SHI X T, LI D P, ZHUANG P, et al. Effects of rearing density on juvenile Acipenser schrenckii digestibility, feeding rate and growth[J]. Chinese Journal of Applied Ecology, 2006, 17(8): 1517-1520. DOI:10.3321/j.issn:1001-9332.2006.08.031 |
| [6] |
逯尚尉, 刘兆普, 余燕. 密度胁迫对点带石斑鱼幼鱼生长、代谢的影响[J]. 中国水产科学, 2010, 18(2): 322-328. LU S W, LIU Z P, YU Y. Effects of density stress on growth and metabolism of juvenile Epinephelus malabaricus[J]. Journal of Fishery Sciences of China, 2010, 18(2): 322-328. |
| [7] |
RAFATNEZHAD S, FALAHATKAR B, GILANI M H T. Effects of stocking density on haematological parameters, growth and fin erosion of great sturgeon (Huso huso) juveniles[J]. Aquaculture Research, 2008, 39(14): 1506-1513. DOI:10.1111/j.1365-2109.2008.02020.x |
| [8] |
SAOUD I P, GHANAWI J, LEBBOS N. Effects of stocking density on the survival, growth, size variation and condition index of juvenile rabbit fish (Siganus rivulatus)[J]. Aquaculture International, 2008, 16(2): 109-116. DOI:10.1007/s10499-007-9129-7 |
| [9] |
施永海, 张根玉, 张海明, 等. 配合饲料和活饵料对刀鲚幼鱼生长、存活和消化酶、非特异性免疫酶、代谢酶及抗氧化酶活性的影响[J]. 水产学报, 2014, 38(12): 2029-2038. SHI Y H, ZHANG G Y, ZHANG H M, et al. Effects of compound feed and live feed on the growth, survival, and the activities of digestive enzyme, nonspecific immunity enzyme, metabolic enzyme, and antioxidant enzyme of young fish Coilia nasus[J]. Journal of Fisheries of China, 2014, 38(12): 2029-2038. |
| [10] |
唐雪, 徐钢春, 徐跑, 等. 野生与养殖刀鲚肌肉营养成分的比较分析[J]. 动物营养学报, 2011, 23(3): 514-520. TANG X, XU G C, XU P, et al. A comparison of muscle nutrient composition between wild and cultured Coilia nasus[J]. Chinese Journal of Animal Nutrition, 2011, 23(3): 514-520. DOI:10.3969/j.issn.1006-267x.2011.03.024 |
| [11] |
施永海, 张根玉, 张海明, 等. 刀鲚的全人工繁殖及胚胎发育[J]. 上海海洋大学学报, 2015, 24(1): 36-43. SHI Y H, ZHANG G Y, ZHANG H M, et al. Complete artificial propagation and embryonic development of Coilia nasus[J]. Journal of Shanghai Ocean University, 2015, 24(1): 36-43. |
| [12] |
徐钢春, 聂志娟, 杜富宽, 等. 长江刀鲚亲鱼强化培育及自然产卵规律研究[J]. 水生生物学报, 2016, 40(6): 1194-1200. XU G C, NIE Z J, DU F K, et al. Intensive culture and natural spawning of broodstock Coilia nasus under artificial feeding conditions[J]. Acta Hydrobiolgica Sinica, 2016, 40(6): 1194-1200. |
| [13] |
董文霞, 唐文乔, 王磊. 长江刀鲚繁殖群体的生长特性[J]. 上海海洋大学学报, 2014, 23(5): 669-674. DONG W X, TANG W Q, WANG L. Growth characteristics of reproductive population of Coilia nasus in the Yangtze River[J]. Journal of Shanghai Ocean University, 2014, 23(5): 669-674. |
| [14] |
李丽, 唐文乔, 张亚. 长江下游雌性刀鲚生殖洄游过程中脂肪酸含量及其组分的变化[J]. 水产学报, 2019, 43(4): 790-800. LI L, TANG W Q, ZHANG Y. Changes of fatty acid content and its components in different tissues during spawning migration processes of female Coilia nasus in the lower reaches of the Yangtze River[J]. Journal of Fisheries of China, 2019, 43(4): 790-800. |
| [15] |
冯广朋, 章龙珍, 庄平, 等. 海水网箱养殖长鳍篮子鱼的摄食与生长特性[J]. 海洋渔业, 2008, 30(1): 37-42. FENG G P, ZHANG L Z, ZHUANG P, et al. Feeding habit and growth characteristics of Siganus canaliculatus cultured in sea net cage[J]. Marine Fisheries, 2008, 30(1): 37-42. |
| [16] |
SHELBOURN J E, BRETT J R, SHIRAHATA S. Effect of temperature and feeding regime on the specific growth rate of sockeye salmon fry (Oncorhynchus nerka), with a consideration of size effect[J]. Journal of Fisheries Research Board of Canada, 2011, 30(8): 1191-1194. |
| [17] |
廖锐, 区又君, 勾效伟. 养殖密度对鱼类福利影响的研究进展Ⅰ. 死亡率、生长、摄食以及应激反应[J]. 南方水产, 2006, 2(6): 76-80. LIAO R, QU Y J, GOU X W. A review: influence of stocking density on fish welfare Ⅰ. Mortality, growth, feeding and stress response[J]. South China Fisheries Science, 2006, 2(6): 76-80. |
| [18] |
CHRISTIANSEN J S, SVENDSEN Y S, JOBLING M, et al. The combined effects of stocking density and sustained exercise on the behaviour, food intake, and growth of juvenile Arctic charr (Salvelinus alpinus L.)[J]. Canadian Journal of Zoology, 1992, 70(1): 115-122. |
| [19] |
王跃斌, 胡成硕, 胡则辉, 等. 养殖密度对日本黄姑鱼幼鱼生长及非特异性免疫的影响[J]. 海洋渔业, 2017, 39(1): 51-57. WANG Y B, HU C S, HU Z H, et al. Effects of different stocking densities on growth performance and non-specific immunity of juvenile Nibea japonica[J]. Marine Fisheries, 2017, 39(1): 51-57. |
| [20] |
SAWCER S J, MARANIAN M, SINGLEHURST S, et al. Enhancing linkage analysis of complex disorders: an evaluation of high-density genotyping[J]. Human Molecular Genetics, 2004, 13(17): 1943-1949. |
| [21] |
LAMBOOIJ E, VAN DE VIS J W, KLOOSTERBOER R J, et al. Welfare aspects of live chilling and freezing of farmed eel (Anguilla anguilla L.): neurological and behavioural assessment[J]. Aquaculture, 2002, 210(1/4): 159-169. |
| [22] |
魏广莲, 徐钢春, 顾若波, 等. 不同人工饲料对刀鲚幼鱼生长、血清生化指标及脂质代谢酶活性的影响[J]. 应用生态学报, 2013, 24(12): 3567-3573. WEI G L, XU G C, GU R B, et al. Effects of diets on growth, serum biochemical indices and lipid metabolism in Coilia nasus fingerlings[J]. Chinese Journal of Applied Ecology, 2013, 24(12): 3567-3573. |
| [23] |
BAGLEY M J, BENTLEY B, GALL G A E. A genetic evaluation of the influence of stocking density on the early growth of rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1994, 121(4): 313-326. |
| [24] |
CRUZ E M, RIDHA M. Production of the tilapia Oreochromis spilurus Günther stocked at different densities in sea cages[J]. Aquaculture, 1991, 99(1/2): 95-103. |
| [25] |
ROWLAND S J, MIFSUD C, NIXON M, et al. Effects of stocking density on the performance of the Australian freshwater silver perch (Bidyanus bidyanus) in cages[J]. Aquaculture, 2006, 253(1/4): 301-308. |
| [26] |
LUNDSTEDT L M, MELO J F B, MORAES G. Digestive enzymes and metabolic profile of Pseudoplatystoma corruscans (Teleostei: Siluriformes) in response to diet composition[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2004, 137(3): 331-339. |
| [27] |
彭士明, 林少珍, 施兆鸿, 等. 饲养密度对银鲳幼鱼增重率及消化酶活性的影响[J]. 海洋渔业, 2013, 35(1): 72-76. PENG S M, LIN S Z, SHI Z H, et al. Effects of rearing density on growth rate and digestive enzyme activity of juvenile Pampus argenteus[J]. Marine Fisheries, 2013, 35(1): 72-76. |
| [28] |
檀晨曦. 循环水养殖模式下养殖密度和投喂频率对花鳗鲡生长性能、体组成、消化酶活性和血清生化指标的影响[D]. 上海: 上海海洋大学, 2016. TAN C X. Effects of stocking density and feeding frequency on growth, body composition, digestive enzyme and blood biochemical of Anguilla marmorata in recirculating aquaculture system[D]. Shanghai: Shanghai Ocean University, 2016. |
| [29] |
杨代勤, 严安生, 陈芳, 等. 不同饲料对黄鳝消化酶活性的影响[J]. 水产学报, 2003, 27(6): 558-563. YANG D Q, YAN A S, CHEN F, et al. Effects of different diets on activities of digestive enzymes of Monopterus albus[J]. Journal of Fisheries of China, 2003, 27(6): 558-563. |
| [30] |
肖鸣鹤, 肖英平, 吴志强, 等. 养殖密度对克氏原螯虾幼虾生长、消化酶活力和生理生化指标的影响[J]. 水产学报, 2012, 36(7): 1088-1093. XIAO M H, XIAO Y P, WU Z Q, et al. Effects of stocking density on growth, digestive enzyme activities and biochemical indices of juvenile Procambarus clarkii[J]. Journal of Fisheries of China, 2012, 36(7): 1088-1093. |
| [31] |
刘宝良, 雷霁霖, 贾睿, 等. 养殖密度对鱼类福利影响研究进展[J]. 中国工程科学, 2014, 16(9): 100-105. LIU B L, LEI J L, JIA R, et al. A review: The influence of stocking density on fish welfare[J]. Engineering Sciences, 2014, 16(9): 100-105. |
| [32] |
丁金强, 刘萍, 李健, 等. 不同地理群体日本虫寻非特异性免疫及抗氧化酶活力的比较[J]. 水产学报, 2013, 37(2): 275-280. DING J Q, LIU P, LI J, et al. Comparison of nonspecific immunity and the activities of antioxidant enzymes in different populations of Charybdis japonica[J]. Journal of Fisheries of China, 2013, 37(2): 275-280. |
| [33] |
HEGAZI M M, ATTIA Z I, ASHOUR O A. Oxidative stress and antioxidant enzymes in liver and white muscle of Nile tilapia juveniles in chronic ammonia exposure[J]. Aquatic Toxicology, 2010, 99(2): 118-125. |
| [34] |
曹阳, 李二超, 陈立侨, 等. 养殖密度对俄罗斯鲟幼鱼的生长、生理和免疫指标的影响[J]. 水生生物学报, 2014, 38(5): 968-974. CAO Y, LI E C, CHEN L Q, et al. Effects of stocking density on growth, physiological and immune responses in juvenile Russian sturgeon[J]. Acta Hydrobiologica Sinica, 2014, 38(5): 968-974. |
| [35] |
PETERS G, FAISAL M, LANG T, et al. Stress caused by social interaction and its effect on susceptibility to Aeromonas hydrophila infection in rainbow trout Salmo gairdneri[J]. Diseases of Aquatic Organisms, 1988, 4: 83-89. |
 2021,
Vol. 30
2021,
Vol. 30


