2. 上海海洋大学 农业农村部淡水水产种质资源重点实验室, 上海 201306;
3. 上海海洋大学 水产动物遗传育种中心上海市协同创新中心, 上海 201306;
4. 上海申漕特种水产开发公司, 上海 201516
罗氏沼虾(Macrobrachium rosenbergii)是我国重要的养殖虾类之一。原产于东南亚地区,主要在淡水或咸淡水水域中生存,具有生长迅速、营养价值高等优点。但长时间的病害问题对罗氏沼虾产业发展造成很大限制[1],因此需要研究其先天免疫机制,为罗氏沼虾的病害防控提供参考。
由于获得性免疫的缺乏,甲壳动物主要依赖先天性免疫作为自身的主要防御体系,其中免疫信号通路扮演着重要角色。当病原微生物入侵时,先天免疫信号通路中的模式识别受体(pattern recognition receptors,PRRs)识别并结合病原微生物自身具有的病原相关分子模式(pathogen associated molecular patterns,PAMPs),随后PRRs与PAMPs的结合体将免疫信号通路激活,从而调控下游的免疫相关基因如溶菌酶、酚氧化酶原(prophenoloxidase,proPO)以及抗菌肽(anti-microbial peptides,AMPs)等来对抗病原微生物。目前在虾先天免疫系统中发现的3种主要信号通路为JAK/STAT信号通路、IMD信号通路以及Toll信号通路。其中:JAK/STAT信号通路主要参与对病毒引起的免疫反应;IMD信号通路则主要通过调控抗菌肽的表达来防御细菌入侵;而Toll信号通路可以介导细菌和病毒所引起的先天免疫反应[2]。
作为先天免疫信号通路中主要的PRRs之一,Toll样受体可以通过识别多种PAMPs或通过识别体内的代谢产物来激活先天免疫系统,它是先天性免疫与获得性免疫的结合点[3],具有较高保守性的特点。在脊椎动物中,Toll样受体(TLRs)是一种跨膜受体,主要包括胞外区亮氨酸重复结构域(leucine rich repeat,LRR)、跨膜区以及位于胞内的Toll/白介素1受体结构域(Toll/IL-1Rdomain,TIR)。其中:LRR结构域主要通过识别并结合配体来启动信号通路,不同的TLR可选择性识别特异性配体;而TIR结构域可以通过募集接头蛋白来启动下游信号转导,从而激活相关免疫转录因子启动先天免疫。目前,相关研究在人类体内发现了11种TLR,在小鼠(Mus musculus)中则发现13种TLR[4],它们都具有高度同源性。在无脊椎动物中,Toll样受体最早在果蝇(Drosophila melanogaster)体内发现[5-6]。与脊椎动物不同,果蝇Tolls不可以与PAMPs直接结合,需要通过活化Spätzle配体然后与Toll的LRR结构域结合形成二聚体,胞内TIR与包含死亡结构域的蛋白MyD88、Tube、Pelle相互作用形成异源三源体,随后Cactus磷酸化并水解,导致转录因子Did和Dorsal释放,最终调控抗菌肽等免疫相关基因的表达来进行免疫防御。在果蝇体内共发现9种Toll样受体,Toll1 参与果蝇生长与免疫[6];Toll2 参与果蝇胚胎发育[7];Toll7和Toll8可能调控果蝇的生长[8];Toll9可以激活免疫相关基因的表达[9]。同时,2007年虾类首个Toll样受体基因在凡纳滨对虾(Litopenaeus vannamei)中被发现并鉴定[10]。随后,陆续在斑节对虾(Penaeus monodon)[11]、中国明对虾(Fenneropenaeus chinensis)[12]、克氏原螯虾(Procambium clarkii)[13]、日本囊对虾(Marsupenaeus japonicus)[14]、罗氏沼虾[15]等多种虾体内发现Toll样受体基因。目前在凡纳滨对虾以及罗氏沼虾体内都发现了3种不同类型TLR,然而不同类型的TLR在虾先天免疫调控中的生理功能差异研究尚处于起步阶段。
本实验包括2个部分,首先通过荧光定量PCR技术检测罗氏沼虾3种TLR基因在RNA干扰(RNA interference,RNAi)[16]过程中的相对表达量来探索RNAi的最适注射剂量和观察时间。随后在RNA干扰下测定分析多种免疫相关基因的相对表达量来研究3种MrTLRs的免疫调控功能。为进一步研究罗氏沼虾的免疫调控机制以及不同类型TLR之间的免疫功能差异提供一定的研究基础。
1 材料与方法 1.1 实验材料与养殖管理实验用罗氏沼虾共400只,取自上海申漕特种水产开发有限公司,体质量为(8.0±0.5) g,规格统一,体表无损伤。实验虾暂养于55个容积为400 L的水箱中(长78 cm,宽58 cm,高46 cm)。水箱中加入200 L水,其间保持水温为(27.0±1.0) ℃,盐度为2,pH为8.0±0.2,提供自然光照,每日吸污1次并更换50%水体,养殖3 d后开始正式实验。
1.2 实验方法 1.2.1 实验设计实验开始前,随机抽取实验用虾进行白斑综合征病毒和溶藻弧菌感染检测,以确保实验用虾不存在病原体感染。将实验用虾分为5个大组依次为空白对照组、阴性对照组、MrTLR1干扰组、MrTLR2干扰组、MrTLR3干扰组,其中每个干扰组分为0.4、0.8和1.2 μg/g(siRNA/体质量)等3个剂量组,每组30尾虾。空白对照组与阴性对照组分别注射磷酸缓冲液(Phosphate buffer saline,PBS)与scrambled-siRNA,干扰组注射MrTLR-siRNA。于腹肢第二小节进行注射,注射100 μL PBS、scrambled-siRNA或siRNA,分别于注射后0、6、12、24和48 h随机采集每组3只实验用虾的血液和鳃组织样品保存于RNA keeper溶液(南京诺唯赞生物科技有限公司)中,于-80 ℃冰箱中保存。本实验中所有操作均符合上海海洋大学实验动物伦理委员会规范。
1.2.2 总RNA的提取及反转录组织匀浆后,RNA isolater (南京诺唯赞生物科技有限公司)抽提总RNA,Nanodrop2000(Thermo Scientific)测定其浓度及纯度,测得OD260/OD280为1.8~2.0,判定RNA的纯度符合要求可用于后续实验。RNase-Free水稀释总RNA质量浓度至500 ng/μL,-80 ℃备用。HiScript Ⅱ RT SuperMix for qPCR(+gDNA wiper)试剂盒(南京诺唯赞生物科技有限公司)反转稀释后总RNA获得cDNA。
1.2.3 引物及siRNA设计根据NCBI GenBank罗氏沼虾MrTLR1(KJ188410.1)、MrTLR2(KJ188411.1)、MrTLR3(KJ188412.1)和Mr18S rRNA(GQ131934.1)序列以及相关免疫基因MyD88、Crustin、ALF、IMD和proPO在其序列保守区域采用软件PrimerPremier 6.0分别设计引物,根据3种MrTLR基因的全长序列设计siRNA,引物序列及siRNA序列见表 1。所用引物委托生工生物工程(上海)有限公司合成,所用scrambled-siRNA及siRNA由锐博生物科技有限公司合成。

|
表 1 引物及siRNA序列 Tab.1 Sequences of the primers or siRNA |
设定20.0 μL反应体系:SYBR Premix Fx Taq 10.0 μL,取上文实验中所得cDNA 2.0 μL(100 ng),上、下游引物各0.8 μL,ddH2O 6.4 μL。反应程序:95 ℃预变性30 s,95 ℃变性5 s,55 ℃退火30 s,72 ℃延伸30 s,共40个循环,根据溶解曲线分析PCR产物质量。根据预实验结果以及本实验室团队之前的研究发现MrTLR1、MrTLR2、MrTLR3和IMD主要在鳃中表达,而ALF、Crustin和proPO主要在血淋巴中表达,故本实验选择在鳃组织中检测分析3种MrTLRs以及IMD的表达量,在血淋巴中检测分析ALF、Crustin和proPO的表达量。
1.2.5 数据处理采用2-ΔΔCt方法对所测基因进行表达量分析,以罗氏沼虾Mr18S rRNA (GQ131934.1)为内参基因。所有数据采用平均值±标准差(Means±SD)表示。以SPSS 17.0进行单因素方差分析(One-way ANOVA),当P<0.05认为差异显著。
2 结果 2.1 MrTLRs基因的干扰规律分析在MrTLR1的RNA干扰实验中,siRNA(0.4 μg/g)组对MrTLR1的抑制效果不显著,而siRNA(0.8 μg/g)组以及siRNA(1.2 μg/g)组对MrTLR1均有显著的抑制效果。由图 1可以看出:siRNA(0.4 μg/g)组、siRNA(0.8 μg/g)组以及siRNA(1.2 μg/g)组在注射后6、12、24 hMrTLR1基因的表达量出现下降,而在注射后48 h表达量升高;siRNA(0.4 μg/g)组对MrTLR1的抑制效果不显著;siRNA(0.8 μg/g)组在注射后24 hMrTLR1的表达量得到显著抑制(P<0.05),为0 h表达量的25%,siRNA(1.2 μg/g)组在注射后24 h以及48 h表达量得到显著抑制(P<0.05),其中注射后24 h抑制效果最明显,为0 h表达量的15%。
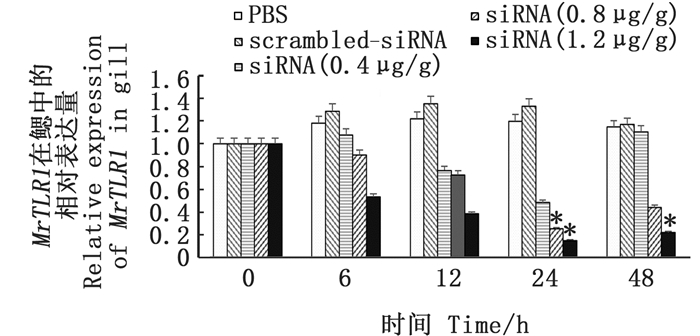
|
柱状图上方"*"代表与0 h的数据相比差异显著(P<0.05)。 "*" above the bar represented significant difference(P < 0.05)compared with the data at 0 h. 图 1 罗氏沼虾鳃中MrTLR1基因在RNA干扰实验中的表达变化情况 Fig. 1 Expression of MrTLR1 in gill of Macrobrachium rosenbergii during RNA interference |
在MrTLR2的RNA干扰实验中,siRNA(0.4 μg/g)组、siRNA(0.8 μg/g)组以及siRNA(1.2 μg/g)组对MrTLR2均有显著的抑制效果(P<0.05)。从图 2可以看出:siRNA(0.4 μg/g)组和siRNA(0.8 μg/g)组在注射之后MrTLR2的基因表达量均出现先下降后上升,在注射后24 h两组表达量均显著降低(P<0.05)且达到最低水平,分别为0 h表达水平的6%与4%;siRNA(1.2 μg/g)组MrTLR2的基因表达量呈现下降趋势,注射后24和48 h抑制显著(P<0.05),在注射后48 h达到最低水平,为0 h表达量的21%。
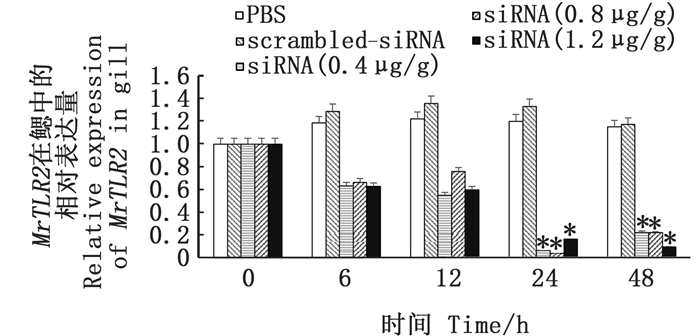
|
柱状图上方"*"代表与0 h的数据相比差异显著(P<0.05)。 "*" above the bar represented significant difference(P < 0.05)compared with the data at 0 h. 图 2 罗氏沼虾鳃中MrTLR2基因在RNA干扰实验中的表达变化情况 Fig. 2 Expression of MrTLR2 in gill of Macrobrachium rosenbergii during RNA interference |
在MrTLR3的RNA干扰实验中,siRNA(0.4 μg/g)组、siRNA(0.8 μg/g)组以及siRNA(1.2 μg/g)组对MrTLR3均有显著的抑制效果(P<0.05)。图 3显示:siRNA(0.4 μg/g)组呈现下降趋势,在注射后24 h以及48 h抑制效果显著(P<0.05),在注射后48 h MrTLR3基因表达水平最低,为0 h表达量的26%;siRNA(0.8 μg/g)组与siRNA(1.2 μg/g)组表达量都呈现先下降后上升,并均在注射后24 h达到最低水平且抑制效果显著(P<0.05),分别为0 h表达量的26%和19%。
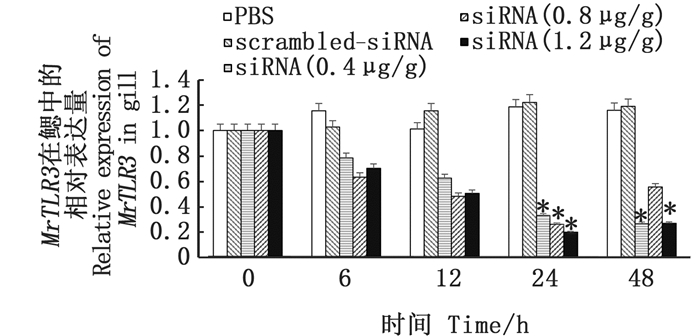
|
柱状图上方"*"代表与0 h的数据相比差异显著(P<0.05)。 "*" above bar represented significant difference(P < 0.05)compared with the data at 0 h. 图 3 罗氏沼虾鳃中MrTLR3基因在RNA干扰实验中的表达变化情况 Fig. 3 Expression of MrTLR3 in gill of Macrobrachium rosenbergii during RNA interference |
基于上文MrTLRs基因干扰实验的结果,本实验选取1.2 μg/g剂量组0、24以及48 h鳃组织和血液样品进行研究分析。
2.2.1 MrTLR1 基因沉默后对其他免疫基因表达影响图 4显示,MyD88基因表达水平呈现先下降后上升的规律。其中:注射siRNA后24 h表达量达到最低,与0 h相比显著降低(P<0.05),为0 h表达量的20%;Crustin基因的表达量随着时间变化而逐渐降低,在注射后48 h表达量下降显著(P<0.05),为0 h表达量的43%;ALF基因在注射后48 h表达量呈现显著降低(P<0.05),为0 h表达量的47%;IMD基因无显著变化;proPO基因相对表达量无显著变化;MrTLR2基因在注射后24 h的表达量显著升高1.36倍(P<0.05),而MrTLR3无显著变化。
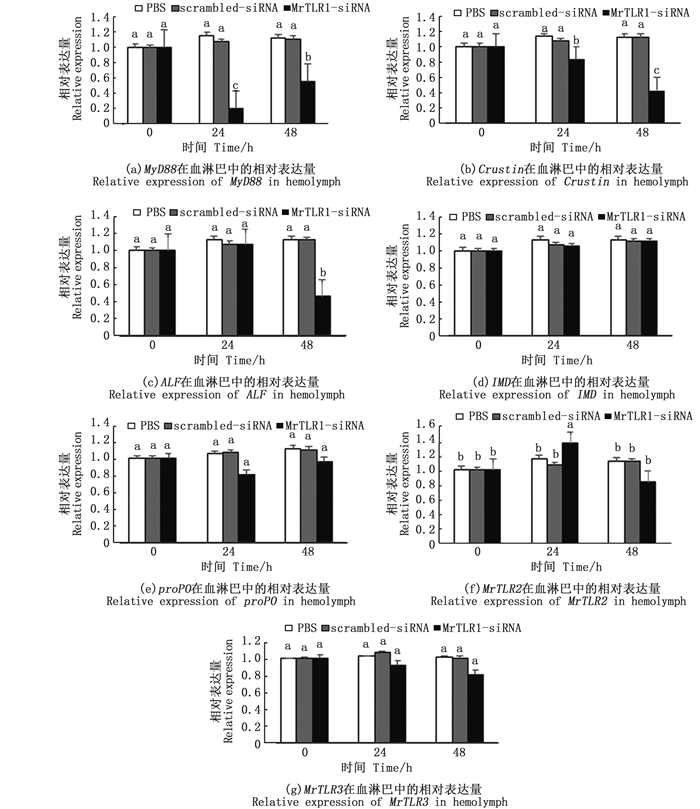
|
图中不同小写字母表示差异显著(P<0.05)。 Different lowercase letters in the figure represented significant difference(P < 0.05). 图 4 罗氏沼虾MrTLR1基因沉默后不同免疫相关基因的表达变化情况 Fig. 4 Expression of different immune-related genes in MrTLR1 silenced Macrobrachium rosenbergii |
由图 5可知:IMD、proPO、ALF、MrTLR1以及MrTLR3基因表达量均无显著变化;MyD88基因表达量呈现下降趋势,在48 h表达量显著降低(P<0.05),为0 h表达量的74%;Crustin基因在注射后24 h的表达量较0 h出现显著抑制(P<0.05),为0 h表达量的33%,而注射后48 h则无显著差异。

|
图中不同小写字母表示差异显著(P<0.05)。 Different lowercase letters in the figure represented significant difference(P < 0.05). 图 5 罗氏沼虾MrTLR2基因沉默后不同免疫相关基因的表达变化情况 Fig. 5 Expression of different immune-related genes in MrTLR2silencedMacrobrachium rosenbergii |
由图 6可知:ALF基因在注射后24 h、48 h均出现显著升高并呈现上升趋势(P<0.05),在注射后48 h表达量最高,为0 h表达量的1.63倍;IMD基因在注射后24 h表达出现显著升高(P<0.05),为0 h表达量的1.40倍;MyD88、Crustin、proPO、MrTLR1以及MrTLR2基因均无显著变化。
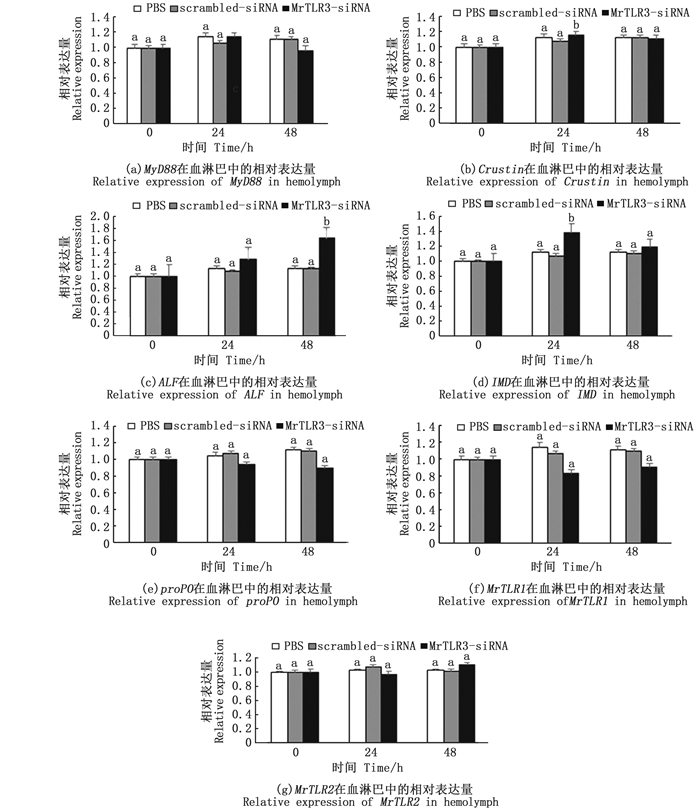
|
图中不同小写字母表示差异显著(P<0.05)。 Different lowercase letters in the figure represented significant difference(P < 0.05). 图 6 罗氏沼虾MrTLR3基因沉默后不同免疫相关基因的表达变化情况 Fig. 6 Expression of different immune-related genes in MrTLR3 silenced Macrobrachium rosenbergii |
TAN等[17]在研究罗氏沼虾MrIR基因siRNA干扰的最适剂量的实验中设计了0.1、0.5、1.5和3.0 μg/g等4个组,发现0.5 μg/g剂量对MrIR基因的沉默效果最佳。FENG等[18]对罗氏沼虾注射siRNA沉默MrToll基因,每只注射15 μg siRNA(0.75~1.00 μg/g),在第24 h时MrToll基因的表达量得到极显著抑制。本实验中也发现不同剂量siRNA对罗氏沼虾3种TLRs基因的干
扰效果有明显影响。其中,0.4 μg/g组对MrTLR1干扰效果不显著,而0.8 μg/g组与1.2 μg/g组对3种MrTLRs均具有显著抑制,在MrTLR1以及MrTLR3的干扰实验中0.8 μg/g组在注射后24 h抑制效果显著,但在注射后48 h MrTLR1和MrTLR3的表达量出现上升,抑制效果不显著;1.2 μg/g组在注射后48 h对3种MrTLRs仍有显著抑制效果。除此之外,不同剂量siRNA干扰后Toll样受体基因的最低表达量在3个剂量组间并无显著差异,其中1.2 μg/g组未能将目的基因表达量抑制到更低水平,这与江丰伟等[19]对青虾transformer-2基因RNA干扰规律研究中的结果相似,在达到一定剂量以后RNA干扰素对基因表达的抑制效果并不随着剂量的升高而发生变化。田宏刚等[20]认为存在于昆虫血淋巴或肠道内的核酸酶可以降解dsRNA或siRNA,从而影响RNAi的效率。由此推测罗氏沼虾对siRNA的干扰剂量存在一定的耐受范围,不会使被沉默的基因表达量下降得过低。还有研究表明不同虾类注射不同类型干扰素对目的基因的干扰持续时间不同。关于虾类RNAi的研究报道有:江丰伟等[19]对青虾注射4 μg/g dsRNA对transformer-2基因的有效干扰可持续一周;TAN等[17]对罗氏沼虾注射0.5 μg/g siRNA沉默MrIR基因,有效干扰效果持续5 d,同时TAN又发现注射dsRNA达到同样干扰效果时所需剂量在4~5 μg/g。综上分析,RNA干扰素的剂量及类型都可能对RNA干扰效果产生影响,因此,综合之前干扰时间及剂量实验的结果,选取1.2 μg/g剂量作为本实验中siRNA的最佳干扰剂量,并选用注射后的24 h和48 h作为最佳观察时间。
在将罗氏沼虾MrTLR1和MrTLR2沉默之后,MyD88基因的表达均被显著抑制,最低表达量分别为0 h表达量的20%和73%;然而沉默MrTLR3并没有对MyD88的表达产生显著影响。DEEPIKA等[21]研究发现MyD88参与斑节对虾对WSSV的免疫应答;CHEN等[22]发现沉默拟穴青蟹SpToll1后,MyD88的表达被极显著抑制,沉默SpToll2后,MyD88的表达则被显著抑制;可以推测MrTLR1和MrTLR2都参与MyD88基因的表达调控且MrTLR1对MyD88的调控影响更大,罗氏沼虾MrTLR3对MyD88的表达水平没有显著影响。MyD88在Toll信号通路中发挥着重要作用,首先病原入侵后,机体产生Spätzle配体,Spätzle与TLR的LRR结构域结合启动信号通路,随后MyD88与TLR两者的TIR结构域相互作用使得MyD88召集到TLR受体上,MyD88再通过其死亡结构域与IRAK(interleukin-1 receptor associated kinase)相互作用并激活IRAKs,从而启动Toll信号通路下游的免疫应答并最终激活转录因子NF-κB,抗菌肽及其他免疫基因的表达因此得以调控[23]。
抗菌肽在虾类先天免疫系统中发挥着重要作用,不仅可以抵御外来病原入侵还可以排解自身的代谢产物。在甲壳动物中,目前报道的抗菌肽主要有4类:对虾素(Penaeidin)、甲壳素(Crustin)、抗脂多糖因子(ALF)以及溶菌酶(Lysozyme),这些抗菌肽都具有广谱杀菌活性。有研究报道TLR是在识别入侵细菌的分子模式后,通过激活抗菌肽的表达来调节虾的先天免疫。PAN等[24]研究发现在副溶血弧菌的刺激下对日本沼虾MnToll1进行沉默,ALF2、Crustin1和Crustin2的表达量因此被抑制;WANG等[25]发现凡纳滨对虾LvToll2基因可以显著激活NF-κB通路的抗菌肽基因;WANG等[13]发现在鳗弧菌的刺激下同时沉默克氏原鳌虾(Procambarus clarkii)PcToll基因,Crustin、ALF和溶菌酶的表达被显著抑制; CHEN等[22]发现沉默拟穴青蟹SpToll1和SpToll2都可以抑制ALF5的表达,而ALF3只在沉默SpToll2后出现表达抑制。本实验中在MrTLR1被沉默之后ALF以及Crustin的表达量出现了显著下降,同时MrTLR2的表达量也出现了上升;在MrTLR2沉默实验中Crustin的表达量出现了显著下降,ALF的表达量没有显著变化;而在MrTLR3沉默实验中ALF的表达量显著上升,Crustin的表达量没有显著变化。在MrTLR1和MrTLR2的沉默实验中,Crustin的表达量均出现了显著下降,前者Crustin表达量在注射后48 h表达量达到最低水平,为0 h的43%,后者在24 h表达量达到最低水平,为0 h表达量的33%。可以推测MrTLR1和MrTLR2都可调控罗氏沼虾抗菌肽的表达,而沉默MrTLR1后抑制了部分抗菌肽的表达,例如本实验中Crustin基因,这部分抗菌肽同时受到MrTLR2的调控影响且MrTLR2的影响作用大于MrTLR1,机体为了维持体内抗菌肽的正常水平从而增加MrTLR2的表达量。此外,在MrTLR1沉默实验中,ALF的表达量显著下降,而在MrTLR3沉默实验中,ALF的表达量出现显著上升,这可能与沉默MrTLR3后IMD的表达量出现上升有关。
IMD信号通路是关键的NF-κB信号通路之一,它参与调控抗菌肽的免疫应答。相关免疫基因的表达在IMD信号通路发生异常后会受到影响造成病原微生物入侵。LAN等[26]发现中国对虾和克氏原鳌虾体内IMD信号通路参与抗菌肽的免疫调控;史晏如[27]发现罗氏沼虾IMD基因参与对抗菌肽的表达调控。本实验中IMD表达上升后ALF的表达也出现了上升。HOU等[28]发现凡纳滨对虾Toll信号通路与IMD信号通路存在关联,在抑制凡纳滨对虾LvToll的表达后,LvIMD的表达出现了抑制,抑制LvIMD的表达同样会抑制LvToll的表达。在LIU等[29]的研究中,在凡纳滨对虾体内沉默Toll或IMD都会促使另一个基因的表达出现上调,发现Toll信号通路与IMD信号通路之间存在平衡调控。本实验中沉默MrTLR1和MrTLR2对IMD的表达量没有显著影响,而沉默MrTLR3时,IMD的表达量显著上升。由此可以推测罗氏沼虾体内Toll信号通路与IMD信号通路之间存在关联,即当Toll信号通路受到影响时机体会上调IMD基因的表达量来调控免疫平衡,而MrTLR3在其中发挥重要作用。
酚氧化酶原系统作为一种异己认知先天性免疫系统,在无脊椎动物的免疫防御中发挥重要作用[30]。酚氧化酶原基因proPO是酚氧化酶系统中的上游关键基因。酚氧化酶原只有在酚氧化酶原激活酶的刺激下才可以形成具有活性的酚氧化酶,从而抵御病原。本研究中,沉默罗氏沼虾3种MrTLRs基因对虾体内proPO的表达没有显著影响。但有研究报道称在昆虫体内酚氧化酶原系统与Toll信号通路之间存在关联。在黄粉虫(Tenebrio molitor)体内β-1, 3-葡聚糖依赖性酚氧化酶原系统和Toll信号通路共享3种酶:模块化丝氨酸蛋白酶、Spätzle加工酶激活酶和Spätzle加工酶,其中Spätzle加工酶被发现是可同时影响两种免疫系统的末端蛋白酶,降解proPO前体以及pro-Spätzle影响黑色素和抗菌肽的产生[31]。在烟草天蛾(Manduca sexta)体内的血淋巴蛋白酶6通过对pro-PAP1的作用参与proPO的激活,此外还通过血淋巴蛋白酶8的水解过程进行裂解并激活pro-Spätzle影响Toll信号通路[32]。根据本实验结果可以推测, 罗氏沼虾3种TLRs与酚氧化酶原系统之间没有直接的相互调控作用,但可能存在间接的调控关系,仍需进一步研究。
目前在虾类中只有凡纳滨对虾和罗氏沼虾报道有3种TLRs。有研究[33-34]发现在关于凡纳滨对虾TLR的报道中,LvToll1主要参与病毒引起的免疫反应,LvToll2主要参与抵御细菌的免疫反应,而LvToll3可能对dsRNA病毒作出免疫反应。刘伟利等[35]认为罗氏沼虾MrTLR1基因是鳃组织抵御细菌感染的主要应答基因,MrTLR2基因可能参与鳃组织的其他免疫活动,MrTLR3基因的调控机制尚未清晰。实验结果表明: 罗氏沼虾MrTLR1和MrTLR2都参与了MyD88的表达调控,并且MrTLR1对MyD88的调控影响更显著,同时沉默MrTLR3对MyD88的表达没有显著影响;另外MrTLR1和MrTLR2都可以调控抗菌肽基因的表达,并且MrTLR1与MrTLR2之间可能存在某种平衡机制来维持机体免疫系统的正常运作;除此之外, MrTLR3可能参与Toll信号通路和IMD信号通路之间的调控。
| [1] |
周俊名, 戴习林, 蒋飞, 等. 池养罗氏沼虾生长缓慢原因初步分析[J]. 上海海洋大学学报, 2017, 26(6): 853-861. ZHOU J M, DAI X L, JIANG F, et al. The preliminary analysis of the reasons for the poor growth of Macrobrachium rosenbergii in pond[J]. Journal of Shanghai Ocean University, 2017, 26(6): 853-861. |
| [2] |
LI F H, XIANG J H. Signaling pathways regulating innate immune responses in shrimp[J]. Fish & Shellfish Immunology, 2013, 34(4): 973-980. |
| [3] |
O'NEILL L A J, GOLENBOCK D, BOWIE A G. The history of Toll-like receptors-redefining innate immunity[J]. Nature Reviews Immunology, 2013, 13(6): 453-460. DOI:10.1038/nri3446 |
| [4] |
BEUTLER B. Inferences, questions and possibilities in Toll-like receptor signalling[J]. Nature, 2004, 430(6996): 257-263. DOI:10.1038/nature02761 |
| [5] |
NVSSLEIN-VOLHARD C, LOHS-SCHARDIN M, SANDER K, et al. A dorso-ventral shift of embryonic primordia in a new maternal-effect mutant of Drosophila[J]. Nature, 1980, 283(5746): 474-476. DOI:10.1038/283474a0 |
| [6] |
ANDERSON K V, BOKLA L, NVSSLEIN-VOLHARD C. Establishment of dorsal-ventral polarity in the Drosophila embryo: the induction of polarity by the Toll gene product[J]. Cell, 1985, 42(3): 791-798. DOI:10.1016/0092-8674(85)90275-2 |
| [7] |
ELDON E, KOOYER S, D'EVELYN D, et al. The Drosophila 18 wheeler is required for morphogenesis and has striking similarities to Toll[J]. Development, 1994, 120(4): 885-899. DOI:10.1242/dev.120.4.885 |
| [8] |
YAGI Y, NISHIDA Y, IP Y T. Functional analysis of Toll-related genes in Drosophila[J]. Development, Growth & Differentiation, 2010, 52(9): 771-783. |
| [9] |
OOI J Y, YAGI Y, HU X D, et al. The Drosophila Toll-9 activates a constitutive antimicrobial defense[J]. EMBO Reports, 2002, 3(1): 82-87. DOI:10.1093/embo-reports/kvf004 |
| [10] |
YANG L S, YIN Z X, LIAO J X, et al. A Toll receptor in shrimp[J]. Molecular Immunology, 2007, 44(8): 1999-2008. DOI:10.1016/j.molimm.2006.09.021 |
| [11] |
刘文静. 斑节对虾TLR22及Relish基因的克隆与表达分析[D]. 上海: 上海海洋大学, 2012. LIU W J. Cloning and expression analysis of TLR22 & Relish genes in Penaeus monodon[D]. Shanghai: Shanghai Ocean University, 2012. |
| [12] |
YANG C J, ZHANG J Q, LI F H, et al. A Toll receptor from Chinese shrimp Fenneropenaeus chinensis is responsive to Vibrio anguillarum infection[J]. Fish & Shellfish Immunology, 2008, 24(5): 564-574. |
| [13] |
WANG Z, CHEN Y H, DAI Y J, et al. A novel vertebrates Toll-like receptor counterpart regulating the anti-microbial peptides expression in the freshwater crayfish, Procambarus clarkii[J]. Fish & Shellfish Immunology, 2015, 43(1): 219-229. |
| [14] |
MEKATA T, KONO T, YOSHIDA T, et al. Identification of cDNA encoding Toll receptor, MjToll gene from kuruma shrimp, Marsupenaeus japonicus[J]. Fish & Shellfish Immunology, 2008, 24(1): 122-133. |
| [15] |
SRISUK C, LONGYANT S, SENAPIN S, et al. Molecular cloning and characterization of a Toll receptor gene from Macrobrachium rosenbergii[J]. Fish & Shellfish Immunology, 2014, 36(2): 552-562. |
| [16] |
赵炜, 陆娣, 赵树进. RNAi研究进展[C]//2014年广东省药师周大会论文集. 广州: 广东省药学会, 2014. ZHAO W, LU D, ZHAO S J. Research progress of RNAi[C]//Essays of 2014 Guangdong Pharmacist Week Conference. Guangzhou: Guangdong Pharmaceutical Association, 2014. |
| [17] |
TAN K, LI Y H, ZHOU M, et al. siRNA knockdown of MrIR induces sex reversal in Macrobrachium rosenbergii[J]. Aquaculture, 2020, 523: 735172. DOI:10.1016/j.aquaculture.2020.735172 |
| [18] |
FENG J L, ZHAO L L, JIN M, et al. Toll receptor response to white spot syndrome virus challenge in giant freshwater prawns (Macrobrachium rosenbergii)[J]. Fish & Shellfish Immunology, 2016, 57: 148-159. |
| [19] |
江丰伟, 傅洪拓, 乔慧, 等. 青虾Transformer-2基因RNA干扰规律的研究[J]. 中国农学通报, 2014, 30(32): 32-37. JIANG F W, FU H T, QIAO H, et al. The RNA interference regularity of Transformer-2 gene of oriental river prawn Macrobrachium nipponense[J]. Chinese Agricultural Science Bulletin, 2014, 30(32): 32-37. DOI:10.11924/j.issn.1000-6850.2014-0536 |
| [20] |
田宏刚, 刘同先, 张文庆. RNAi技术在中国昆虫学研究中的发展、应用与展望[J]. 应用昆虫学报, 2019, 56(4): 605-616. TIAN H G, LIU T X, ZHANG W Q. Progress in RNAi technology, and prospects for its application, in entomological research in China[J]. Chinese Journal of Applied Entomology, 2019, 56(4): 605-616. |
| [21] |
DEEPIKA A, SREEDHARAN K, PARIA A, et al. Toll-pathway in tiger shrimp (Penaeus monodon) responds to white spot syndrome virus infection: evidence through molecular characterisation and expression profiles of MyD88, TRAF6 and TLR genes[J]. Fish & Shellfish Immunology, 2014, 41(2): 441-454. |
| [22] |
CHEN Y, AWEYA J J, SUN W W, et al. SpToll1 and SpToll2 modulate the expression of antimicrobial peptides in Scylla paramamosain[J]. Developmental & Comparative Immunology, 2018, 87: 124-136. |
| [23] |
WEST A P, KOBLANSKY A A, GHOSH S. Recognition and signaling by toll-like receptors[J]. Annual Review of Cell and Developmental Biology, 2006, 22: 409-437. DOI:10.1146/annurev.cellbio.21.122303.115827 |
| [24] |
PAN X T, LI T T, YANG C H, et al. A toll receptor is involved in antibacterial defense in the oriental river prawn, Macrobrachium nipponense[J]. Fish & Shellfish Immunology, 2019, 92: 583-589. |
| [25] |
WANG P H, LIANG J P, GU Z H, et al. Molecular cloning, characterization and expression analysis of two novel Tolls (LvToll2 and LvToll3) and three putative Spätzle-like Toll ligands (LvSpz1-3) from Litopenaeus vannamei[J]. Developmental & Comparative Immunology, 2012, 36(2): 359-371. |
| [26] |
LAN J F, ZHOU J, ZHANG X W, et al. Characterization of an immune deficiency homolog (IMD) in shrimp (Fenneropenaeus chinensis) and crayfish (Procambarus clarkii)[J]. Developmental & Comparative Immunology, 2013, 41(4): 608-617. |
| [27] |
史晏如. 罗氏沼虾IMD信号通路关键基因(Relish、IMD)的克隆和功能研究[D]. 南京: 南京师范大学, 2016. SHI Y R. Cloning and functional study of key genes (Relish, IMD) of IMD signaling pathway in Macrobrachium rosenbergii[D]. Nanjing: Nanjing Normal University, 2016. |
| [28] |
HOU F J, HE S L, LIU Y J, et al. RNAi knock-down of shrimp Litopenaeus vannamei Toll gene and immune deficiency gene reveals their difference in regulating antimicrobial peptides transcription[J]. Developmental & Comparative Immunology, 2014, 44(2): 255-260. |
| [29] |
LIU Y J, SONG L, SUN Y H, et al. Comparison of immune response in Pacific white shrimp, Litopenaeus vannamei, after knock down of Toll and IMD gene in vivo[J]. Developmental & Comparative Immunology, 2016, 60: 41-52. |
| [30] |
CERENIUS L, LEE B L, SÖDERHÄLL K. The proPO-system: pros and cons for its role in invertebrate immunity[J]. Trends in Immunology, 2008, 29(6): 263-271. DOI:10.1016/j.it.2008.02.009 |
| [31] |
KAN H, KIM C H, KWON H M, et al. Molecular control of phenoloxidase-induced melanin synthesis in an insect[J]. Journal of Biological Chemistry, 2008, 283(37): 25316-25323. DOI:10.1074/jbc.M804364200 |
| [32] |
AN C J, JIANG H B, KANOST M R. Proteolytic activation and function of the cytokine Spätzle in the innate immune response of a lepidopteran insect, Manduca sexta[J]. FEBS Journal, 2010, 277(1): 148-162. DOI:10.1111/j.1742-4658.2009.07465.x |
| [33] |
GUANZON D A V, MANINGAS M B B. Functional elucidation of LvToll 3 receptor from P. vannamei through RNA interference and its potential role in the shrimp antiviral response[J]. Developmental & Comparative Immunology, 2018, 84: 172-180. |
| [34] |
李晶晶, 李云, 刘红, 等. 感染溶藻弧菌及白斑综合症病毒后凡纳滨对虾不同组织的Toll样受体基因表达变化研究[J]. 海洋与湖沼, 2016, 47(2): 476-483. LI J J, LI Y, LIU H, et al. The expression of toll-like receptors in different tissues of Litopenaeus vannamei after challenges with white spot syndrome virus and Vibrio alginolyticus[J]. Oceanologia et Limnologia Sinica, 2016, 47(2): 476-483. |
| [35] |
刘伟利, 刘红, 丁福江, 等. 罗氏沼虾TLRs基因表达差异分析[J]. 南方农业学报, 2017, 48(4): 721-727. LIU W L, LIU H, DING F J, et al. Differential expression of TLRs gene in Macrobrachium rosenbergii[J]. Journal of Southern Agriculture, 2017, 48(4): 721-727. DOI:10.3969/j.issn.2095-1191.2017.04.026 |
2. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306, China;
4. Shanghai Shen Cao Special Aquatic Development Company, Shanghai 201516, China
 2021,
Vol. 30
2021,
Vol. 30


