2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306
裸藻(Euglena gracilis)是古代原生动物眼虫的植物学名称,因眼细胞中含有叶绿体可进行光合作用,所以其具有动物与植物两种特性[1-3]。裸藻含有丰富的营养成分,如多糖、蛋白质、维生素、矿物质等。同时,裸藻还具有清除有害胆固醇、重金属,解决便秘等功能[4]。多糖是一类具有抗氧化、降血糖、降血脂、降胆固醇、增强免疫等功能的高分子化合物,本实验室前期通过超声波辅助酶法提取裸藻多糖(Euglena gracilis polyccharides,EGPS)并通过超滤初步分段进行体外抗氧化实验,研究表明其具有一定的抗氧化活性。据报道在几种抗衰老功能的化妆品[5-6]中有裸藻多糖的添加,但有关裸藻多糖分离纯化和结构分析的实验研究报道较少。本文将实验室前期提取的抗氧化活性较好片段的裸藻多糖(EGPS)经DEAE-纤维素和Sephadex G-100柱层析进行分离纯化,并对纯化后的组分进行纯度鉴定、红外光谱分析以及抗氧化活性分析,将抗氧化活性较好的裸藻多糖组分进行分子量测定、单糖组成分析,为具有抗氧化活性裸藻多糖结构的研究和开发利用奠定基础。
1 材料与方法 1.1 实验材料裸藻粉购自德味生物科技(上海)有限公司。
1.2 试剂与仪器主要试剂与仪器:抗超氧阴离子自由基试剂盒,南京建成生物科技研究所;d-葡萄糖甘酶,美国Sigma公司;1-苯基-3-甲基-5-吡唑啉酮(PMP),上海阿拉丁生化科技股份有限公司;核糖、甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、半乳糖、阿拉伯糖、岩藻糖(HPLC≥ 98%),DEAE-纤维素,上海源叶生物科技有限公司;木糖、葡萄糖(HPLC≥ 98%),北京坛墨质检标准物质中心;葡聚糖凝胶G-100,GE公司;其他试剂皆为分析纯,国药集团化学试剂有限公司。
真空冷冻干燥箱,CHRIST ALPHA1-2型,北京博劢行仪器有限公司;电脑程控多功能全自动部分收集器,CBS-C,上海沪西分析仪器有限公司;凝胶色谱仪,ELEOS System,Wyatt;液相色谱仪,1 200,Agilent;氮吹仪,MTN-5 800,天津奥特赛恩斯仪器有限公司。
1.3 实验方法 1.3.1 裸藻多糖提取与分离取一定量的裸藻粉末,按料液质量体积比1∶40(g/mL)加入磷酸盐缓冲溶液(pH 7.0),在超声功率360 W下处理19 min,加入3.7%的中性蛋白酶,50 ℃下酶解3.5 h,4 000 r/min离心20 min取上清液,旋转蒸发后的浓缩液中加入8倍体积的无水乙醇,静置24 h,TCA法去除蛋白。通过超滤(截流分子量:3~5 ku)后冷冻干燥得裸藻粗多糖(EGPS)收集备用。
1.3.2 裸藻多糖的纯化DEAE-纤维素柱层析:将预处理后的DEAE-纤维素装柱(16 mm×500 mm),去离子水平衡,将EGPS配成20 mg/mL,上样体积为5 mL,依次用0、0.1、0.3、0.5、0.7、0.9、1.0 mol/L的NaCl进行梯度洗脱[7],每个浓度洗脱两个柱体积,流速1 mL/min,每管收集6 mL,自动收集仪进行收集,采用苯酚硫酸法[8]跟踪检测,以管号为横坐标,吸光度值为纵坐标,绘制洗脱曲线。将收集的样品透析、冷冻干燥备用。Sephadex G-100柱层析:将Sephadex G-100凝胶预处理之后装柱(16 mm×500 mm),去离子水平衡,将经DEAE-纤维素柱层析纯化得到的EGPS1、EGPS3配成20 mg/mL进行上样,用去离子水洗脱[9],流速0.5 mL/min,每管收集3 mL,自动收集器收集。采用苯酚硫酸法进行检测,以管号为横坐标,吸光度值为纵坐标,绘制洗脱曲线。收集的样品冷冻干燥备用。
1.3.3 裸藻多糖的纯度鉴定多糖含量测定采用苯酚硫酸法[8]。
紫外光谱鉴定:将EGPS1-A、EGPS1-B以及EGPS3-A配成1 mg/mL的水溶液,在200~400 nm进行紫外波长扫描,检测其在260 nm和280 nm处有无明显吸收峰来判定是否含有核酸和蛋白质[10]。
1.3.4 红外光谱分析用傅立叶变换红外光谱对EGPS1-A、EGPS1-B以及EGPS3-A进行表征,采用单点ATR法,测定波数为400~4 000 cm-1,分辨率为2 cm-1[11]。
1.3.5 抗氧化活性分析参照邵佳等[12]的方法测定EGPS各组分对羟基自由基清除能力,将一定浓度1 mL的样品与1 mL FeSO4、1 mL水杨酸、0.2 mL H2O2混合,37 ℃水浴30 min,蒸馏水调零,在波长510 nm处测定吸光度值A1,去离子水代替H2O2测得A2,去离子水代替样品测定A0,以Vc为阳性对照。每个样品测定3次取其平均值,测定结果以清除率T表示:
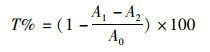 (1)
(1)
式中:A0为空白对照管;A1为样品测定管;A2为样品对照管。
参照DINIS等[13]的方法测定EGPS各组分对Fe2+的螯合能力,将一定浓度1 mL样品与3.7 mL的甲醇和0.1 mL的2 mmol/L FeCl2溶液混合,加入0.2 mL的5 mmol/L菲啰嗪溶液开始反应,在室温下静置10 min,蒸馏水调零,在波长562 nm处测得吸光度值A1,去离子水代替菲啰嗪溶液测得A2,去离子水代替样品溶液测得A0,以EDTA为阳性对照。每个样品测定3次取其平均值,测定结果以螯合率W表示:
 (2)
(2)
式中:A0为空白对照管;A1为样品测定管;A2为样品对照管。
参照OYAIZU等[14]的方法测定EGPS各组分的还原能力,将一定浓度2.5 mL的样品与2.5 mL的0.2 mol/L pH 6.6的PBS、2.5 mL的1%铁氰化钾溶液混合,50 ℃下恒温水浴20 min,迅速冰浴冷却,加入2.5 mL的10%三氯乙酸溶液混合均匀,2 000 r/min离心10 min,将2 mL上清液与2 mL超纯水、0.4 mL的0.1%的FeCl3溶液混合,然后静置10 min,超纯水调零,在波长700 nm处测定吸光度值A1,超纯水代替样品测得A0,超纯水代替铁氰化钾溶液测得A2,以Vc为阳性对照。每个样品测定3次取其平均值,测定结果以还原力S表示:
 (3)
(3)
式中:A0为空白对照管;A1为样品测定管;A2为样品对照管。
参照TANG等[15]的方法测定EGPS各组分对脂质过氧化抑制能力,将一定浓度4 mL的样品与3.6 mL的卵磷酸脂溶液、0.4 mL的10 mmol/L FeSO4、0.4 mL的10 mmol/L Vc溶液混合,37 ℃下水浴1 h,冷却至室温,加入1 mL的20%三氯乙酸溶液、1 mL的0.8%硫代巴比妥酸溶液,沸水浴15 min,3 000 r/min离心15 min,去离子水调零,上清液在波长535 nm处测定吸光度值A1,去离子水代替卵磷酸脂溶液测得A2,去离子水代替样品溶液测得A0,以Vc为阳性对照。每个样品测定3次取其平均值,测定结果以抑制率Q表示:
 (4)
(4)
式中:A0为空白对照管;A1为样品测定管;A2为样品对照管。
参照试剂盒说明书测定对超氧阴离子的清除能力。
参照FU等[16]的方法测定EGPS各组分对脂质过氧化的抑制能力,将一定浓度2 mL的样品与2 mL的DPPH无水乙醇混合,去离子水调零,放在暗处30 min后在517 nm处测得吸光值A1,无水乙醇代替DPPH无水乙醇测得A2,去离子水代替样品溶液测得A0,以Vc为阳性对照。每个样品测定3次取其平均值,测定结果以清除率Y表示:
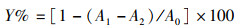 (5)
(5)
式中:A0为空白对照管;A1为样品测定管;A2为样品对照管。
1.3.6 分子量测定裸藻多糖的相对分子质量采用凝胶渗透色谱法[17]测定,色谱柱为Shodex OHpak系列SB-806 HQ,检测器为Waters515泵的激光检测器(LS)和示差检测器(DRI),流动相为水和0.02%NaN3,流速1 mL/min,柱温40 ℃;进样量500 L。
1.3.7 单糖组成分析取2 mg样品于水解管中,加入4 mol/L TFA(三氟乙酸) 1 mL,于120 ℃烘箱中水解2 h。取出后,氮气吹干。向吹干后的样品中加1 mL 0.5 mol/L PMP-甲醇溶液以及0.5 mL 0.3 mol/L NaOH溶液,70 ℃水浴60 min,冷却,加0.5 mL 0.3 mol/L HCl溶液后,加0.5 mL氯仿,振荡摇匀后静置20 min,弃去下层,上层萃取3次,取水层过膜上机。
采用高效液相色谱(HPLC)[18]测定,色谱柱为SHISEIDO C18柱(4.6 mm×250 mm, 5 μm),流动相A为0.1 mol/L KH2PO4(pH 6.8),流动相B为乙腈,流动相A∶B为82∶18,流速1.0 mL/min,柱温25 ℃;进样量10 μL;波长245 nm。
1.4 数据处理用SPSS 20对实验所得数据进行显著性差异分析,实验采用Origin 8.0作图。
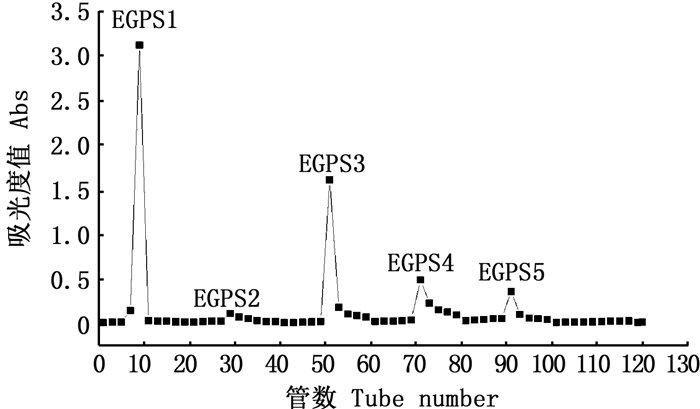
2 结果 2.1 裸藻多糖的分离纯化 2.1.1 DEAE-纤维素柱层析EGPS经DEAE-纤维素柱层析分离,依次用0、0.1、0.3、0.5、0.7、0.9、1.0 mol/L的NaCl进行梯度洗脱。由图 1可知在0、0.1、0.3、0.5、0.7 mol/L的NaCl溶液洗脱部分得到5个洗脱峰,分别命名为EGPS1、EGPS2、EGPS3、EGPS4、EGPS5。由于EGPS2、EGPS4、EGPS5组分多糖含量较低,很难收集足够的量进行后续研究,所以仅对DEAE-纤维素柱层析分离得到的EGPS1、EGPS3组分收集后进行透析并冷冻干燥备用进行Sephadex G-100的分离纯化。
|
图 1 EGPS的DEAE-纤维素柱层析洗脱曲线 Fig. 1 Elution curve of EGPS DEAE cellulose column |
EGPS1、EGPS3组分经Sephadex G-100柱层析分离,去离子水进行洗脱。EGPS1得到两个洗脱峰,分别命名为EGPS1-A、EGPS1-B,见图 2。EGPS3得到单一对称的洗脱峰,命名为EGPS3-A,见图 3。对EGPS1-A、EGPS1-B、EGPS3-A进行收集并冷冻干燥备用。

|
图 2 EGPS1的Sephadex G-100洗脱曲线 Fig. 2 Elution curve of EGPS1 Sephadex G-100 |

|
图 3 EGPS3的Sephadex G-100洗脱曲线 Fig. 3 Elution curve of EGPS3 Sephadex G-100 |
由表 1可知,3个组分EGPS1-A、EGPS1-B、EGPS3-A的多糖含量均达到93%以上,说明3个组分纯度较高,DEAE-纤维素和Sephadex G-100柱层析两步纯化裸藻多糖的效果较好。李晋等[19]采用DEAE-纤维素柱纯化洋葱多糖,纯化后组分中多糖含量为85.32,吴金松等[20]采用DEAE-纤维素和Sephadex G-50柱层析纯化大叶麻竹笋多糖,纯化后的组分多糖含量为95.3。对比研究表明,DEAE-纤维素和Sephadex G-100柱层析两步联合纯化的效果更佳。

|
表 1 EGPS1-A、EGPS1-B、EGPS3-A多糖含量 Tab.1 Polysaccharide contents of EGPS1-A, EGPS1-B, EGPS3-A |
由图 4可知,3个组分EGPS1-A、EGPS1-B、EGPS3-A经紫外光谱扫描在260 nm和280 nm处未见明显的核酸和蛋白质的特征吸收峰,说明3个组分中均不含有核酸和蛋白质。

|
图 4 EGPS1-A、EGPS1-B、EGPS3-A紫外光谱图 Fig. 4 UV spectrum of EGPS1-A, EGPS1-B, EGPS3-A |
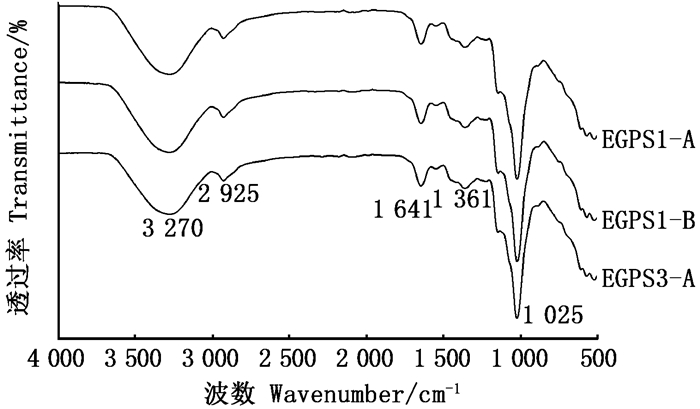
由图 5可知:3个组分均在3 270 cm-1处有吸收峰,说明存在O-H伸缩振动;位于2 925 cm-1处的吸收峰为C-H伸缩振动;这两个峰为糖类的特征峰[21]。位于1 641 cm-1处吸收峰为C=O伸缩振动,说明可能含有糖醛酸[7];位于1 361 cm-1处的吸收峰为C=O对称伸缩振动;位于1 025 cm-1处吸收峰为吡喃糖糖环上C-O-C的非对称吸收峰。
|
图 5 EGPS1-A、EGPS1-B、EGPS3-A红外光谱图 Fig. 5 Infrared absorption spectrum of EGPS1-A, EGPS1-B, EFPS3-A |
将经过DEAE-纤维素和Sephadex G-100纯化后得到的3个裸藻多糖组分进行体外抗氧化实验,各组分的质量浓度均为5 mg/mL,结果见表 2。结果表明:3个组分均具有一定的抗氧化活性,EGPS1-A的羟基自由基清除率、Fe2+螯合率、脂质过氧化抑制率、超氧阴离子清除率均高于其他两个组分。3个组分的还原力都较差且均无DPPH自由基清除率。对比刘洪超等[22]制备的羊栖菜多糖,其多糖浓度为22 mg/mL时超氧阴离子自由基清除率达40.56%,浓度为9.85 mg/mL时,羟基自由基清除率达50 %。EGPS1-A在浓度5 mg/mL时超氧阴离子清除率为63.71%,羟基自由基清除率为69.54%,表明EGPS1-A的超氧阴离子清除率、羟基自由基清除率较好。对比纯化前后指标结果,纯化后超氧阴离子清除率和脂质过氧化抑制率上升,分析其原因可能是纯化前后在样品浓度相同的情况下多糖含量增加,进一步证实裸藻多糖具有抗氧化活性。

|
表 2 EGPS纯化前后抗氧化活性结果 Tab.2 Results of antioxidant activities of before and after EGPS purification |
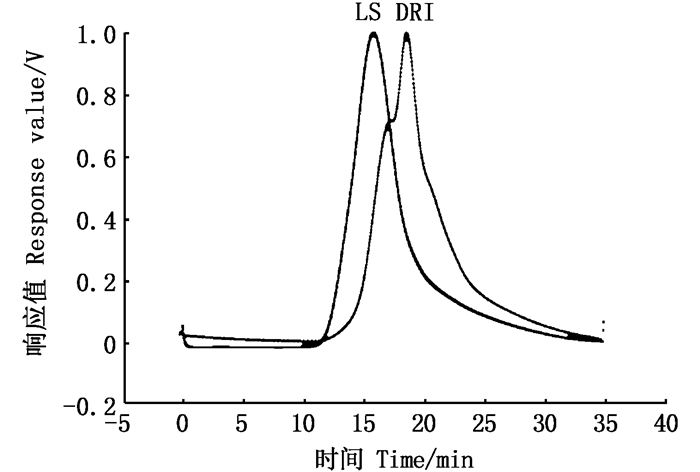
采用凝胶渗透色谱法测定抗氧化活性较好的EGPS1-A的分子量,其示差检测器(DRI)和激光检测器(LS)图谱如图 6所示。从图 6和表 3可以看出,EGPS1-A的分子量为136.8 ku。
|
图 6 EGPS1-A的GPC谱图 Fig. 6 GPC spectrum of EGPS1-A |

|
表 3 EGPS1-A的分子量以及分子量分布 Tab.3 Molecular weight and molecular weight distribution of EGPS1-A |
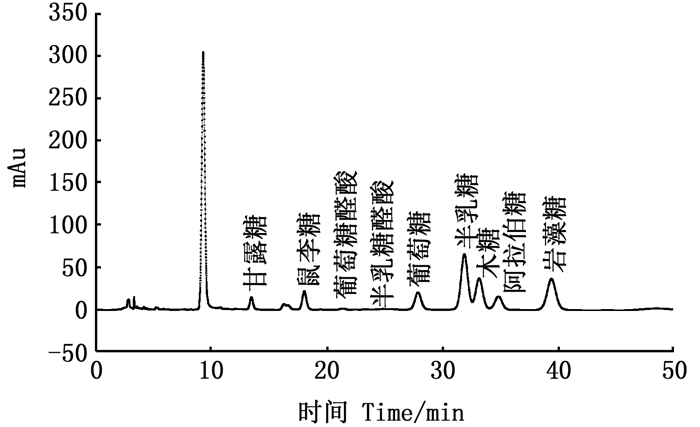
单糖标准品的HPLC色谱图如图 7,将抗氧化效果较好的EGPS1-A经三氟乙酸水解,PMP衍生化后通过HPLC测定其单糖组成,结果如图 8所示。根据保留时间可以确定EGPS1-A中至少含有9种单糖:甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖,其单糖组分间物质的量比为0.072∶0.430∶0.049∶0.010∶0.260∶0.620∶0.530∶0.180∶1.010。量比值表明其中岩藻糖、半乳糖、木糖含量较高,葡萄糖醛酸和半乳糖醛酸含量较低,两种醛酸在其红外光谱的1 641 cm-1也有特征峰显示。

|
图 7 标准品的单糖组成分析HPLC色谱图 Fig. 7 Analysis of standard monosaccharide composition by HPLC |
|
图 8 EGPS1-A单糖组成分析HPLC色谱图 Fig. 8 Analysis of EGPS1-A monosaccharide composition by HPLC |
本文将实验室提取的抗氧化活性较好片段的裸藻多糖(EGPS)经DEAE-纤维素和Sephadex G-100柱层析进行分离纯化,得到3种纯度较高的多糖EGPS1-A、EGPS1-B和EGPS3-A,体外抗氧化实验表明EGPS1-A的抗氧化活性最好。有研究显示多糖的抗氧化活性与其分子量、糖醛酸含量、硫酸化程度、单糖组成及糖苷键等因素相关,其中,糖醛酸可以活化异头碳上的氢原子使其表现出较高的DPPH自由基清除率[23],羟基自由基清除能力、Fe2+螯合率与羟基、羧基、氨基等官能团有关,还原能力与物质中是否存在还原酮类物质有关[24-25]。EGPS中含有较多的活性羟基,表现较强的羟基自由基清除能力和Fe2+螯合能力。EGPS1-A的羟基自由基清除率比EGPS下降了14.53%,Fe2+螯合率下降了26.22%,是因为纯化后蛋白质等其他活性物质含量降低。刘洪超等[22]研究的具有抗氧化活性的羊栖菜多糖的单糖组成中岩藻糖、半乳糖、葡萄糖含量较高,羊栖菜多糖羟基自由基清除率和DPPH自由基清除率的IC50分别为9.85 mg/mL、7.73 mg/mL,其超氧阴离子自由基清除率在12 mg/mL时达到最大值40.56%;徐勇[26]研究的具有抗氧化活性的姬松茸多糖的单糖组成中阿拉伯糖、葡萄糖、半乳糖含量较高,姬松茸多糖还原力和DPPH自由基清除率的IC50分别为0.0136 mg/mL、0.104 mg/mL;张宁[27]研究的具有抗氧化活性的朝鲜淫羊藿多糖的单糖组成中葡萄糖、阿拉伯糖、葡萄糖醛酸含量较高,在5 mg/mL时其羟基自由基清除率约为66%,Fe2+螯合率约为70%,而DPPH自由基清除率在0.4 mg/mL时则达到了71.83%。商佳琦等[28]研究5种食用菌多糖单糖组成与抗氧化活性之间的关系表明岩藻糖含量越高,其超氧阴离子清除能力越强。艾于杰[29]研究的抗氧化性茶多糖构效关系表明甘露糖、鼠李糖含量越高,其抗氧化活性越高,而半乳糖、木糖、阿拉伯糖含量越高,DPPH自由基清除能力越差。张奇等[30]研究了不同产地霸王花多糖的单糖组成及体外抗氧化活性,研究结果表明半乳糖和阿拉伯糖含量能够影响其抗氧化活性。本文纯化出的EGPS1-A单糖组成中岩藻糖、半乳糖、木糖、鼠李糖含量较高表现出较好的羟基自由基清除率、Fe2+螯合率和超氧阴离子自由基清除率,与上述研究结果吻合,同时EGPS1-A中木糖含量较高,未能检测出DPPH自由基清除率。
裸藻作为营养成分较高的具有动植物两性的藻类物质,在食品、药品、化妆品等行业的应用仍需要深度挖掘。本文研究了抗氧化活性较好片段的裸藻多糖的分离纯化及单糖组成,为裸藻多糖结构和抗氧化功能之间构效关系的建立提供了研究基础。
| [1] |
AHMADINEJAD N, DAGAN T, MARTIN W. Genome history in the symbiotic hybrid Euglena gracilis[J]. Gene, 2007, 402(1/2): 35-39. |
| [2] |
AFIUKWA C A, OGBONNA J C. Effects of mixed substrates on growth and vitamin production by Euglena gracilis[J]. African Journal of Biotechnology, 2007, 6(22): 2612-2615. DOI:10.5897/AJB2007.000-2417 |
| [3] |
OGBONNA J C. Microbiological production of tocopherols: current state and prospects[J]. Applied Microbiology and Biotechnology, 2009, 84(2): 217-225. DOI:10.1007/s00253-009-2104-7 |
| [4] |
张彦慧, 张文慧, 姜智飞, 等. 5种抗生素对纤细裸藻蛋白含量的影响[J]. 河北渔业, 2017(8): 13-17. ZHANG Y H, ZHANG W H, JIANG Z F, et al. Response of protein levels of Euglena gracilis to five kinds of antibiotic stress[J]. Hebei Fisheries, 2017(8): 13-17. DOI:10.3969/j.issn.1004-6755.2017.08.005 |
| [5] |
广州千百度化妆品有限公司. 一种祛痘修复精华: 中国, 111201610133573.0[P]. 2016-06-22. Guangzhou Qianbaidu Cosmetics Co Ltd. Acne-removing repair essence: China, 201610133573.0[P]. 2016-06-22. |
| [6] |
广州丹奇日用化工厂有限公司. 一种植物蛋白肽舒纹弹力眼霜: 中国, 201610440461. X[P]. 2016-09-21. Canton Damekiss Daily Chemical Factory Ltd Co. Vegetable protein peptide wrinkle reducing and resilience restoring eye cream: China, 201610440461. X[P]. 2016-09-21. |
| [7] |
刘树兴, 任益平, 李浩恒, 等. 藜麦多糖的分离纯化及结构初步分析[J]. 中国食品添加剂, 2019(10): 48-52. LIU S X, REN Y P, LI H H, et al. Isolation, purification and structure preliminary analysis of Quinoa polysaccharides[J]. China Food Additives, 2019(10): 48-52. |
| [8] |
史瑞琴, 李大伟, 梁静静, 等. 响应面法优化小球藻多糖提取工艺研究[J]. 食品研究与开发, 2018, 39(3): 18-23. SHI R Q, LI D W, LIANG J J, et al. Optimization of extraction technology of polysaccharides from chlorella by response surface methodology[J]. Food Research and Development, 2018, 39(3): 18-23. DOI:10.3969/j.issn.1005-6521.2018.03.004 |
| [9] |
江小妹, 林春伟, 王魁云, 等. 团头鲂肠道菌株MA35产纤维素酶分离纯化及性质分析[J]. 上海海洋大学学报, 2020, 29(2): 313-320. JIANG X M, LIN C W, WANG K Y, et al. Isolation, purification and characterization of cellulase produced from Aspergillus niveus MA35 in the Gut of the Megalobrama amblycephala[J]. Journal of Shanghai Ocean University, 2020, 29(2): 313-320. |
| [10] |
任爱农, 邹义芳, 陆颖, 等. 红花多糖的分离纯化及单糖组成分析[J]. 药物分析杂志, 2013, 33(7): 1190-1196. REN A N, ZOU Y F, LU Y, et al. Isolation, purification and monosaccharide composition analysis of polysaccharides from safflower[J]. Chinese Journal of Pharmaceutical Analysis, 2013, 33(7): 1190-1196. |
| [11] |
SUN Y Y, WANG H, GUO G L, et al. The isolation and antioxidant activity of polysaccharides from the marine microalgae Isochrysis galbana[J]. Carbohydrate Polymers, 2014, 113: 22-31. DOI:10.1016/j.carbpol.2014.06.058 |
| [12] |
邵佳, 郁建平, 胡美忠. 草珊瑚水溶性粗多糖提取及抗氧化性能研究[J]. 食品科学, 2007, 28(11): 283-286. SHAO J, YU J P, HU M Z. Study on extraction and antioxidant activity of polysaccharides from Sarcandra glabra[J]. Food Science, 2007, 28(11): 283-286. DOI:10.3321/j.issn:1002-6630.2007.11.064 |
| [13] |
DINIS T C P, MADEIRA V M C, ALMEIDA L M. Action of phenolic derivatives (acetaminophen, salicylate, and 5-Aminosalicylate) as inhibitors of membrane lipid peroxidation and as peroxyl radical scavengers[J]. Archives of Biochemistry and Biophysics, 1994, 315(1): 161-169. DOI:10.1006/abbi.1994.1485 |
| [14] |
OYAIZU M. Studies on products of browning reaction: antioxidative activities of products of browning reaction prepared from glucosamine[J]. The Japanese Journal of Nutrition and Dietetics, 1986, 44(6): 307-315. DOI:10.5264/eiyogakuzashi.44.307 |
| [15] |
TANG Q L, HUANG G L, ZHAO F Y, et al. The antioxidant activities of six (1→3)D-glucan derivatives prepared from yeast cell wall[J]. International Journal of Biological Macromolecules, 2017, 98: 216-221. DOI:10.1016/j.ijbiomac.2017.01.132 |
| [16] |
FU L L, CHEN H X, Dong P, et al. Effects of ultrasonic treatment on the physicochemical properties and DPPH radical scavenging activity of polysaccharides from mushroom Inonotus obliquus[J]. Journal of Food Science, 2010, 75(4): C322-C327. DOI:10.1111/j.1750-3841.2010.01590.x |
| [17] |
XIE J H, XIE M Y, NIE S P, et al. Isolation, chemical composition and antioxidant activities of a water-soluble polysaccharide from Cyclocarya paliurus (Batal.) Iljinskaja[J]. Food Chemistry, 2010, 119(4): 1626-1632. DOI:10.1016/j.foodchem.2009.09.055 |
| [18] |
伍善广, 冯学珍, 陈颖, 等. 高效液相色谱法测定金钱菇多糖的单糖组成[J]. 广西植物, 2014, 34(2): 179-182. WU S G, FENG X Z, CHEN Y, et al. Analysis of monosaccharide compositions of Lentinus edodes polysaccharide by HPLC[J]. Guihaia, 2014, 34(2): 179-182. |
| [19] |
李晋, 徐怀德, 米林峰. 洋葱多糖的分离纯化及单糖组成研究[J]. 中国食品学报, 2012, 12(2): 202-206. LI J, XU H D, MI L F, et al. Isolation, purification and monosaccharide analysis of polysaccharide from onion[J]. Journal of Chinese Institute of Food Science and Technology, 2012, 12(2): 202-206. DOI:10.3969/j.issn.1009-7848.2012.02.031 |
| [20] |
吴金松, 郑炯, 夏雪娟, 等. 大叶麻竹笋多糖分离纯化工艺[J]. 食品科学, 2015, 36(2): 80-84. WU J S, ZHENG J, XIA X J, et al. Separation and purification of polysaccharides from ma bamboo shoots (Dendrocalamus latiflorus)[J]. Food Science, 2015, 36(2): 80-84. |
| [21] |
郭亚贞, 王慥, 曲鹏鹏. 香菇多糖的纯化和结构分析[J]. 上海水产大学学报, 2000, 9(1): 35-39. GUO Y Z, WANG Z, QU P P. Purification and identification of polysaccharide from Lentinus edodes[J]. Journal of Shanghai Fisheries University, 2000, 9(1): 35-39. |
| [22] |
刘洪超. 羊栖菜多糖的提取分离、生物活性及结构鉴定[D]. 上海: 上海海洋大学, 2017: 50-52. LIU H C. Study isolation, purification and determination of physiological activity on SFPS (Sargassum fusiforme polysaccharides)[D]. Shanghai: Shanghai Ocean University, 2017: 50-52. |
| [23] |
袁清霞. 桑叶多糖分离纯化、结构分析及生物活性研究[D]. 南京: 南京农业大学, 2016: 96-102. YUAN Q X. Isolation, purification, structure and bioactivity of polysaccharides from mulberry (Morus alba L. ) leaves[D]. Nanjing: Nanjing Agricultural University, 2016: 96-102. |
| [24] |
COMMINS S P, BORISH L, STEINKE J W. Immunologic messenger molecules: cytokines, interferons, and chemokines[J]. Journal of Allergy and Clinical Immunology, 2010, 125(2): S53-S72. DOI:10.1016/j.jaci.2009.07.008 |
| [25] |
SHUAI X H, HU T J, LIU H L, et al. Immunomodulatory effect of a Sophora subprosrate polysaccharide in mice[J]. International Journal of Biological Macromolecules, 2010, 46(1): 79-84. DOI:10.1016/j.ijbiomac.2009.10.016 |
| [26] |
徐勇. 姬松茸碱提水溶性多糖提取、结构鉴定及抗氧化活性研究[D]. 杭州: 浙江工业大学, 2019: 40-41. XU Y. Extraction, structural elucidation and antioxidant activity of water-soluble polysaccharides alkali extracted from Agaricus blazei Murill[D]. Hangzhou: Zhejiang University of Technology, 2019: 40-41. |
| [27] |
张宁. 朝鲜淫羊藿中性多糖结构分析及抗氧化活性研究[D]. 长春: 长春中医药大学, 2019: 19-21. ZHANG N. Structural analysis and antioxidant activities of neutral polysaccharide isolated from Epimedium koreanum Nakia[D]. Changchun: Changchun University of Chinese Medicine, 2019: 19-21. |
| [28] |
商佳琦, 滕翔宇, 范荣, 等. 5种食用菌多糖的结构特征及抗氧化活性对比[J]. 食品工业科技: 1-13[2020-05-18]. http://kns.cnki.net/kcms/detail/11.1759.TS.20200224.1134.009.html. SHANG J Q, TENG X Y, FAN R, et al. Structual characterization and antioxidant activity of five edible fungus polysaccharides[J]. Science and Technology of Food Industry, 1-13[2020-05-18]. http://kns.cnki.net/kcms/detail/11.1759.TS.20200224.1134.009.html. |
| [29] |
艾于杰. 抗氧化活性茶多糖构效关系研究[D]. 武汉: 华中农业大学, 2019: 86-93. AI Y J. Study of the structure-activity relationship of antioxidant tea polysaccharides[D]. Wuhan: Huazhong Agricultural University, 2019: 86-93. |
| [30] |
张奇, 冯峰, 杨淑玲, 等. 不同产地霸王花粗多糖的单糖组成及体外抗氧化活性[J]. 上海交通大学学报(农业科学版), 2019, 37(2): 83-89. ZHANG Q, FENG F, YANG S L, et al. Studies on monosaccharide composition and antioxidant activity of crude polysaccharide from Hylocereus undatus(Haw.) Urilt. et. Rose of different regions[J]. Journal of Shanghai Jiaotong University (Agricultural Science), 2019, 37(2): 83-89. DOI:10.3969/J.ISSN.1671-9964.2019.02.014 |
2. Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


