2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306;
3. 农业农村部水产品贮藏保鲜质量安全风险评估实验室, 上海 201306
冻藏是肉制品尤其是水产品保藏加工的常用手段,它具有保持产品质量、延长产品的货架期以及不受产季或产地限定供应的优势。但在冻品的贮藏、运输、销售以及消费过程中,温度波动不可避免,冰晶的成长及重结晶作用会破坏产品肌肉结构,导致线粒体、溶酶体酶和其他细胞器释放到肌浆中,造成产品质量(风味、营养、色泽等)下降[1-2]。在低温条件下,虽然微生物和酶的作用会受到抑制,但脂肪和蛋白氧化仍在缓慢进行,冷冻无法抑制由物理或化学原因引起的产品劣变,且反复冻融过程中会加剧劣变的速度[2-4]。邓思杨等[5]研究发现反复冻融破坏了镜鲤(Cyprinus carpio var. specularis)纤维结构的完整性,随着冻融次数的增加,α-螺旋含量下降且部分结构丧失。ZHANG等[6]研究了鲢(Hypophthalmichthys molitrix)鱼鳍水解物对鳙(Hypophthalmichthys nobilis)鱼片在冻融循环中蛋白质和脂质氧化作用,发现鱼鳍水解物可成为保存鱼片的天然抗氧化剂。SRIKET等[7]对比凡纳滨对虾(Litopenaeus vannamei)和班节对虾(Penaeus monodon)冻融后肌纤维变化时发现,冻融会导致肌纤维收缩,Z-盘损坏,物种间二硫键与疏水相互作用的不同可能与其蛋白完整性的丧失程度相关。目前对冷冻水产品冻融的研究主要集中在鱼类和虾,贝类鲜有报道。
皱纹盘鲍(Haliotis discus hannai)又称鳆鱼、海耳等,由于其营养丰富、口感独特,深受全世界人们的喜爱。我国是世界第一养鲍大国,据2018中国渔业年鉴统计,总产量约为16.3万t, 相比2017年增长了9.85%[8], 皱纹盘鲍现已成为家庭餐桌上的常见食材。季节性与地域性使得皱纹盘鲍常常需要进行远距离、长时间的运输,在此过程中皱纹盘鲍极易死亡,其体内富含的蛋白质在微生物的作用下迅速分解并散发出恶臭气味,工业上常常对其进行加工以利于运输。贝柱是皱纹盘鲍可食部位中与外壳紧密相连的部分,研究表明贝柱与其他部位肌肉的肌纤维结构存在差异,这可能与皱纹盘鲍的吸附和运动有关[9]。贝柱部分主要由肌原纤维蛋白构成,在冻融过程中,冰晶会破坏肌肉蛋白的二级结构与三级结构,导致蛋白变性,发生聚集和交联[10]。肌原纤维蛋白的性质对肌肉的嫩度、保水性及感官特性等均有影响[11]。因此,本研究以速冻皱纹盘鲍的贝柱部分作为研究对象,探明冻融循环对肌肉质地的影响,以及从水合特性及蛋白氧化两方面分析质地的变化机制。
1 材料与方法 1.1 实验材料速冻皱纹盘鲍,购自上海某食品公司,生产日期为2019年7月12日。皱纹盘鲍平均体质量(去壳、去内脏)为(11.42±0.29)g, 平均壳长为(6.46±0.08)cm。
五水硫酸铜、氯化钠、氢氧化钠、酒石酸钾钠、磷酸氢二钠、磷酸二氢钾购自国药集团化学试剂有限公司;溴酚蓝、5, 5′-二硫代二硝基苯甲酸盐购自Sigma-aldrich公司;尿素、羰基试剂盒购自南京建成生物工程研究所。
1.2 仪器与设备主要仪器与设备:200-SH数显高速分散均质机,上海标本模型厂;H2050R高速冷冻离心机,长沙湘仪有限公司;TA.XT Plus质构仪,英国SMS公司;MesoMR23-060H.I低场核磁共振成像分析仪,上海纽迈科技有限公司。
1.3 方法 1.3.1 原料处理速冻皱纹盘鲍处理流程为清洗、漂烫、冷却、速冻、镀冰衣及真空袋装处理。工厂处理完毕后,将皱纹盘鲍装袋,并置于-40 ℃冷库中贮藏。
样品生产于2019年7月,将样品加冰袋置于塑料泡沫箱中,后经冷链物流保鲜车运回实验室,路途耗时约8 h。样品到达后,置于-40 ℃中备用。
1.3.2 冻融循环处理取-40 ℃贮藏的皱纹盘鲍,置于4 ℃冰箱中解冻6 h至其中心温度达到0 ℃左右,放回-40 ℃冰箱中贮藏,作为1次冻融处理。每隔18 h循环1次,共进行5次处理。每次冻融后按照图 1所示,取下贝柱部分进行后续相关的测定。
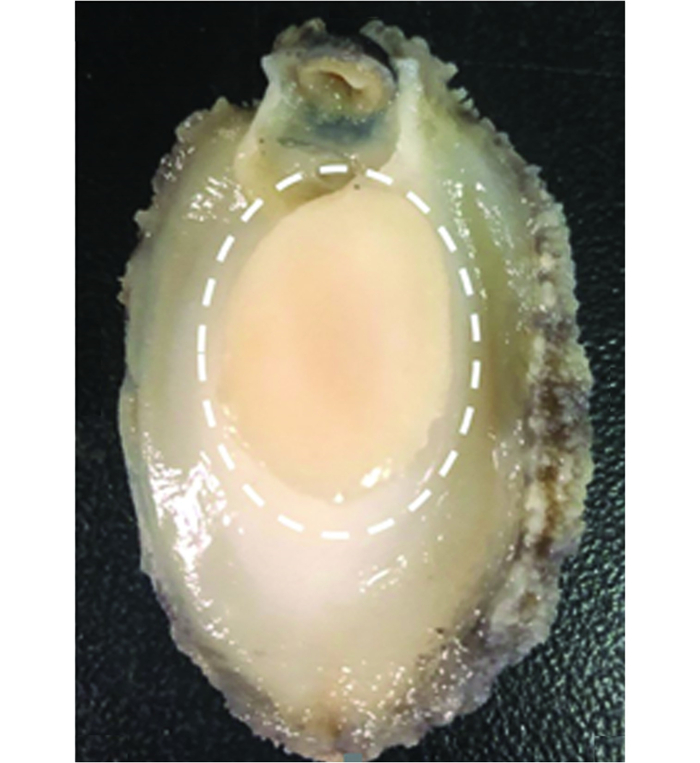
|
图 1 皱纹盘鲍肌肉图 Fig. 1 Schema of abalone muscle |
将样品置于测试平台上,室温条件下进行测定。TPA测试探头:P/0.5。剪切力测试探头:HDP/BS。测试条件:测前、测中与测后速率分别为1、1和10 mm/s; 压缩程度为50%;触发值10 g; 间隔时间为5 s; 数据采集速率为400 pps。
1.3.4 解冻损失测定用纸巾将样品表面水分擦干,称量质量后进行速冻处理,将冻好的样品置于4 ℃冰箱中解冻6 h, 擦干样品表面水分并称量质量。解冻损失率(thawing loss, TL)的计算公式为
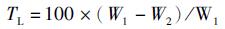 (1)
(1)
式中:TL为解冻损失率,%; W1和W2分别为冻前及解冻后样品的质量,g。
1.3.5 离心损失测定用纸巾擦干样品表面水分并称量质量。将样品用双层滤纸包裹,置于离心管中,在4 ℃下1 000g离心15 min。取出样品,擦干表面水分并称量质量。离心损失率(centrifugal loss, CFL)的计算公式为
 (2)
(2)
式中:CFL为离心损失率,%; W3和W4分别为离心前及离心后样品的质量,g。
1.3.6 蒸煮损失测定用纸巾擦干样品表面水分并称量质量。将样品置于自封袋中,后浸没于100 ℃中15 min, 在整个加热过程中,样品不会与热水有任何接触。加热结束后,取出样品,擦干其表面水分并称量质量。蒸煮损失率(cooking loss, CKL)的计算公式为
 (3)
(3)
式中:CKL为蒸煮损失率,%; W5和W6分别为蒸煮前及蒸煮后样品的质量,g。
1.3.7 水分分布的测定使用低场核磁共振分析仪(low-field nuclear magnetic resonance, LF-NMR)测定样品中的水分分布,自旋弛豫时间T2采用CPMG序列进行测量。CPMG得到的指数衰减曲线用仪器自带的软件进行T2反演,得到T2值。在25 ℃条件下CPMG测试参数:SW=200 kHz; P1=18 μs; P2=35 μs; TD= 360 068;RG1=20 db; TW=3 000 ms; TE=0.45 ms; NS=8。
1.3.8 蛋白溶解性测定蛋白溶解性参考张龙等[12]的方法,并略有改动,所有操作过程均在4 ℃下进行。取2 g样品加入15 mL 0.6 mol/L NaCl, 20 mmol/L Tris-HCl(pH 7.5)缓冲液均质数秒,使样品均匀地分散在溶液中,静置20 min。4 ℃下12 000g离心10 min, 取上清液,采用双缩脲法测定蛋白溶液的质量分数。
测定盐溶性蛋白质量分数时,取2 g样品加入15 mL 0.1 mol/L NaCl, 20 mmol/L Tris-HCl(pH 7.5)缓冲液均质数秒,使样品均匀地分散在溶液中,静置20 min。4 ℃下12 000g离心10 min弃上清液取沉淀,此过程重复2次。在沉淀中加入15 mL 0.6 mol/L NaCl, 20 mmol/L Tris-HCl(pH 7.5)缓冲液,搅拌均匀后静置20 min。4 ℃下12 000g离心10 min, 取上清液,此过程重复3次,合并上清液,采用双缩脲法测定盐溶性蛋白溶液的质量分数。
1.3.9 表面疏水性测定参考CHELH等[13]的方法并略有改动。取1 g样品溶解于20 mL 20 mmol/L的磷酸缓冲溶液(pH 6.0)中,均质数秒使碎肉均匀分散于溶液中。后取5 mL溶液,加入1 mL 1 mg/mL的溴酚蓝(BPB), 剧烈振荡20 min使其充分混匀。在4 ℃下6 000 r/min离心15 min, 吸取0.5 mL上清液,稀释10倍,在595 nm处测定其吸光值。计算公式为
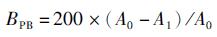 (4)
(4)
式中:BPB为表面疏水性,μg/mg; A0为空白吸光度;A1为样品的吸光度。
1.3.10 羰基含量测定参照羰基含量测定试剂盒进行测定。
1.3.11 巯基含量测定参考ELLMAN[14]的方法并略有改动。取0.15 g样品加入25 mL的Tris-HCl缓冲液(pH 8.0)。样品于溶液中均质数秒后,加入50 μL Ellman试剂(二硫代硝基苯甲酸,DNTB), 置于25 ℃的水浴锅中静置反应60 min。5 000g离心15 min, 去泡沫后溶液在412 nm处测定吸光值。计算公式为
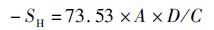 (5)
(5)
式中:-SH为巯基浓度,μmol/g; A表示除去空白的样品吸光度;D表示稀释倍数;C表示样品的质量浓度,mg/mL。
1.3.12 数据处理所有实验组测定3个平行,数据用平均值±标准差表示,使用SPSS 17.0和Origin 9.0进行数据分析与图像绘制,采用Duncan氏法进行显著性差异分析处理,显著水平P < 0.05。
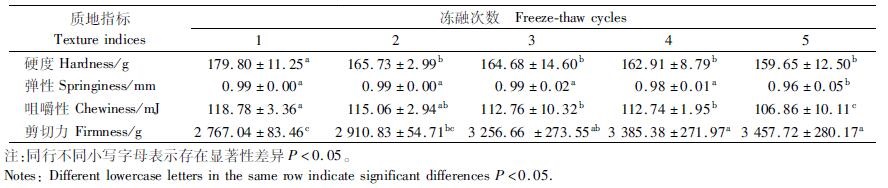
2 结果与分析 2.1 反复冻融对皱纹盘鲍贝柱质构的影响硬度、弹性等是水产品冷藏中最易受影响的质构特性指标,也是消费者评价食品品质的重要依据之一[15]。通过测定反复冻融后皱纹盘鲍肌肉的硬度、弹性、咀嚼性及剪切力,分析其对皱纹盘鲍肌肉质构的影响,结果如表 1所示。硬度和咀嚼性随着冻融次数的增加而显著降低(P < 0.05), 弹性在第5次冻融时降低,而剪切力随着冻融次数的增加而显著增加(P < 0.05)。硬度反映的是样品达到某种程度变形所需要的力。5次冻融循环过程后,样品硬度分别下降了7.83%、8.41%、9.39%和11.21%, 这可能与蛋白变性有关[16]。弹性反映了外力作用时的变形程度及撤去外力后的恢复程度,咀嚼性是评价硬度、弹性及细胞间结合力的综合评价参数[17]。从第1次到第5次冻融过程中,弹性和咀嚼性分别下降了3.03%和10.04%。剪切力可以衡量肌肉的嫩度,剪切力越小,肌肉的嫩度越好[18]。冻融过程中,剪切力逐渐增大可能是由于水分迁移而肌肉收缩导致的[19]。姜晴晴等[18]也发现秘鲁鱿鱼剪切力随冻融次数的增加而增加, 推测可能是由于蛋白变性产生交联、聚集或汁液损失所导致的。也有研究[20]发现,随着冻融次数的增加,剪切力先增加后降低,推测可能是由于冰晶造成肌纤维结构断裂使得剪切力降低。
|
表 1 反复冻融对皱纹盘鲍贝柱质构的影响 Tab.1 Effect of freeze-thaw cycles on texture of adductor muscle from H. discus hannai |
保水性对于肌肉的质地、色泽、风味等具有重要影响,常用解冻损失、蒸煮损失等参数进行衡量。本次实验中,采用离心法来评估冻融次数对于肌肉持水力的影响。离心损失越低,肌肉的持水力越高。由表 2可知,每冻融1次后,解冻损失与离心损失都显著增加(P < 0.05)。从第1次冻融到第5次冻融后,解冻损失与离心损失分别增加了约4.61倍和1.77倍。蒸煮损失在第5次冻融时有了显著增加至43.67%, 增加了约1.13倍(P < 0.05)。

|
表 2 反复冻融对皱纹盘鲍贝柱持水性的影响 Tab.2 Effect of freeze-thaw cycles on water holding capacity of adductor muscle from H. discus hannai |
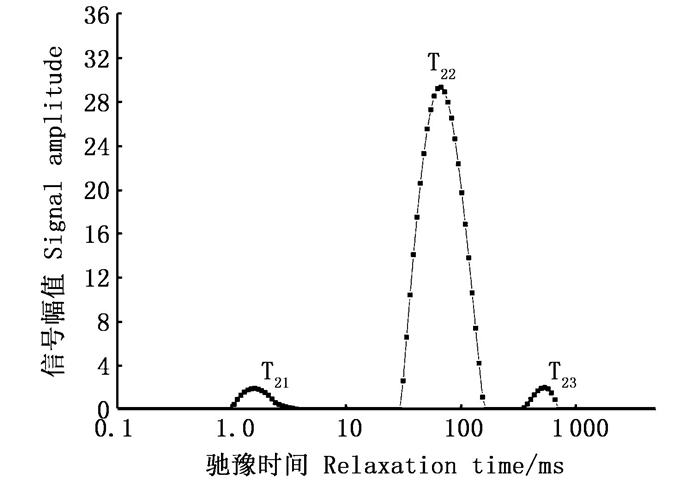
低场核磁因其无损特性,被证明可以用于检测肌肉中水分的分布及迁移情况[21-22]。从图 2可以发现解冻1次的贝柱其水分分布,从弛豫时间T2图谱中可以看出皱纹盘鲍贝柱在0.1~5 000 ms的弛豫时间内共有3个峰,分别对应3种不同状态的水分,依次为结合水T21(1~10 ms)、不易流动水T22(10~100 ms)和自由水T23(> 100 ms)。结合水对肌肉的系水能力影响微弱,反映的是能与蛋白质表面极性基团紧密结合的水分子层:不易流动水与肌肉的保水性息息相关,反映的是高度组织化蛋白质结构内部的水分子层;自由水是最易流失的水分,反映的是胞外水分子层[23-24]。贝柱内水分的分布与迁移会对肌肉质地产生影响。
|
图 2 皱纹盘鲍贝柱弛豫时间T2分布图 Fig. 2 Relaxation time T2 of adductor muscle from H. discus hannai |
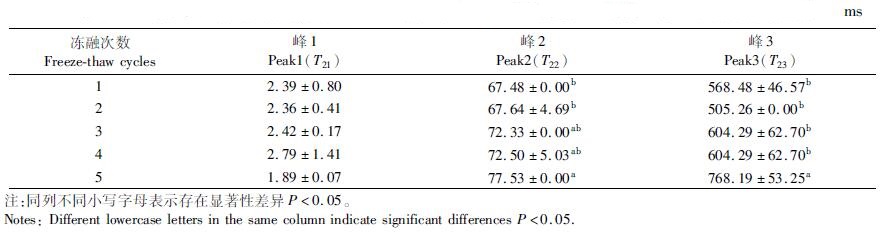
水分的自由度可以由弛豫时间T2反映,结果如表 3所示。随着冻融次数的增加,T21无明显变化,说明温度的波动对结合水几乎无影响。而T22和T23显著增加(P < 0.05), 这表明贝柱中不易流动水与自由水都发生了明显的迁移,不易流动水向自由水转化,而自由水向肌肉表面移动,形成汁液损失,肌肉的持水能力下降。
|
表 3 反复冻融对皱纹盘鲍贝柱弛豫时间T2的影响 Tab.3 Effect of freeze-thaw cycles on relaxation time T2 of adductor muscle from H. discus hannai |
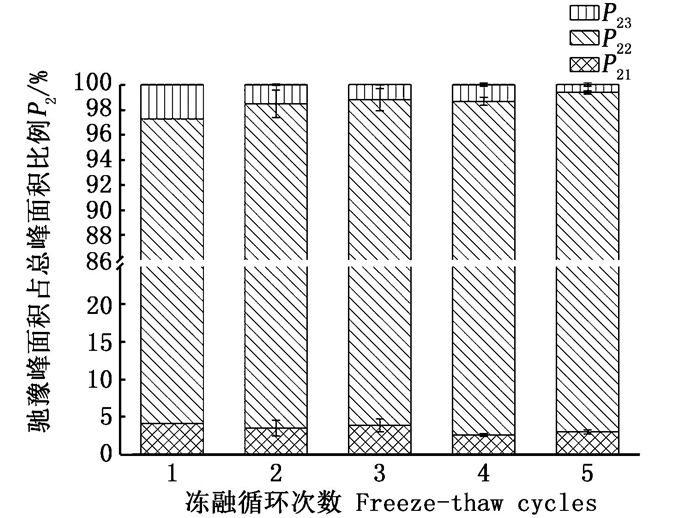
水分的组成状态可以由其对应的峰面积占总面积的比例反映出来,如图 3所示。由于结合水在此过程中几乎不受影响,所以主要分析不易流动水和自由水峰面积所占比例,即P22和P23。在5次冻融过程中,虽有波动,但P22相对呈现上升趋势,P23相反,相对呈现下降趋势,说明不易流动水占比增加,自由水占比降低,推测在此过程中不易流动水与自由水之间发生了一定的转化,汁液流失,自由水含量降低导致不易流动水的占比增大。祖崟雪[25]对海参的研究中发现解冻时间及次数的增加会导致束缚水占比逐渐增加,自由水占比逐渐降低。
|
图 3 反复冻融对皱纹盘鲍贝柱T2弛豫时间峰面积比例的影响 Fig. 3 Effect of freeze-thaw cycles on proportion of relaxation time T2 peak areas of adductor muscle from H. discus hannai |
蛋白的溶解性是蛋白质与蛋白质、水与水及蛋白质与水之间的动态平衡,其变化对蛋白的功能和应用价值有重要影响[26]。如图 4所示,贝柱的蛋白溶解性随着冻融次数的增加显著降低(P < 0.05), 由最初的48.08 mg/g降至42.55 mg/g, 下降为原来的88.50 %。可以看到,在第2和3次冻融过程中,蛋白溶解性缓慢下降,在第4次冻融时才出现显著降低。另外,从图 4也可以发现,随着冻融次数的增加,盐溶性蛋白含量同样显著降低(P < 0.05), 由最初的39.91 mg/g降至34.70 mg/g, 下降为原来的86.95 %, 表明盐溶性蛋白发生了变性。
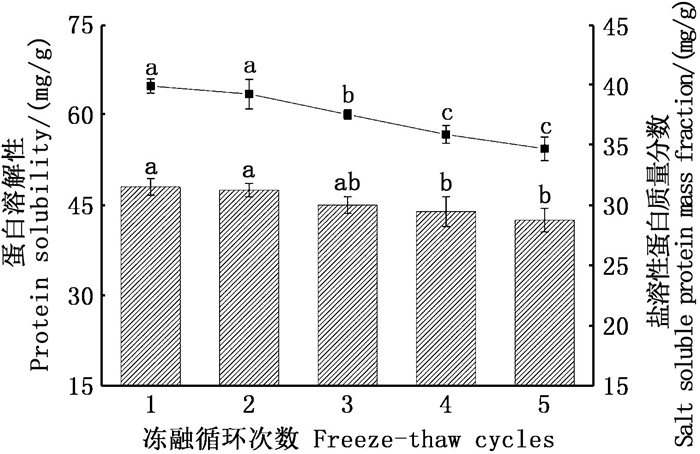
|
柱状图中不同的小写字母代表样品的蛋白溶解性存在显著性差异P < 0.05; 折线图中不同的小写字母代表样品的盐溶性蛋白含量存在显著性差异P < 0.05。 Different lowercase letters in the histogram represent a significant difference in protein solubility of the sample P < 0.05;different lowercase letters in the line graph represent a significant difference in the salt-soluble protein content of the sample P < 0.05. 图 4 反复冻融对皱纹盘鲍贝柱蛋白溶解性的影响 Fig. 4 Effect of freeze-thaw cycles on protein solubility of adductor muscle from H. discus hannai |
表面疏水性不仅可以反映蛋白质表面疏水性氨基酸的相对含量,也可以反映肽链的展开程度,对于蛋白质的性质和功能具有重要影响,是蛋白氧化的关键性指标[27-28]。如图 5所示,随着冻融次数的增加,表面疏水性在第1~3次冻融后先上升后在4~5次发生了下降,这可能是由于起初蛋白构象发生变化,分子内部的一些疏水性氨基酸侧链基团暴露出来,蛋白发生折叠,表面疏水性增加;但随后冻融次数的增加导致肌球蛋白的三级结构发生改变,疏水基团或被掩盖,或通过疏水相互作用发生交联和聚集,使得所检测到的表面疏水减少[13, 18, 29]。
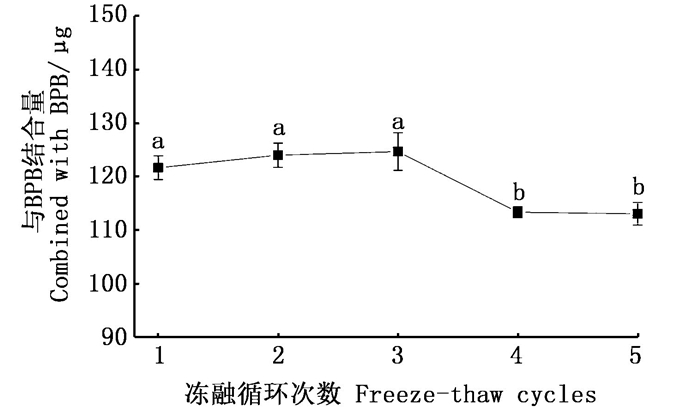
|
折线图中不同的小写字母代表样品的表面疏水性存在显著性差异P < 0.05。 Different lowercase letters in the line graph represent a significant difference in surface hydrophobicity content of the sample P < 0.05. 图 5 反复冻融对皱纹盘鲍贝柱表面疏水性的影响 Fig. 5 Effect of freeze-thaw cycles on surface hydrophobicity of adductor muscle from H. discus hannai |
羰基主要由肽键或者氨基酸侧链断裂多产生,可作为蛋白氧化的关键性指标[30]。羰基浓度的多少与蛋白氧化程度呈正相关。由图 6可以看出,从第3次循环开始,贝柱中羰基浓度开始显著增加(P < 0.05), 经过5次冻融循环后羰基的浓度由起初的2.14 nmol/mg变为4.89 nmol/mg, 增加了约54.40 %, 蛋白氧化反应明显。
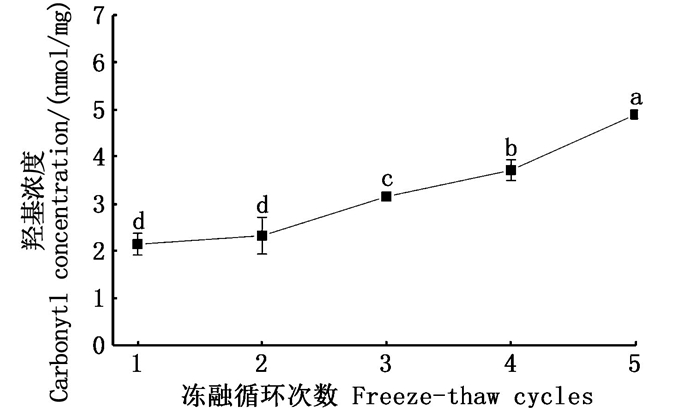
|
折线图中不同的小写字母代表样品的羰基含量存在显著性差异P < 0.05。 Different lowercase letters in the line graph represent a significant difference in carnonyl content of the sample P < 0.05. 图 6 反复冻融对皱纹盘鲍贝柱羰基浓度的影响 Fig. 6 Effect of freeze-thaw cycles on carnonyl concentraion of adductor muscle from H. discus hannai |
总巯基包括蛋白分子表面的活性巯基与分子内部的隐藏巯基,活性巯基会氧化形成二硫键,甚至进一步生成亚砜等有害物质,它是反映蛋白氧化的重要标志[5, 18]。由图 7所示,活性巯基的浓度随冻融次数的增加显著降低(P < 0.05)。前2次巯基浓度变化不大,从第3次开始显著降低,5次冻融后,巯基浓度由最初的4.41 μmol/g降至3.24 μmol/g, 比第1次冻融降低了26.53 %。
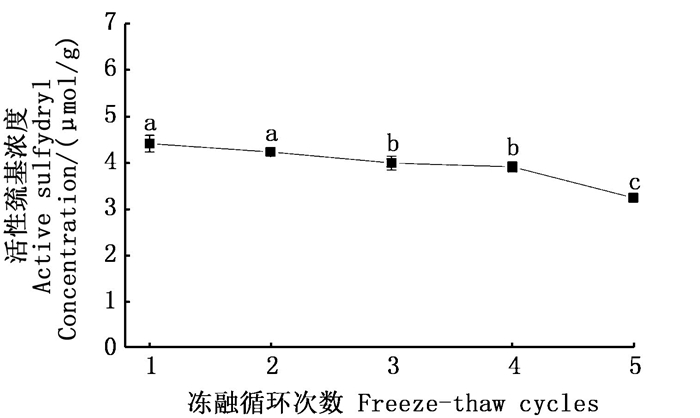
|
折线图中不同的小写字母代表样品的活性巯基含量存在显著性差异P < 0.05。 Different lowercase letters in the line graph represent a significant difference sulfhydryl content of the sample P < 0.05. 图 7 反复冻融对皱纹盘鲍贝柱巯基浓度的影响 Fig. 7 Effect of freeze-thaw cycles on sulfhydryl concentraion of adductor muscle from H. discus hannai |
水产品死后,在内源酶及微生物的作用下,质地会发生相应变化。冻藏在一定程度上能够有效抑制微生物与酶的作用,但冰晶的反复溶解与生成会在肌肉内形成一系列大小不一、形状不规则的冰晶,对细胞造成机械损伤,导致蛋白结构发生改变,蛋白变性加剧及质地劣化。有研究[31]表明,肌原纤维蛋白含量的降低会导致肌肉硬度、弹性等降低,也会造成肌肉持水能力和凝胶能力的下降。
3.2 反复冻融对皱纹盘鲍贝柱水合特性的影响水分是肌肉中含量最多的物质,水分的流失不仅影响了产品的质地、营养与色泽,也会造成经济损失[32]。研究[33]表明,肌肉的保水性与肌原纤维蛋白有关,冻融过程中肌纤维结构的破坏和蛋白氧化作用,会造成肌肉保水性的降低。但也有学者[34]发现适度的氧化可以提高肌肉的持水能力,这可能与肌肉收缩导致肌细胞间距减小有关。肌肉中水分子的分布与迁移情况可以通过低场核磁共振技术进行观测,本实验中弛豫时间的增加推测可能是由于蛋白质交联及结构的改变,降低了对水分子的束缚能力而导致的[35-36], 进而不易流动水与自由水之间发生转换,造成汁液流失。这与祖崟雪[25]的研究结果相同。朱学伸等[37]发现鸡胸肉与腿肉中自由水的弛豫时间会随着冻融次数的增加先上升后下降。柏霜等[38]对羊臊子肉的研究中发现自由水的弛豫时间随冻融次数的增加而降低。这种差异可能是与样品的种类、加工后样品的状态等有关。总体来看,冻融循环对肌肉的保水性影响较大,在产品加工贮藏与流通过程中要注意温度的波动。
3.3 反复冻融对皱纹盘鲍贝柱蛋白氧化的影响肌原纤维蛋白是维持细胞骨架完整性的结构蛋白,冻融会促使肌原纤维蛋白氧化变性,影响蛋白功能。蛋白溶解性、表面疏水性、羰基和巯基都是反映蛋白氧化的重要指标[39], 其中蛋白的溶解性与蛋白的起泡性、乳化性和凝胶性有关[26]。本次实验中蛋白溶解性与盐溶性蛋白含量随冻融次数的增加均呈现下降趋势,这与BENJAKUL等[40]、姜晴晴等[18, 39]的研究结果一致。分子结构、带电性、pH和离子强度等内外因素都会影响蛋白溶解性[26]。此外,蛋白天然构象的改变、疏水性氨基酸的暴露、二硫键的形成等也会对其溶解性产生影响[41-43]。实验中盐溶性蛋白含量的降低可能与二硫键、氢键或疏水键的形成有关[44]。李艳青等[26]认为肌球蛋白之间形成共价键、离子强度的增加及碱溶性蛋白的产生等因素会导致盐溶性蛋白溶解性降低。张龙腾等[45]通过6次冻融循环发现在鱼糜中盐溶性蛋白含量会随冻融次数的增加而减少,但向其中加入含有亲水性氨基酸的酶解产物,可以缓解降低速度。
疏水作用的增强会导致肌原纤维蛋白含量的降低,进而减弱肌肉的持水性[46]。KORZENIOWSKA等[47]研究鱼蛋白水解和冻融处理对太平洋鳕鱼天然肌动球蛋白理化性质的影响,发现鳕鱼肉表面疏水性随冻融次数的增加呈现先增加后降低的趋势,他认为最初的增加与肌球蛋白头部变化有关,而后续降低则是疏水相互作用导致暴露的残留物聚集所导致的。SRIKET等[7]对比黑虎虾与白虾肉的冻融稳定性时发现,5次冻融循环后白虾的表面疏水性高于黑虎虾,白虾蛋白氧化程度也更高。
蛋白侧链的NH-或NH2-基团容易受到自由氧的攻击,转变为羰基基团[48]。此外,脂质氧化生成的醛类也可以和蛋白质中的亲核基团反应,形成席夫碱化合物,这可能会加速羰基的形成[49]。本次研究中可能是由于活性氧攻击蛋白质导致氨基酸发生脱氨反应,转变为羰基致使其含量增加。ZHANG等[6]对鳙鱼片冻融的研究及WANG等[50]对鱼糜冻融的研究表明,冻融会造成蛋白羰基含量的显著增加,但添加一些抗氧化剂,如酶解鱼鳍、抗坏血酸、褐藻间氯菌素等,可以有效缓解蛋白氧化速率。
巯基含量的减少可能与肌球蛋白的构象变化有关,其结构的变化导致巯基不断地暴露与氧化。邓思杨等[5]在对镜鲤的冻融研究中也发现了5次冻融后鱼肉的总巯基含量降低了23.78%, 活性巯基含量降低了18.06%。并且认为蛋白溶解度与α-螺旋含量和巯基含量密切相关。THANONKAEW等[51]研究发现冻融过程中主要是铜离子对墨鱼蛋白质理化性质的改变起主要作用。另外,也有学者认为二硫键的多少与肌肉硬度有关,含量越高,硬度越大[52]。本次实验中巯基含量的减少推测可能是因为巯基氧化成二硫键或蛋白聚集导致的。
4 结论水产品在贮运流通过程中经常会发生温度波动,从而导致冻品反复冻融。通过对反复冻融中皱纹盘鲍贝柱的质构、水合特性及蛋白氧化的影响研究发现:贝柱肉经冻融循环后,肌肉的硬度、弹性等降低,剪切力增高;冰晶的生成与重结晶导致肌纤维裂解、蛋白变性,肌肉持水能力降低,LF-NMR显示在冻融过程中弛豫时间T2发生了明显右移,不易流动水与自由水之间发生相互转化。同时,冻融过程中,肌肉中表面疏水性先上升后降低,活性巯基含量增加而羰基含量升高,表明此过程中发生了蛋白氧化,这对肌肉的质地、色泽等有重要影响。因此,今后应进一步完善冻品冷藏链系统,减少其温度波动,控制其品质劣变,进而可降低经济损失。此外,也需要研发抗冻力强的天然抗冻剂,以保障冷冻产品的质量。
| [1] |
MARTINO M N, OTERO L, SANZ P D, et al. Size and location of ice crystals in pork frozen by high-pressure-assisted freezing as compared to classical methods[J]. Meat Science, 1998, 50(3): 303-313. DOI:10.1016/S0309-1740(98)00038-2 |
| [2] |
JASRA S K, JASRA P K, TALESARA C L. Myofibrillar protein degradation of carp (Labeo rohita Hamilton) muscle after post-mortem unfrozen and frozen storage[J]. Journal of the Science of Food and Agriculture, 2001, 81(5): 519-524. DOI:10.1002/jsfa.841 |
| [3] |
SANTOS H, M NDEZ L, SECCI G, et al. Pathway-oriented action of dietary essential oils to prevent muscle protein oxidation and texture deterioration of farmed rainbow trout[J]. Animal, 2019, 13(9): 2080-2091. DOI:10.1017/S1751731119000016 |
| [4] |
张洪超, 薛张芝, 丁源, 等. 不同解冻方式反复冻融对金乌贼蛋白质分子间作用力的影响[J]. 水产学报, 2019, 43(8): 1839-1849. ZHANG H C, XUE Z Z, DING Y, et al. Effects of different thawing ways and multiple freeze-thaw cycles on myofibrillar protein intermolecular force of Sepia esculenta[J]. Journal of Fisheries of China, 2019, 43(8): 1839-1849. |
| [5] |
邓思杨, 王博, 李海静, 等. 冻融次数对镜鲤鱼肌原纤维蛋白功能和结构特性变化的影响[J]. 食品科学, 2019, 40(11): 95-101. DENG S Y, WANG B, LI H J, et al. Effect of freeze-thaw cycles on changes in functional and structural properties of myofibrillar protein from mirror carp (Cyprinus carpio var. specularis)[J]. Food Science, 2019, 40(11): 95-101. |
| [6] |
ZHANG L T, SHAN Y K, HONG H, et al. Prevention of protein and lipid oxidation in freeze-thawed bighead carp (Hypophthalmichthys nobilis) fillets using silver carp (Hypophthalmichthys molitrix) fin hydrolysates[J]. LWT, 2020, 123: 109050. DOI:10.1016/j.lwt.2020.109050 |
| [7] |
SRIKET P, BENJAKUL S, VISESSANGUAN W, et al. Comparative studies on the effect of the freeze-thawing process on the physicochemical properties and microstructures of black tiger shrimp (Penaeus monodon) and white shrimp (Penaeus vannamei) muscle[J]. Food Chemistry, 2007, 104(1): 113-121. DOI:10.1016/j.foodchem.2006.11.004 |
| [8] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴2018[M]. 北京: 中国农业出版社, 2019. Ministry of Agriculture and Rural Affairs of the People's Republic of China, National Fisheries Technology Extension Center, China Society of Fisheries. China fishery statistical yearbook 2018[M]. Beijing: China Agriculture Press, 2019. |
| [9] |
郝林娟, 陈俊, 郝更新, 等. 鲍鱼不同部位肌肉的成分和热特性[J]. 食品工业科技, 2017, 38(24): 1-5. HAO L J, CHEN J, HAO G X, et al. Composition and thermal properties of different parts in abalone (Haliotis discus hannai Ino) muscle[J]. Science and Technology of Food Industry, 2017, 38(24): 1-5. |
| [10] |
CHEN T H, ZHU Y P, HAN M Y, et al. Classification of chicken muscle with different freeze-thaw cycles using impedance and physicochemical properties[J]. Journal of Food Engineering, 2017, 196: 94-100. DOI:10.1016/j.jfoodeng.2016.10.003 |
| [11] |
王耀耀. 鲍鱼肌原纤维蛋白的提取及性质研究[D]. 大连: 大连工业大学, 2011. WANG Y Y. Study on the extraction and characteristics of myofibrillar protein from abalone (Haliotis discus hannai Ino)[D]. Dalian: Dalian Polytechnic University, 2011. |
| [12] |
张龙, 刘俊荣, 田元勇, 等. 菲律宾蛤仔(Ruditapes philippinarum)软体部位含氮物的组成及其分布[J]. 食品科学, 2015, 36(24): 95-100. ZHANG L, LIU J R, TIAN Y Y, et al. Composition and distribution of nitrogenous compounds in soft body of Ruditapes philippinarum[J]. Food Science, 2015, 36(24): 95-100. DOI:10.7506/spkx1002-6630-201524016 |
| [13] |
CHELH I, GATELLIER P, SANT-LHOUTELLIER V. Technical note: a simplified procedure for myofibril hydrophobicity determination[J]. Meat Science, 2006, 74(4): 681-683. DOI:10.1016/j.meatsci.2006.05.019 |
| [14] |
ELLMAN G L. Tissue sulfhydryl groups[J]. Archives of Biochemistry and Biophysics, 1959, 82(1): 70-77. DOI:10.1016/0003-9861(59)90090-6 |
| [15] |
BOTTA J R. Instrument for nondestructive texture measurement of raw Atlantic cod (Gadus morhua) fillets[J]. Journal of Food Science, 1991, 56(4): 962-964. DOI:10.1111/j.1365-2621.1991.tb14616.x |
| [16] |
BADII F, HOWELL N K. Changes in the texture and structure of cod and haddock fillets during frozen storage[J]. Food Hydrocolloids, 2002, 16(4): 313-319. DOI:10.1016/S0268-005X(01)00104-7 |
| [17] |
王俏仪, 董强, 卢水仙, 等. 冷冻贮藏对罗非鱼肌肉质构特性的影响[J]. 广东海洋大学学报, 2011, 31(4): 86-90. WANG Q Y, DONG Q, LU S X, et al. Effect of freezing storage on tilapia muscle texture[J]. Journal of Guangdong Ocean University, 2011, 31(4): 86-90. DOI:10.3969/j.issn.1673-9159.2011.04.016 |
| [18] |
姜晴晴, 李珊, 刘文娟, 等. 冻融循环对秘鲁鱿鱼蛋白及肌肉品质的影响[J]. 现代食品科技, 2014, 30(7): 171-178. JIANG Q Q, LI S, LIU W J, et al. Effect of freeze-thaw cycles on proteins and muscle quality of Dosidicus gigas[J]. Modern Food Science and Technology, 2014, 30(7): 171-178. |
| [19] |
张丹, 孙金辉, 王晓香, 等. 反复冻融对兔背最长肌肉品质特性和微观结构的影响[J]. 食品科学, 2014, 35(7): 38-42. ZHANG D, SUN J H, WANG X X, et al. Effects of freeze-thaw cycle on the quality properties and microstructure of rabbit muscle[J]. Food Science, 2014, 35(7): 38-42. |
| [20] |
常海军, 牛晓影, 周文斌. 不同冻融次数对猪肉品质的影响[J]. 食品科学, 2014, 35(15): 43-48. CHANG H J, NIU X Y, ZHOU W B. Effects of different freezing and thawing cycles on pork quality[J]. Food Science, 2014, 35(15): 43-48. DOI:10.7506/spkx1002-6630-201415009 |
| [21] |
BERTRAM H C, KARLSSON A H, ANDERSEN H J. The significance of cooling rate on water dynamics in porcine muscle from heterozygote carriers and non-carriers of the halothane gene: a low-field NMR relaxation study[J]. Meat Science, 2003, 65(4): 1281-1291. DOI:10.1016/S0309-1740(03)00038-X |
| [22] |
BERTRAM H C, ANDERSEN H J, KARLSSON A H. Comparative study of low-field NMR relaxation measurements and two traditional methods in the determination of water holding capacity of pork[J]. Meat Science, 2001, 57(2): 125-132. DOI:10.1016/S0309-1740(00)00080-2 |
| [23] |
王阳. 不同预制条件和熟化方式对鲍鱼品质的影响[D]. 大连: 大连工业大学, 2017. WANG Y. Effect of different pre-prepared and cooking methods on the quality of abalone (Haliotis discus hanai)[D]. Dalian: Dalian Polytechnic University, 2017. |
| [24] |
BERTRAM H C, KARLSSON A H, RASMUSSEN M, et al. Origin of multiexponential T2 relaxation in muscle myowater[J]. Journal of Agricultural and Food Chemistry, 2001, 49(6): 3092-3100. DOI:10.1021/jf001402t |
| [25] |
祖崟雪. 反复冻融对即食海参水分动力学的影响研究[D]. 大连: 大连工业大学, 2017. ZU Y X. Research on water dynamics of instant sea cucumber in multiple freeze-thaw processes[D]. Dalian: Dalian Polytechnic University, 2017. |
| [26] |
李艳青, 孔保华, 杨赫鸿, 等. 自由基氧化引起鲤鱼肌原纤维蛋白结构的变化[J]. 食品科学, 2012, 33(13): 70-74. LI Y Q, KONG B H, YANG H H, et al. Structural changes of common carp myofibrillar(MPI)influenced by hydroxyl radical system[J]. Food Science, 2012, 33(13): 70-74. |
| [27] |
闫利国, 唐善虎, 王柳, 等. 冷冻贮藏过程中氧化诱导牦牛肉肌原纤维蛋白结构的变化[J]. 食品科学, 2015, 36(24): 337-342. YANG L G, TANG S H, WANG L, et al. Oxidation-induced changes of myofibrillar protein structure of yak muscles during frozen storage[J]. Food Science, 2015, 36(24): 337-342. DOI:10.7506/spkx1002-6630-201524062 |
| [28] |
RIEBROY S, BENJAKUL S, VISESSANGUAN W, et al. Acid-induced gelation of natural actomyosin from Atlantic cod (Gadus morhua) and burbot (Lota lota)[J]. Food Hydrocolloids, 2009, 23(1): 26-39. DOI:10.1016/j.foodhyd.2007.11.010 |
| [29] |
LI-CHAN E, NAKAI S, WOOD D F. Relationship between functional(fat binding, emulsifying)and physicochemical properties of muscle proteins. Effects of heating, freezing, pH and species[J]. Journal of Food Science, 1985, 50(4): 1034-1040. DOI:10.1111/j.1365-2621.1985.tb13006.x |
| [30] |
STADTMAN E R. Protein oxidation and aging[J]. Science, 1992, 257(5074): 1220-1224. DOI:10.1126/science.1355616 |
| [31] |
BADII F, HOWELL N K. A comparison of biochemical changes in cod (Gadus morhua) and haddock (Melanogrammus aeglefinus) fillets during frozen storage[J]. Journal of the Science of Food and Agriculture, 2002, 82(1): 87-97. DOI:10.1002/jsfa.998 |
| [32] |
李银. 蛋白氧化对肌肉保水性的影响机制研究[D]. 北京: 中国农业科学院, 2014. LI Y. Effect-mechanism of protein oxidation on water-holding capacity of muscle[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014. |
| [33] |
姜晴晴. 冻融过程中带鱼脂肪和蛋白氧化及其对肌肉品质影响的研究[D]. 杭州: 浙江大学, 2015. JIANG Q Q. Studies on the oxidation of lipid and protein as well as muscle quality changes of Trichiurus haumela during freezing and thawing[D]. Hangzhou: Zhejiang University, 2015. |
| [34] |
LIU Z L, XIONG Y L, CHEN J. Protein oxidation enhances hydration but suppresses water-holding capacity in porcine longissimus muscle[J]. Journal of Agricultural and Food Chemistry, 2010, 58(19): 10697-10704. DOI:10.1021/jf102043k |
| [35] |
高兴盛. 基于低场核磁共振技术对皱纹盘鲍品质的研究[D]. 大连: 大连海洋大学, 2016. GAO X S. The study of the Haliotis discus hannai quality based on the low field nuclear magnetic resonance (NMR) technology[D]. Dalian: Dalian Ocean University, 2016. |
| [36] |
KIM Y H B, LIESSE C, KEMP R, et al. Evaluation of combined effects of ageing period and freezing rate on quality attributes of beef loins[J]. Meat Science, 2015, 110: 40-45. DOI:10.1016/j.meatsci.2015.06.015 |
| [37] |
朱学伸, 黄雪方, 鲁小讯, 等. 结合低场核磁共振分析反复冻融处理对肉鸡不同部位肌肉品质的影响[J]. 食品科学, 2016, 37(9): 23-28. ZHU X S, HUANG X F, LU X X, et al. Effect of freeze-thaw cycles on the quality of broiler breast and thigh muscles as evaluated by low-field nuclear magnetic resonance[J]. Food Science, 2016, 37(9): 23-28. |
| [38] |
柏霜, 张同刚, 罗瑞明, 等. 反复冻融处理对羊肉臊子品质特性的影响[J]. 食品工业科技, 2017, 38(13): 30-35, 41. BO S, ZHANG T G, LUO R M, et al. Effects of repeated freezing and thawing on quality characteristics of fired and diced mutton[J]. Science and Technology of Food Industry, 2017, 38(13): 30-35, 41. |
| [39] |
姜晴晴, 邵世奇, 陈士国, 等. 冻融循环对带鱼蛋白性质及肌肉品质的影响[J]. 中国食品学报, 2016, 16(4): 122-129. JIANG Q Q, SHAO S Q, CHEN S G, et al. Effect of freeze-thaw cycles on the characteristics of protein and the quality of muscle in hairtail (Trichiurus haumela)[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(4): 122-129. |
| [40] |
BENJAKUL S, BAUER F. Physicochemical and enzymatic changes of cod muscle proteins subjected to different freeze-thaw cycles[J]. Journal of the Science of Food and Agriculture, 2000, 80(8): 1143-1150. DOI:10.1002/1097-0010(200006)80:8<1143::AID-JSFA610>3.0.CO;2-C |
| [41] |
HULTIN H O. Textural attributes of proteinaceous animal foods as influenced by reactions during food processing[M]//FENNEMA O R, CHANG W H, LII C Y. Role of Chemistry in the Quality of Processed Food. Westport: Food and Nutrition Press, 1986: 202.
|
| [42] |
XIONG Y L, AGYARE K K, ADDO K. Hydrolyzed wheat gluten suppresses transglutaminase-mediated gelation but improves emulsification of pork myofibrillar protein[J]. Meat Science, 2008, 80(2): 535-544. DOI:10.1016/j.meatsci.2008.02.005 |
| [43] |
LIM H K, HAARD N E. Protein insolubilization in frozen Greenland halibut (Reinhardtius hippoglossoides)[J]. Journal of Food Biochemistry, 1984, 8(3): 163-187. DOI:10.1111/j.1745-4514.1984.tb00323.x |
| [44] |
JIANG S T, HWANG D C, CHEN C S. Effect of storage temperatures on the formation of disulfides and denaturation of milkfish actomyosin (Chanos chanos)[J]. Journal of Food Science, 1988, 53(5): 1333-1335. DOI:10.1111/j.1365-2621.1988.tb09270.x |
| [45] |
张龙腾, 洪惠, 罗永康, 等. 鱼糜副产物酶解物对冻融鲢鱼鱼糜品质的影响[J]. 肉类研究, 2019, 33(10): 1-7. ZHANG L T, HONG H, LUO Y K, et al. Effect of addition of hydrolysates derived from surimi processing byproducts on quality changes of silver carp (Hypophthalmichthys molitrix) surimi after multiple freeze-thaw cycles[J]. Meat Science, 2019, 33(10): 1-7. |
| [46] |
HERRERO A M. Raman spectroscopy for monitoring protein structure in muscle food systems[J]. Critical reviews in Food Science and Nutrition, 2008, 48(6): 512-523. DOI:10.1080/10408390701537385 |
| [47] |
KORZENIOWSKA M, CHEUNG I W Y, LI-CHAN E C Y. Effects of fish protein hydrolysate and freeze-thaw treatment on physicochemical and gel properties of natural actomyosin from Pacific cod[J]. Food Chemistry, 2013, 138(2/3): 1967-1975. |
| [48] |
王芳芳, 张一敏, 罗欣, 等. 冷冻解冻对生鲜肉品质的影响及其新技术研究进展[J]. 食品科学, 2020, 41(11): 295-322. WANG F F, ZHANG Y M, LUO X, et al. Advance research of effect of freezing and thawing on meat quality and new technology development[J]. Food Science, 2020, 41(11): 295-322. DOI:10.7506/spkx1002-6630-20190515-164 |
| [49] |
CAI L Y, CAO A L, LI Y C, et al. The effects of essential oil treatment on the biogenic amines inhibition and quality preservation of red drum (Sciaenops ocellatus) fillets[J]. Food Control, 2015, 56: 1-8. DOI:10.1016/j.foodcont.2015.03.009 |
| [50] |
WANG T T, LI Z X, MI N S, et al. Effects of brown algal phlorotannins and ascorbic acid on the physiochemical properties of minced fish (Pagrosomus major) during freeze-thaw cycles[J]. International Journal of Food Science & Technology, 2017, 52(3): 706-713. |
| [51] |
THANONKAEW A, BENJAKUL S, VISESSANGUAN W, et al. The effect of metal ions on lipid oxidation, colour and physicochemical properties of cuttlefish (Sepia pharaonis) subjected to multiple freeze-thaw cycles[J]. Food Chemistry, 2006, 95(4): 591-599. DOI:10.1016/j.foodchem.2005.01.040 |
| [52] |
LIN W L, ZENG Q X, ZHU Z W, et al. Relation between protein characteristics and TPA texture characteristics of crisp grass carp(Ctenopharyngodon idellus C. et V)and grass carp (Ctenopharyngodon idellus)[J]. Journal of Texture Studies, 2012, 43(1): 1-11. DOI:10.1111/j.1745-4603.2011.00311.x |
2. Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China;
3. Laboratory of Quality and Safety Risk Assessment for Aquatic Products on Storage and Preservation, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


