2. 上海市水产养殖工程技术研究中心, 上海 201306;
3. 上海海洋大学 水产与生命学院, 上海 201306;
4. 中国水产科学研究院东海水产研究所, 上海 200090;
5. 上海市奉贤区水产技术推广站, 上海 201419;
6. 上海思阳水产养殖合作社, 上海 201400
凡纳滨对虾(Litopenaeus vannamei),又称南美白对虾,原产于中美洲、南美洲太平洋沿岸水域,具有生长速度快、适应盐度范围广、易于集约饲养、养殖模式多样等优点,是世界上产量最大的三大养殖虾之一[1]。但近年来,凡纳滨对虾养殖过程中不时暴发疾病, 导致其产量下滑,养殖及相关产业受到冲击。凡纳滨对虾养殖中常见的病毒有偷死野田村病毒(CMNV)[2]、传染性皮下和造血器官坏死病毒(IHHNV)[3]、黄头病毒(YHV)[4]、桃拉病毒(TSV)[5]、白斑综合征病毒(WSSV)[6]等。
对虾的生长及健康状况与水质密切相关。方金龙等[7]研究发现,感染WSSV后,氨氮胁迫组凡纳滨对虾的死亡率显著高于无胁迫组,氨氮胁迫会刺激对虾的免疫系统,使对虾对病原的抵抗力降低, 导致病毒快速增殖。李侃等[8]发现,在不同水温条件下,WSSV在克氏原螯虾肌肉组织中的增殖过程、在细胞中的入侵和转录过程均有显著差异。陈勇贵等[9]的研究发现,在感染WSSV后,凡纳滨对虾的平均存活时间与pH、亚硝酸盐氮和氨氮浓度间存在极显著相关, 但与盐度的相关性未达到显著水平。向赟等[10]研究发现,对于携带有WSSV的凡纳滨对虾, 氨氮浓度变化幅度越大,WSSV从潜伏感染转为急性感染的可能越大;同时,高浓度氨氮会降低未感染WSSV对虾的抗病能力。
本课题对某养殖场凡纳滨对虾生产全周期的水质与病害发生情况进行了跟踪调查,对其病害发生与水质之间的相关性进行分析,以期发现与病害发生关系最为密切的水质指标,为发病预警提供参考。
1 材料与方法 1.1 养殖场基本情况实验于2018年在上海市奉贤区某虾类养殖合作社进行(图 1)。该合作社共有15个池塘,每个池塘长93 m、宽47 m,有效水深1.5 m左右,配备4台涡轮增氧机,每天12:00—16:00、21:00—次日9:00间开启,约运行16 h。进、排水方式以及投喂的饲料均相同,虾塘的饲料投喂历史状况及饲料成分见表 1。
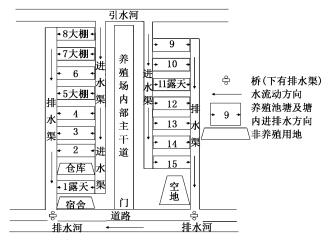
|
图 1 养殖合作社池塘分布图 Fig. 1 Distribution map of culturing cooperative ponds |
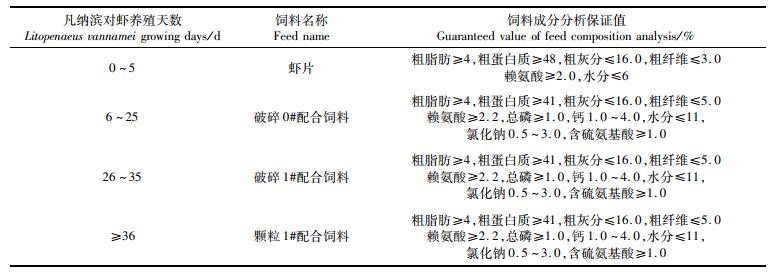
|
表 1 饲料投喂情况 Tab.1 Feed feeding situation |
该合作社的15个池塘苗种投放时间有所不同,其中5、7及8号池塘是3月18日投放的同一批虾苗。其放苗与分塘信息如图 2所示,其中5、7及8号池塘为大棚养殖,1、11号池塘为露天养殖。根据其是否携带病毒、是否发病等分为3组。
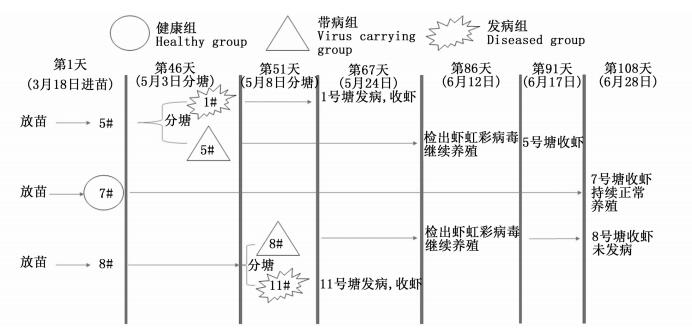
|
图 2 凡纳滨对虾试验塘基本信息 Fig. 2 Basic information of the Litopenaeus vannamei ponds |
健康组(7号):养殖过程中未检测到病原生物,未发病,正常养殖至上市。
带病组(5、8号):养殖过程中检测到虾血细胞虹彩病毒(shrimp hemocyte iridescent virus,SHIV,下文简称虾虹彩病毒),即携带病毒但未发病,正常养殖至上市。
发病组(1、11号):养殖过程中检测到虾虹彩病毒,因发病而提前收虾。
1.2 水质与病毒检测方法试验期间,参考《地表水环境质量标准》(GB 3838—2002),每5天测定1次各试验塘的水温、溶解氧(DO,HJ 506—2009)、pH(GB 6920—86)、总氮(TN,HJ 636—2012)、总磷(TP,GB 11893—1989)、化学需氧量(COD,HJ/T 132—2003)及叶绿素a(Chl.a)[11]等。
采用套式RT-PCR方法(GBT 28630.2—2012)检测虾白斑综合征病毒、偷死野田村病毒[12]和虾虹彩病毒[13]等病毒性病原,并通过细菌分离和16S rRNA测序鉴定方法检测哈维氏弧菌、副溶血性弧菌、鳗弧菌和气单胞菌等细菌性病原。
1.3 数据分析利用Excel和SIMCA等统计分析软件进行数据分析,使用主成分分析法(principal component analysis, PCA)[14]和正交偏最小二乘法分析(orthogonal projections to latent structures discrimination analysis, OPLS-DA)[15]筛选出实验组间差异贡献最大的水质因子,并进行差异显著性等分析。
2 结果 2.1 试验塘水质因子检测数据试验期间,检测到的病毒为虹彩病毒。根据1.1节中所述,分为发病组、带病组和健康组,各组的成虾起捕时间不同,基于同一时间段数据具有可比性的考虑,选择养殖第51天至67天之间的4次监测数据进行比较(表 2)。
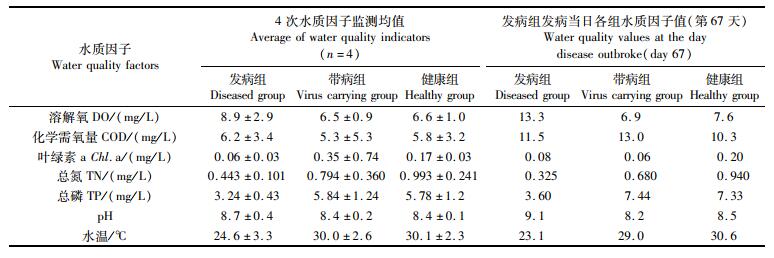
|
表 2 3组池塘水质因子统计结果 Tab.2 Statistical results of water quality factors in three groups of ponds |
主成分分析法是在尽可能保持原有数据信息的前提下,通过降维处理的方式以简化数据指标,区分各个样本组之间的差异。对3组的水质因子数据作主成分分析(principal components analysis, PCA),图 3显示:发病组与带病组之间,以及发病组与健康组之间均能明显区分,但带病组和健康组间则无法明显区分。表明对虾发病的池塘,其水质因子呈现明显异常,而只要不发病,即便携带病毒,其水质与健康组之间亦无明显差异。为方便起见,把带病组和健康组合并为一组,并命名为“带病&健康组”,并与发病组进行正交偏最小二乘法判别分析。
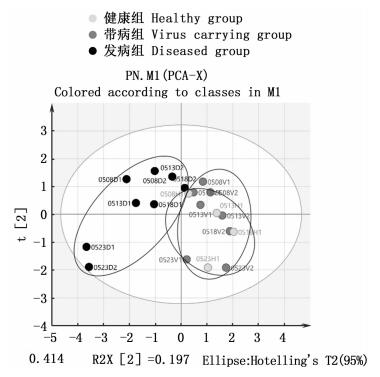
|
图 3 3组池塘的水质因子主成分分析 Fig. 3 PCA of water quality factors in three groups of ponds |
利用正交-偏最小二乘法判别分析(OPLS-DA)进行进一步分析,发病组与“带病&健康”组的水质数据在统计学上进一步聚集,结果显示两组间呈现非常好的分离(图 4)。当样本数据量较少时,可以通过置换检验法进行多次重新分组获得类似大样本的数据量,从而统计推断出数据模型的有效性。图 5中Q2值表示模型的累积交叉有效性,该值越大表示该模型的预测能力越优;R2值表示模型的累积方差值,为原始数据在用于建立OPLS-DA判别模型时的解释率,该值越大模型解释能力越强。本次置换检验结果R2值和Q2值分别为0.250和-0.827,说明建立的OPLS-DA判别模型有效,具有较好的预测能力。
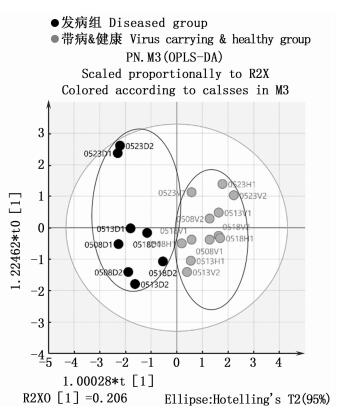
|
图 4 发病组与“带病&健康”组水质因子OPLS-DA统计图 Fig. 4 OPLS-DA chart of water quality factors in diseased group and "virus carrying & healthy" group |
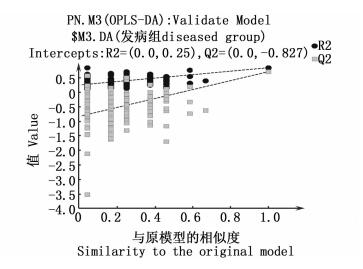
|
图 5 发病组与“带病&健康”组水质因子的置换检验图 Fig. 5 Water quality factor replacement test chart of diseased group and "virus carrying & healthy" group |
变量投影主要性(VIP)主要用于变量筛选。由图 6可知,VIP>1的是变量投影重要性指标,VIP<1的是变量投影非重要性指标。坐标轴中的各项水质因子与疾病发生的关联性从左往右逐渐降低。其关联性程度依次为总氮>水温>总磷>溶解氧。
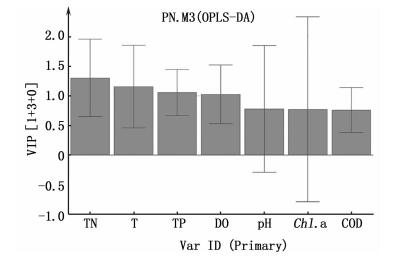
|
图 6 发病组与“带病&健康”组水质因子的主要因子统计图 Fig. 6 Main factor statistics of water quality factors in the diseased group and "virus carrying & healthy" group |
总氮包括氨氮、亚硝酸盐氮、硝酸盐氮等无机态氮以及有机氮等。梁森汉等[16]发现氨氮含量高的孵化池中容易发生罗氏沼虾(Macrobrachium rosenbergii)蚤状幼体肌肉白浊病;邢华[17]发现发生南美白对虾(Penaeus vannamei)偷死现象的池塘中亚硝酸盐氮含量普遍偏高,如能及时降低亚硝酸盐氮,“死底”现象即会停止;吴岗等[18]发现通过拌料投喂和全塘泼洒聚维酮碘的方式可以降低水中的氨氮和亚硝酸盐氮,提升浮游动物和藻类的密度,降低凡纳滨对虾偷死综合征的死亡量;李贵生等[19]发现氨氮是影响斑节对虾(Penaeus monodon)杆状病毒感染度的主要因子, 氨氮含量升高可明显增加病毒的感染度, 两者呈直线相关关系;何建国等[20]发现在水环境为低氨氮、低亚硝酸盐氮条件时,斑节对虾体内潜伏的白斑综合征病毒数量会减少;葛红星[21]发现氨氮浓度超过2.5 mg/L以及亚硝酸盐氮浓度超过2.0 mg/L均会胁迫并减弱凡纳滨对虾的非特异性免疫酶活性,降低对虾的免疫力,增加其对副溶血弧菌的易感性;LIU等[22]发现当养殖水体中的氨氮浓度高于5.24 mg/L后,感染溶藻胶弧菌的凡纳滨对虾死亡率明显提高。本研究测定的是总氮,虽然未单独测定其中不同形态氮的含量,但OPLS-DA结果显示,在几个水质指标中,总氮与疾病暴发之间的关联性最大,未来有必要对不同形态氮与携带虾虹彩病毒的凡纳滨对虾的发病情况进行更进一步地研究。
3.2 水温与疾病的发生GUNALAN等[23]通过连续记录野外条件下斑节对虾养殖场池塘水的水温和pH数据,发现较低的水温(养殖场池塘水的最低水温为23 ℃)和较高的pH(pH=9.5)会提高WSSV感染斑节对虾的速率,进而诱发斑节对虾的高死亡率。
DU等[24]发现被注射WSSV的克氏原螯虾在水温为(32±1)℃的水箱中暂养12 d未出现死亡现象,但将其转移至(24±1) ℃的水箱中后,次日就出现死亡现象,7 d内死亡率达到100%。吴晓果等[25]发现,在养殖水温较高的条件下,对虾白斑综合征病毒感染会引起宿主细胞的应激反应,会激发宿主细胞一系列的防御机制,降低对虾的死亡率。
目前有文献[26]对凡纳滨对虾虹彩病毒的完整基因组序列等进行了研究,也对河北、山东、浙江和广东省等部分养殖场的虾虹彩病毒阳性率进行了调查[27],但虾虹彩病毒增殖与水温之间的关系尚未见详尽报道。
本试验结果与前人关于WSSV的研究有相似之处,例如5、8号池塘是大棚养殖,试验期间水温保持在30 ℃左右,即使凡纳滨对虾带有虾虹彩病毒,依然可以健康生长;但将其转移到较低水温条件下继续养殖时,例如1、11号塘是露天养殖(发病时水温分别为24.0、22.2 ℃),则疾病暴发,凡纳滨对虾出现死亡。
也有研究认为,高水温、低水温均会降低病毒增殖速度,而中间某一水温更容易诱发疾病。例如李侃等[28]研究发现,养殖水在高水温(>33 ℃)和低水温(<12 ℃)条件下均会显著减低白斑综合征病毒进入细胞的数量,而在27 ℃条件下会促进病毒进入细胞的数量。DU等[24]发现在(24±1)℃条件下向克氏原螯虾中注射WSSV病毒粒子,在注射12、24和48 h后大约有104个/mg、106个/mg和1010个/mg病毒粒子,但在(32±1)℃条件下,注射后12 h大约有105个/mg病毒粒子,而96 h后病毒粒子浓度依然保持在105个/mg,表明高温可以减少病毒复制。DU等[29]发现在(10±1)℃的条件下感染WSSV的克氏原螯虾为带病生存,将其从(10±1)℃转移到(24±1)℃会出现迅速死亡现象,(10±1)℃时病毒粒子增长率低于(24±1)℃条件下。
本研究中,用于比对分析期间的数据,最低水温为20.7 ℃,平均为(24.6±3.3)℃,不足以判断更低的水温是否会抑制病害发生。对于虾虹彩病毒,是否也存在一个易暴发疾病的水温区域,尚需进一步研究。
3.3 总磷与疾病的发生有研究[30-31]表明,在养殖早期,浮游植物可以是幼虾直接或间接的饵料,虾苗还可以通过摄食轮虫、桡足类等浮游生物来提高免疫力、抗病力。发病组总磷含量低于“带病&健康”组,这与其水温有着密切关系。当水中营养物质充足时,浮游植物将快速增长,导致水中总磷含量快速上升;而试验期间,发病组为露天池塘,水温低于“带病&健康”组,浮游植物增长相对较缓慢,对凡纳滨对虾的营养和免疫能力提升帮助有限。
3.4 溶解氧与疾病的发生水中溶解氧含量是影响虾生长和存活的重要环境因素。段妍等[32]发现,当DO<2.0 mg/L时,凡纳滨对虾增重显著降低,当DO>4.2 mg/L时,实验虾体质量与正常及高氧处理组之间无显著差异。本实验中,发病当日以及数据比对周期内,发病组的溶解氧均高于“带病&健康”组,且均高于相应水温下水中溶解氧的饱和含量;而带病组、健康组的溶解氧之间无显著差异,溶氧饱和度亦在85%以上。所有池塘溶解氧含量均满足凡纳滨对虾养殖需要,其增氧方式均相同,发病组与“带病&健康”组之间溶解氧的差异,主要源自水温的差异。发病组水温低、溶氧高,“带病&健康”组水温高、溶氧低;而后者,由于养殖虾较前者更为健康,新陈代谢活跃,会消耗更多的溶解氧。
3.5 分塘操作与疾病的发生前述分析主要聚焦于水质指标本身,但从养殖管理的角度看,会有另外发现。未经任何分塘操作的7号塘在整个102 d的养殖过程中,没有发病,直至商品规格后收虾;经过分塘操作后,留在原池塘的5号、8号塘的虾在第86天亦检测到虾虹彩病毒,但未暴发疾病,后续分别养至第91天和102天收虾;而分塘出去的1号塘和11号塘虾则因暴发疾病而提前收虾。因此很有可能分塘操作在一定程度上诱发了疾病的发生。分塘时很容易搅动池底,引起水质发生变化,而拉网也会导致虾体的机械损伤,并引起凡纳滨对虾的应激反应。
尹伦甫等[33]认为,养殖过程中的管理行为、养殖环境和微生物病菌均可引起虾类的应激反应,诱发疾病发生,严重时还会出现大批死亡。对虾的应激反应[34]一方面可以让对虾适应新的环境变化,但另一方面也会引起虾体自身内环境变化,使虾体免疫下降,诱发疾病,甚至死亡。因此,养殖过程中,应尽量维持养殖塘相对稳定的生态状况,避免过多地人为干扰,以降低凡纳滨对虾的应激反应。
3.6 总结本试验中,凡纳滨对虾虹彩病毒病的发生与总氮、水温、总磷、溶解氧等水质因子存在不同程度的关联。跟据养殖进程实行的分塘操作产生了大棚、露天两种养殖模式。露天养殖模式下,水温较低,溶解氧含量高,水中浮游生物生长相对缓慢,导致露天养殖的发病组总氮、总磷含量均低于大棚养殖的“带病&健康”组。分塘操作等管理行为若有不当也会引起凡纳滨对虾的应激反应,导致疾病暴发。
| [1] |
李世凯, 江敏, 戴习林, 等. 凡纳滨对虾池塘水质及对虾肌肉品质的对比分析[J]. 上海海洋大学学报, 2012, 21(6): 955-964. LI S K, JIANG M, DAI X L, et al. Comparative analysis of water quality in Litopenaeus vannamei ponds and nutritional quality of shrimp muscle[J]. Journal of Shanghai Ocean University, 2012, 21(6): 955-964. |
| [2] |
李小平, 万晓媛, 张庆利, 等. 2016-2017年中国沿海省市虾类偷死野田村病毒(CMNV)分子流行病学调查[J]. 渔业科学进展, 2019, 40(2): 65-73. LI X P, WAN X Y, ZHANG Q L, et al. Molecular epidemiological survey of covert mortality noda virus (CMNV) in cultured crustaceans in China in 2016-2017[J]. Progress in Fishery Sciences, 2019, 40(2): 65-73. |
| [3] |
范东东, 魏永伟, 苗亮, 等. 罗氏沼虾(Macrobrachium rosenbergii)传染性皮下和造血器官坏死病毒(IHHNV)的流行病学调查[J]. 海洋与湖沼, 2015, 46(5): 1153-1159. FAN D D, WEI Y W, MIAO L, et al. Epidemiology of infectious hypodermal and hematopoietic necrosis virus in Macrobrachium rosenbergii[J]. Oceanologia et Limnologia Sinica, 2015, 46(5): 1153-1159. |
| [4] |
朱罗罗, 张庆利, 万晓媛, 等. 我国一株新型黄头病毒的分子流行病学[J]. 渔业科学进展, 2016, 37(3): 68-77. ZHU L L, ZHANG Q L, WAN X Y, et al. Molecular epidemiology of a new yellow head virus strain in China[J]. Progress in Fishery Sciences, 2016, 37(3): 68-77. |
| [5] |
金立方, 余招锋. 桃拉病毒感染对南美白对虾血液学参数的影响[J]. 农业与技术, 2013, 33(10): 14-16, 69. JIN L F, YU Z F. Effect of Taura virus infection on hematological parameters of Penaeus vannamei[J]. Agriculture and Technology, 2013, 33(10): 14-16, 69. |
| [6] |
何培民, 郭媛媛, 贾晓会, 等. 对虾白斑综合征病毒免疫防治研究进展[J]. 海洋渔业, 2016, 38(4): 437-448. HE P M, GUO Y Y, JIA X H, et al. Research advance of immunology prevention of shrimp white spot syndrome virus[J]. Marine Fisheries, 2016, 38(4): 437-448. |
| [7] |
方金龙, 王元, 房文红, 等. 氨氮胁迫下白斑综合征病毒对凡纳滨对虾的致病性[J]. 南方水产科学, 2017, 13(4): 52-58. FANG J L, WANG Y, FANG W H, et al. Study on pathogenicity of WSSV to Pacific white shrimp (Litopenaeus vannamei) under ammonia stress[J]. South China Fisheries Science, 2017, 13(4): 52-58. |
| [8] |
李侃, 罗淑娅, 徐丽美. 温度影响对虾白斑综合征病毒增殖机制的研究[J]. 应用海洋学学报, 2013, 32(1): 61-66. LI K, LUO S Y, XU L M. A study on the mechanism of temperature impact on the proliferation of white spot syndrome virus (WSSV)[J]. Journal of Applied Oceanography, 2013, 32(1): 61-66. |
| [9] |
陈勇贵, 梁秋玲, 何建国. 几种理化因子对急性感染WSSV凡纳滨对虾的影响[J]. 中山大学学报(自然科学版), 2010, 49(6): 78-82, 88. CHEN Y G, LIANG Q L, HE J G. Effects of water physical and chemical factors on WSSV-infected Litopenaeus vannamei[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2010, 49(6): 78-82, 88. |
| [10] |
向赟, 王刚, 龚永, 等. 氨氮质量浓度对感染白斑综合征病毒的凡纳滨对虾的影响[J]. 热带生物学报, 2014, 5(3): 220-227. XIANG Y, WANG G, GONG Y, et al. Effects of ammonia nitrogen concentrations on Litopenaeus vannamei infected with white spot syndrome virus[J]. Journal of Tropical Biology, 2014, 5(3): 220-227. |
| [11] |
刘永定, 范晓, 胡征宇. 中国藻类学研究[M]. 武汉: 武汉出版社, 2001: 245. LIU Y D, FAN X, HU Z Y. Chinese algal research[M]. Wuhan: Wuhan Press, 2001: 245. |
| [12] |
ZHANG Q L, LIU Q, LIU S, et al. A new nodavirus is associated with covert mortality disease of shrimp[J]. Journal of General Virology, 2014, 95(12): 2700-2709. DOI:10.1099/vir.0.070078-0 |
| [13] |
QIU L, CHEN M M, WAN X Y, et al. Characterization of a new member of Iridoviridae, Shrimp hemocyte iridescent virus (SHIV), found in white leg shrimp(Litopenaeus vannamei)[J]. Scientific Reports, 2017, 7(1): 11834. DOI:10.1038/s41598-017-10738-8 |
| [14] |
朱国萍, 曹文红, 章超桦, 等. 虾类微量元素含量的主成分分析[J]. 广东海洋大学学报, 2010, 30(1): 72-75. ZHU G P, CAO W H, ZHANG C H, et al. Principal component analysis on trace elements of shrimp[J]. Journal of Guangdong Ocean University, 2010, 30(1): 72-75. |
| [15] |
周欣, 张琳, 毛婵, 等. 基于化学计量学方法结合正交偏最小二乘判别分析的陈皮饮片HPLC指纹图谱研究[J]. 中草药, 2019, 50(9): 2194-2200. ZHOU X, ZHANG L, MAO C, et al. HPLC fingerprints research on decoction pieces of CitriReticulatae pericarpium based on chemometrics methods combined with orthogonal partial least square discriminate analysis[J]. Chinese Traditional and Herbal Drugs, 2019, 50(9): 2194-2200. |
| [16] |
梁森汉, 郑重, 邓国成, 等. 罗氏沼虾肌肉白浊病的防治研究[J]. 淡水渔业, 2001, 31(5): 34-36. LIANG S H, ZHENG C, DENG G C, et al. Control of cloudy muscle disease of Macrobrachium rosenbergii[J]. Freshwater Fisheries, 2001, 31(5): 34-36. |
| [17] |
邢华. 南美白对虾"死底症"(偷死病)的控制措施探讨[J]. 中国水产, 2004(4): 88-89. XING H. Discussion on the control measures of "Death Bottom Syndrome" (Stealing Death Disease) of Penaeus vannamei[J]. China Fisheries, 2004(4): 88-89. |
| [18] |
吴岗, 周启良, 郭秀玲, 等. 聚维酮碘对凡纳滨对虾偷死综合征的防治研究[J]. 水产养殖, 2016, 37(10): 23-28. WU G, ZHOU Q L, GUO X L, et al. The prevention of povidone iodine to Litopenaeus vannamei AHNS[J]. Journal of Aquaculture, 2016, 37(10): 23-28. |
| [19] |
李贵生, 何建国, 李桂峰, 等. 斑节对虾杆状病毒感染度与水体理化因子关系模型的修订[J]. 中山大学学报(自然科学版), 2001, 40(6): 67-71. LI G S, HE J G, LI G F, et al. Emendation on the model of relationships between Penaeus monodon baculo virus infection and physical and chemical elements ofprawn-farming pond water[J]. Acta Scientiarum Natrualium University Sunyatseni, 2001, 40(6): 67-71. |
| [20] |
何建国, 莫福. 对虾白斑综合征病毒暴发流行与传播途径、气候和水体理化因子的关系及其控制措施[J]. 中国水产, 1999(7): 34-37, 41. HE J G, MO F. The relationship between the outbreak of shrimp white spot syndrome virus and its transmission route, climate and physical and chemical factors of water and its control measures[J]. China Fisheries, 1999(7): 34-37, 41. |
| [21] |
葛红星.两种主要无机氮胁迫下凡纳滨对虾免疫因子变化及其对副溶血弧菌易感性的研究[D].上海: 上海海洋大学, 2014. GE H X. Effects of two main inorganic nitrogen on the immune response of Litopenaeus vannamei and its susceptibility to Vibrio parahemolyticus[D]. Shanghai: Shanghai Ocean University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10264-1014051793.htm |
| [22] |
LIU C H, CHEN J C. Effect of ammonia on the immune response of white shrimp Litopenaeus vannamei and its susceptibility to Vibrio alginolyticus[J]. Fish & Shellfish Immunology, 2004, 16(3): 321-334. |
| [23] |
GUNALAN B, SOUNDARAPANDIAN P, DINAKARAN G K. The effect of temperature and pH on WSSV infection in cultured marine shrimp Penaeus monodon (Fabricius)[J]. Middle-East Journal of Scientific Research, 2010, 5(1): 28-33. |
| [24] |
DU H H, LI W F, XU Z R, et al. Effect of hyperthermia on the replication of white spot syndrome virus (WSSV) in Proca mbarusclarkii[J]. Diseases of Aquatic organisms, 2006, 71(2): 175-178. |
| [25] |
吴晓果, 熊海涛, 杜华华. 高温抑制对虾白斑综合征的机理研究进展[J]. 水产科学, 2012, 31(9): 568-572. WU X G, XIONG H T, DU H H. Advances on possible mechanism of hyperthermia inhibition of white spot syndrome in shrimp[J]. Fisheries Science, 2012, 31(9): 568-572. |
| [26] |
QIU L, CHEN M M, WANG R Y, et al. Complete genome sequence of shrimp hemocyte iridescent virus(SHIV) isolated from white leg shrimp, Litopenaeus vannamei[J]. Archives of Virology, 2018, 163(3): 781-785. DOI:10.1007/s00705-017-3642-4 |
| [27] |
邱亮.养殖对虾的病毒宏基因组分析及虾血细胞虹彩病毒(Shrimp hemocyte iridescent virus, SHIV)的分子流行病学研究[D].上海: 上海海洋大学, 2018. QIU L. Viral metagenomics analysis of farmed shrimp and molecular epidemiological study of shrimp hemocyte iridescent virus (SHIV)[D]. Shanghai: Shanghai Ocean University, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10264-1018848677.htm |
| [28] |
李侃, 罗淑娅, 徐丽美. 温度影响对虾白斑综合征病毒增殖机制的研究[J]. 应用海洋学学报, 2013, 32(1): 61-66. LI K, LUO S Y, XU L M. A study on the mechanism of temperature impact on the proliferation of white spot syndrome virus (WSSV)[J]. Journal of Applied Oceanography, 2013, 32(1): 61-66. |
| [29] |
DU H H, DAI W, HAN X Y, et al. Effect of low water temperature on viral replication of white spot syndrome virus in Proca mbarusclarkii[J]. Aquaculture, 2008, 277(3/4): 149-151. DOI:10.1016/j.aquaculture.2008.03.003 |
| [30] |
张韦, 吴会民, 蔡超, 等. 主养凡纳滨对虾池塘水体理化因子及浮游生物变化特征[J]. 经济动物学报, 2019, 23(1): 29-35, 43. ZHANG W, WU H M, CAI C, et al. The physical-chemical factors and plankton properties of water in Litopenaeus vannamei dominated pond[J]. Journal of Economic Animal, 2019, 23(1): 29-35, 43. |
| [31] |
段妍, 张秀梅, 张志新. 溶解氧对凡纳滨对虾生长及消化酶活性的影响[J]. 中国海洋大学学报, 2013, 43(2): 8-14. DUAN Y, ZHANG X M, ZHANG Z X. The Effect of dissolve oxygen concentration on the growth and digestive enzyme activity of whiteleg shrimp Litopenaeus vannamei[J]. Periodical of Ocean University of China, 2013, 43(2): 8-14. |
| [32] |
宋泰, 黄艇, 张晨捷, 等. 养殖水体中二种溶解态铜对凡纳滨对虾生长和免疫功能的影响[J]. 上海海洋大学学报, 2019, 28(1): 75-83. SONG T, HUANG T, ZHANG C J, et al. Effects of two kinds of dissolved copper on growth and immune function of Litopenaeus vannamei[J]. Journal of Shanghai Ocean University, 2019, 28(1): 75-83. |
| [33] |
尹伦甫, 黄华伟. 水产动物的应激反应及抗应激新产品研发[J]. 科学养鱼, 2009(6): 76. YIN L F, HUANG H W. Stress response of aquatic animals and development of new anti-stress products[J]. Scientific Fish Farming, 2009(6): 76. |
| [34] |
张水波. 对虾游塘、应激的原因及对策[J]. 渔业致富指南, 2016(15): 47-50. ZHANG S B. Causes and countermeasures of prawn wandering and stress response[J]. Fishery Guide to be Rich, 2016(15): 47-50. |
2. Shanghai Aquaculture Engineering Technology Research Center, Shanghai 201306, China;
3. College of Fisheries and Life, Shanghai Ocean University, Shanghai 201306, China;
4. East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shanghai 200090, China;
5. Shanghai Fishery Technology Promotion Station, Fengxian District, Shanghai 201419, China;
6. Shanghai Siyang Aquaculture Cooperative, Shanghai 201400, China
 2020,
Vol. 29
2020,
Vol. 29


