2. 上海海洋大学 海洋科学研究院, 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
上海市金山城市沙滩Ⅰ期为一大型的封闭式围隔海区,是在原有的海堤外建设一个全长3.16 km的新海堤,形成面积约为1.72 km2的人工潟湖[1]。该人工潟湖位于杭州湾北岸,其水质条件直接受杭州湾影响。中国海洋环境质量公报显示,杭州湾是一个典型的喇叭形强潮河口湾,因人口集聚,工、农业发达,受内陆污染和城市污染的影响,杭州湾长期处于富营养化状态[2],有害水华时有发生[3],赤潮暴发严重。该人工潟湖有从杭州湾进排水现象,从而使得水体浑浊,加上水体自身扩散交换能力不佳,富营养化严重,可引发赤潮,不利于水环境的健康发展。金山城市沙滩作为杭州湾典型的人工潟湖和旅游开发区,对水体的生态平衡要求很高,因此,近年来在该水域进行了挂养滤食性贝类等生态修复措施。本研究旨在以评价该水域生态系统健康状况,分析该水域生态系统健康风险为基础,客观判断生态修复手段的有效性,为今后制订更高效、适用的生态修复技术手段提供参考。
浮游植物是河口区域和近海生态系统的主要初级生产者,是水体食物链的最基本环节,在水体生态网络系统中占有重要地位[4]。浮游植物个体小,生活周期短而易受环境变化的影响,可在短时间内对环境变化做出反应,其随营养水平、盐度等环境条件的不同,在形态、结构和种群组成上存在较大差异[5]。比如,在水体营养、水温和光照条件等环境条件适宜时,浮游植物能迅速繁殖,形成藻类水华,威胁水域生态系统健康[6-7]。因此,浮游植物的群落结构能较好地反映水体环境状况,也是评价水质和水体健康的重要手段[8]。迄今为止,我国研究者在杭州湾开展了大量的浮游植物群落结构研究工作[9-11]。这些研究都探讨了杭州湾浮游植物群落结构及与环境因子关系。近年来,随着沿海旅游及其他产业的不断开发,杭州湾区域出现了多处人工围隔形成的人工潟湖,由于这些海域与外界水体交换较少,且施工过程中对水体生态系统也产生了较严重的破坏,因此,了解类似海域中生态系统结构及健康状况,从而更好地服务于生产及生活所需,变成了重中之重。本研究在金山城市沙滩进行生态修复工程过程中,对其浮游植物群落结构的年际变化及水体环境进行了跟踪调查,以期为类似海域生态修复工程提供参考。
1 材料与方法 1.1 研究区域研究区域设置在上海市金山区境内,位于东海杭州湾北部(121°34′E和30°70′N),靠近长江入海口。研究区域用堤坝围成了人工潟湖,水域面积1.75 km2,平均水深5 m,堤坝长4.05 km,从东到西设置5个样品采集点(图 1)。2016—2018年夏季(7、8、9月)对该人工潟湖5个点表层水体的浮游植物和环境因子进行样品采集与测定。

|
图 1 杭州湾研究区域及采样站位 Fig. 1 Study area of Hangzhou Bay and sampling sites |
在水面0.5 m处采集水样1 L,立即加入15 mL的鲁哥氏碘液(Lugol’siodine)固定,静置48 h之后利用虹吸法浓缩至50 mL,加入4%甲醛永久保存。取样品0.1 mL,使用浮游植物计数框在10×40倍的显微镜(OLYMPUS,CX21)下进行种类鉴定和计数[12]。
1.3 水样的采集与分析所有操作均按《海洋调查规范》(GB /T127639—2007)进行。采集表层(0.5 m)水样,水温用温度计现场测定,pH用酸度计测定,盐度用盐度计测定,水样经0.45 μm滤膜过滤后,用水质流动分析仪(Skalar)测定营养盐(NO3--N、NO2--N、NH4+-N、DIP、DIN、N/P、SiO32--Si、TN、TP),化学需氧量(COD)用碱性高锰酸钾法测定,测定的DIN浓度为NH4+-N、NO3--N和NO2--N值之和,N/P为总氮与总磷比值。
1.4 数据分析浮游生物的物种多样性指数的计算采用Shannon-Wiener指数(H′)[13]表示,计算公式为
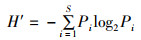 (1)
(1)
式中:H′为种类多样性指数;S为某样品中的种类总数;Pi为第i种个体总数与总个体数的比值。
优势种(Y)[14]的计算公式为
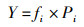 (2)
(2)
式中:Y为优势度;fi为第i种个体在采样点中出现的频率;Pi为第i种个体总数与总个体数的比值,当Y>0.02时,即为优势种。
Pielou均匀度指数(J′)[15]计算公式为
 (3)
(3)
式中:H′为物种多样性指数;S为样品中的种类总数。
数据用Excel进行预处理,采用Origin 8.0分析处理数据作图,理化数据用SPSS 17.0进行one-way ANOVA分析,显著水平为P < 0.05。分析浮游植物与环境因子关系时,先进行弓形效应和去趋势对应分析(DCA),结果显示,第一轴的梯度长度为2.254,4个轴长度均小于3,因此选择RDA分析浮游植物与环境因子的关系。DCA和RDA使用R 3.6.1完成,由程序包vegan实现[16]。
2 结果 2.1 水环境因子研究期间,不同年份夏季水环境变量存在显著差异,结果见表 1。根据《海水水质标准》,人工潟湖内水质基本保持在一类到二类海水水平,7、8、9月,水温有下降趋势,3年间夏季水温相差不大。水体盐度基本保持在8~10之间,2017年盐度相对较小。总氮浓度在3年中不断增加,2016年夏季,氮磷比相对较小,2017年夏季,无机氮的含量相对较低,硅酸盐在2017年7月和2018年9月浓度较高。同其他时间相比,2018年8月,营养盐浓度较高。此外,2018年8月,台风经过该研究区域,且出现天文大潮。

|
表 1 2016—2018年环境因子时空变化 Tab.1 Changes of environmental factors from 2016 to 2018 |
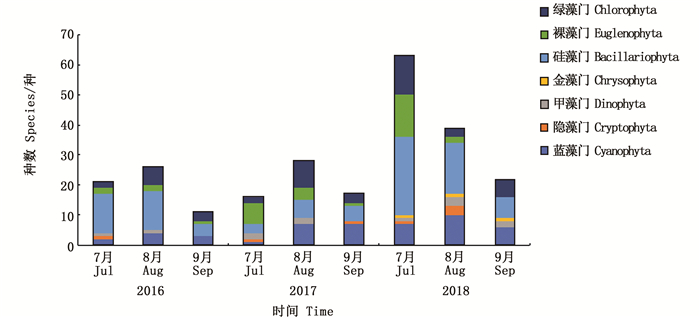
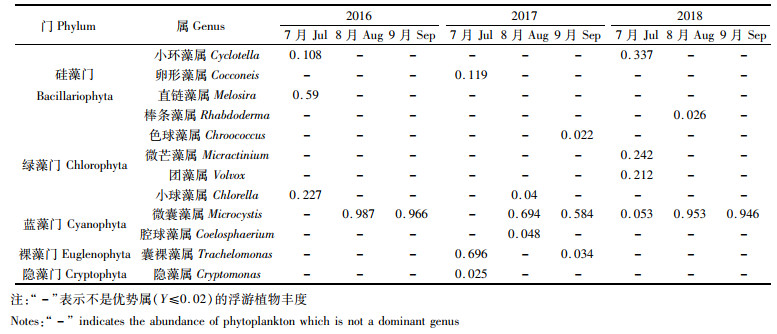
2016年夏季, 该潟湖共鉴定出浮游植物6个门38个种。其中以硅藻门(Bacillariophyta)最多,有19种,所占比例高达50%,其次是蓝藻门(Cyanophyta)8种(21%)、绿藻门(Chlorophyta)7种(18%)、裸藻门(Euglenophyta)2种(5%)、甲藻门(Dinophyta)1种(3%)和隐藻门(Cryptophyta)1种(3%)。2017年共发现6门55种,硅藻门14种(25%),绿藻门13种(24%),蓝藻门12种(22%),裸藻门11种(20%),甲藻门3种(5%),隐藻门2种(4%)。2018年共鉴定浮游植物7门96种,硅藻门37种(38%)、绿藻门20种(21%)、蓝藻门16种(17%)、裸藻门15种(16%)、甲藻门3种(3%)、隐藻门3种(3%)和金藻门2种(2%)。2016—2018年,该人工潟湖的浮游植物种类逐年增加,种类增加的门主要为硅藻门、绿藻门、裸藻门和蓝藻门,其中硅藻门种类为主要优势种。此外,与2016年和2017年相比,2018年出现金藻门(Chrysophyta)。
2.2.2 浮游植物优势种(属级)2016—2018年浮游植物优势种优势度结果见表 2(Y>0.02)。2016年有4个优势属,分别为小环藻属(Cyclotella),直链藻属(Melosira),小球藻属(Chlorella)和微囊藻属(Microcystis)。2017年有7个优势属,分别为卵形藻属(Cocconeis)、色球藻属(Chroococcus)、小球藻属、微囊藻属、腔球藻属(Coelosphaerium)、囊裸藻属(Trachelomonas)和隐藻属(Cryptomonas)。2018年优势种有5个属,分别为小环藻属、棒条藻属(Rhabdoderma)、微芒藻属、团球藻属(Volvox)和微囊藻属(Microcystis)。微囊藻属连续3年为优势属,特别是2016年8月和2018年9月,优势度最大(Y=0.946~0.987)。除微囊藻外,2016—2018年浮游植物优势属重和度不高。
|
图 2 浮游植物种类的年际变化 Fig. 2 Interannual variation of phytoplankton species |

|
表 2 2016—2018年浮游植物优势属优势度 Tab.2 Dominance of phytoplankton dominant genera 2016-2018 |
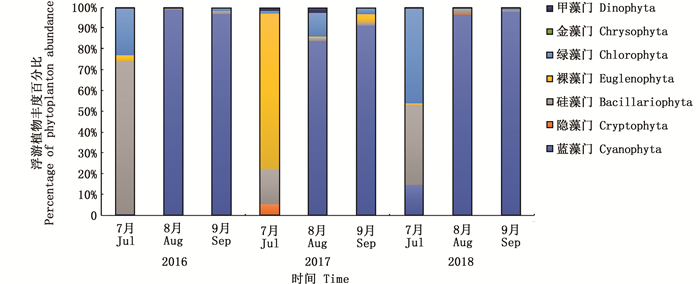
如表 3所示,2016年夏季浮游植物丰度为50.78× 104~5 957.52× 104个/L,平均值为2 230.33×104个/L;2017年为5.35×104~25.67×104个/L,平均值为12.88×104个/L;2018年为474.87×104~1 026.94×104个/L,平均值为659.61×104个/L。2016—2018年浮游植物最大丰度均出现在8月,2017年浮游植物丰度小于2016年和2018年。不同年份和不同月份之间浮游植物的丰度均达到极显著水平(P < 0.01)。不同月份和年份的浮游植物丰度比例如图 3所示,3年中,每年8月和9月蓝藻丰度最大,2016年和2018年7月硅藻丰度最大,而2017年7月,裸藻丰度最大。总体来看,从2016年到2018年,整个夏季蓝藻(特别是微囊藻)的丰度最大,分别占97.88%、68.18%和77.23%(表 4)。

|
表 3 不同月份和年份浮游植物丰度变化(×104个/L) Tab.3 Changes of phytoplankton abundance in different months and years(× 104 cells/L) |
|
图 3 不同月份和年份浮游植物丰度的比例 Fig. 3 Proportion of phytoplankton abundance in different months and years |
|
表 4 浮游植物优势种丰度(× 104个/L) Tab.4 Abundance of phytoplankton dominant species(×104 cells/L) |
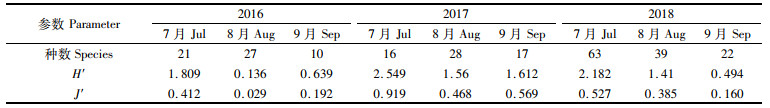
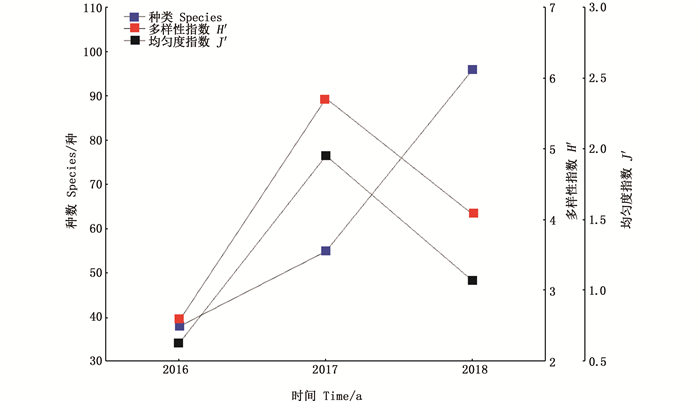
如表 5所示,2016—2018年浮游植物的H′分别为0.136~1.809、1.56~2.549和0.494~2.182;2016—2018年浮游植物的J′分别为0.029~0.412、0.468~0.919和0.16 ~ 0.569。H′和J′的最大值出现在每年的7月,之后在8月和9月大幅下降。图 4可知,H′和J′均在2017年有最大值,到2018年下降,但均高于2016年,3年中H′和J′总体呈上升趋势。
|
表 5 浮游植物的种类数、多样性指数H′和均匀度指数J′ Tab.5 The variety of phytoplankton species number, H′ and J′ |
|
图 4 2016—2018年夏季浮游植物种数、多样性指数H′和均匀度指数J′变化 Fig. 4 Changes of phytoplankton species, H′ and J′ in summer, 2016-2018 |
物种与环境因子的关系如图 5所示。当温度低于30 ℃时,硅藻种类数减少;除2018年外,绿藻种类数随温度的降低先减少后增加,其他年份先增加后减少;蓝藻种类数随温度降低先增加后减少,但在25 ℃ < T < 31 ℃时变化较小;此外,浮游植物种类变化与盐度变化之间没有明显的规律。浮游植物的种类变化与营养盐的关系较为复杂,但总体趋势是随着营养盐的减少而减少。

|
图 5 种类与温度(T)、盐度(S)、氮磷比(N/P)关系 Fig. 5 The relationship of species numbers and temperature, salinity and N/P |
总体来说,浮游植物丰度随温度的降低呈现先增加后减少的趋势;2016年和2018年浮游植物丰度与盐度变化趋势相同,但2017年变化相反(图 6)。研究期间,与2016年和2018年相比,2017年N/P偏大,浮游植物丰度偏小,特别是2017年9月,N/P显著高于其他月份,但此时浮游植物丰度最小。

|
图 6 丰度与温度(T)、盐度(S)、氮磷比(N/P)关系 Fig. 6 The relationship of abundance with temperature, saliniity and N/P |
选择浮游植物优势属,对表 1中12个环境因子进行RDA分析筛选。通过前项选择和蒙特卡洛置换检验,选择相关性高的因子进行冗余分析。选择方差膨胀因子(VIF)小于10的影响因子TN、TP、NH4-N、NO2-N、DIP和SiO3-Si,对入选的13种优势属藻类密度及6项环境因子进行RDA分析,得到RDA1和RDA2的解释度分别为21.58%和45.57%,如图 7所示。

|
a.微囊藻Microcystis;b.腔球藻Coelosphaerium;c.色球藻Chroococcus;d.小环藻Cyclotella;e.卵形藻Cocconeis;f.直链藻Melosira;g.囊裸藻Trachelomonas;h.微芒藻Micractinium;I.团藻Volvox;j.小球藻Chlorella;k.隐藻Cryptophyta;l.棒条藻Rhabdoderma;16-Jul,16-Aug,16-Sep代表2016年7月、8月、9月;17-Jul,17-Aug,17-Sep,代表2017年7月、8月、9月;18-Jul,18-Aug,18-Sep代表2018年7月、8月、9月 图 7 浮游植物与环境因子的冗余分析 Fig. 7 Biplot of RDA of phytoplankton and environmental factors |
从RDA图中可以看出,2016年7月的氨态氮和无机磷的影响较大,此时的优势种为小环藻、直链藻和小球藻。2017年7月硅酸盐含量较高,对囊裸藻、卵形藻、隐藻影响较大。2018年7月,氨态氮和无机磷含量升高,产生的影响较大,优势种主要为小环藻、微芒藻、团球藻。研究期间,每年的8月和9月,亚硝酸盐的影响程度高,与优势藻种微囊藻、色球藻和腔球藻相关性大。但在不同年份,8月亚硝酸盐的影响程度稍有不同,其中,2017年8月亚硝酸盐影响程度最大。此外,2017年9月,水体的营养盐相对都比较平均,氨态氮对浮游植物群落影响小,亚硝酸盐的影响较大,此时的优势种是腔球藻、色球藻,还有少量的微囊藻。
3 讨论 3.1 浮游植物的群落结构特征在本次调查中,共发现浮游植物109种,比刘巧等[17]在2017年对相同水域调查所得的103种有所增加。本研究中,2016—2018年夏季浮游植物多样性不断增加,说明金山潟湖的生态系统结构更加复杂,生态系统逐渐健康发展[18]。研究期间,夏季的浮游植物群落结构组成门类与杭州湾相似,主要以硅藻门,蓝藻门和绿藻门为主,其中硅藻门在种类上占绝对优势[19-20]。调查发现,2018年,出现金藻门浮游植物,其种类主要为鱼鳞藻。金藻门的出现,可能是因为该潟湖水体透明度好,浊度小,水质清澈。有研究发现,鱼鳞藻对水环境因子有着特殊的要求,大部分种类生活在水质清澈、低电导率、低pH以及没有人为干扰的原始天然水环境当中[21],对水体环境具有重要的指示作用,鱼鳞藻的出现,表明金山人工潟湖生态环境逐步好转。
近年来,许多专家研究发现,杭州湾常见浮游植物优势种是中肋骨条藻(Skeletonema costatum)、琼氏圆筛藻(Coscinodiscus jonesianus)[3, 22]。而在本研究中,浮游植物优势种主要是淡水类群和近岸低盐类群,这可能是由于人工潟湖盐度较低,相对于高盐藻类群,浮游植物与淡水类群更相近。调查发现,微囊藻属连续3年为夏季第一优势种,这与WANG等[23]和胡智东[24]的研究结果相似。研究期间,较2016年,2017和2018年的优势种藻类更加多样化,这可能是由于水体营养盐得到控制,水质得到改善。有研究表明,浑浊度会影响浮游植物的光合作用,水动力状况可调节水体营养盐浓度,这均能改变浮游植物群落结构及生物量[25-26]。
每种浮游植物都有生存的最佳环境,当环境因素改变时,浮游植物的种类也会发生相应的变化。有研究表明,浮游植物的多样性指数与生态系统的健康呈正比[27-28]。本次调查结果显示,2016—2018夏季,调查区浮游植物种类数不断增加,H′呈现先增加后减少的趋势,但总趋势是上升的。第一优势种微囊藻的Y值先减少后升高,总体趋势是减少的。这种群落结构的变化说明,2017年,该潟湖浮游植物群落组成最稳定,生态系统较为平衡,但在2018年生态风险较大,可能是由于台风和天文大潮,导致大量外海海水进入,对研究区的营养盐结构产生了巨大影响,使得微囊藻大量繁殖生长[29]。总体来说,该潟湖浮游植物群落组成比较稳定,生物多样性有上升趋势,单优藻类(微囊藻)优势度稍有下降,由此推测2016—2018年夏季金山人工潟湖生态风险有减小趋势。
3.2 微囊藻的丰度变化在本研究中,夏季蓝藻生长迅速,丰度最大,其中微囊藻的数量占最大优势,这可能是因为夏季温度高,蓝藻更适宜生长在温暖的水体中[30]。研究发现,微囊藻会产生毒素,使其不易被浮游动物摄取[31]。因此,浮游动物选择性地以其他浮游植物为食,从而导致其他物种相对于微囊藻的丰度减少。
微囊藻是一种赤潮藻,在夏季,富营养化的水体中更易爆发水华或赤潮。不少研究表明,当海水温度、营养盐和光照强度等环境条件适合微囊藻生长时,7月微囊藻从中层或下层浮出水面,大量繁殖,8月和9月丰度最大,成为主要优势种[32-33]。这与本实验微囊藻夏季丰度变化相吻合。历史研究发现,温度较高时,微囊藻在吸收营养盐方面显示出明显的竞争优势[30, 34]。一般水体营养盐高,微囊藻生长迅速,其中对磷的吸收率最高,与磷的结合能力强于其他藻类,在磷限制的环境下,藻的生长率会大大降低[35]。但有研究[36]发现当水体总氮和总磷浓度分别超过0.5 mg/L和0.02 mg/L,就可能出现水华,许慧萍等[37]的研究也证明了这一点,当外界环境中氮和磷浓度相对较低时,反而有利于水华微囊藻群体生长,而过高的氮和磷浓度则会抑制微囊藻的生长。本研究中,2016年微囊藻丰度最大,研究区域水体浑浊,水体氮和磷的浓度相对较低,促进了微囊藻生长,丰度变大。2017年,水体营养盐得到控制,总磷减小,总氮浓度增加,氮磷比增加,微囊藻生长受到营养盐限制,生长速率低[38],这与KIM等[39]的研究一致,在高浓度氮情况下,低氮磷比更有利于水体中蓝藻的生长。此外,微囊藻丰度可能与硅酸盐的浓度和水体透明度有关,蓝藻能适应低光强,在低光强下竞争力较突出[40]。2018年,微囊藻丰度升高,可能与无机氮的升高有关,无机氮会促进微囊藻生长[33]。同时,也可能受台风的影响,水体营养盐及其他环境因子发生变化,比较适合微囊藻繁殖生长。但从总体来看,3年中,微囊藻的丰度呈下降趋势,水体生态系统向健康方向发展。
3.3 浮游植物群落结构与环境因子的关系浮游植物群落结构易受环境因子的影响,并且不同的环境因子对浮游植物群落结构的影响存在差异。RDA的分析结果表明,亚硝酸盐和硅酸盐是影响浮游植物群落结构的主要因素。
3.3.1 硅酸盐对浮游植物群落结构的影响有研究表明,硅元素是浮游植物的必要生长因素之一,硅酸盐与浮游植物初级生产力特征、动态循环及趋势具有明显的相关性[41]。其中,硅元素主要对硅藻产生影响,它是硅藻合成其硅壳所必需的成分[42]。在本研究中,硅酸盐与硅藻呈正相关,硅酸盐浓度高,促进直链藻、小环藻、卵形藻生长,特别是7月份,硅酸盐含量较高,硅藻丰度最大,成为优势种。此外,调查发现,该潟湖的硅酸盐与微囊藻丰度明显呈负相关,硅酸盐浓度高不利于微囊藻生长,这与TANG等[33]的研究结果一致。这种现象可能是因为硅藻大量繁殖,竞争力较强,使得微囊藻生长受营养盐等环境因子及生存空间的限制,生长缓慢。此外,有研究表明,硅藻死亡后,可以形成硅藻土,可以吸附水体中的微囊藻毒素,并可作为助凝剂,帮助混凝剂铁盐、铝盐等阳离子型聚电解质,可与微囊藻细胞发生吸附电中和或者沉淀,从而过滤去除水体中微囊藻[43-44]。本次调查结果显示,3年来,硅酸盐浓度不断升高,硅藻种类和丰度增多,减小了因浮游植物单一化而爆发微囊藻赤潮的风险。
3.3.2 亚硝酸盐对浮游植物群落结构的影响亚硝酸盐在植物的生命过程中扮演着极为重要的角色,它是植物利用硝酸盐的中间产物,一些研究发现亚硝酸盐作为氮源的一种,在一定的浓度范围内可以为植物生长提供所需的氮[45]。本研究中,每年8月、9月亚硝酸盐对浮游植物影响较大,其中微囊藻同亚硝酸盐呈正相关,且相关性较大,比其他藻类更有竞争力。这与陈卫民等[46]研究的微囊藻在亚硝酸盐低浓度范围下竞争力较大的结果相一致。此外,微囊藻大量繁殖,使得水体浊度增大,溶氧减少[47],从而使得其他藻类光合作用减弱,抑制生长。同时,水体溶氧少,氨氮未能完全转化为硝酸盐,使得亚硝酸盐浓度升高。因此,在本研究中,隐藻、卵形藻和囊裸藻等大部分藻类与亚硝酸盐呈负相关。
3.3.3 无机磷和氨氮对浮游植物群落结构的影响水体中无机磷和无机氮对浮游植物生长尤为重要,浮游植物对各种形态无机氮的吸收以氨态氮为优先[48]。此次研究发现,无机磷和氨氮与小环藻、直链藻、微芒藻、小球藻呈正相关,且相关性较大,特别是在2016年7月和2018年7月,无机磷和氨氮影响显著。这种现象可能是因为在7月份,微囊藻还处于恢复期,在水体中处于上升状态,生长较慢[33],当水体中无机磷和氨氮较高时,小环藻、直链藻、微芒藻、小球藻等硅藻和绿藻快速吸收营养盐,大量繁殖,成为优势种[49]。8月和9月微囊藻大量繁殖,使得无机磷和氨氮浓度下降,与之呈负相关。这与刘巧等[17]发现的微囊藻与无机磷呈正相关的研究结果不同,可能是因为其他因素作用,使水体的营养盐结构及物理结构发生变化,使得无机磷不是微囊藻生长的限制因子。
由RDA结果可知,环境因子对浮游藻类的分布解释度达到67.15%,说明除温度、盐度和营养盐外,还有其他因素影响。比如水文和生物等因素,也会影响浮游植物的组成和丰度。2018年夏季,出现台风和天文大潮,导致研究区的营养盐结构发生巨大变化,微囊藻生长迅速。同年,在金山人工潟湖利用贝类对水体进行生态修复,对浮游植物群落进行调节,使得该潟湖生态风险降低,浮游植物群落向正向演替发展。
综上所述,2016—2018年夏季,在水体生态修复过程中,金山人工潟湖第一优势种微囊藻丰度下降,浮游植物优势种逐渐多元化,水体藻类种数增多,物种多样性和均匀度不断提高,这都说明潟湖的浮游植物群落结构不断完善,水体生态系统逐渐稳定,生态风险减小。为了提高金山城市沙滩的生态效益和经济效益,可继续采用贝类进行生态修复,并不断对其水质及浮游植物群落进行检测监督,保证潟湖水体生态系统健康发展。同时,这也为其他类似海域的生态修复工程提供了可靠依据。
| [1] |
叶维钧, 陈亚瞿. 上海金山城市沙滩人工潟湖水体生态修复及效果评价[J]. 水产科学, 2014, 33(12): 794-799. YE W J, CHEN Y Q. Ecological restoration and effective assessment of an artificial lagoon in City Beach of Jinshan District in Shanghai[J]. Fisheries Science, 2014, 33(12): 794-799. |
| [2] |
高生泉, 陈建芳, 金海燕, 等. 杭州湾及邻近水域营养盐的时空分布与富营养化特征[J]. 海洋学研究, 2011, 29(3): 36-47. GAO S Q, CHEN J F, JIN H Y, et al. Characteristics of nutrients and eutrophication in the Hangzhou Bay and its adjacent waters[J]. Journal of Marine Sciences, 2011, 29(3): 36-47. |
| [3] |
章守宇, 郡君波, 戴小杰. 杭州湾富营养化及浮游植物多样性问题的探讨[J]. 水产学报, 2001, 25(6): 512-517. ZHANG S Y, JUN J B, DAI X J. Studies on eutrophication and phytoplankton diversity in Hangzhou Bay[J]. Journal of Fisheries of China, 2001, 25(6): 512-517. |
| [4] |
张真, 胡忠军, 史先鹤, 等. 千岛湖浮游植物群落结构及功能群的划分[J]. 上海海洋大学学报, 2019, 28(1): 37-48. ZHANG Z, HU Z J, SHI X H, et al. Community structures and functional groups of phytoplankton in Qiandao Lake[J]. Journal of Shanghai Ocean University, 2019, 28(1): 37-48. |
| [5] |
PROKOPKIN I G, MOOIJ W M, JANSE J H, et al. A general one-dimensional vertical ecosystem model of Lake Shira (Russia, Khakasia):Description, parametrization and analysis[J]. Aquatic Ecology, 2010, 44(3): 585-618. |
| [6] |
张艳会, 李伟峰, 陈求稳. 太湖水华程度及其生态环境因子的时空分布特征[J]. 生态学报, 2016, 36(14): 4337-4345. ZHANG Y H, LI W F, CHEN Q W. Spatial-temporal variance of the intensity of algal bloom and related environmental and ecological factors in Lake Taihu[J]. Acta Ecologica Sinica, 2016, 36(14): 4337-4345. |
| [7] |
赵巧华, 孙国栋, 王健健, 等. 水温、光能对春季太湖藻类生长的耦合影响[J]. 湖泊科学, 2018, 30(2): 385-393. ZHAO Q H, SUN G D, WANG J J, et al. Coupling effect of water temperature and light energy on the algal growth in Lake Taihu[J]. Journal of Lake Sciences, 2018, 30(2): 385-393. |
| [8] |
张家路, 王银平, 蔺丹清, 等. 安庆新洲水域浮游植物群落结构特征[J]. 上海海洋大学学报, 2019, 28(5): 680-688. ZHANG J L, WANG Y P, LIN D Q, et al. Characteristics of community structure of phytoplankton of Xinzhou waters in Anqing[J]. Journal of Shanghai Ocean University, 2019, 28(5): 680-688. |
| [9] |
张晋芳, 沈芳, 余小龙, 等. 杭州湾邻近海域浮游植物吸收特性的冬、夏季变化特征[J]. 地理与地理信息科学, 2013, 29(5): 112-118. ZHANG J F, SHEN F, YU X L, et al. Variations of phytoplankton absorption properties in winter and summer in Hangzhou Bay adjacent coastal ocean[J]. Geography and Geo-Information Science, 2013, 29(5): 112-118. |
| [10] |
周燕, 赵聪蛟, 高元森, 等. 2005-2008年杭州湾生态监控区浮游植物分布特征及变化趋势[J]. 海洋学研究, 2010, 28(2): 28-35. ZHOU Y, ZHAO C J, GAO Y S, et al. Variation and distribution characteristics of phytoplankton in ecology-monitoring area of Hangzhouwan Bay from 2005 to 2008[J]. Journal of Marine Sciences, 2010, 28(2): 28-35. |
| [11] |
蔡燕红, 张海波. 杭州湾生态监控区浮游植物多样性研究[J]. 浙江海洋学院学报(自然科学版), 2006, 25(3): 327-330. CAI Y H, ZHANG H B. Diversity of marine phytoplankton in ecology-monitoring area of Hangzhou Bay[J]. Journal of Zhejiang Ocean University(Natural Science), 2006, 25(3): 327-330. |
| [12] |
郭玉洁. 中国海藻志[M]. 北京: 科学出版社, 2003. GUO Y J. Flora algarum marinarum sinicarum[M]. Beijing: Science Press, 2003. |
| [13] |
SHANNON C E, WEAVER W. The mathematical theory of communication[J]. Physics Today, 1950, 3(9): 31. DOI:10.1063/1.3067010 |
| [14] |
孙军, 宋书群, 乐凤凤, 等. 2004年冬季南海北部浮游植物[J]. 海洋学报, 2007, 29(5): 132-145. SUN J, SONG S Q, LE F F, et al. Phytoplankton in northern South China Sea in the winter of 2004[J]. ActaOceanologicaSinica, 2007, 29(5): 132-145. |
| [15] |
PIELOU E C. An introduction to mathematical ecology[M]. New York: Hans Publishers, 1969: 7-12.
|
| [16] |
OKSANEN J, BLANCHET G F, FRIENDLY M, et al. vegan: Ordination methods, diversity analysis and other functions for community and vegetation ecologists. Version 2.5-3[R].Vienna, Austria: R Project for Statistical Computing, 2018.
|
| [17] |
刘巧, 刘萌萌, 杨娜, 等. 杭州湾生物修复区与非修复区浮游植物群落结构比较[J]. 生态学杂志, 2019, 38(2): 412-419. LIU Q, LIU M M, YANG N, et al. Comparative analysis of phytoplankton community structure in bioremediation area and non-remediation area of Hangzhou Bay[J]. Chinese Journal of Ecology, 2019, 38(2): 412-419. |
| [18] |
李广玉, 鲁静, 何拥军. 胶州湾浮游植物多样性及其与环境因子的关系[J]. 海洋地质动态, 2005, 21(4): 10-13. LI G Y, LU J, HE Y J. Relation between diversity of phytoplankton and environmental factors in the JiaozhouBay[J]. Marine Geology Letters, 2005, 21(4): 10-13. |
| [19] |
秦铭俐, 魏永杰, 王晓波, 等. 杭州湾枯水期浮游植物群落结构的研究[J]. 海洋环境科学, 2008, 27(s1): 57-60. QIN M L, WEI Y J, WANG X B, et al. Studies on community structure of phytoplankton in Hangzhou Bay in dry season[J]. Marine Environmental Science, 2008, 27(s1): 57-60. |
| [20] |
林庆莹, 白凯强, 孙彬, 等. 长江口封闭养殖海域水质污染及潜在风险[J]. 上海海洋大学学报, 2019, 28(6): 902-910. LIN Q Y, BAI K Q, SUN B, et al. Water pollution and potential risk in closed aquaculture area of Yangtze River Estuary[J]. Journal of Shanghai Ocean University, 2019, 28(6): 902-910. |
| [21] |
马成学.黑龙江省五个湿地保护区硅质鳞片金藻研究[D].哈尔滨: 东北林业大学, 2013. MA C X. Silica-scaled Chrysophytes in five national wetland reserve of Heilongjiang province[D]. Harbin: Northeast Forestry University, 2013. |
| [22] |
刘守海, 张海景, 项凌云, 等. 杭州湾富营养化水域春季浮游生物生态群落特征研究[J]. 上海海洋大学学报, 2015, 24(2): 265-271. LIU S H, ZHANG H J, XIANG L Y, et al. Study on the plankton ecological community characteristics in eutrophication areas of Hangzhou Bay in spring[J]. Journal of Shanghai Ocean University, 2015, 24(2): 265-271. |
| [23] |
WANG P F, WANG Y X, WANG C, et al. Ecological characteristics and environmental factors of phytoplankton during different seasons and in different parts of Taihu Lake[J]. Fundamental and Applied Limnology/Archivfür Hydrobiologie, 2015, 187(1): 33-42. DOI:10.1127/fal/2015/0724 |
| [24] |
胡智东. 杭州湾南岸开发区域浮游生物研究[J]. 环境科学与技术, 2017, 40(s1): 305-309. HU Z D. Study on the status of plankton in the development zone of the South Bank of Hangzhou Bay[J]. Environmental Science & Technology, 2017, 40(s1): 305-309. |
| [25] |
CLOERN J E. Turbidity as a control on phytoplankton biomass and productivity in estuaries[J]. Continental Shelf Research, 1987, 7(11/12): 1367-1381. |
| [26] |
ÁLVAREZ-BORREGO S. New phytoplankton production as a tool to estimate the vertical component of water exchange between the Gulf of California and the Pacific[J]. Ciencias Marinas, 2012, 38(1A): 89-99. DOI:10.7773/cm.v38i1A.1885 |
| [27] |
况琪军, 马沛明, 胡征宇, 等. 湖泊富营养化的藻类生物学评价与治理研究进展[J]. 安全与环境学报, 2005, 5(2): 87-91. KUANG Q J, MA P M, HU Z Y, et al. Study on the evaluation and treatment of lake eutrophication by means of algae biology[J]. Journal of Safety and Environment, 2005, 5(2): 87-91. |
| [28] |
李仁全, 王明书, 孙敏, 等. 赤城湖指示藻类的组成及物种多样性指数分析[J]. 安徽农业科学, 2009, 37(2): 773-776, 782. LI R Q, WANG M S, SUN M, et al. Analysis of constitution features and species diversity index of indicator algae in ChichengLake[J]. Journal of Anhui Agricultural Sciences, 2009, 37(2): 773-776, 782. |
| [29] |
许慧萍.氮磷营养盐对水华微囊藻群体的影响研究[D].无锡: 江南大学, 2014. XU H P. Study of effect of nitrogen and phosphorous on colony of Microcystis[D]. Wuxi: Jiangnan University, 2014. |
| [30] |
上官欣欣, 薛俊增, 吴惠仙. 长江口浮游植物群落结构的特征[J]. 上海海洋大学学报, 2019, 28(5): 689-698. SHANGGUAN X X, XUE J Z, WU H X. Ecological features of phytoplankton community in the Yangtze RiverEstuary[J]. Journal of Shanghai Ocean University, 2019, 28(5): 689-698. |
| [31] |
BERG K, SKULBERG O M, SKULBERG R, et al. Observations of toxic blue-green algae (Cyanobacteria) in some Scandinavian lakes[J]. Actaveterinaria Scandinavica, 1986, 27(3): 440-452. |
| [32] |
孔繁翔, 曹焕生, 谭啸. 水华蓝藻复苏的研究进展与水华预测[J]. 环境监控与预警, 2010, 2(1): 1-4. KONG F X, CAO H S, TAN X. Development of research on recruitment of bloom-forming cyanobacteria and blooms forecast[J]. Environmental Monitoring and Forewarning, 2010, 2(1): 1-4. |
| [33] |
TANG C Y, SUN B, YU K F. Environmental triggers of a Microcystis (Cyanophyceae) bloom in an artificial lagoon of Hangzhou Bay, China[J]. Marine Pollution Bulletin, 2018, 135: 776-782. DOI:10.1016/j.marpolbul.2018.08.005 |
| [34] |
LÜRLING M, VAN OOSTERHOUT F, FAASSEN E. Eutrophication and warming boost cyanobacterial biomass and microcystins[J]. Toxins, 2017, 9(2): 64. DOI:10.3390/toxins9020064 |
| [35] |
OU M M, WANG Y, CAI W M. Physiological and biochemical changes in Microcystis aeruginosa Qutz. in phosphorus Limitation[J]. Journal of Integrative Plant Biology, 2005, 47(6): 692-702. DOI:10.1111/j.1744-7909.2005.00106.x |
| [36] |
孔繁翔, 宋立荣. 蓝藻水华形成过程及其环境特征研究[M]. 北京: 科学出版社, 2011: 43. KONG F X, SONG L R. Study on the process of cyanobacteria bloom and environmental characteristics[M]. Beijing: Science Press, 2011: 43. |
| [37] |
许慧萍, 杨桂军, 周健, 等. 氮磷浓度对太湖水华微囊藻(Microcystis flos-aquae)群体生长的影响[J]. 湖泊科学, 2014, 26(2): 213-220. XU H P, YANG G J, ZHOU J, et al. Effect of nitrogen and phosphorus concentration on colony growth of Microcystis flos-aquae in Lake Taihu[J]. Journal of Lake Sciences, 2014, 26(2): 213-220. |
| [38] |
许海, 朱广伟, 秦伯强, 等. 氮磷比对水华蓝藻优势形成的影响[J]. 中国环境科学, 2011, 31(10): 1676-1683. XU H, ZHU G W, QIN B Q, et al. Influence of nitrogen-phosphorus ratio on dominance of bloom-forming cyanobacteria (Microcystis aeruginosa)[J]. China Environmental Science, 2011, 31(10): 1676-1683. |
| [39] |
KIM H S, HWANG S J, SHIN J K, et al. Effects of limiting nutrients and N:P ratios on the phytoplankton growth in a shallow hypertrophic reservoir[J]. Hydrobiologia, 2007, 589(1): 317. DOI:10.1007/s10750-007-0727-1 |
| [40] |
SCHEFFER M, RINALDI S, GRAGNANI A, et al. On the dominance of filamentous cyanobacteria in shallow, turbid lakes[J]. Ecology, 1997, 78(1): 272-282. |
| [41] |
YANG D F, ZHANG J, LU J B, et al. Examination of silicate limitation of primary production in Jiaozhou Bay, China[J]. Chinese Journal of Oceanology and Limnology, 2002, 20(3): 208-225. DOI:10.1007/BF02848849 |
| [42] |
REYNOLDS C S. The ecology of freshwater Phytoplankton[M]. Cambridge: Cambridge University Press, 1984.
|
| [43] |
杨宇翔, 陈荣三. 硅藻土的结构特征及其应用[J]. 江苏化工, 1989(3): 11-13, 29. YANG Y X, CHEN R S. Structural characteristics and application of diatomite[J]. Jiangsu Chemical Industry, 1989(3): 11-13, 29. |
| [44] |
王林. PAC与硅藻土强化混凝处理水中铜绿微囊藻影响因素的研究[D].广州: 华南理工大学, 2014. WANG L. Study on influencing factors of Microcystis aeruginosa removal in water by enhanced coagulationwith PAC combining diatomite[D]. Guangzhou: South China University of Technology, 2014. |
| [45] |
YANG S L, WANG J, CONG W, et al. Utilization of nitrite as a nitrogen source by Botryococcus braunii[J]. Biotechnology Letters, 2004, 26(17): 239-243. |
| [46] |
陈卫民, 戴树桂, 张清敏. 亚硝酸盐对铜绿微囊藻和四尾栅藻生长和竞争的影响[J]. 重庆大学学报, 2010, 33(9): 86-91. CHEN W M, DAI S G, ZHANG Q M. Effects of nitrite on the growth and competition of Microcystis aeruginosa and Scendesmus quadricauda[J]. Journal of Chongqing University, 2010, 33(9): 86-91. |
| [47] |
CODD G A. Cyanobacterial toxins, the perception of water quality, and the prioritisation of eutrophication control[J]. Ecological Engineering, 2000, 16(1): 51-60. |
| [48] |
张晓萍. 厦门马銮湾水域无机氮的化学特征[J]. 台湾海峡, 2001, 20(3): 319-322. ZHANG X P. Chemical characteristics of inorganic nitrogen in Maluan Bay, Xiamen[J]. Journal of Oceanography in Taiwan Strait, 2001, 20(3): 319-322. |
| [49] |
唐娅菲, 王金辉, 程宏, 等. 三沙湾春季浮游植物群落结构及其与环境因子的关系[J]. 上海海洋大学学报, 2018, 27(4): 522-530. TANG Y F, WANG J H, CHENG H, et al. Community structure of phytoplankton and its relationship with environmental factors of Sansha Bay in spring[J]. Journal of Shanghai Ocean University, 2018, 27(4): 522-530. |
2. Institute of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


