2. 上海海洋大学极地研究中心, 上海 201306;
3. 大洋渔业资源可持续开发教育部重点实验室极地海洋生态系统研究室, 上海 201306;
4. 国家远洋渔业工程技术研究中心, 上海 201306
狭鳕(Gadus chalcogrammus)是一种冷水性半底栖鱼类,隶属鳕形目(Gadiformes)鳕科(Gadidae)狭鳕属(Gadus)[1-2]。狭鳕是北太平洋生态系统的重要组成部分[3], 主要分布于日本东北部至白令海和阿拉斯加湾,往南至加利福尼亚北部均有分布。狭鳕栖息水域较为广泛,栖息水温为1~10 ℃, 是一种典型的亚北极物种[4]。3~4龄时达到性成熟,雌性个体每年产卵数百万枚[5]; 与其他鳕科鱼类一样,狭鳕在海洋中层水域集群产卵[5-8]。此外,狭鳕还具有较高的商业价值,我国为全球目前最大的狭鳕加工市场。
开展海洋鱼类生殖与发育的研究有助于了解这些鱼种的繁殖期和产卵场及其形成机制。因此,开展鱼类生殖系统研究有着特殊的理论意义。卵巢是决定雌性动物繁殖性能的重要器官,它直接关系到卵子的排出和雌激素的分泌[9]。目前,关于狭鳕性腺发育的研究较多,如YOSHIDAH等[10]对夏季中白令海狭鳕的成熟度进行了鉴定和描述;YOON[11]总结了北海道富卡湾附近水域雌性狭鳕的生殖周期;PRIVALIKHIN等[12]对多个分布区内的狭鳕样本卵母细胞的闭锁情况进行了研究;STAHL[13]结合宏观观察和组织学方法对东白令海狭鳕的成熟度进行了分析;黄开等[14]研究了西白令海夏季狭鳕性腺组织的能量密度及其影响因素。但总的来讲,关于西白令海狭鳕卵巢发育特征的研究较少。自2015年以来,我国通过双边入渔协定的方式进入西白令海水域开展狭鳕捕捞,目前该渔场也是我国大型加工拖网船队的重要渔场之一。针对该海域狭鳕开展生殖与发育方面研究,为了解该海域狭鳕的种群结构以及生活史过程提供重要的科学参考。为此,本研究对夏季西白令海狭鳕卵巢的发育特征进行描述,以期为西白令海狭鳕的资源状况评估及渔业可持续发展提供科学依据。
1 材料与方法 1.1 采样时间与地点狭鳕样本来自西白令海海域(179°11′E~177°57′W, 60°28′N~61°57′N, 图 1)作业的“开利轮”和“新宇一号”调查船,采集时间分别为2017年6—9月和2018年8—9月。采集后的样本在-20 ℃下冷冻保存后运回实验室。

|
图 1 研究区域和采样点 Fig. 1 Study area showing the sampling locations |
狭鳕样本在实验室解冻后,测量其生物学数据后解剖,鉴定性别,并获取性腺组织。生物学数据包括叉长(精确至0.1 ㎝)、体质量(精确至0.1 g)、性腺质量(精确至0.1 g)和纯体质量(精确至0.1 g, 去除内脏的质量)。针对雌性,依据STAHL[13]制定的狭鳕卵巢宏观分期表进行肉眼观察和分期;组织学分期的依据为最先发育的卵母细胞时相[15]以及排卵后卵泡存在与否[5]。最后,取小块卵巢(约1.5 cm×1.5 cm×1 cm)保存于质量分数为10%的中性甲醛固定液中,以备组织学观察。
1.3 实验方法本研究采用常规的石蜡组织切片法,实验过程依次为固定→脱水→透明→浸蜡→包埋→修蜡→切片→贴片→染色→封片等10个步骤。取固定于中性甲醛溶液中时间超过12 h以上的小块卵巢,利用流水冲洗残余的甲醛溶液后,将组织置入包埋盒内,依次浸入质量分数为70%、80%、90%、95%Ⅰ、95%Ⅱ、100%Ⅰ和100%Ⅱ的乙醇中脱水(相同质量分数乙醇Ⅰ、Ⅱ两步脱水是为了避免析出水分降低乙醇质量分数,影响脱水效果), 100%乙醇∶二甲苯(体积比为1∶1)和二甲苯溶液透明处理后,将组织分别浸于65 ℃恒温箱中的二甲苯∶石蜡(体积比为1∶1)和石蜡中;浸好蜡后将组织连同石蜡包埋至药盒中,待冷却后修蜡和切片。本研究使用莱卡RM2016轮转式切片机进行切片,厚度为4~7 μm, 在载玻片上贴片后烘干,苏木精-伊红(H.E)染色,中性树胶封片,Olympus BX-51型显微镜观察拍照。
1.4 数据处理性腺指数(gonadosomatic index, GSI)[16]计算公式为
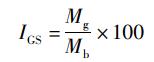 (1)
(1)
式中:IGS为性腺指数,%; Mg为狭鳕卵巢质量,g; Mb为狭鳕去除内脏的纯体质量,g。由于实验原因,并未称量2017年狭鳕样本的卵巢质量,故本部分的分析仅基于2018年所获得的狭鳕样本估算GSI数据(n=26)。利用独立样本t检验判断狭鳕各发育期个体GSI之间的差异(P=0.05)。利用相关性检验分析狭鳕卵巢发育期与个体叉长、纯体质量、卵巢质量和GSI之间的相关性。
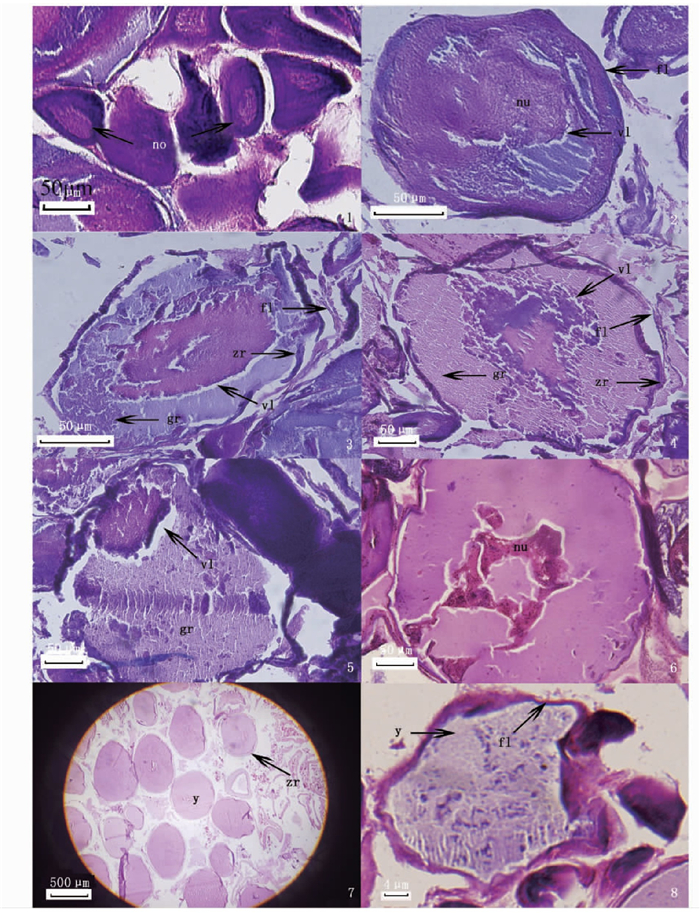
2 结果 2.1 卵母细胞的发育根据组织学观察,将西白令海狭鳕的卵母细胞发育过程分为9个时相。
Ⅰ时相(核周): 细胞个体小,形状不规则,前期细胞质和细胞核大小比例接近1∶1, 后期细胞质变大。细胞嗜碱性强,经染色后,呈紫色且颜色较深(图版Ⅰ-1)。
|
1.Ⅰ时相(核周)卵母细胞;2.Ⅱ时相(卵黄囊)卵母细胞;3.Ⅲ时相(初级卵黄)卵母细胞;4.Ⅳ时相(次级卵黄)卵母细胞;5. Ⅴ时相(完全卵黄)卵母细胞;6. Ⅵ时相(核迁移)卵母细胞;7. Ⅶ时相(预成熟)卵母细胞;8. Ⅷ时相(成熟)卵母细胞; no.核仁;nu.细胞核;fl.卵泡;vl.囊泡;zr.放射带;gr.卵黄颗粒;y.融合的卵黄。 1.The oocyte in the Ⅰ (peri-nucleus); 2. The oocyte in the Ⅱ (yolk vesicle); 3. The oocyte in theⅢ (primary yolk); 4. The oocyte in the Ⅳ (secondary yolk); 5. The oocyte in the Ⅴ (tertiary yolk); 6. The oocyte in the Ⅵ (nuclear migration); 7. The oocyte in the Ⅶ (prematuration); 8. The oocyte in the Ⅷ (maturation); no. Nucleoli; nu. Nucleus; fl. Follicle; vl. Vacuoles; zr. Zona radiata; gr. Granulosa; y. Fused yolk. 图版 Ⅰ 卵母细胞发育 Plate Ⅰ Oocyte development of Walleye Pollock |
Ⅱ时相(卵黄囊): 细胞增大,呈椭圆形,细胞核形状不规则,细胞质中出现囊泡,囊泡经融合呈带状,细胞质依然呈紫色,但颜色较Ⅰ时相浅。细胞质外由1层卵泡包围,卵泡呈紫色(图版Ⅰ-2)。
Ⅲ时相(初级卵黄): 卵细胞较Ⅱ时相的大,细胞核和细胞质颜色比Ⅱ时相的浅,在带状的囊泡和卵泡之间的细胞质中出现粉色的卵黄颗粒,这是卵黄积累的开始。此时,可以观察到卵母细胞外膜即放射带,介于细胞质和卵泡之间(图版Ⅰ-3)。
Ⅳ时相(次级卵黄): 粉色的卵黄颗粒与囊泡充分混合。可以明显地观察到放射带(图版Ⅰ-4)。
Ⅴ时相(完全卵黄): 混合的卵黄颗粒与囊泡占据细胞较大比例,细胞核变小(图版Ⅰ-5)。
Ⅵ时相(核迁移): 细胞形状不规则,细胞核分裂并朝着放射带的方向移动(图版Ⅰ-6)。
Ⅶ时相(预成熟): 细胞增大明显,细胞核核膜解体,卵黄颗粒与囊泡融合。卵细胞呈粉红色,放射带明显变粗(图版Ⅰ-7)。
Ⅷ时相(成熟): 所有卵黄颗粒与囊泡完全融合。卵细胞水化发生,但由于实验过程中的固定导致脱水,水化卵母细胞形状不规则,导致放射带被拉长(图版Ⅰ-8)。
Ⅸ时相(产卵): 卵泡脱落,此时的卵母细胞称为卵子,卵子状态与Ⅷ时相类似。
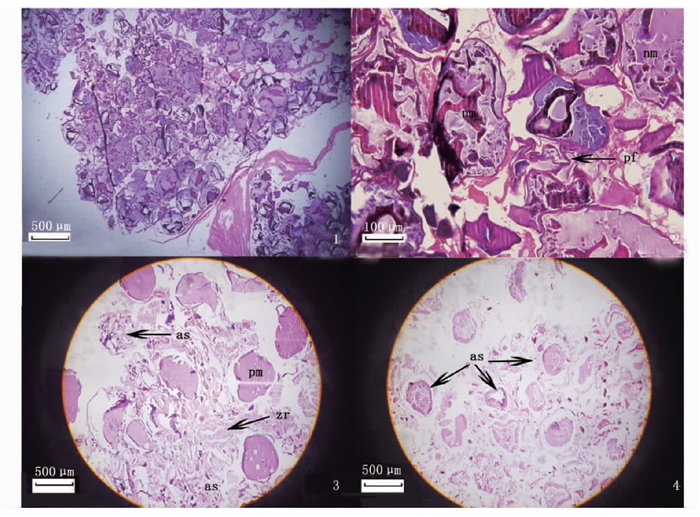
2.2 卵巢的发育根据组织学观察,将西白令海狭鳕的卵巢发育过程分为5个时期。
Ⅰ期(未成熟期): 卵巢成对位于体腔的腹中线两侧,体积小,半透明,呈橘偏粉色,无可见卵颗粒。组织学观察显示卵巢最先发育的是Ⅰ时相卵母细胞。
Ⅱ期(发育期): 卵巢呈浅橘黄色。经组织学观察,卵巢主要以Ⅱ时相卵母细胞为主,最先发育的也是Ⅱ时相卵母细胞。
Ⅲ期(产卵前期): 卵巢呈鲜艳的橘黄或橘红色,卵巢体积大小不等,体积小的卵巢表面光滑,体积大的卵巢表面较粗糙,有明显的颗粒感。组织学观察发现,卵巢中最先发育的是Ⅷ时相卵母细胞,同时可能存在Ⅰ时相至Ⅷ时相的卵母细胞(图版Ⅱ-1)。
|
1. Ⅲ期卵巢(产卵前期);2、3.Ⅳ期卵巢(产卵期);4.Ⅴ期卵巢(产卵后期);nm.核迁移;pf.排卵后卵泡;as.闭锁细胞;pm.预成熟卵母细胞;zr.放射带。 1. The ovary in the Ⅲ (pre-spawning); 2, 3. The ovary in the Ⅳ (spawning); 4. The ovary in the Ⅴ (spent); nm. Nuclear migration; pf. Postovulatory follicles; as. Atresia; pm. Prematuration oocyte; zr. Zona radiata. 图版 2 卵巢发育 Plate 2 Ovary development of Walleye Pollock |
Ⅳ期(产卵期): 卵巢质量和体积显著增大,形态和Ⅲ期卵巢类似。组织学观察发现,卵巢中出现排卵后残余的卵泡,表示卵巢已产卵,同时卵巢可能出现Ⅰ时相至Ⅸ时相卵细胞(图版Ⅱ-2, 3)。
Ⅴ期(产卵后期): 卵巢内无任何时相的卵细胞,出现排卵后卵泡和闭锁细胞(图版Ⅱ-4)。
2.3 卵巢发育时的个体特征6月,仅发现Ⅱ期、Ⅲ期未产卵的狭鳕,且Ⅱ期个体比Ⅲ期多1倍;7月,除了Ⅰ期、Ⅱ期,还发现Ⅳ期个体;8月,Ⅰ至Ⅳ期个体均有出现,其中Ⅱ期个体最多;9月,发现Ⅱ至Ⅴ期的狭鳕,其中Ⅲ期最多,Ⅳ期、Ⅴ期各1尾。总的来说,夏季该调查海域大部分狭鳕个体并不产卵,主要处于发育期,首、末发育阶段的狭鳕个体均较少,Ⅲ期个体最多,其次是Ⅱ期。
经相关性分析检验得出,卵巢发育期与叉长(P=0.134)、纯体质量(P=0.489)、卵巢质量(P=0.675)和GSI(P=0.587)均无统计学上的相关性。Ⅱ期个体平均卵巢质量为(9.80±7.02) g(1.20~17.50 g), 平均GSI为1.38±1.02(0.38~2.42);Ⅲ期个体平均卵巢质量为(16.23±15.58) g(0.30~44.10 g), 平均GSI为1.77±1.37(0.31~5.62);Ⅳ期和Ⅴ期个体卵巢各1个,卵巢质量分别为22.90 g和9.50 g, GSI分别为2.62和1.09。利用独立样本t检验判断Ⅱ期和Ⅲ期间GSI的差异,剔除1个显著的异常值(图 2)后显示,Ⅱ期和Ⅲ期个体卵巢间的GSI不存在统计学差异(t=-0.55, P=0.587 > 0.05)。

|
图 2 狭鳕各卵巢发育期与性腺指数的箱线图 Fig. 2 Box plot of ovarian development stage and GSI for walleye pollock |
本研究针对卵母细胞的划分与YOON[11]的操作较为相似,后者也将卵母细胞划分为9个时相,分别为无卵黄、卵黄囊、卵黄形成早期、卵黄形成晚期、核迁移、成熟、产卵早期、产卵晚期以及休眠期。YOON[11]认为当卵母细胞达到卵黄形成早期时相时,此个体在当下的产卵季节产卵,但在本研究中,当最先发育为初级或次级卵黄时,狭鳕并不产卵。在整个生殖周期中,无卵黄卵母细胞储存在核周卵母细胞内,可以称之为“储备”卵母细胞[17], 而某一产卵季节不发育的“储备”卵母细胞会在下个产卵季节发育[18]。1个生殖周期的周转是1组卵母细胞由“储备”状态异步推进的过程,即卵母细胞中开始形成卵黄或达到卵黄生成期,一旦这组卵母细胞达到完全卵黄阶段,卵黄生成期即将完成。因此,在该产卵季节,个体将不会再为“储备”卵母细胞提供补充以用于发育[5]。此时,“储备”卵母细胞和完全卵黄卵母细胞的大小就会存在明显差异[19]。成批的完全卵黄卵母细胞进一步同步发育为成熟的水合卵母细胞,先经历卵黄融合再水化[19], 随后卵母细胞从卵泡中排出,在排卵过程中变成卵子[20]; 其他批次的卵母细胞也经历同样的过程。这个重复的过程称为批次产卵[5]。卵巢内残余的含卵黄卵母细胞,直到产卵季节结束后,在恢复期被再吸收[19]。
卵母细胞的再吸收称为闭锁。一些研究[21-25]认为,发育中的卵母细胞闭锁是一种生殖调节机制,是对环境变化的响应。由此,卵母细胞闭锁程度可作为种群状态和生境条件变化的生物指标[26]。PRIVALIKHIN等[12]认为,闭锁发生在卵子发生的所有阶段。本研究结果显示,2017和2018年夏季,Ⅰ~Ⅴ期个体卵巢中均出现闭锁现象,但只有少部分Ⅲ期和Ⅳ期个体卵巢中存在高水平闭锁(闭锁细胞数量 > 50%), 占所有卵巢的5%, 而STAHL[13]的分析显示,高水平闭锁的卵巢约为3%。高水平闭锁可能会降低繁殖力[27]、延迟性成熟或推迟二次产卵的时间[27-28]。在决定种群繁殖潜力时,需要考虑闭锁现象。如果闭锁导致雌体跳过产卵季节、延迟成熟或降低繁殖力,那么产卵生物量可能会被高估。
3.2 卵巢发育特征卵泡包围着卵母细胞,排卵后,留在卵巢内的卵泡称为排卵后卵泡,它可能呈卷曲结构。狭鳕卵巢的组织学检查可以用于确认产卵是否开始,因为一旦产卵,就会出现排卵后卵泡[29]。
狭鳕卵巢内的卵母细胞属于不同步发育。通常情况下,综合最先发育的卵母细胞时相[15]以及排卵后卵泡存在与否等2个指标估计卵巢的成熟度[5]。但也有学者[30]认为,由于狭鳕属于卵母细胞不同步发育、分批产卵种类,因此这种方法可能高估了个体成熟度。这些学者进一步建议,使用数量最多、最先发育的卵母细胞时相作为判断狭鳕性成熟度的指标。但笔者认为,数量最多与最先发育的卵母细胞时相较难兼得,且组织切片较难保证切到一个完整的卵巢横截面,故使用常用的狭鳕性成熟度评估方法。
直观观察性腺成熟分期的手段较为主观。由于它取决于卵巢的颜色、大小和卵子的能见度,所以在分类上难免会出现一些误辨。本研究中,一些Ⅱ期的狭鳕个体被直观检测为Ⅲ期,还有部分Ⅲ期个体被划分为Ⅳ期。
3.3 卵巢发育时的个体特征Ⅲ期的卵巢质量是Ⅱ期的1.6倍,是Ⅴ期的1.7倍,Ⅳ期的卵巢质量是Ⅱ期和Ⅴ期的2倍以上,这与HUNTER等[29]的研究结果一致。通常情况下,当最先发育的卵母细胞达到成熟阶段时,卵母细胞在水合过程中吸收水分,卵巢质量可能比其他成熟阶段的质量高出2~4倍。SAKURAI[19]提出,临近产卵季节的狭鳕可以通过GSI等于或高于2.5予以识别,而STAHL[13]的研究发现,最先发育为卵黄生成或核迁移时相时,其GSI均小于2.5, 但这些狭鳕却预计在临近的产卵季节产卵。同样地,直观划分为Ⅱ、Ⅲ和Ⅴ期的狭鳕个体,其平均GSI也并非均高于2.5, 或均低于2.5。即使在组织学分析中,未成熟和成熟狭鳕的GSI在3.8以下均有重叠。鉴于上述原因,本研究认为,GSI并不能较好地预测白令海临近产卵季节时即将产卵的狭鳕个体状况。
MERATI[31]认为,Ⅴ期的狭鳕GSI介于Ⅱ期与Ⅲ期或Ⅳ期之间。本研究中,Ⅴ期狭鳕的GSI小于Ⅱ期狭鳕的GSI, 但大于Ⅲ期狭鳕的最小值。SAKURAI[19]使用GSI大于1.0作为确定Ⅴ期狭鳕的标准。STAHL[13]的研究发现,Ⅴ期狭鳕的平均GSI为7.12, 且有些低于1.0。因此,笔者认为,利用GSI作为确定狭鳕处于Ⅴ期也可能存在疑问,这与HUNTER等[29]的看法较为一致。
GSI可能因海区、个体体型、个体成熟阶段的不同而有所差异,这也可能是导致本研究结果与日本富卡湾或阿拉斯加谢利科夫海峡狭鳕GSI之间存在差异的原因之一。白令海水域存在3个独立的狭鳕产卵种群,它们分别位于阿留申盆地、白令海东南大陆架和斜坡以及西北大陆架上以及普里比洛夫群岛西北陆坡区[5]。由于卵巢质量与体质量的关系可能随着发育的推进而改变[15, 29, 32], 因此对不同种群的狭鳕个体的GSI进行比较并不合适[32]。GSI除了与取样时间有关,还与个体大小有关。因此,针对不同大小的狭鳕,比较GSI也可能会有偏差,即使处于同一成熟阶段的个体,大个体可能比小个体具有更大的GSI[15, 29], 这种效应会随着卵巢的成熟而不断增强[29]。
| [1] |
CARR S M, MARSHALL H D. Phylogeographic analysis of complete mtDNA genomes from Walleye Pollock (Gadus chalcogrammus Pallas, 1811) shows an ancient origin of genetic biodiversity[J]. DNA Sequence, 2008, 19(6): 490-496. DOI:10.1080/19401730802570942 |
| [2] |
PAGE L M, ESPINOSA-PÉREZ H, FINDLEY L T, et al. New Seventh Edition of Common and Scientific Names of Fishes: Changes include capitalization of common names[J]. Fisheries, 2013, 38(4): 188-189. DOI:10.1080/03632415.2013.767244 |
| [3] |
National Research Council. The Bering Sea ecosystem[M]. Washington, DC: The National Academies Press, 1996.
|
| [4] |
MUETER F J, LITZOW M A. Sea ice retreat alters the biogeography of the Bering Sea continental shelf[J]. Ecological Applications, 2008, 18(2): 309-320. DOI:10.1890/07-0564.1 |
| [5] |
HINCKLEY S. The reproductive biology of walleye pollock, Theragra chalcogramma, in the Bering Sea, with reference to spawning stock structure[J]. Fishery Bulletin, 1987, 85(3): 481-498. |
| [6] |
SVETOVIDOV A N. Treskoobraznye (Gadiformes)[R]. Fauna SSSR, ZoologicheskiiInstitutAkademiiNauk SSSR 34. Ryby, 1948: 1-222.
|
| [7] |
SHAW W, MCFARLANE G A. Biology, distribution and abundance of walleye pollock (Theragra chalcogramma) off the west coast of Canada[J]. Bulletinof International North Pacific Fisheries Commission, 1986, 45: 262-283. |
| [8] |
MAEDA T. Life cycle and behavior of adult pollock (Theragra chalcogramma) in waters adjacent to Funka Bay, Hokkaido Island[J]. Bulletin of International North Pacific Fisheries Commission, 1986, 45: 39-65. |
| [9] |
AEGERTER S, JALABERT B. Effects of post-ovulatory oocyte ageing and temperature on egg quality and on the occurrence of triploid fry in rainbow trout, Oncorhynchus mykiss[J]. Aquaculture, 2004, 231(1/4): 59-71. |
| [10] |
YOSHIDAH, YOON T H. Maturity and identification of the post-spawner of walleye pollock, Theragra chalcogramma (Pallas), in the surface layers of the central Bering Sea in summer[J]. Bulletin of the Faculty of FisheriesHokkaido University, 1981, 32(4): 329-337. |
| [11] |
YOON T H. Reproductive cycle of female walleye pollock, Theragra chalcogramma (Pallas), in the adjacent waters of Funka bay, Hokkaido[J]. Bulletin of the Faculty of FisheriesHokkaido University, 1981, 32(1): 22-38. |
| [12] |
PRIVALIKHIN A M, ZHUKOVA K A, POLUEKTOVA O G. Atresia of developing Oocytes in walleye pollock Theragra chalcogramma[J]. Journal of Ichthyology, 2015, 55(5): 664-670. DOI:10.1134/S0032945215050136 |
| [13] |
STAHL J P. Maturation of walleye pollock, Theragra chalcogramma, in the Eastern Bering Sea in relation to temporal and spatial factors[D]. Fairbanks: University of Alaska Fairbanks, 2004.
|
| [14] |
黄开, 韦贝贝, 朱国平. 西白令海夏季狭鳕性腺组织能量密度的影响因素分析[J]. 大连海洋大学学报, 2020, 35(4): 564-569. HUANG K, WEI B B, ZHU G P. Effect of factors on energy density for gonadal tissue of Alaska pollock (Gadus chalcogrammus) in the Western Bering Sea during summer[J]. Journal of Dalian Ocean University, 2020, 35(4): 564-569. |
| [15] |
WEST G. Methods of assessing ovarian development in fishes: a review[J]. Australian Journal of Marine and Freshwater Research, 1990, 41(2): 199-222. DOI:10.1071/MF9900199 |
| [16] |
陈新军. 渔业资源与渔场学[M]. 北京: 海洋出版社, 2004. CHEN X J. Fishery resources and fisheries[M]. Beijing: Ocean Press, 2004. |
| [17] |
FOUCHER R P, BEAMISH R J. Production of nonviable oocytes by Pacific hake (Merluccius productus)[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1980, 37(1): 41-48. DOI:10.1139/f80-004 |
| [18] |
MORRISON C M. Histology of the Atlantic cod, Gadusmorhua: an atlas. Part four. Eleutheroembryo and larva[M]. Ottawa, Ontario: National Research Council of Canada, 1993.
|
| [19] |
SAKURAI Y. Reproductive characteristics of walleye pollockwith special reference to ovarian development, fecundity and spawning behavior[C]//Proceedings of the International Symposium on Biology and Management of Walleye Pollock. Fairbanks, AK, USA: University of Alaska, 1989: 97-115.
|
| [20] |
BOWDEN D G, FOUCHER R P, TYLER A V. A guide to the ovarian histology of Pacific cod[M]. Nanaimo, British Columbia, Canada: Department of Fisheries and Oceans, Biological Sciences Branch, Pacific Biological Station, 1990.
|
| [21] |
PERSOV G M. 'Potential'and 'final'fecundity of fishes, based on the study of pink salmon (Oncorhynchus gorbuscha Walb) acclimatized in the White and Barents sea basin[J]. VoprosyIkhtiologii, 1963, 3(28): 490-496. |
| [22] |
PERSPV G M. Functional lability of the reproductive system of fish[J]. VoprosyIkhtiologii, 1972, 12(2): 226-240. |
| [23] |
MOISEEVA E B, KUKHAREV N N. The adaptive significance of resorption female gametes in Indian ruff Psenopsis cyanea (Alcock)[C]//The VIII Scientific Conference on Ecological Physiology and Biochemistry of Fishes. Petrozavodsk: Karel. Nauch. Tsentr, Ross. Akad. Nauk, 1992, 2: 13-14.
|
| [24] |
TYLER C R, SUMPTER J P. Oocyte growth and development in teleosts[J]. Reviews in Fish Biology and Fisheries, 1996, 6(3): 287-318. DOI:10.1007/BF00122584 |
| [25] |
MCDERMOTT S F, Maslenikov K P, Gunderson D R. Annual fecundity, batch fecundity, and oocyte atresia of Atka mackerel (Pleurogrammus monopterygius) in Alaskan waters[J]. Fishery Bulletin, 2007, 105(1): 19-29. |
| [26] |
CHNILEVSKY D A. Fish oogenesis as a sensitive test system affected by different factors[C]//The V All-Union Conference on Early Ontogenesis of Fishes. Moscow: VNIRO, 1991(in Russian).
|
| [27] |
BROMLEY P J, RAVIER C, WITTHAMES P R. The influence of feeding regime on sexual maturation, fecundity and atresia in first-time spawning turbot[J]. Journal of Fish Biology, 2000, 56(2): 264-278. DOI:10.1111/j.1095-8649.2000.tb02105.x |
| [28] |
RIDEOTT R M, BURTON M P M, ROSE G A. Observations on mass atresia and skipped spawning in northern Atlantic cod, from Smith Sound, Newfoundland[J]. Journal of Fish Biology, 2000, 57(6): 1429-1440. DOI:10.1111/j.1095-8649.2000.tb02222.x |
| [29] |
HUNTER J R, MACEWICZ B J. Measurement of spawning frequency in multiple spawning fishes[R]. NOAA Technical Report NMFS, 1985: 79-99.
|
| [30] |
HOLLAND T, NEIDETCHER S. Spatial and temporal reproductive patterns in Walleye Pollock (Theragra chalcogramma) in the Bering Sea[R]. Alaska Fisheries Science Center, NMFS, NOAA.
|
| [31] |
MERATI N. Spawning dynamics of walleye pollock, Theragra chalcogramma, in the Shelikof Strait, Gulf of Alaska[D]. Washington, Seattle: University of Washington, 1993.
|
| [32] |
DEVLAMING V, GROSSMAN G, CHAPMAN F. On the use of the gonosomaticindex[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1982, 73(1): 31-39. DOI:10.1016/0300-9629(82)90088-3 |
2. Center for Polar Research, Shanghai Ocean University, Shanghai 201306, China;
3. Polar Marine Ecosystem Lab, Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


