2. 华中农业大学 水产学院, 湖北 武汉 430070;
3. 农业农村部淡水生物繁育重点实验室, 湖北 武汉 430070;
4. 水产高效健康生产湖南省协同创新中心, 湖南 常德 415000;
5. 集美大学 水产学院, 福建 厦门 361021
八聚体结合转录因子4(octamer-binding transcription factor 4, Oct4)属于POU(Pit-Oct-Unic)转录因子家族第Ⅴ亚组,是最重要的维持胚胎干细胞(embryonic stem cells, ESCs)多潜能性和自我更新的关键转录因子之一,在ESCs分化为特定细胞系的过程中处于中心地位[1-2]。Oct4主要在一些具有全能性的未分化细胞中表达,如ESCs、早期胚胎卵裂球、原始生殖细胞(primordial germ cells, PGCs)、间充质干细胞等[3-6]。当细胞发生分化时,Oct4的表达会随之下降或消失[7]。Oct4可与转录因子Sox2、Klf4和Myc(OSKM)一起将小鼠(Mus musculus)成纤维细胞重编程为诱导多潜能干细胞(induced pluripotent stem cell, iPSC)[8-9],且这些因子中Oct4是形成iPSC不可缺少的基因[10]。Oct4缺失后小鼠囊胚内细胞团细胞易失去多能性;身体轴的正常定位和随后的谱系分化均受到干扰[11-12]。Oct4不但可以调控多个维持自我更新和多能性相关基因的表达,还参与到动物早期胚胎发育、体细胞重编程等多个过程,是复杂、精密而又精巧的调控网络中的核心调控因子[13]。
不过关于Oct4的研究多集中在哺乳动物[3, 14],在鱼类中的研究相对偏少[4-5],鱼类oct4基因功能研究有待深入进行,而构建oct4真核表达载体可为进一步了解其功能与作用机制提供有力工具。目前真核表达载体在鱼类中的构建与应用已有多篇报道:YE等[15]构建了RFP-Advasa 3′-UTR重组载体,有效标记了达氏鲟PGCs并进行了示踪观察;黄小换[16]构建了尼罗罗非鱼pT2AL-Oroct4-EGFP真核表达载体,可监测不同细胞的多能性状态;杨敏等[17]构建了真核表达质粒Tol2-actin-4-2A-EGFP,有助于探讨南极鱼中多聚三型抗冻蛋白基因的作用机制;许巧情等[18]构建了重组黄鳝NK-lysin-pPIC9K真核表达质粒,用于检测黄鳝抗菌肽蛋白对水环境中几种细菌的抑菌活性。这些研究在珍稀濒危鱼类保护、鱼类繁殖生物学、抗逆育种及疾病防控等方面都具有较强的应用潜力,但在大宗淡水鱼类中仍缺少oct4真核表达载体构建与应用的相关研究。
团头鲂(Megalobrama amblycephala)是我国主要淡水养殖鱼类之一,经济价值和科研价值较高[19-20],开展oct4基因相关研究可为日后进行团头鲂干细胞的分离鉴定与应用等工作打下基础。前期已经克隆了团头鲂oct4基因(Maoct4, GenBank登录号: KY994571)并构建了克隆载体pDrive-Maoct4,本研究进一步构建Maoct4荧光真核表达载体pCMV-Maoct4-Red,并采用脂质体法将该重组载体转染人肝癌细胞系HepG2,观察其在真核细胞中的表达与亚细胞中的定位情况,为进一步研究团头鲂oct4基因的生物学功能奠定基础。
1 材料与方法 1.1 实验材料大肠杆菌(Escherichia coli)TOP 10购自全式金公司(中国北京);载体pMD18-T购自TaKaRa公司(日本),载体pCVpr、pCS2+Maoct4、pLVX-CD9-GFP、pEGFP-N1-Mananog及人肝癌细胞系HepG2均由本实验室保存;高保真PCR预混合试剂与转染试剂盒LipofectamineTM 2000购自Invitrogen公司(美国);胶回收试剂盒与质粒提取试剂盒购自Omega公司(美国);ClonExpress试剂盒与HRP标记的羊抗兔二抗购自Vazyme公司(中国南京);限制性内切酶购自NEB公司(美国);DMEM培养基与PBS缓冲液购自Hyclone公司(美国);Opi-MEM培养基、胎牛血清(Fetal bovine serum, FBS)、青霉素和链霉素(Penicillin-Streptomycin, PS)以及EDTA-胰蛋白酶购自Gibco公司(美国);蛋白凝胶配制试剂盒、蛋白提取试剂盒、BCA蛋白定量试剂盒均购自康为世纪有限公司(中国北京);Actin抗体购自博奥森公司(中国北京);团头鲂Oct4抗体由本实验室制备并保存[21];其他试剂均为国产分析纯;引物合成与序列测定工作由武汉擎科创新生物科技有限公司完成。
1.2 pCS2+Maoct4载体的构建本实验所用Maoct4基因片段源自载体pCS2+Maoct4,该载体构建过程:将已构建的pDrive-Maoct4克隆载体用限制性内切酶AfeⅠ和XbaⅠ双酶切;pCS2+载体先用BamHⅠ酶切,加入T4 DNA polymerase,经12 ℃、15 min,75 ℃、20 min作用形成平末端后,再加入XbaⅠ进行酶切;酶切产物经1%琼脂糖凝胶电泳分离,使用胶回收试剂盒回收目的片段;将纯化的Maoct4基因片段与线性化pCS2+载体用T4 DNA连接酶于16 ℃连接1 h,转化至大肠杆菌TOP 10感受态细胞中,筛选重组表达载体pCS2+Maoct4阳性克隆,提取质粒DNA;分别用限制性内切酶XhoⅠ、KpnⅠ、XhoⅠ + NotⅠ进行酶切鉴定,挑选鉴定正确的质粒备用。
1.3 pCMV-Maoct4-Red重组载体的构建与鉴定根据Maoct4基因序列和pCVpr载体序列信息,按照ClonExpress试剂盒说明书要求设计引物,其中上游引物Maoct4-Fusion-F:5′-TCAGATCTCGAGCTCaagcttatgacggagagaccgcag-3′,下游引物Maoct4-Fusion-R:5′- GGCGACCGGTGGATCgctggtgaggtgacccacc-3′(加粗部分为线性化pCVpr载体末端同源序列),即Maoct4基因扩增产物5′和3′最末端分别带有与线性化pCVpr载体两末端对应完全一致的序列。以Maoct4-Fusion-F和Maoct4-Fusion-R为引物,pCS2+Maoct4质粒为模板(稀释至1 ng/μL),采用高保真PCR预混合试剂进行PCR扩增获得所需Maoct4片段。PCR反应条件:94 ℃预变性3 min;94 ℃变性20 s,52 ℃退火30 s,72 ℃延伸90 s,25个循环;72 ℃终延伸5 min。
将pCVpr载体用限制性内切酶BamHⅠ和Hind Ⅲ进行双酶切,制备线性化载体备用。使用ClonExpress试剂盒按照说明书要求连接Maoct4目的片段与线性化pCVpr载体,采用20 μL反应体系:5 × CE Ⅱ Buffer 5 μL,pCVpr 5 μL(106 ng),Maoct4 2 μL(60 ng),ExnaseTM Ⅱ 2 μL,ddH2O补足至20 μL,反应条件为37 ℃ 30 min。反应结束后将得到的连接产物转化入大肠杆菌TOP 10感受态细胞,挑取克隆后提取质粒DNA,分别用限制性内切酶Hind Ⅲ、XhoⅠ和SacⅠ进行酶切验证,并将连接正确的质粒进行测序鉴定。测序无误后,将重组质粒扩大培养,重新提取质粒DNA于-20 ℃保存备用。
1.4 细胞的培养、转染与荧光观察将HepG2细胞接种于DMEM培养液(10% FBS和1% PS)中,置于37 ℃,5% CO2培养箱中培养。取对数生长期细胞接种至12孔板中,待细胞融合率达70%时,使用脂质体转染试剂盒(LipofectamineTM 2 000)进行转染,同时设立裸质粒pCVpr对照和不转染阴性对照,48 h后在倒置荧光显微镜(Leica,德国)下观察转染细胞中荧光表达情况并拍照。另取重组载体pCMV-Maoct4-Red分别与膜定位载体pLVX-CD9-GFP及核定位载体pEGFP-N1-Mananog共转染HepG2细胞,观察两种不同载体组合在细胞内的共定位情况。
1.5 转染细胞的Western blot分析分别收集未转染、转染pCVpr载体和pCMV-Maoct4-Red载体的HepG2细胞,制备细胞总蛋白提取液,采用Western blot方法检测团头鲂Oct4多克隆抗体与Oct4-DsRed融合蛋白的反应情况,实验步骤参考文献[22]。
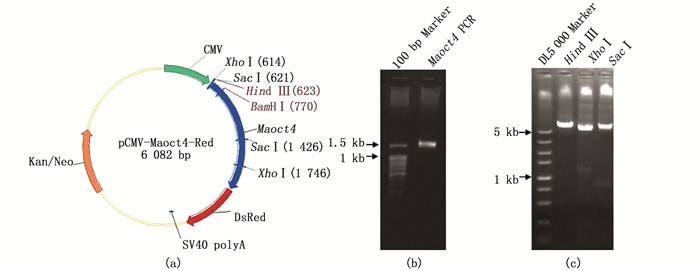
2 结果 2.1 重组载体pCMV-Maoct4-Red的构建与鉴定Maoct4基因片段来源于本实验室已构建载体pCS2+Maoct4。重组载体的构建以pCVpr为骨架,用内切酶BamHⅠ和HindⅢ将载体片段去除pr融合中的p片段,然后插入Maoct4基因片段构建重组载体pCMV-Maoct4-Red(图 1a)。Maoct4片段以pCS2+Maoct4载体为模板进行PCR扩增,经1%琼脂糖凝胶电泳检测,在约1 500 bp处出现1条特异性条带(图 1b),然后通过同源重组构建载体pCMV-Maoct4-Red。该载体分别经HindⅢ、XhoⅠ、SacⅠ酶切,得到预期大小的片段(图 1c),并且载体经测序确定序列无误。
|
(a) pCMV-Maoct4-Red质粒图谱;(b) PCR扩增Maoct4目的片段;(c) pCMV-Maoct4-Red酶切鉴定。 (a) Vector map of pCMV-Maoct4-Red; (b) PCR amplification of Maoct4 fragment; (c) Enzyme digestion of pCMV-Maoct4-Red. 图 1 pCMV-Maoct4-Red重组载体的构建与鉴定 Fig. 1 Construction and identification of the pCMV-Maoct4-Red recombinant vector |
采用脂质体转染法将对照载体pCVpr和重组载体pCMV-Maoct4-Red分别转染HepG2细胞,48 h后在荧光显微镜下观察细胞内红色荧光的表达情况。结果显示,2种载体转染后细胞中均发出红色荧光,表明2种载体均能在HepG2细胞中成功表达(图版Ⅰ),其中图版Ⅰ-1,4为明场。不过二者荧光表达的部位有所不同,pCVpr载体转染后红色荧光分布在整个细胞(图版Ⅰ-2, 3),而pCMV-Maoct4-Red载体转染后红色荧光浓缩在细胞的局部(图版Ⅰ-5,6)。

|
1~3.转染pCVpr;4~6.转染pCMV-Maoct4-Red。 1-3.Transfection of pCVpr; 4-6.Transfection of pCMV-Maoct4-Red. 图版 Ⅰ 重组载体在HepG2细胞中的表达 Plate Ⅰ Expression of the recombinant vector in HepG2 cells |
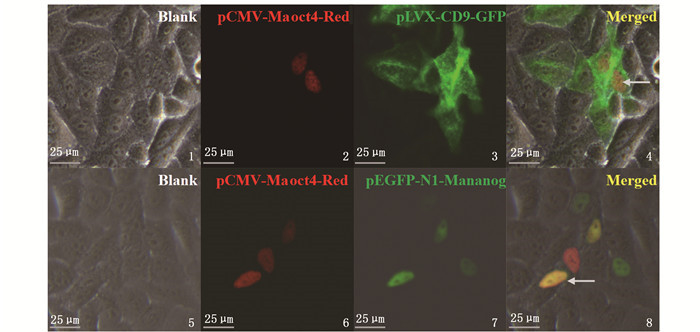
接下来进行细胞共转染实验以进一步了解该重组载体在HepG2细胞中的表达与分布情况。将pCMV-Maoct4-Red重组载体与已知不同亚细胞定位的绿色荧光蛋白载体共转染HepG2细胞,通过观察共转染后各色荧光的位置判断Maoct4的定位情况。结果显示,重组载体pCMV-Maoct4-Red分别与膜定位载体pLVX-CD9-GFP(图版Ⅱ-1~4)及核定位载体pEGFP-N1-Mananog(图版Ⅱ-5~8)共转染后,两种共转染细胞的细胞核部位均呈现出黄色(图版Ⅱ-4,8),该颜色是红色与绿色合并后的颜色,表明其在细胞核部位重叠,Maoct4定位于细胞核中(图版Ⅱ-2,4,6,8),所构建的重组载体pCMV-Maoct4-Red能够应用于细胞核定位研究。
|
1~4.共转染pCMV-Maoct4-Red和pLVX-CD9-GFP;5~8.共转染pCMV-Maoct4-Red和pEGFP-N1-Mananog;1, 5.自然光;2, 6.红色荧光;3, 7.绿色荧光;4, 8.三色合并;箭头指示核定位。 1-4.Co-transfection of pCMV-Maoct4-Red and pLVX-CD9-GFP; 5-8. Co-transfection of pCMV-Ma oct4-Red and pEGFP-N1-Mananog; 1, 5. Light; 2, 6. Red fluorescence; 3, 7. Green fluorescence; 4, 8. Merged; Arrow indicates the nuclear location. 图版 Ⅱ pCMV-Maoct4-Red重组载体与其他荧光标记载体在HepG2细胞中的共定位 Plate Ⅱ Co-localization of pCMV-Maoct4-Red and other fluorescence marked vectors in HepG2 cells |
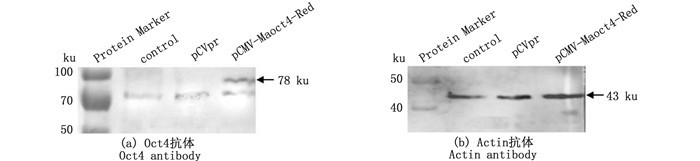
为进一步检测融合蛋白的表达情况,分别收集未转染、转染pCVpr对照载体和重组载体的3种细胞进行Western blot分析,使用自制的团头鲂Oct4抗体作为一抗[21]。经聚丙烯酰胺凝胶电泳检测,转染pCMV-Maoct4-Red的细胞蛋白提取物中出现1条约78 ku的条带,与融合蛋白大小相符,而未转染和转染pCVpr组在相应位置无条带出现(图 2a),表明该重组载体在HepG2细胞中获得了有效表达且其融合蛋白可被Maoct4抗体识别;使用Actin抗体作内参在3种细胞中均能检测到相应条带(43 ku,图 2b)。
|
图 2 HepG2细胞蛋白的Western blot分析 Fig. 2 Western blot analysis of the protein in HepG2 cells |
近30年来,oct4同源基因的相关研究工作相继开展,通过人(Homo sapiens)[1]、牛(Bos taurus)[14]、青鳉(Oryzias latipes)[4]、中华鲟(Acipenser sinensis)[5]、斑马鱼(Danio rerio)[11]、尼罗罗非鱼(Oreochromis niloticus)[16]、牙鲆(Paralichthys olivaceus)[23]和大黄鱼(Larimichthys crocea)[24]等实验进一步证明了该因子在胚胎早期发育及维持干细胞多能性等方面具有重要作用。本实验构建了团头鲂oct4基因荧光真核表达载体,该重组载体一方面可保留oct4的生物学活性,另一方面又便于在oct4功能相关实验中检测到蛋白表达,是进一步研究oct4生物学功能及其作用机制的有效工具。
在基因工程技术中,常使用载体携带外源DNA片断进入宿主细胞进行扩增和表达,这些载体可分为原核载体、真核载体和穿梭载体[25]。选用的pCVpr载体属于真核载体,用于表达含香菇珊瑚红色荧光蛋白(Discosoma sp. red fluorescent protein, DsRed)标签的融合蛋白。该载体含有CMV启动子,在多克隆位点处根据阅读框插入目的基因就可以高效表达融合蛋白;该载体还含有neo基因,可用新霉素筛选真核靶细胞;同时,利用载体中DsRed的荧光特性能够直接观察融合蛋白的表达情况,还可以利用DsRed抗体来检测或免疫沉淀融合蛋白。构建的重组载体pCMV-Maoct4-Red也具有此种特性,便于后期深入分析团头鲂oct4基因的功能。例如:可用此重组载体转染不同类型的细胞,利用DsRed的荧光特性实时观察不同细胞的转染效率并筛选出阳性克隆,进而分析这些细胞的增殖、迁移与部分功能是否受到影响;也可把该重组载体转染至体细胞,为研究鱼类oct4基因功能以及获得鱼类诱导性多能干细胞奠定基础。
在载体构建过程中,使用ClonExpress技术,这是一种简单、快速并且高效的DNA定向克隆技术,可将插入片段PCR产物定向克隆至任意载体的任意位点,极大地简化了实验步骤。通过PCR扩增获得Maoct4基因特异性片段后,将其克隆到pCVpr载体中DsRed表达框之前,即可快速获得重组载体pCMV-Maoct4-Red。将该重组载体转染HepG2细胞,可直接在荧光显微镜下观察细胞中是否有红色荧光出现。实验结果显示,转染后HepG2细胞能够发出明亮的红色荧光,且用Oct4抗体能够检测到融合蛋白条带,表明该荧光真核表达载体构建成功且在HepG2细胞中获得表达。
大分子物质从胞浆到胞核的转运是真核生物一个重要的生物学事件,以便通过核内外物质交换的精确调控,从而对基因表达和信号转导等产生重要影响。Oct4是转录因子,具有一段核定位信号(nuclear localization signals, NLS)。NLS具有通透生物膜和携带外源蛋白质、DNA或寡核苷酸等进入细胞的能力,其主要作用是帮助核蛋白与载体蛋白相结合形成聚合物[26]。本研究一方面通过前期的生物信息学分析得出团头鲂Oct4蛋白含有NLS序列(RKRKR);另一方面单独转染pCMV-Maoct4-Red或其与绿色荧光蛋白载体共转染的细胞中均可观察到红色荧光信号分布于细胞核,结果表明获得的团头鲂oct4基因能够定位于细胞核中,符合其作为转录因子的特征,同时也证明构建的重组载体pCMV-Maoct4-Red可用于细胞核定位研究。
综上所述,本研究成功构建了团头鲂oct4基因荧光表达载体pCMV-Maoct4-Red,该载体能在真核细胞HepG2的细胞核部位表达,可用团头鲂Oct4抗体进行鉴定,这些工作为进一步研究其功能奠定了基础。
| [1] |
TAKEDA J, SENINO S, BELL G I. Human Oct3 gene family:cDNA sequences, alternative splicing, gene organization, chromosomal location, and expression at low levels in adult tissues[J]. Nucleic Acids Research, 1992, 20(17): 4613-4620. DOI:10.1093/nar/20.17.4613 |
| [2] |
PARDO M, LANG B, YU L, et al. An expanded Oct4 interaction network:implications for stem cell biology, development, and disease[J]. Cell Stem Cell, 2010, 6: 382-395. DOI:10.1016/j.stem.2010.03.004 |
| [3] |
MITALIPOV S M, KUO H C, HENNEBOLD J D, et al. Oct-4 expression in pluripotent cells of the rhesus monkey[J]. Biology of Reproduction, 2003, 69: 1785-1792. DOI:10.1095/biolreprod.103.019455 |
| [4] |
SÁNCHEZ-SÁNCHEZ A V, CAMP E, GARCÍA-ESPAÑA A, et al. Medaka Oct4 is expressed during early embryo development, and in primordial germ cells and adult gonads[J]. Developmental Dynamics, 2010, 239: 672-679. DOI:10.1002/dvdy.22198 |
| [5] |
YE H, DU H, CHEN X H, et al. Identification of a pou2 ortholog in chinese sturgeon, Acipenser sinensis and its expression patterns in tissues, immature individuals and during embryogenesis[J]. Fish Physiology and Biochemistry, 2012, 38: 929-942. DOI:10.1007/s10695-011-9579-8 |
| [6] |
MALAKOOTIAN M, MIRZADEH A F, NAELI P, et al. Novel spliced variants of OCT4, OCT4C and OCT4C1, with distinct expression patterns and functions in pluripotent and tumor cell lines[J]. European Journal of Cell Biology, 2017, 96(4): 347-355. DOI:10.1016/j.ejcb.2017.03.009 |
| [7] |
符毓豪, 王菊, 谢松松, 等. 转录因子Oct-4的研究进展[J]. 农垦医学, 2009, 31(6): 542-545. FU Y H, WANG J, XIE S S, et al. The research development of transcriptional factor Oct-4[J]. Journal of Nongken Medicine, 2009, 31(6): 542-545. DOI:10.3969/j.issn.1008-1127.2009.06.022 |
| [8] |
TAKAHASHI K, YAMANAKA S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors[J]. Cell, 2006, 126(4): 663-676. DOI:10.1016/j.cell.2006.07.024 |
| [9] |
STADHOUDERS R, VIDAL E, SERRA F, et al. Transcription factors orchestrate dynamic interplay between genome topology and gene regulation during cell reprogramming[J]. Nature Genetics, 2018, 50(2): 1-12. |
| [10] |
KIM J B, SEBASTIANO V, WU G, et al. Oct4-induced pluripotency in adult neural stem cells[J]. Cell, 2009, 136(3): 411-419. DOI:10.1016/j.cell.2009.01.023 |
| [11] |
ONICHTCHOUK D, FLORIAN G, POLOK B, et al. Oct4/Pou5f1 controls differentiation timing in early zebrafish embryo[J]. Developmental Biology, 2010, 344(1): 415-417. |
| [12] |
MULAS C, CHIA G, JONES K A, et al. Oct4 regulates the embryonic axis and coordinates exit from pluripotency and germ layer specification in the mouse embryo[J]. Development, 2018, 145(12): dev159103. DOI:10.1242/dev.159103 |
| [13] |
JERABEK S, MERINO F, SCHÖLER H R, et al. OCT4:dynamic DNA binding pioneers stem cell pluripotency[J]. Biochimica et Biophysica Acta, 2014, 1839(3): 138-154. DOI:10.1016/j.bbagrm.2013.10.001 |
| [14] |
NORDHOFF V, HVBNER K, BAUER A, et al. Comparative analysis of human, bovine, and murine Oct-4 upstream promoter sequences[J]. Mammalian Genome, 2001, 12: 309-317. DOI:10.1007/s003350010279 |
| [15] |
YE H, YUE H M, YANG X G, et al. Identification and sexually dimorphic expression of vasa isoforms in Dabry's sturgeon (Acipenser dabryanus), and functional analysis of vasa 3'-untranslated region[J]. Cell & Tissue Research, 2016, 366(1): 203-218. |
| [16] |
黄小换.尼罗罗非鱼Oct4的表达、多能性活性及转录调控研究[D].重庆: 西南大学, 2016. HUANG X H. The expression, pluripotent activity and transcriptional regulation of Oct4 from Nile tilapia[D]. Chongqing: Southwest University, 2016. |
| [17] |
杨敏, 黄巧, 陈良标. 南极鱼Ⅲ型抗冻基因真核表达质粒的构建及其细胞表达[J]. 浙江农业学报, 2016, 28(11): 1862-1866. YANG M, HUANG Q, CHEN L B. Construction of type Ⅲ antifreeze protein eukaryotic expression plasmid and expression in zebrafish cell line[J]. Acta Agriculturae Zhejiangensis, 2016, 28(11): 1862-1866. DOI:10.3969/j.issn.1004-1524.2016.11.09 |
| [18] |
许巧情, 汤东东, 夏理海, 等. 黄鳝NK-lysin基因的真核表达与体外活性分析[J]. 生物技术, 2019(4): 317-323. XU Q Q, TANG D D, XIA L H, et al. Eukaryotic expression of the swamp eel NK-lysin in Pichia pastoris and analysis of antibacterial activity in vitro[J]. Biotechnology, 2019(4): 317-323. |
| [19] |
王卫民. 团头鲂养殖产业现状[J]. 科学养鱼, 2009(4): 49-50. WANG W M. Current situation of blunt snout bream culture industry[J]. Scientific Fish Farming, 2009(4): 49-50. |
| [20] |
张新辉, 罗伟, 高泽霞, 等. 团头鲂三倍体的诱导及其鉴定[J]. 水产科学, 2013, 32(9): 503-508. ZHANG X H, LUO W, GAO Z X, et al. Induction and identification of triploid in bluntnose black bream Megalobrama amblycephala[J]. Fisheries Science, 2013, 32(9): 503-508. DOI:10.3969/j.issn.1003-1111.2013.09.002 |
| [21] |
于淼, 方健, 李玲玉, 等. 团头鲂转录因子Oct4的原核表达和多克隆抗体的制备[J]. 上海海洋大学学报, 2018, 27(1): 8-15. YU M, FANG J, LI L Y, et al. Prokaryotic expression and polyclonal antibody preparation of Oct4 protein in Megalobrama amblycephala[J]. Journal of Shanghai Ocean University, 2018, 27(1): 8-15. |
| [22] |
李玲玉, 方健, 于淼, 等. 青鳉prdm14的原核表达、多克隆抗体制备及其应用[J]. 水生生物学报, 2017, 41(4): 748-754. LI L Y, FANG J, YU M, et al. Prokaryotic expression, preparation and application of anti-Prdm14 polyclonal antibody of medaka (Oryzias latipes) prdm14[J]. Acta Hydrobiologica Sinica, 2017, 41(4): 748-754. |
| [23] |
GAO J, WANG X, ZHANG Q. Evolutionary conservation of pou5f3 genomic organization and its dynamic distribution during embryogenesis and in adult gonads in Japanese flounder Paralichthys olivaceus[J]. International Journal of Molecular Sciences, 2017, 18(1): 231-251. DOI:10.3390/ijms18010231 |
| [24] |
姜永华.大黄鱼干细胞诱导相关多能性因子的克隆与表达分析[D].厦门: 厦门大学, 2016. JIANG Y H. Molecular cloning and expression of pluripotent factors related to stem cell induction in large yellow croaker Larimichthys crocea[D]. Xiamen: Xiamen University, 2016. |
| [25] |
楼士林. 基因工程[M]. 北京: 科学出版社, 2005. LOU S L. Genetic engineering[M]. Beijing: Science Press, 2005. |
| [26] |
付爱玲, 孙曼霁. 核定位信号介导的细胞转运及其机制[J]. 中国药理学通报, 2003, 19(10): 1081-1083. FU A L, SUN M J. Mechanism of celluar import mediated by nuclear localization signals[J]. Chinese Pharmacological Bulletin, 2003, 19(10): 1081-1083. DOI:10.3321/j.issn:1001-1978.2003.10.001 |
2. College of Fisheries, Huazhong Agricultural University, Wuhan 430070, Hubei, China;
3. Key Laboratory of Freshwater Animal Breeding, Ministry of Agriculture and Rural Affairs, Wuhan 430070, Hubei, China;
4. Collaborative Innovation Center for Efficient and Health Production of Fisheries in Hunan Province, Changde 415000, Hunan, China;
5. Fisheries College of Jimei University, Xiamen 361021, Fujian, China
 2021,
Vol. 30
2021,
Vol. 30


