2. 远洋渔业协同创新中心, 上海 201306;
3. 国家远洋渔业工程技术研究中心, 上海 201306;
4. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306
现存的7种海龟广泛分布于三大洋的热带及亚热带海域,是大洋生态系统中的重要组成部分[1]。除平背龟(Natator depressus)外,其余种类的海龟在热带大西洋海域的活动均较为频繁:几内亚湾的玳瑁(Eretmochelys imbricata)种群丰度较高[2],墨西哥至法属圭亚那沿岸是大西洋丽龟(Lepidochelys kempii)、蠵龟(Caretta caretta)和棱皮龟(Dermochelys coriacea)的主要繁殖场[3-5]。近年来热带大西洋海域逐渐增多的渔业活动对该海域的海龟资源状况影响较大[6],尤其是拖网、刺网及延绳钓作业中容易发生海龟兼捕[7-9]。其中金枪鱼延绳钓渔业中存在的兼捕现象较为严重,导致热带大西洋海域的海龟兼捕率全球最高[10]。
目前太平洋丽龟(Lepidochelys olivacea)、棱皮龟和蠵龟的资源状况被世界自然保护联盟(International Union for Conservation of Nature, IUCN)评估为近危(vulnerable, VU), 绿海龟(Chelonia mydas)为濒危(endangered, EN), 玳瑁和丽龟则列为极危(critically endangered, CR)[11]。国内外学者[12-17]对其他海域的海龟兼捕现象开展了少量研究,但针对热带大西洋海域兼捕现象的研究尚且缺乏。鉴于此,本研究根据2009—2019年延绳钓渔业科学观察员数据,分析了热带大西洋海域中国金枪鱼延绳钓渔业中的海龟兼捕情况,旨在为我国积极承担渔业大国责任,有效减少兼捕和实现资源可持续开发提供科学依据。
1 材料与方法 1.1 渔业与渔具信息在大西洋金枪鱼国际养护委员会(International Commission for the Conservation of Atlantic Tunas,ICCAT)注册的中国渔船共41艘,目标鱼种为蓝鳍金枪鱼(Thunnus thynnus)和大眼金枪鱼(Thunnus obesus)。热带大西洋公海海域捕捞努力量一般发生在20°S~20°N,主要捕捞大眼金枪鱼。中国渔船所用钓具规格较一致,一般两浮球间主绳长度为848~946 m,主绳材料采用8股尼龙单丝缠绕,浮绳长平均45 m,挂钩16枚,支绳长度平均58 m,支绳由尼龙线、玻璃单丝和包芯线等组成,各部分材料间用轻质搭扣连接,不同渔船支绳各部分材料长度比或有差异,支绳间距平均50 m,由于支绳损坏或磨损后补接,支绳长度亦会产生差异(误差±1 m),见图 1。使用J型钓钩(Japan tuna hook),钓钩尺寸为4.0或4.2英寸,各钓钩深度可根据齐藤昭二[18]方法计算。使用阿根廷滑柔鱼(Illex argentinus)、沙丁鱼(Sardina pilchardus)、鲭(Pneumatophorus japonicus)和遮目鱼(Chanos chanos)为饵料。下钩时间为6:00-9:00,起钩时间为12:00-20:00,目标鱼种为大眼金枪鱼。蓝鳍金枪鱼渔船作业在北大西洋更高的纬度,一般在48°N以北。
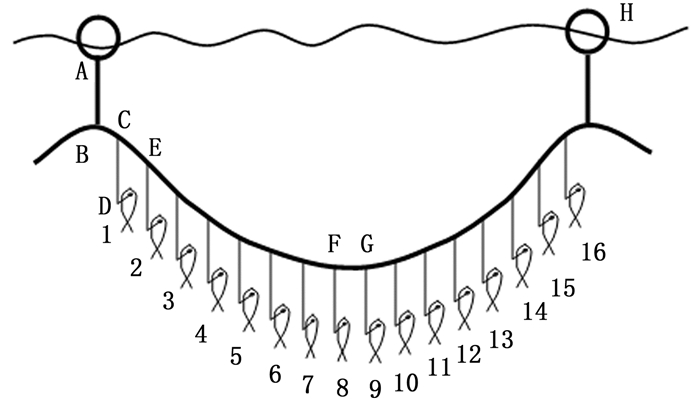
|
AB.浮绳长;CD.支绳长;CE.支绳间距。 AB. Length of float line; CD. Length of branch line; CE. Interval length between two branch lines. 图 1 延绳钓渔具示意图 Fig. 1 Diagram of longline fishing gear |
渔获信息和海龟兼捕数据由中国远洋渔业观察员计划2009—2019年大西洋金枪鱼延绳钓记录提供,共计收集20个航次观察员取样数据,总投钩2 249钩次(d),共计6 975 731钩,总共捕获108只海龟,总兼捕率为0.015 5只/千钩。作业海域为热带大西洋公海(15°S~15°N, 15°W~45°W)金枪鱼延绳钓渔业活动区域(图 2)。
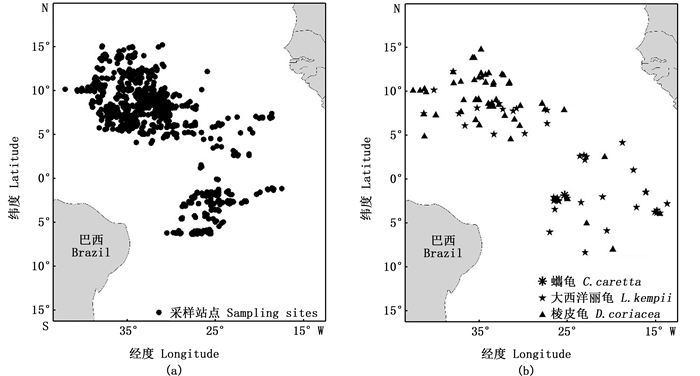
|
图 2 采样站点图(a)和兼捕海龟位置图(b) Fig. 2 Location of sampling site(a) and bycatch of sea turtles(b) |
将收集到的兼捕海龟种类、长度、体质量、存活状态、钓钩位置和相关渔业数据进行分类汇总。其中:长度记背甲长和背甲宽,测量精确至cm,背甲长是从中间测量的前缘到背壳后缘,穿过中央部分,背甲宽是背壳最大处的宽度,穿过背壳的侧边缘;海龟体质量精确至1 kg;存活状态分为:存活、接近死亡、死亡;上钩方式记为直接咬钩、鱼钩钩住四肢、支绳缠绕躯干、支绳缠绕前肢、浮球绳缠绕四肢和主绳缠绕躯干等。
绘制各年份海龟兼捕率(bycatch per unit effort, BPUE)分布图,利用卡方检验分析2009—2019年间热带大西洋兼捕海龟资源是否具有统计学意义;对海龟BPUE按照月份进行汇总,采用单因素方差分析和多重比较检验各月份不同种类海龟BPUE变化是否存在显著性差异。
计算出目标鱼种渔获率(catch per unit effort, CPUE)和海龟兼捕率作比较,并将渔业数据的环境因子如海表面温度、农历日期等与每只海龟匹配。初步分析得出海龟兼捕率与以上因子间均存在线性关系且符合双变量正态分布,运用皮尔森相关性检验探寻海龟兼捕率与目标鱼种渔获率及相关影响因子之间的内在联系。
上述分析均借助ArcGIS 10.2、SPSS 22.0和Excel 2016软件进行。
2 结果 2.1 兼捕海龟状态根据2009—2019年远洋渔业观察员记录,发现热带大西洋延绳钓渔业中共出现3种海龟,其中棱皮龟61只、大西洋丽龟46只和蠵龟1只,分别占56.48%、42.59%、0.93%。棱皮龟存活只数占总只数的70.49%,大西洋丽龟存活只数占31.15%,蠵龟1只,其接近死亡。存活海龟利用脱钩装置去钩或解开缠绕后释放,已死亡海龟直接丢弃(图 3)。
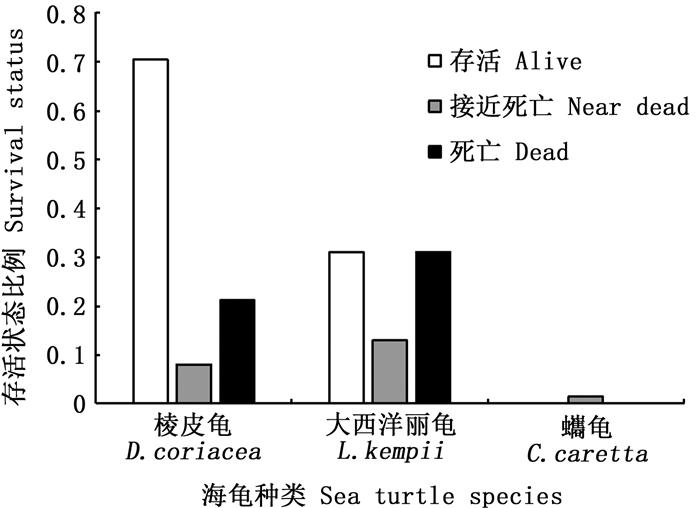
|
图 3 海龟种类及存活状态 Fig. 3 Species of sea turtles and survival status |
棱皮龟背甲长范围为45~180 cm,平均背甲长为112.57 cm;背甲宽范围为45~150 cm,平均背甲宽为64.29 cm;体质量范围为35~170 kg,平均值为98.33 kg。大西洋丽龟背甲长范围为45~180 cm,平均背甲长为101.53 cm;背甲宽范围为45~107 cm,平均背甲宽为60.29 cm,体质量范围为20~30 kg,平均值为25.20 kg(表 1)。

|
表 1 兼捕海龟的长度及体质量 Tab.1 Average lengths and mass of sea turtles |
海龟兼捕主要受延绳钓渔具主绳、浮球绳、支线和钓钩的影响。其中,摄食行为直接咬钩和游泳运动中被支绳缠绕是热带大西洋延绳钓海龟兼捕的主要方式,鱼钩钩挂以及主绳或浮球绳缠绕等方式对海龟兼捕造成的影响相对较小。大西洋丽龟被兼捕的方式和比例分别为咬钩57%、鱼钩钩住四肢4%、支绳缠绕躯干11%、支绳缠绕四肢4%、浮球绳缠绕四肢2%;棱皮龟被兼捕的方式和比例分别为咬钩21%、鱼钩钩住四肢7%、支绳缠绕躯干11%、支绳缠绕四肢8%、浮球绳缠绕四肢3%、主绳缠绕躯干2%、主绳缠绕四肢3%,见图 4。
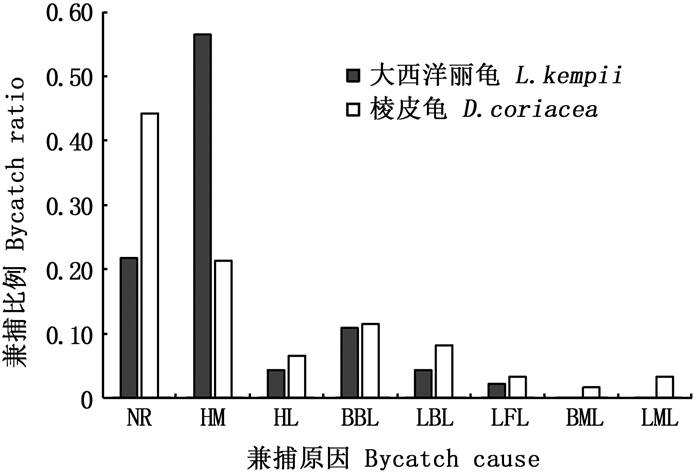
|
NR.无记录;HM.直接咬钩;HL.钩住四肢;BBL.支绳缠绕躯干;LBL.支绳缠绕四肢;LFL.浮球绳缠绕四肢;BML.主绳缠绕躯干;LML.主绳缠绕四肢。 NR. No record; HM. Hooked mouth; HL. Hooked legs; BBL. Body entangled by branch line; LBL. Legs entangled by branch line; LFL. Legs entangled by float line; BML. Body entangled by main line; LML. legs entangled by main line. 图 4 海龟主要兼捕原因及频率 Fig. 4 Main causes and frequency of sea turtles'bycatch |
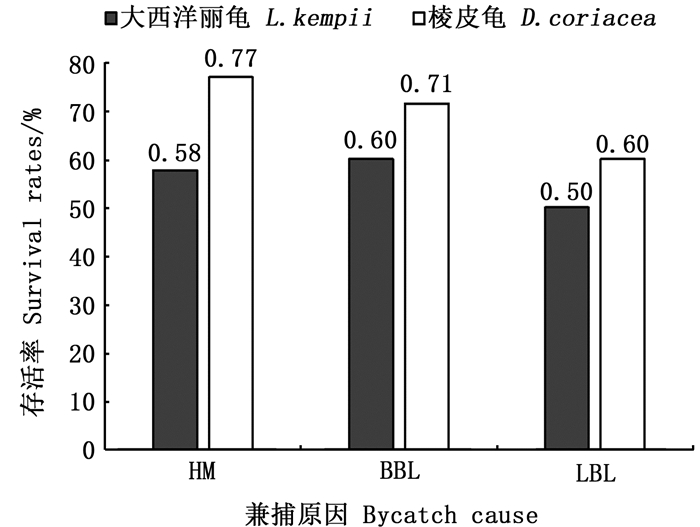
对不同兼捕原因导致的海龟存活率差异的分析可以发现,经历咬钩和支绳缠绕躯干的海龟被兼捕后存活率较高,大西洋丽龟中这2种不同兼捕原因存活率分别为58%和60%,棱皮龟存活率分别为77%和71%,而支线缠绕四肢导致存活率相对较低,大西洋丽龟和棱皮龟中存活率分别为50%和60%(图 5)。
|
HM. 直接咬钩;BBL. 支绳缠绕躯干;LBL.支绳缠绕四肢。 HM. Hooked mouth; BBL. Body entangled by branch line; LBL. Legs entangled by branch line. 图 5 海龟主要兼捕方式的存活率 Fig. 5 Survival rates of main bycatch methods for sea turtles |
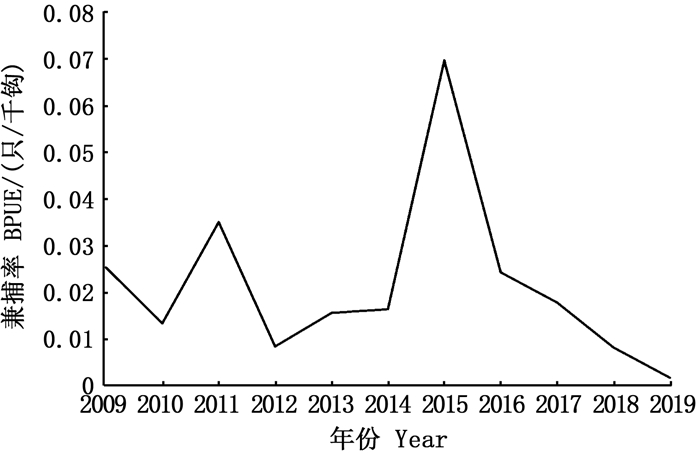
由2009—2019年大西洋金枪鱼延绳钓观察员记录的海龟生物学数据分析可知,中国热带大西洋金枪鱼延绳钓船队海龟年度兼捕率范围为0.001 6~0.069 3只/千钩,各年BPUE出现波动,但经线性卡方检验,BPUE并没有出现显著上升趋势(P>0.05),2011和2015年BPUE数值较高,均超过0.030 0只/千钩,其中2014—2015年BPUE增幅较大,并于2015年达到记录数据的最大值0.069 3只/千钩。见图 6。
|
图 6 海龟兼捕率的年变化分布图 Fig. 6 Annual variation of sea turtle's BPUE |
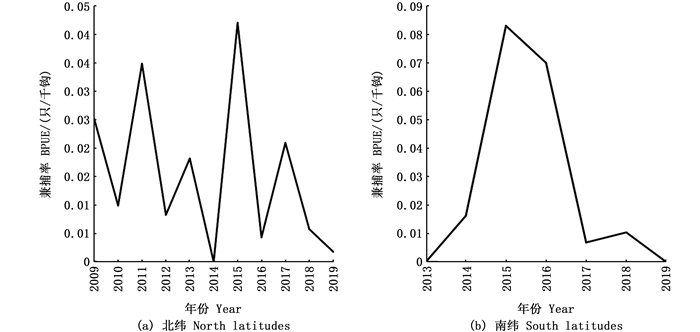
将2009—2019年海龟兼捕率按照纬度分布分析,经单因素方差检验,可发现棱皮龟和大西洋丽龟BPUE月份之间均出现显著性差异(P < 0.05)。其中:赤道以北海域BPUE虽年际间出现一定波动,但兼捕率总体维持在0.017 0只/千钩浮动;赤道以南海域BPUE年际间差异较大,且2009—2013年间未出现海龟兼捕报告,自2013年后南纬BPUE增长趋势明显,于2015年达到最大值,随后BPUE逐渐降低,直到2019年达到最小值。见图 7。
|
图 7 海龟兼捕率北纬与南纬比较 Fig. 7 Comparison of North and South latitudes for sea turtles' BPUE |
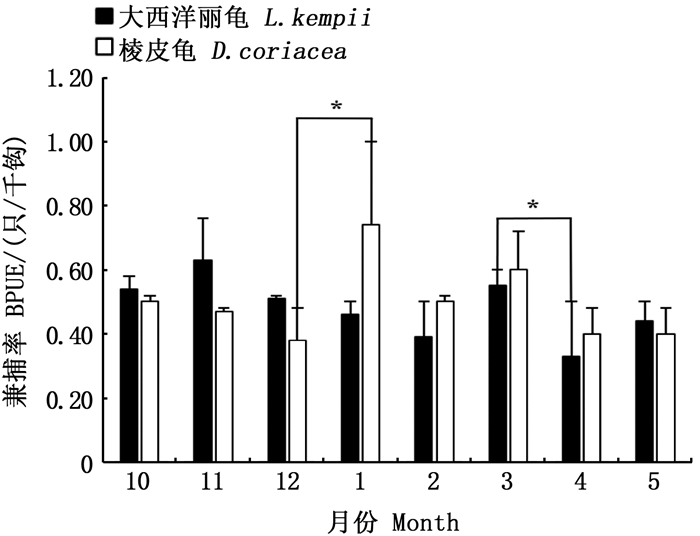
分析2009—2019年不同月份海龟BPUE,可发现海龟兼捕的发生存在一定的季节性差异,BPUE集中在10月至翌年5月,其中棱皮龟BPUE在1月和3月较高,大西洋丽龟BPUE则在11月和3月较高。对不同兼捕海龟各月份间BPUE经单因素方差检验,棱皮龟和大西洋丽龟BPUE月份之间存在显著性差异(F棱皮龟=12.3,P棱皮龟 < 0.05;F大西洋丽龟=12.9,P大西洋丽龟 < 0.05)。经过多重比较检验,棱皮龟12月和1月间出现显著性差异(P < 0.05),丽龟3月和4月间出现显著性差异(P < 0.05)。见图 8。
|
*表示差异显著(P < 0.05)。 *represent significant difference(P < 0.05). 图 8 2种海龟兼捕率的月变化 Fig. 8 Monthly variation of two species of sea turtles' BPUE |
中国热带大西洋金枪鱼延绳钓船队主要目标鱼种为大眼金枪鱼,也会捕获一定的黄鳍金枪鱼(Thunnus albacores)和剑鱼(Xiphias gladius)作为经济鱼种。通过皮尔森相关性检验对2009—2019年海龟BPUE与大眼金枪鱼、黄鳍金枪鱼及剑鱼CPUE分析可以看出,海龟兼捕率与大眼金枪鱼渔获率增长趋势最为相关(r=0.72,P < 0.05),与剑鱼渔获率变化趋势相关性较弱(r=0.62,P < 0.05),与黄鳍金枪鱼渔获率变化趋势相关性最差(r=0.50,P < 0.05)。见图 9。
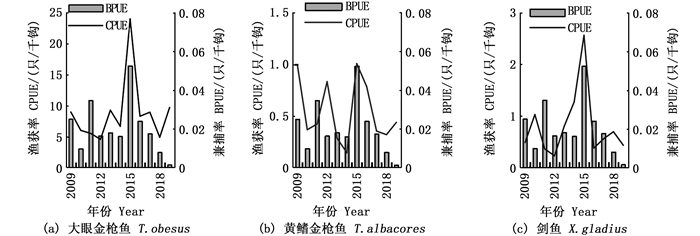
|
图 9 海龟BPUE与3种目标鱼种CPUE的关系 Fig. 9 Relationship between sea turtles' BPUE and three target species' CPUE |
根据农历月相盈亏的周期性,将观察员报告中发生海龟兼捕的农历日期换算成相应的月相亮度,经皮尔森相关性分析后可发现热带大西洋海龟兼捕率往往在满月或接近满月的环境下明显增多。见图 10。
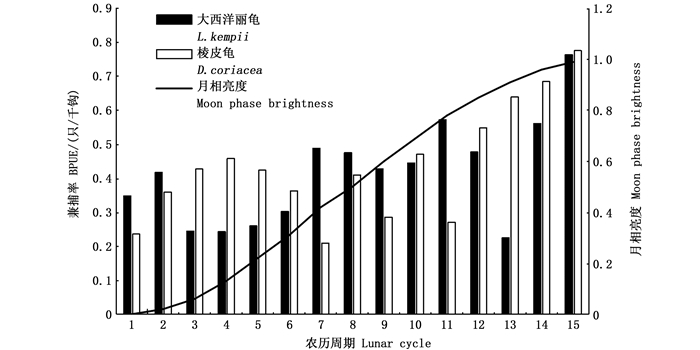
|
图 10 海龟兼捕与月相亮度的关系 Fig. 10 Relationship between sea turtle bycatch and moon phase brightness |
将不同海龟兼捕发生时的海表面温度数据汇总后经皮尔森检验后可知,棱皮龟和大西洋丽龟BPUE均与海表面温度显著相关(P < 0.05)。棱皮龟适应温度范围相对较广,23~28 ℃间的海域均有分布,其中24~26 ℃的水温环境下兼捕相对发生较多;大西洋丽龟分布则相对集中在26~27 ℃,推测其最适温度较棱皮龟要高。见图 11。
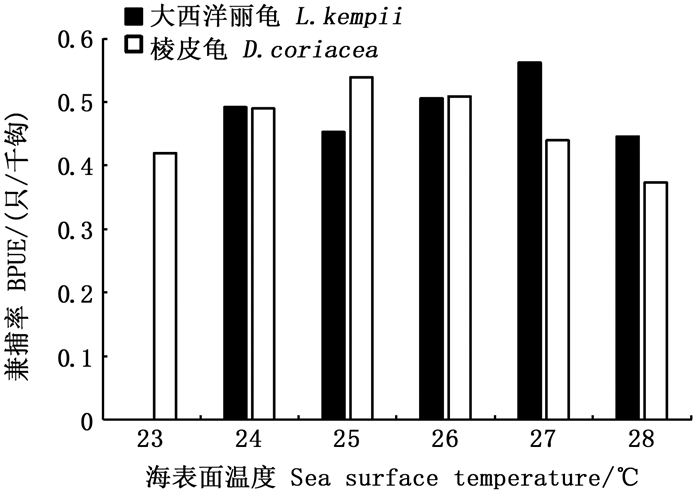
|
图 11 海龟兼捕与海表面温度的关系 Fig. 11 Relationship between sea turtle bycatch and sea surface temperature |
本次调查中,兼捕的海龟种类为3种,其中棱皮龟61只、大西洋丽龟46只、蠵龟1只,共计108只,分别占兼捕总数的56.48%、42.59%、0.93%。这3种海龟兼捕与巴西南部延绳钓海龟兼捕出现的海龟种类一致[19],但热带大西洋海域海龟优势种为棱皮龟和大西洋丽龟,而巴西南部海域发现的优势种为蠵龟[19]。不同海域海龟优势种的差异可能是不同种类海龟的栖息地环境存在差异,也可能与不同海域的海龟拥有不同的洄游路线有关。有研究[20]表明,不同海域海龟年兼捕率存在较为明显的差异:西北大西洋年兼捕率为0.001 0~1.758 0只/千钩;东北大西洋为0.030 0~1.050 0只/千钩;西南大西洋为0.000 0~4.310 0只/千钩;东南大西洋为0.001 0~0.527 0只/千钩;地中海海域为0.030 0~3.207 0只/千钩。而中国热带大西洋船队的年兼捕率为0.001 6~0.069 3只/千钩,兼捕率差异的原因可能与中国船队作业渔场大多集中在热带大西洋公海有关,也可能与近年来人类活动导致海龟整体种群数量减少有关。
3.2 目标鱼种对海龟兼捕的影响研究发现,对于中国热带大西洋金枪鱼延绳钓船队来说,最主要的兼捕物种为棱皮龟,其次为大西洋丽龟。国外研究[21-22]认为,在大西洋金枪鱼延绳钓渔业的兼捕对象中,蠵龟和棱皮龟最为常见。差异产生的原因可能是各国针对目标鱼种作业渔场的不同或者针对目标鱼种渔具设计的不同[23],中国船队在热带大西洋离岸公海主要以大眼金枪鱼为目标鱼种,采用更深的钩位深度,这点与巴西、乌拉圭等国在大西洋沿岸浅海以剑鱼为目标鱼种的小型金枪鱼延绳钓渔船船队不同[11]。HUANG[24]利用台湾省大西洋公海延绳钓船队历年数据进行分析,也得出类似的结论。
3.3 环境因子对海龟兼捕的影响棱皮龟、大西洋丽龟和蠵龟作为大洋洄游性物种,分布范围广[25]。在大西洋海域,不同海龟物种一般都会选择在热带沙滩区域筑巢产卵,如加勒比海或几内亚湾海域众多热带岛屿地区[26]。海龟破壳后,稚龟会经历随中上层洋流漂流的生活史阶段,直至性成熟,此阶段死亡率受温度等环境因子影响较大[20]。在繁殖阶段,海龟可能受季节性水温变化驱动横跨几千公里广阔大洋前往适宜的觅食索饵场和交配筑巢地[27]。不同物种海龟在不同的生活史阶段受环境温度的影响不同[28]。本次调查中,可发现棱皮龟和大西洋丽龟的兼捕在相对水温较暖的海域更易发生,其中棱皮龟最适温度推测在24 ℃以上,大西洋丽龟最适温度推测在26 ℃以上。
海龟作为目视捕食者,其行为学容易受到月相亮度的影响[29-30]。本次调查中,热带大西洋海龟兼捕发生率在满月或接近满月的环境下明显增多,与美国大西洋中上层延绳钓月相对海龟兼捕影响原因的结果基本一致[31]。针对以上月相亮度对海龟兼捕的影响,在接下来的研究中,可以进一步讨论如何减少作业中人为光亮以减轻海龟兼捕的发生,如减少桅桁亮灯数量和限制近海剑鱼延绳钓中荧光棒的使用等。
3.4 降低延绳钓兼捕海龟的对策海龟作为海洋生态系统的旗舰物种[3],减少兼捕是海龟整体保护策略的重要组成部分[32]。现阶段在热带大西洋海域,关于海龟保护工作主要是由ICCAT在基于可持续渔业发展宗旨和框架内的区域性渔业管理组织(Regional Fisheries Management Organization, RFMO)模式下实行,具体海龟养护管理建议包括:要求船旗国履约并强制收集和提交ICCAT管辖海域内发生的海龟兼捕数据;要求每艘渔船携带脱钩器具(De-hooker)且渔业生产中必须采取有效行为如取出钓钩或解开网具缠绕释放兼捕海龟个体以提高其存活率;要求改进或减少使用现有易产生海龟副渔获物或易造成兼捕海龟受伤的渔具渔法,推荐使用圆形钓钩和全鱼饵料[33]。
本次研究中海龟死亡率为29.63%,低于庄之栋等[34]2009年在相关海域初步调查死亡率(34.80%)的结果,3种兼捕海龟都有活捉后并被成功放生的记录,这表明近年来随着中国渔业管理机构对船员和观察员进行误捕海龟安全处理培训的普及,使他们能够熟练使用兼捕释放装置(by catch reduction devices, BRDs)解开鱼线和鱼钩,并使昏迷的海龟苏醒并被安全释放,提高了存活率,对海龟养护有着积极意义。此外,在目前的研究中,北太平洋和地中海拖网渔业中夜间视觉阻吓剂(紫外线发光二极管)的使用已被证明是有效减小海龟兼捕的措施,并且对目标鱼种商业渔获量没有影响[35-36]。考虑到大西洋海域中海龟在夜间海表面停留的时间与月相光照强度呈正相关,其行为学易受光亮影响[30],如何利用上述特性进一步开发适应热带大西洋延绳钓渔业的BRDs和替代渔具以减少对海龟造成的伤害是接下来一个值得思考的方向。
| [1] |
戴小杰, 李延, 许柳雄, 等. 中东太平洋公海金枪鱼延绳钓误捕海龟的观察和分析[J]. 水产学报, 2009, 33(6): 1044-1049. DAI X J, LI Y, XU L X, et al. Observation and analysis of sea turtles mortality longline fishing in high seas of Central and Eastern Pacific Ocean[J]. Journal of Fisheries of China, 2009, 33(6): 1044-1049. |
| [2] |
FORMIA A, TIWARI M, FRETEY J, et al. Sea turtle conservation along the Atlantic Coast of Africa[J]. Marine Turtle Newsletter, 2003, 100: 33-37. |
| [3] |
夏中荣, 古河祥, 李丕鹏. 全球海龟资源和保护概况[J]. 野生动物杂志, 2008, 29(6): 312-316. XIA Z R, GU H X, LI P P. Resources of Sea Turtles in the world and their Conservation[J]. Chinese Journal of Wildlife, 2008, 29(6): 312-316. |
| [4] |
AGUILERAM, MEDINA-SUÁREZM, PINÓSJ, et al. Assessing the effects of multiple off-road vehicle (ORVs) tyre ruts on seaward orientation of hatchling sea turtles: implications for conservation[J]. Journal of Coastal Conservation, 2019, 23: 111-119. DOI:10.1007/s11852-018-0641-x |
| [5] |
SHAVER DJ, HART KM, FUJISAKI I, et al. Migratory corridors of adult female Kemp's ridley turtles in the Gulf of Mexico[J]. Biological Conservation, 2016, 194: 158-167. DOI:10.1016/j.biocon.2015.12.014 |
| [6] |
ICCAT Task I-Nominal catch information[R/OL]. Madrid, Spain: ICCAT, 2018. https://www.iccat.int/en/accesingdb.html.
|
| [7] |
DE QUEVEDOÁ, FÉLIX M S, CARDONA L. Mortality rates in by-caught loggerhead turtle Carettacaretta in the Mediterranean Sea and implications for the Atlantic populations[J]. Marine Ecology Progress Series, 2013, 489: 225-234. DOI:10.3354/meps10411 |
| [8] |
GUIMARÃESSM, TAVARES D C, MONTEIRO-NETO C. Incidental capture of sea turtles by industrial bottom trawl fishery in the tropical South-western Atlantic[J]. Journal of the Marine Biological Association of the United Kingdom, 2018, 98(6): 1525-1531. DOI:10.1017/S0025315417000352 |
| [9] |
WALLACE B P, LEWISON R L, MCDONALD S L, et al. Global patterns of marine turtle bycatch[J]. Conservation Letters, 2010, 3(3): 131-142. DOI:10.1111/j.1755-263X.2010.00105.x |
| [10] |
ANGEL A, NEL R, WANLESS R M, et al. Ecological risk assessment of sea turtles to tuna fishing in the ICCAT region[R]. Madrid, Spain: ICCAT, 2014.
|
| [11] |
DOMINGO A, BUGONI L, PROSDOCIMI L, et al. The impact generated by fisheries on Sea Turtles in the Southwestern Atlantic[R]. San José, Costa Rica: WWF Programa Marino para Latinoamérica y el Caribe, 2006.
|
| [12] |
BARTRAMP K, KANEKO JJ, KUCEY-NAKAMURA K. Sea turtle bycatch to fish catch ratios for differentiating Hawaii longline-caught seafood products[J]. Marine Policy, 2010, 34(1): 145-149. DOI:10.1016/j.marpol.2009.05.006 |
| [13] |
DONOSOM, DUTTONP H. Sea turtle bycatch in the Chilean pelagic longline fishery in the southeastern Pacific: opportunities for conservation[J]. Biological Conservation, 2010, 143(11): 2672-2684. DOI:10.1016/j.biocon.2010.07.011 |
| [14] |
CERUTTI-PEREYRA F, MOITY N, DUREUIL M, et al. Artisanal longline fishing the Galapagos Islands-effects on vulnerable megafauna in a UNESCO World Heritage site[J]. Ocean & Coastal Management, 2020, 183: 104995. |
| [15] |
TEMPLE A J, WAMBIJI N, POONIAN C NS, et al. Marine megafauna catch in southwestern Indian Ocean small-scale fisheries from landings data[J]. Biological Conservation, 2019, 230: 113-121. DOI:10.1016/j.biocon.2018.12.024 |
| [16] |
PUSINERI C, QUILLARD M. Bycatch of protected megafauna in the artisanal coastal fishery of Mayotte Island, Mozambique Channel[J]. Western Indian Ocean Journal of Marine Science, 2008, 7(2): 137-150. |
| [17] |
CAMBIō G, JRIBI I, CAMBERA I, et al. Intra-gear variation in sea turtle bycatch: implications for fisheries management[J]. Fisheries Research, 2020, 221: 105405. DOI:10.1016/j.fishres.2019.105405 |
| [18] |
斋藤昭二. マグロの游泳层と延绳渔法[M]. 东京: 成山堂书屋, 1992: 7-11.
|
| [19] |
PINEDO MC, POLACHECK T. Sea turtle by-catch in pelagic longline sets off southern Brazil[J]. Biological Conservation, 2004, 119(3): 335-339. DOI:10.1016/j.biocon.2003.11.016 |
| [20] |
COELHO R, FERNANDEZ-CARVALHO J, SANTOS MN. A review of fisheries within the ICCAT convention area that interact with sea turtles[R]. Madrid, Spain: ICCAT, 2013.
|
| [21] |
HONIG MB, PETERSENSL, DUARTEA. Turtle by-catch in longline fisheries operating within the Benguela current large marine ecosystem[R]. Madrid, Spain: ICCAT, 2008.
|
| [22] |
PONS M, MARRONI S, MACHADO I, et al. Machine learning procedures: an application to by-catch data of the marine turtles Caretta caretta in the Southwestern Atlantic Ocean[R]. Madrid, Spain: ICCAT, 2009.
|
| [23] |
BÁEZ J C, GARCÍA-BARCELONA S, CAMIÑASJ A, et al. Fishery strategy affects the logger head sea turtle mortality trend due to the longline bycatch[J]. Fisheries Research, 2019, 212: 21-28. DOI:10.1016/j.fishres.2018.11.032 |
| [24] |
HUANG H W. Characteristics of sea turtle incidental catch of Taiwanese longline fisheries in the Atlantic Ocean[R]. Madrid, Spain: ICCAT, 2013.
|
| [25] |
FERRAROLI S, GEORGES J Y, GASPAR P, et al. Endangered species: where leatherback turtles meet fisheries[J]. Nature, 2004, 429(6991): 521-522. DOI:10.1038/429521a |
| [26] |
夏连军, 李励年, 陆建学. 世界第三大海龟繁殖地: 佛得角[J]. 现代渔业信息, 2010, 25(1): 17-19. XIA L J, LI L L, LU J X. The third breeding place of sea turtles in the world: Cape Verde[J]. Modern Fisheries Information, 2010, 25(1): 17-19. DOI:10.3969/j.issn.1004-8340.2010.01.005 |
| [27] |
NEEMAN N, ROBINSON N J, PALADINO F V, et al. Phenology shifts in leatherback turtles (Dermochelys coriacea) due to changes in sea surface temperature[J]. Journal of Experimental Marine Biology and Ecology, 2015, 462: 113-120. DOI:10.1016/j.jembe.2014.10.019 |
| [28] |
BLADOW R A, MILTON S L. Embryonic mortality in green (Chelonia mydas) and loggerhead (Caretta caretta) sea turtle nests increases with cumulative exposure to elevated temperatures[J]. Journal of Experimental Marine Biology and Ecology, 2019, 518: 151180. DOI:10.1016/j.jembe.2019.151180 |
| [29] |
MILLSA M. Latitudinal gradients of biologically useful semi-darkness[J]. Ecography, 2008, 31(5): 578-582. DOI:10.1111/j.0906-7590.2008.05346.x |
| [30] |
FREITAS C, CALDEIRA R, DELLINGER T. Surface behavior of pelagic juvenile loggerhead sea turtles in the eastern North Atlantic[J]. Journal of Experimental Marine Biology and Ecology, 2019, 510: 73-80. DOI:10.1016/j.jembe.2018.10.006 |
| [31] |
KOT C Y, BOUSTANY A M, HALPIN P N. Temporal patterns of target catch and sea turtle bycatch in the US Atlantic pelagic longline fishingfleet[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2010, 67(1): 42-57. DOI:10.1139/F09-160 |
| [32] |
DUTTON P H, SQUIRES D. Reconciling biodiversity with fishing: a holistic strategy for Pacific sea turtle recovery[J]. Ocean Development & International Law, 2008, 39(2): 200-222. |
| [33] |
Sea Turtle Bycatch in ICCAT Fisheries[R]. Paris, France: ICCAT, 2010.
|
| [34] |
庄之栋, 戴小杰, 许柳雄. 热带大西洋公海金枪鱼延绳钓海龟兼捕的初步研究[J]. 海洋湖沼通报, 2011(2): 66-72. ZHUANG Z D, DAI X J, XU L X. Catch rate and species of sea turtles by longline fishery in high seas of tropical Atlantic Ocean[J]. Transactions of Oceanology and Limnology, 2011(2): 66-72. DOI:10.3969/j.issn.1003-6482.2011.02.009 |
| [35] |
LUCCHETTI A, BARGIONE G, PETETTA A, et al. Reducing sea turtle bycatch in the Mediterranean mixed demersal fisheries[J]. Frontiers in Marine Science, 2019, 6: 387. DOI:10.3389/fmars.2019.00387 |
| [36] |
VIRGILI M, VASAPOLLO C, LUCCHETTI A. Can ultraviolet illumination reduce sea turtle bycatch in Mediterranean set net fisheries?[J]. Fisheries Research, 2018, 199: 1-7. DOI:10.1016/j.fishres.2017.11.012 |
2. Collaborative Innovation Center for Distant-Water Fisheries, Shanghai 201306, China;
3. National Engineering Research Center for Distant-Water Fisheries, Shanghai 201306, China;
4. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


