2. 上海海洋大学 水产动物遗传育种中心上海市协同创新中心, 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
缢蛏(Sinonovacula constricta)俗称蛏子,隶属于软体动物门(Mollusca)瓣鳃纲(Lamellibranchia)真瓣鳃目(Eulamellibranchia)竹蛏科(Solenida)缢蛏属(Sinonovacula),广泛分布在我国的福建、浙江、海南以及台湾等地,是我国主要的经济养殖贝类之一[1-2],其养殖年产量可达80多万t[3]。贝类的生长性状是重要的经济性状,研究生长性状的分子作用机理,对加速贝类的分子选育具有重要作用。
类胰岛素生长因子(insulin-like growth factor, IGF)系统在胚胎的早期发育、生长以及繁殖方面起着调控作用[4]。该系统主要包括IGF、IGF受体(IGF receptor, IGFR),以及IGF结合蛋白(IGF binding protein, IGFBP)和类胰岛素生长因子酸不稳定亚基(IGF acid-labile subunit, IGFALS)[5]。IGF由靶细胞表面的特异性受体介导,通过自分泌、旁分泌和内分泌的方式来实现其生物学功能。研究表明,IGF系统可以通过MAPK途径和PI3K /Akt参与调节下游转录因子,进而调控机体的发育、生长以及繁殖等生理过程[6]。在水产动物中,IGF系统相关基因的研究主要集中在鱼类,而在贝类中相对较少,仅在虾夷扇贝(Mizuhopecten yessoensis)[7]、合浦珠母贝(Pinctada fucata)[8]、杂色鲍(Haliotis diversicolor Reeve)[9]以及缢蛏[10]中有所报道。
IGFALS作为IGF系统中重要的一员,与IGF和IGFBP结合形成异源三聚体后,IGF的半衰期得到显著延长,达到原来的70多倍[11]。尽管早在1992年IGFALS就已在人的肝脏中被分离鉴定[12],但相对于IGF系统中的配体、受体以及结合蛋白,IGFALS的研究依然只停留在IGF的半衰期方面[13]。本实验在缢蛏中鉴定了两个IGFALS基因,分析了该基因在不同发育阶段和不同组织中的表达规律,并进一步探究了外源胰岛素对缢蛏IGF系统相关基因表达以及稚贝生长的影响。
1 材料与方法 1.1 材料本实验所用缢蛏采自浙江省三门县东航水产育苗有限公司生产基地。缢蛏早期发育个体用300目滤网收集,包括受精卵期、担轮幼虫期、D型面盘幼虫期、壳顶幼虫期、匍匐幼虫期、单水管期和双水管期,共7个时期。将收集到的样本保存于1.5 mL RNase-free离心管中,加入足量RNAstore,4 ℃保存。低温运回实验室,-80 ℃保存备用。
将1龄缢蛏带回实验室,在室温28 ℃、盐度15的海水中暂养1周后,分别取血淋巴、水管、斧足、外套膜、肝胰腺、性腺和鳃等7个组织,放入1.5 mL RNase-free离心管中,用液氮快速预冷,-80 ℃保存备用。将稚贝带回实验室,用12目和8目的筛网进行筛选,筛选出大小规格一致的稚贝,在室温28 ℃、盐度15的海水中暂养以备后续生长实验使用。
1.2 cDNA模板链的合成参照RNAsimple总RNA提取试剂盒(北京,天根)说明书提取各发育时期以及各组织的总RNA,并用1%琼脂糖凝胶电泳检测RNA完整性,用NanoDrop 2000C来检测OD260/OD280以及RNA质量浓度。参照PrimeScriptTM RT reagent Kit with gDNA Eraser以及PrimeScript ® 1st Strand cDNA Synthesis Kit的试剂盒(TaKaRa)操作要求进行总RNA的反转录,得到的cDNA模板-20 ℃保存备用。
1.3 IGFALSa/b 基因序列的验证在缢蛏转录组文库中获得两个IGFALS基因片段序列,根据获得片段使用Primer 5分别设计上、下游引物,其中ALSa F1R1、ALSa F2R2和ALSa F3R3是IGFALSa基因片段验证所需引物对,ALSb F1R1和ALSb F2R2则是IGFALSb基因片段验证所需引物对(表 1),扩增体系为2×Taq PCR Master Mix 12.5 μL,上下游引物各1 μL (10 μmol/L),1.2节中合成的cDNA模板2 μL和RNase-free water 8.5 μL。反应条件为94 ℃预变性2 min,94 ℃ 30 s变性,54 ℃ 30 s复性,72 ℃ 1min延伸,40个循环,最后72 ℃延伸10 min,4 ℃保存。反应产物用1%琼脂糖凝胶电泳验证后割胶回收,并参照MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0试剂盒(TaKaRa)说明书进行纯化,将纯化后的PCR产物和PGEM-T easy载体用T4连接酶16 ℃过夜(16 h)连接,连接产物通过90 s热激转化至DH 5α大肠杆菌中,将菌液接种在不含抗生素的LB培养基中,在37 ℃、150 r/min的摇床中扩培3 h,取200 μL涂板,倒置过夜生长,挑选5个阳性克隆送到上海生物工程股份有限公司测序。

|
表 1 本实验所需引物 Tab.1 Primers for the present study |
使用DNAMAN 8以及NCBI网站的BLAST工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对测序得到的基因片段进行去载体以及序列拼接。开放阅读框和氨基酸预测通过NCBI网站的ORF Finder工具(https://ncbiinsights.ncbi.nlm.nih.gov/tag/orffinder/)获得。蛋白信号肽通过使用SingalP(http://www.cbs.dtu.dk/services/SignalP/)进行预测。使用ProtParam(http://web.expasy.org/protparam/)预测蛋白的理化性质。使用TMpred程序(http://www.ch.embnet.org/software/TMPRED_form.html)分析蛋白跨膜结构。使用工具NetNGlyc 1.0 Server(http://www.cbs.dtu.dk/services/NetNGlyc/)获得N端糖基化位点。使用工具InterPro(http://www.ebi.ac.uk/interpro/search/sequence/)预测氨基酸结构域。
1.4 进化树分析在NCBI网站下载IGFALS蛋白序列,使用软件MEGA 5.0,以邻接法(NJ)构建了缢蛏IGFALS与其他物种的系统进化树。所用物种及登录号分别为文昌鱼(Branchiostoma belcheri )XP_019618313、牡蛎(Crassostrea virginica)XP_022332923、虾夷扇贝(Mizuhopecten yessoensis)XP_021351711、海胆(Strongylocentrotus purpuratus)XP_030845376、火鸡(Meleagris gallopavo)XP_010717629、小嘴树雀(Camarhynchus parvulus)XP_030813748、人(Homo sapiens)AAF06774、美洲鲎(Limulus polyphemus)XP_013781460、牛(Bos taurus)ABE01082、大鼠(Rattus norvegicus)NP_445781、猪(Sus scrofa)NP_001041651、狗(Canis lupus familiaris)XP_547189和狒狒(Papio hamadryas)AAN86722。
1.5 IGFALS a/b基因在不同发育期和不同组织中的表达用已验证的cDNA基因片段设计荧光定量所用引物,引物设计网站为https://www.genscript.com/tools/real-time-pcr-taqman-primer-design-tool。将cDNA模板按梯度稀释(50、5-1、5-2、5-3、5-4、5-5、5-6)绘制标准曲线,得到扩增效率为95%~105%无非特异性扩增产物的引物对(表 1),并将18S rRNA作为内参基因。以稀释5倍的cDNA作为模板,参照TB GreenTM Premix Ex TaqTM Ⅱ (Tli RNaseH Plus)试剂盒(TaKaRa)操作说明进行基因各发育时期和组织的相对定量分析,反应条件为95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,40个循环,在延伸阶段实时采集信号,并在扩增结束后收集熔解曲线荧光信号。
荧光定量数据由软件Bio-Red CFX Manager V1.6导出,目的基因和内参基因的相对定量结果采用2-ΔΔCt法计算。
1.6 不同胰岛素浓度对IGF系统相关基因的影响将胰岛素粉末溶解于1 mol/L的Tris-HCL(pH 6.8,不含EDTA)中,缓缓加入1 mol/L的HCL,直至胰岛素完全溶解,再缓缓加入1 mol/L的NaOH调节pH至6.8,最终配制成2.5 mg/mL的母液,4 ℃保存备用。设置6个胰岛素质量浓度实验组,分别为0、5、10、20、50和100 mg/L,每组将10只2月龄稚贝放入30 mL培养皿中,加入盐度15的藻液20 mL,按照设置的实验组分别加入不同质量浓度的胰岛素,并在24 h后进行取样,取得样品用液氮快速预冷,-80 ℃保存。
将保存的样品用1.2节中的方法进行总RNA的提取以及反转录,并在转录组数据库中筛选获得IGF系统相关基因序列[14],分别为类胰岛素受体底物-1(insulin receptor substrate 1-like, IRS)、3-磷酸肌醇依赖性蛋白激酶-1(3-phosphoinositide-dependent protein kinase-1, PDK1)和丝裂原活化蛋白激酶结合蛋白-1(Mitogen-activated protein kinase-binding protein-1, MPKP1),通过各基因序列设计荧光定量引物(表 1),采用1.5节中的方法检测各基因在不同胰岛素质量浓度下的相对表达量。
1.7 长期摄入胰岛素对于缢蛏日生长率的影响根据1.6节中的实验结果,最终采用10 mg/L的胰岛素质量浓度作为长期生长实验的最终质量浓度。挑选大小规格一致且暂养1周的稚贝,通过随机抽样法,选择100只稚贝用游标卡尺分别测得其平均壳长为(0.338 2±0.038 2) cm,平均壳宽为(0.163 0±0.011 0) cm。设置3个组,分别为胰岛素组、Tris-HCL组以及空白组,每组放置稚贝150只。每天定时换水,投喂藻液,并按设置的组别对各组进行相应处理,40 d以后,用游标卡尺分别测量各组稚贝的壳长壳宽。缢蛏稚贝日生长率计算公式[15]如下:
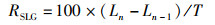 (1)
(1)
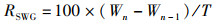 (2)
(2)
式中:RSLG为壳长日生长率,%;RSWG为壳宽日生长率,%;Ln为正式实验40 d后的稚贝壳长, cm;Ln-1为正式实验前的稚贝壳长,cm;Wn为正式实验40 d后的稚贝壳宽,cm;Wn-1正式实验前的稚贝壳宽,cm;T表示实验天数,d。
1.8 统计分析所有数据采用平均值±标准差表示。使用软件SPSS 18.0,通过单因素方差分析(ANOVA)计算各发育期、各组织和不同胰岛素浓度刺激之后的基因表达量差异,及各实验组日生长率之间的差异,P < 0.05表示具有显著性差异,使用SigmaPlot 12.5软件绘图。
2 结果 2.1 缢蛏IGFALSa/b基因序列分析特征IGFALSa基因的cDNA序列为4 809 bp(NCBI登录号:MN910104),其中包括5′非编码区469 bp,3′非编码区1 349 bp,包含Poly A,开放阅读框(open reading frame, ORF)2 991 bp,共编码996个氨基酸。SingalP预测结果显示,蛋白N端1~17个氨基酸构成IGFALSa的信号肽。预测其蛋白分子量(MW)为112.91 ku,理论等电点(pI)为8.99。Tmpred预测结果显示,IGFALSa是非跨膜蛋白。糖基化预测结果显示IGFALSa具有6个N糖基化位点,分别为第22、191、298、346、389以及727个氨基酸。InterPro的蛋白结构预测显示,第179~661个氨基酸为富含亮氨酸序列,包括19个亮氨酸残基富集(leucine-rich repeats, LRR)结构域。其中,第18个LRR结构域由19个氨基酸组成,第6、8、9、10、12、13个LRR结构域由22个氨基酸组成,第19个LRR结构域由23个氨基酸组成,其余LRR结构域均由24个氨基酸组成。此外,第674~726位氨基酸为富含亮氨酸的C-端结构域,第748~956位氨基酸为胰蛋白酶样丝氨酸蛋白酶结构域。
IGFALSb基因的cDNA序列为1 925 bp(NCBI登录号:MN910105),其中包括5′非编码区266 bp,部分3′非编码区18 bp,ORF1 641 bp,共编码546个氨基酸。信号肽结果预测显示,N端1~17个氨基酸构成IGFALSb的信号肽。MW为62.48 ku,pI为8.87。Tmpred预测结果显示,IGFALSb是非跨膜蛋白。糖基化预测结果显示,IGFALSb具有6个N糖基化位点,分别在第47、74、84、131、394和481个氨基酸。氨基酸结构预测发现:第45~410个氨基酸共有7个LRR结构域,其中第7个LRR结构域由20个氨基酸组成,第4和第6个LRR结构域由22个氨基酸组成,第1和第3个结构域由24个氨基酸组成,第2和第5个结构域分别由26和33个氨基酸组成。
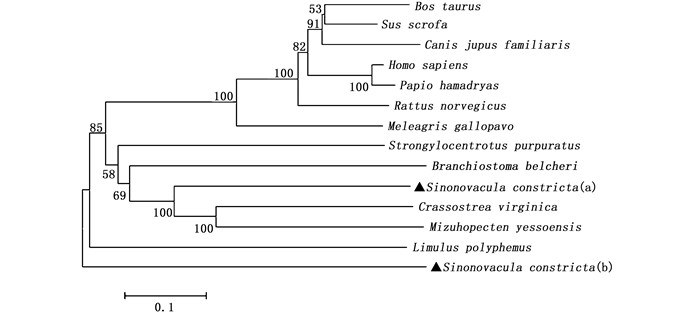
2.2 缢蛏IGFALSa/b的系统进化树分析利用NJ法构建IGFALS的系统进化树,结果显示,哺乳动物和鸟类聚为一支,而鱼类以及软体动物的亲缘关系则比较接近。缢蛏IGFALSa与软体动物中的牡蛎和虾夷扇贝的亲缘关系较近,聚为一支,支持概率达到100%。此外,缢蛏的IGFALSb与美洲鲎的亲缘关系较近,并在进化树中单独聚为一支(图 1)。
|
节点上的数字表示重复1 000次的自举(Bootstrap)检验置信值;▲表示缢蛏的IGFALSa/b。 Using the neighbour-joining (NJ) method with 1 000 bootstrap repeats; IGFALSa/b of Sinonovacula constricta are indicated by ▲. 图 1 基于IGFALSa/b氨基酸序列的系统进化树 Fig. 1 Phylogenetic analysis based on amino acid sequences of IGFALSa/b |
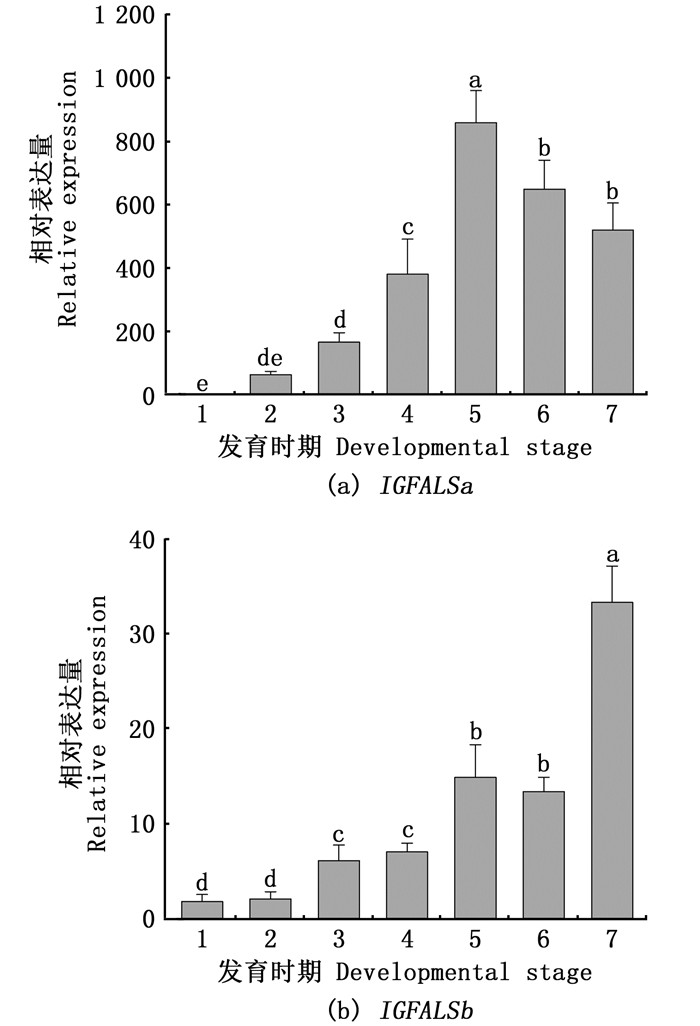
利用qRT-PCR技术检测了两个IGFALS基因在缢蛏的不同发育时期和不同组织中的相对表达情况(图 2,3),其中内参基因为18S rRNA。结果显示,在缢蛏幼虫发育过程中,IGFALSa主要在壳顶幼虫期、匍匐幼虫期、单水管期以及双水管期表达,在受精卵时期的表达量极低,之后表达量随着幼虫的发育逐渐上升。在不同组织中,IGFALSa主要在外套膜和性腺中表达,在肝胰腺、鳃、血淋巴、水管和斧足中的表达量相对较低。
|
1.胚胎期; 2.担轮幼虫期; 3.D型面盘幼虫期; 4.壳顶幼虫期; 5.匍匐幼虫期; 6.单水管期; 7.双水管期;数据以平均值±标准误(n=3)的形式呈现;不同字母代表着显著性差异(P < 0.05)。 1. Embryogenesis; 2. Trochophore; 3. Veliger; 4. Umbo larvae; 5. Creeping larvae; 6. Single pipe juvenile; 7. Double pipe juvenile; bars represent the Mean±SE (n=3); different letters represent significant differences (P < 0.05). 图 2 IGFALSa/b不同发育时期相对表达量 Fig. 2 Relative expression of IGFALSa/b at different developmental stages |

|
1.肝胰腺; 2.鳃; 3.血淋巴; 4.水管; 5.外套膜; 6.斧足; 7.性腺;数据以平均值±标准误(n=3)的形式呈现;不同字母代表着显著性差异(P < 0.05)。 1. Liver; 2.Gill; 3. Hemolymph; 4.Siphon; 5.Mantle; 6.Foot; 7.Gonad; bars represent the Mean±SE (n=3); different letters represent significant differences (P < 0.05). 图 3 IGFALSa/b不同组织相对表达量 Fig. 3 Relative expression of IGFALSa/b in different tissues |
IGFALSb基因在各个发育时期均有表达,其表达量随着幼虫的发育不断上升,并在双水管期表达量达到最高。在不同组织中,发现IGFALSb主要在水管、斧足、性腺和外套膜中表达,其中在水管的表达量最高,在肝胰腺、鳃和血淋巴中只有极少量表达。
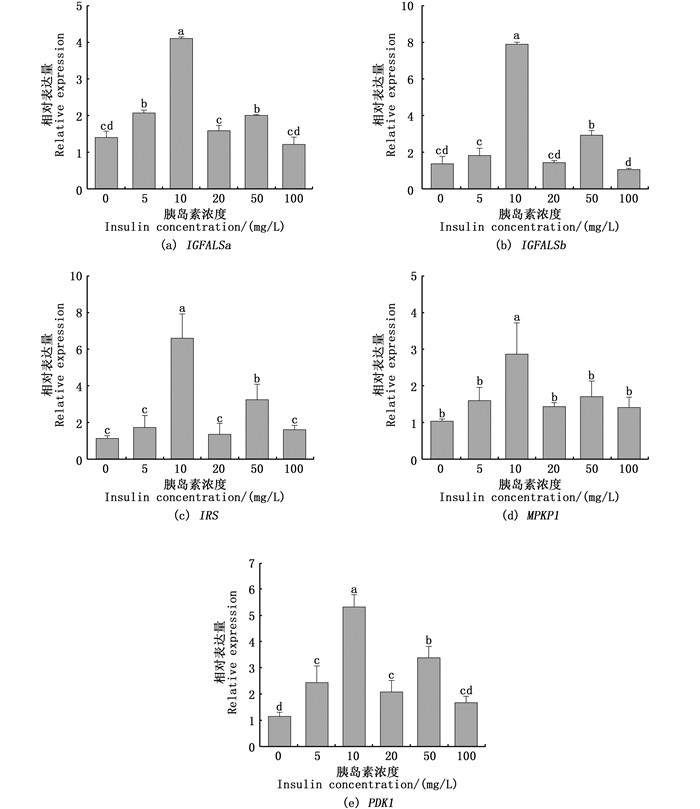
2.4 胰岛素对缢蛏IGF系统基因的影响利用不同浓度胰岛素对缢蛏稚贝进行喂食,并在24 h后检测IGFALSa、IGFALSb、IRS、PDK1和MPKP1 5个基因的相对表达情况(图 4)。
|
数据以平均值±标准误(n=3)的形式呈现;不同字母代表着显著性差异(P < 0.05)。 Bars represent the Mean±SE (n=3); different letters represent significant differences (P < 0.05). 图 4 不同胰岛素浓度对IGFALSa/b、IRS、MPKP1、PDK1表达量的影响 Fig. 4 Effect of different insulin concentrations on IGFALSa/b, IRS, MPKP1, PDK1 expression levels |
结果显示,当胰岛素质量浓度为10 mg/L时,IGFALSa、IGFALSb、IRS、PDK1和MPKP1 5个基因表达量均有显著上升。
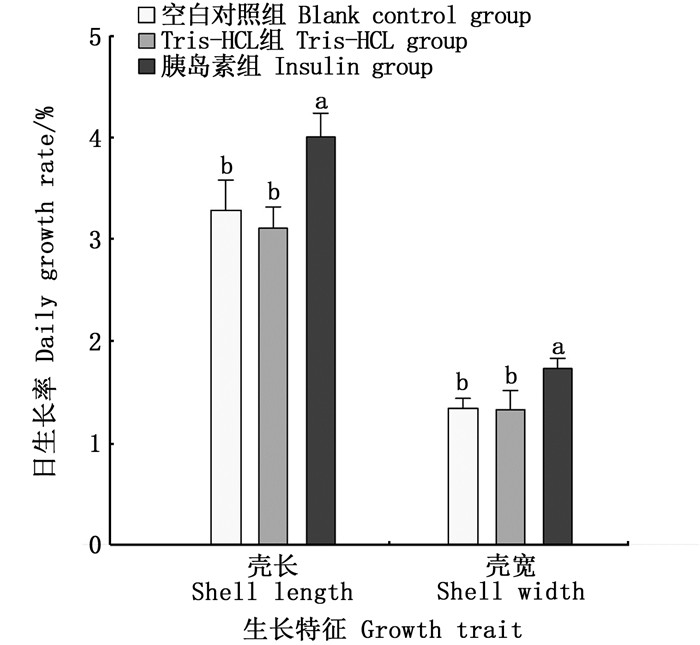
2.5 长期摄入胰岛素对缢蛏日生长率的影响为了探究IGF系统对缢蛏生长的影响,在2.4节的基础上,进一步测定长期摄入胰岛素对于缢蛏日生长率的影响(图 5)。结果显示,在加入胰岛素喂养40 d后,缢蛏壳长和壳宽的日生长率都明显高于空白组和Tris-HCL组。各组壳长的平均日生长率分别为胰岛素组4%,空白组3.28%,Tris-HCL组3.11%。各组壳宽的平均日生长率分别为胰岛素组1.73%,空白组1.34%,Tris-HCL组1.33%。
|
数据以平均值±标准误(n=10)的形式呈现;不同字母代表显著性差异(P < 0.05)。 Bars represent the Mean±SE (n=10); different letters represent significant differences (P < 0.05). 图 5 长期摄入胰岛素对缢蛏稚贝日生长率的影响 Fig. 5 Effect of long-term insulin intake on daily clam growth rate of juveniles |
动物生长发育的调控机制一直是发育生物学以及基因表达调控所关注的热点问题。IGF信号通路能够介导生长激素(growth hormone, GH)来调节机体的生理功能[16]。在脊椎动物中,IGF1和IGF2在细胞的凋亡与增殖分化过程中起着关键作用,IGFALS则在确保IGF对靶组织的作用中扮演着重要角色。有研究表明,果蝇(Drosophila melanogaster)中的IGFALS与其幼虫的生长和发育相关[17-18]。
本研究首次在缢蛏转录组库中筛选鉴定了两个IGFALS基因。值得注意的是,目前在人[12]、小鼠[19]、牛[20]以及果蝇[17]的研究中,仅发现了一个IGFALS基因。在之前的研究中,首次在缢蛏的IGF系统中发现了两个类胰岛素受体(insulin-like peptide receptor, ILPR)[10]。推测在贝类中存在独特的IGF信号通路系统。通过结构预测分析,发现两个IGFALS蛋白都包含了多个LRR结构域,符合IGFALS氨基酸序列的主要特征。LRR可折叠成弧形或马蹄形,参与蛋白质间的作用。而IGFALS中的LRR结构域主要参与了IGF与IGFBP之间的结合[12]。对比缢蛏的两个IGFALS蛋白结构,发现IGFALSa的LRR结构域更多,且具有富含亮氨酸的C-端结构域和胰蛋白酶样丝氨酸蛋白酶结构域,推测IGFALSa在参与蛋白质的结合中起着更重要的作用。
在缢蛏不同发育期的表达分析中,两个IGFALS基因在幼虫发育前期的表达量都极低,而随着发育时间的延长,表达量逐渐升高。在绵羊和猪的胚胎细胞发育过程中,发育前期几乎检测不到IGFALS基因的表达,而随着发育时间的增加,IGFALS基因的表达也会逐渐增加[21-22]。此外,在绵羊出生后的早期发育过程中,IGFALS的表达量与发育时间存在正相关[21],这与的实验结果一致,表明缢蛏的IGFALS很可能参与了幼虫的变态发育。在1龄缢蛏成体的各组织中,发现IGFALSa在外套膜中的表达量最高,在性腺中的表达量也比较高,而IGFALSb则在水管中的表达量最高,其次是外套膜,揭示IGFALSa和IGFALSb在缢蛏成体的繁殖和生长中发挥着不同的功能。
在不同质量浓度胰岛素对IGFALS表达模式的影响中,当胰岛素刺激24 h后,IGFALSa以及IGFALSb的表达量均在质量浓度为10 mg/L时有极显著的上升,而当质量浓度达到20 mg/L时,基因表达量基本恢复与0 mg/L一致,表明胰岛素刺激存在着浓度效应。有研究[23]表明,在胰岛素的刺激下,大鼠肝脏细胞和Kupffer细胞中IGFALS以及IGFBP3的表达均有上升,且同样存在剂量依赖性。此外,在不同质量浓度胰岛素的刺激下,两个IGFALS基因的表达模式相似。在绵羊的胚胎研究中,发现IGFALS基因的表达会随着发育时间的增加而增加[21],而在怀孕10 d的大鼠体内,IGFALS的含量是未怀孕大鼠的3倍[24]。结合IGFALS在缢蛏不同发育时期和不同组织中的表达模式,推测在缢蛏的早期生长发育阶段,两个IGFALS基因起着协同作用,而在其成体阶段,两个IGFALS基因分别在缢蛏的繁殖和生长中承担着不同的角色。
在果蝇和线虫的IGF信号通路中,配体与受体结合后,会直接与受体底物或者磷酸化的受体继续结合,进而激活相应的蛋白激酶,然后调控下游转录因子[25-27]。在缢蛏转录组文库中找到了受体底物IRS,以及MAPK途径和PI3K/Akt途径中的两个蛋白激酶相关基因MPKP1和PDK1,检测了不同胰岛素质量浓度对IRS、MPKP1和PDK1表达模式的影响,得到与两个缢蛏IGFALS基因相似的结果。IRS、MPKP1和PDK1这3个基因均在胰岛素质量浓度为10 mg/L时表达量显著上升,表明缢蛏的IGF信号通路与MAPK途径和PI3K/Akt途径之间存在着调控机制,这与之前的研究[6]类似。在本实验中,以质量浓度10 mg/L的胰岛素长期喂养缢蛏稚贝,发现其壳长壳宽的日生长率都高于对照组,这与胰岛素质量浓度实验中各基因表达模式结果相符。同样,在小鼠的胚胎中将IGFALS基因过表达后,对其出生后的生长产生了显著影响[28]。
综上所述,本研究筛选鉴定了缢蛏两个IGFALS基因(IGFALSa和IGFALSb),这2个基因均在缢蛏幼虫发育前期痕量表达,在发育后期表达量显著增加,且IGFALSa在外套膜和性腺中高表达,而IGFALSb则在水管中高表达。当受到质量浓度为10 mg/L的胰岛素刺激时,两个IGFALS基因表达量显著上升,且影响IGF信号通路下游基因IRS、MPKP1和PDK1,并促进缢蛏稚贝的生长。研究结果为阐明IGF信号通路在贝类发育和生长方面的作用机制提供了参考。
| [1] |
李浩, 薛宝宝, 李炼星, 等. 缢蛏快长选育系早期生长性状的遗传参数估计[J]. 海洋渔业, 2018, 40(3): 342-350. LI H, XUE B B, LI L X, et al. Heritability estimates for growth traits at the earlier stage of the fast-growth selected line of Sinonovacula constricta[J]. Marine Fisheries, 2018, 40(3): 342-350. DOI:10.3969/j.issn.1004-2490.2018.03.010 |
| [2] |
NIU D H, XIONG Y, PENG M X, et al. Hemolytic reactions in the hemolymph of bivalve Sinonovacula constricta show complement-like activity[J]. Fish & Shellfish Immunology, 2018, 79: 11-17. |
| [3] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2019. Bureau of Fisheries, Ministry of Agriculture and Rural Affairs, The China Society of Fisheries. China fishery statistical yearbook[M]. Beijing: China Agriculture Press, 2019. |
| [4] |
谢淑媚, 牛东红, 阮海灯, 等. 缢蛏IGFBP基因结构及生长性状相关SNP筛选[J]. 水产学报, 2015, 39(6): 799-809. XIE S M, NIU D H, RUAN H D, et al. Molecular characterization of IGFBP and association analysis with growth traits in the razor clam Sinonovacula constricta[J]. Journal of Fisheries of China, 2015, 39(6): 799-809. |
| [5] |
郑凯迪.斑马鱼Igfals的表达、转录调控及功能研究[D].重庆: 西南大学, 2010. ZHENG K D. Expression, transcriptional regulation and function of insulin-like growth factor acid-labile subunit (Igfals) in zebrafish[D]. Chongqing: Southwest University, 2010. |
| [6] |
KIDO Y, NAKAE J, ACCILI D. Clinical review 125:the insulin receptor and its cellular targets[J]. The Journal of Clinical Endocrinology & Metabolism, 2001, 86(3): 972-979. |
| [7] |
封利颖.虾夷扇贝IGFBP5、IGF2BP2基因克隆、表达分析及与生长相关的SNP位点筛查[D].青岛: 中国海洋大学, 2013. FENG L Y. IGFBP5 and IGF2BP2 genes in Yesso scallop (Patinopecten yessoensis): molecular cloning, expression analysis and identification of SNPs associated with growth traits[D]. Qingdao: Ocean University of China, 2013. |
| [8] |
ZHANG H, SHI Y, HE M X. Molecular identification of an insulin growth factor binding protein (IGFBP) and its potential role in an insulin-like peptide system of the pearl oyster, Pinctada fucata[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2017, 214: 27-35. DOI:10.1016/j.cbpb.2017.09.003 |
| [9] |
张龙辉. IGFBP4, 5, 7和胰岛素样蛋白在杂色鲍幼虫附着变态过程中的作用研究[D].厦门: 集美大学, 2014. ZHANG L H. IGFBP4, 5, 7 and insulin-related peptide roles larval settlement and metamorphosis in the small abalone Haliotis diversicolor[D]. Xiamen: Jimei University, 2014. |
| [10] |
谢淑媚.缢蛏类胰岛素生长因子系统3个基因表达特征及功能初步分析[D].上海: 上海海洋大学, 2018. XIE S M. Expression characteristics and preliminary functional analysis of three genes in the insulin-like growth factor system of razor clam Sinonovacula constricta[D]. Shanghai: Shanghai Ocean University, 2018. |
| [11] |
李贵林, 牛丽莉, 刘海峰, 等. 哺乳动物胰岛素样生长因子酸不稳定亚基的结构与功能[J]. 遗传, 2015, 37(12): 1185-1193. LI G L, NIU L L, LIU H F, et al. Structure and function of insulin-like growth factor acid-labile subunits in mammalian homologues[J]. Hereditas (Beijing), 2015, 37(12): 1185-1193. |
| [12] |
LEONG S R, BAXTER R C, CAMERATO T, et al. Structure and functional expression of the acid-labile subunit of the insulin-like growth factor-binding protein complex[J]. Molecular Endocrinology, 1992, 6(6): 870-876. |
| [13] |
BOISCLAIR Y R, RHOADS R P, UEKI I, et al. The acid-labile subunit (ALS) of the 150 kDa IGF-binding protein complex:an important but forgotten component of the circulating IGF system[J]. Journal of Endocrinology, 2001, 170(1): 63-70. DOI:10.1677/joe.0.1700063 |
| [14] |
NIU D H, WANG F, XIE S M, et al. Developmental transcriptome analysis and identification of genes involved in larval metamorphosis of the razor clam, Sinonovacula constricta[J]. Marine Biotechnology, 2016, 18(2): 168-175. DOI:10.1007/s10126-016-9691-y |
| [15] |
PENG M X, YE B, LIU X J, et al. Effects of alkalinity and pH on survival, growth, and enzyme activities in juveniles of the razor clam, Sinonovacula constricta[J]. Frontiers in Physiology, 2018, 9: 552. DOI:10.3389/fphys.2018.00552 |
| [16] |
鲍丽颖, 黄耕培. GH-IGF-I轴与骨发育的研究进展[J]. 天津体育学院学报, 2002, 17(2): 60-62. BAO L Y, HUANG G P. The study progress of GH-IGF-I axis and bone development[J]. Journal of Tianjin Institute of Physical Education, 2002, 17(2): 60-62. DOI:10.3969/j.issn.1005-0000.2002.02.017 |
| [17] |
SWANSON L E, YU M, NELSON K S, et al. Drosophila convoluted/dALS is an essential gene required for tracheal tube morphogenesis and apical matrix organization[J]. Genetics, 2009, 181(4): 1281-1290. DOI:10.1534/genetics.108.099531 |
| [18] |
ARQUIER N, GÉMINARD C, BOUROUIS M, et al. Drosophila ALS regulates growth and metabolism through functional interaction with insulin-like peptides[J]. Cell Metabolism, 2008, 7(4): 333-338. DOI:10.1016/j.cmet.2008.02.003 |
| [19] |
BOISCLAIR Y R, SETO D, HSIEH S, et al. Organization and chromosomal localization of the gene encoding the mouse acid labile subunit of the insulin-like growth factor binding complex[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(19): 10028-10033. DOI:10.1073/pnas.93.19.10028 |
| [20] |
KIM J W, RHOADS R P, SEGOALE N, et al. Isolation of the cDNA encoding the acid labile subunit (ALS) of the 150 kDa IGF-binding protein complex in cattle and ALS regulation during the transition from pregnancy to lactation[J]. Journal of Endocrinology, 2006, 189(3): 583-593. DOI:10.1677/joe.1.06824 |
| [21] |
RHOADS R P, GREENWOOD P L, BELL A W, et al. Organization and regulation of the gene encoding the sheep acid-labile subunit of the 150-kilodalton insulin-like growth factor-binding protein complex[J]. Endocrinology, 2000, 141(4): 1425-1443. DOI:10.1210/endo.141.4.7425 |
| [22] |
LEE C Y, KWAK I, CHUNG C S, et al. Molecular cloning of the porcine acid-labile subunit (ALS) of the insulin-like growth factor-binding protein complex and detection of ALS gene expression in hepatic and non-hepatic tissues[J]. Journal of Molecular Endocrinology, 2001, 26(2): 135-144. DOI:10.1677/jme.0.0260135 |
| [23] |
SCHARF J G, RAMADORI G, BRAULKE T, et al. Cellular localization and hormonal regulation of biosynthesis of insulin-like growth factor binding proteins and of the acid-labile subunit within rat liver[J]. Progress in Growth Factor Research, 1995, 6(2/4): 175-180. |
| [24] |
HWANG D L, LEE P D K, COHEN P. Quantitative ontogeny of murine insulin-like growth factor (IGF)-I, IGF-binding protein-3 and the IGF-related acid-labile subunit[J]. Growth Hormone & IGF Research, 2008, 18(1): 65-74. |
| [25] |
PARRELLA E, LONGO V D. Insulin/IGF-I and related signaling pathways regulate aging in nondividing cells:from yeast to the mammalian brain[J]. The Scientific World Journal, 2010, 10: 161-177. DOI:10.1100/tsw.2010.8 |
| [26] |
KIMURA K D, TISSENBAUM H A, LIU Y X, et al. daf-2, an insulin receptor-like gene that regulates longevity and diapause in Caenorhabditis elegans[J]. Science, 1997, 277(5328): 942-946. DOI:10.1126/science.277.5328.942 |
| [27] |
CLANCY D J, GEMS D, HARSHMAN L G, et al. Extension of life-span by loss of CHICO, a Drosophila insulin receptor substrate protein[J]. Science, 2001, 292(5514): 104-106. DOI:10.1126/science.1057991 |
| [28] |
SILHA J V, GUI Y T, MODRIC T, et al. Overexpression of the acid-labile subunit of the IGF ternary complex in transgenic mice[J]. Endocrinology, 2001, 142(10): 4305-4313. DOI:10.1210/endo.142.10.8427 |
2. Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


