2. 上海海洋大学 农业农村部淡水水产种质资源重点实验室, 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
维生素D在维持机体正常的生长发育、调节机体钙磷代谢平衡、改善机体的免疫系统和调控基因表达等方面发挥重要的作用[1]。自然界中存在两种形式的维生素D,即麦角钙化固醇(维生素D2)和胆钙化醇(维生素D3),而动物体内仅存在维生素D3。动物体内的维生素D3一般由维生素D3原(7-脱氢胆固醇)经紫外线照射转化而来,然而在水体下层光线较弱,且不同深度光线差异较大,因此鱼类获得的维生素D3很少由皮肤产生,主要还是靠鳃和肠道的吸收来保证机体对维生素D的需要。研究[2]表明:脊椎动物能直接从食物中获取维生素D,且鱼类维生素D内分泌系统跟哺乳动物相似[3],但是在维生素D的代谢过程中,鱼类又有着它的特别之处。对于哺乳动物而言,维生素D3无论是从食物中获取还是经皮肤生成都会进入血液被维生素D结合蛋白(VBP)转运至肝脏,在肝脏细胞内通过25-羟化酶作用生成25(OH)D3,再经血液转运至肾脏,在1-羟化酶作用下再次在1α位羟基化,生成有生物活性的1α-25(OH)2D3;而鱼类肝脏中含有1-羟化酶,是合成1α-25(OH)2D3的主要器官,故第二次羟基化依旧在肝脏中进行[4]。另一方面,鱼类肝脏和脂肪能积累大量维生素D3,而哺乳动物并没有这种现象。
不同的代谢方式使哺乳动物和水产动物对维生素D的需求量迥异,即使在代谢方式相近的鱼类,其对维生素D的需求量也存在较大的种间差异。如虹鳟[5](Oncorhynchus mykiss)对维生素D的需求量为1 600~2 400 IU/kg饲料、斑点叉尾鮰(Ietalurus punetaus)为1 000[6]或250 IU/kg饲料[7]、杂交罗非鱼(Oreochromis mossambicus)[8]为374.8 IU/kg饲料。饲料中维生素D缺乏或不足时,部分鱼类会出现低血钙、低血磷、骨骼异常等症状[9-10];过量维生素D也会使得部分鱼类生长缓慢且出现中毒症状[5-6]。张璐等[11]通过采用在纯化饲料中添加不同含量的维生素D3的方法,得出用增重率作为评价指标,海鲈(Lateolabrax japonicus)幼鱼对维生素D3的需求量为431.0 IU/kg饲料,以肝脏维生素D3含量作为评价指标时,需求量为2 444.4 IU/kg饲料。而王可宝[12]用不同维生素D3含量的纯化饲料投喂团头鲂(Megalobrama amblycephala),发现饲料中维生素D3含量在500 IU/kg以上时可以防止团头鲂产生维生素D缺乏症,500~1 000 IU/kg可以满足生长的基本需求,1 000~2 000 IU/kg时有利于提高团头鲂生长和非特异性免疫能力,2 000~4 000 IU/kg有利于提高非特异性免疫能力和抗病原菌感染能力,而200 000 IU/kg不仅对非特异性免疫、抗病原菌感染的能力有不利影响,而且对肝细胞和肠道组织造成一定程度的损伤。这也说明了鱼类对维生素D的需求量不仅仅因为鱼类大小及种类的不同而有所差异,还会因为不同的研究目的而不同。
大口黑鲈(Micropterus salmoides)是一种温水肉食性鱼类,由于适应能力强、生长速度快、病害少、对温度的适应范围较广和肉质鲜美等优点而成为我国淡水鱼养殖的主要品种之一。然而,全程专用的大口黑鲈人工配合饲料并没有在我国得到广泛应用,这与营养素需求量研究不够充分、已有饲料产品仍需进一步优化不无关系。
基于维生素D对动物的重要生理功能及不同水产动物对其的需求量差异,不难想象饲料中维生素D含量的微小变化就可能引起鱼体生理功能的改变。因此本研究尝试在较小的添加量范围内研究维生素D对大口黑鲈生长性能、钙磷代谢、血清和肝脏抗氧化能力以及抗感染能力的影响,旨在为复合维生素的配方设计和配合饲料的研发提供科学的理论依据。
1 材料与方法 1.1 实验饲料实验饲料根据大口黑鲈营养需求[13]配制。用部分脱脂鱼粉、豆粕、玉米蛋白粉和血粉作为蛋白源,鱼油和菜籽油作为脂肪源,微晶纤维素与沸石粉作为填充剂配制基础饲料,在此基础上分别添加0(VD0)、15(VD15)、30(VD30)、45(VD45)和60 IU/kg(VD60)的维生素D3(含量为500 000 IU/kg的饲料添加剂维生素D3微粒),VD0为对照。由于鱼粉脱脂后仍然残留部分维生素D3,故通过测定基础组的维生素D3含量,计算得到各组的维生素D3含量为1 370、1 385、1 400、1 415和1 430 IU/kg。将饲料原料粉碎,全部通过60目的网筛后,充分混匀,用饲料制粒机制成直径为2 mm的颗粒,在50 ℃条件下烘干,使得水分含量低于10%,密封于-20 ℃保存。基础饲料组成及营养成分见表 1。

|
表 1 基础饲料组成及营养水平(干物质基础) Tab.1 Composition and nutrient levels of control diet (DM basis) |
实验在上海海洋大学滨海养殖基地进行。正式实验前,将从浙江省湖州市购买的大口黑鲈鱼苗在水泥池(长×宽×高=3 m×2 m×1 m)中暂养14 d,暂养期间投喂购买的商品饲料。正式实验开始前暂养鱼饥饿处理24 h,然后挑选体质健康、规格均匀的大口黑鲈[(14.19±0.05)g],每组设置4个网箱(长×宽×高=1.8 m×0.7 m×0.8 m),每个网箱40尾鱼,养殖周期为63 d,每天限量投喂2次(8: 00、16: 00),每日投喂量是体质量的2%~3%,并保持每组之间投喂量相同。投喂饲料30 min后收集每个网箱的残饵,烘干、称量并记录,投喂量与残饵量的差值即为摄食量。定期检测养殖水体水质,水质条件控制在:溶解氧质量浓度高于7.0 mg/L;水体总氨氮质量浓度低于0.5 mg/L;pH为7.5~8.5;水温为23~26 ℃;吸污换水间隔时间为7 d,每次换水量为总养殖水体的1/3左右。
1.3 样品的采集养殖实验结束后,将大口黑鲈进行24 h的饥饿处理,分别统计每个网箱中大口黑鲈的数目并称量。随机在每个网箱中捞取10尾鱼,使用丁香酚将其麻醉后,称体质量,测体长,然后尾静脉取血,并在3 500 r/min转速下离心15 min,吸取上清液置于-20 ℃保存,用于各项生理生化指标的分析。取完血液后解剖鱼体,称量内脏团质量及肝脏质量,用于计算鱼体的形体指标;取侧线上方的肌肉,冷冻干燥至恒重,粉碎后密封保存,用于粗蛋白、粗脂肪以及钙磷含量的测定;取脊椎骨用来测定粗灰分和钙、磷含量。
1.4 抗感染实验养殖实验结束后,选择各组间规格相对一致的鱼进行攻毒实验。每个饲料组设3个平行,每个平行20尾鱼,并注射生理盐水作为阴性对照。病原菌为淡水鱼类细菌性败血症病原嗜水气单胞菌(Aeromonas hydrophila),由国家水生动物病原库馈赠。将活化后的细菌用无菌生理盐水稀释至终浓度为5×107cells/mL,按每100 g鱼体质量腹腔注射菌液1.0 mL,并统计0、12、24、36、48、72和96 h的累计死亡率。
1.5 测定指标及方法在进行3个及以上的技术重复、确保仪器稳定性和检测方法准确性的基础上,所有指标再进行4个及以上的生物学重复测定。
1.5.1 常规营养成分的测定实验饲料和肌肉中水分的含量:烘箱干燥恒重法(GB/T 6435—1986);粗蛋白质含量:凯氏定氮法(GB/T 6432—1994);粗脂肪含量:氯仿-甲醇法[15];粗灰分含量:马弗炉550 ℃灼烧法(GB/T 6438—1992);肌肉和脊椎骨中钙含量:高锰酸钾滴定法(GB/T 6436—2002);肌肉和脊椎骨中磷含量:钼黄比色法(GB/T 6437—2002)。
1.5.2 生化指标的测定生化指标采用南京建成生物工程研究所提供的试剂盒进行测定。
1.6 指标的计算各项指标计算公式如下:
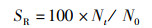 (1)
(1)
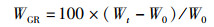 (2)
(2)
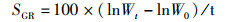 (3)
(3)
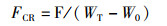 (4)
(4)
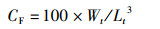 (5)
(5)
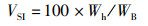 (6)
(6)
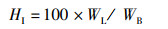 (7)
(7)
式中:SR为存活率, %;WGR为增重率, %;SGR为特定生长率,%/d;FCR为饲料系数;CF为肥满度,g/cm3;VSI为脏体比, %;HI为肝体比, %;W0为初始体质量,g;Wt为终末体质量,g;t为实验天数,d;Nt为终末尾数;N0为初始尾数;F为摄食量;Lt为终末体长,cm;Wh为内脏质量,g;WL为肝脏质量,g;WB为实验末鱼体质量,g;WT为实验末总质量,g;W0为实验初总质量,g。
1.7 数据统计与分析实验数据以平均值±标准差(Mean±SD)表示。采用SPSS 17.0软件对数据进行单因素方差分析(One-way ANOVA), 若影响显著,则用Duncan’s法进行多重差异显著性比较,显著水平P < 0.05。
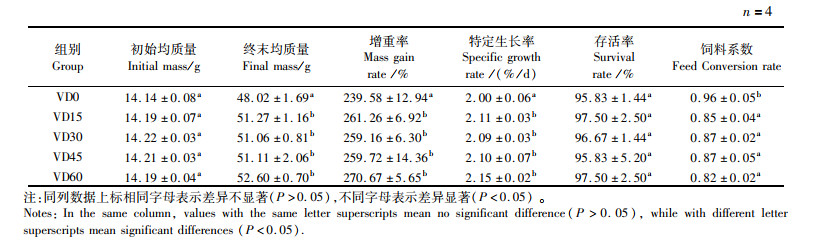
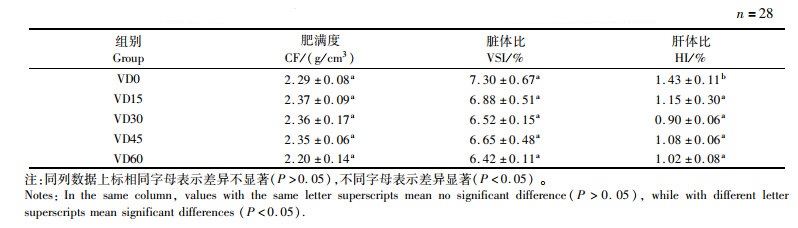
2 结果 2.1 维生素D3含量对大口黑鲈生长性能、存活率及饲料系数的影响由表 2可知,饲料中添加不同含量的维生素D3可以显著影响大口黑鲈的增重率、特定生长率和饲料系数(P < 0.05),但是对存活率没有显著影响(P>0.05)。由表 3可以看出,饲料中不同含量维生素D3对大口黑鲈的肥满度和脏体比无显著性影响(P>0.05),添加维生素D3可显著降低大口黑鲈肝体比(P < 0.05)。
|
表 2 饲料维生素D3含量对大口黑鲈生长、存活率及饲料系数的影响 Tab.2 Effect of dietary vitamin D3 content on growth, survival rate and feed coefficient of largemouth bass |
|
表 3 饲料维生素D3含量对大口黑鲈形体指标的影响 Tab.3 Effect of dietary vitamin D3 content on the index of largemouth bass |
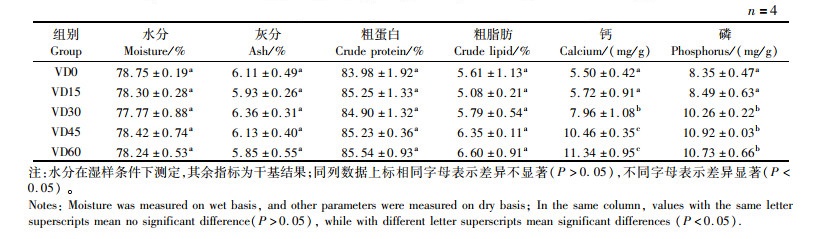
由表 4可知:饲料中不同维生素D3含量显著影响大口黑鲈肌肉中的钙和磷含量,当维生素D3水平超过1 400 IU/kg时,肌肉中的钙和磷含量均显著高于VD0(P < 0.05),且呈现逐渐增加的趋势;饲料中不同维生素D3含量对肌肉粗蛋白质、粗脂肪、粗灰分和水分含量均没有显著影响(P>0.05)。
|
表 4 饲料维生素D3含量对大口黑鲈肌肉成分的影响 Tab.4 Effect of dietary vitamin D3 on the muscle composition of largemouth bass |
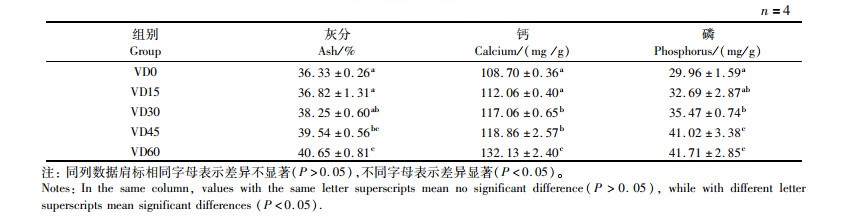
由表 5可知,饲料中不同维生素D3含量显著影响大口黑鲈脊椎骨中粗灰分、钙和磷的含量(P < 0.05)。随着饲料中维生素D3含量的升高,大口黑鲈脊椎骨中粗灰分、钙和磷的含量呈增加趋势,且在维生素D3含量最高组(VD60组)均显著高于VD0组,P < 0.05。
|
表 5 饲料维生素D3含量对大口黑鲈脊椎骨粗灰分和钙磷含量的影响 Tab.5 Effect of dietary vitamin D3 on crude ash and calcium and phosphorus contents in vertebrae of largemouth bass |
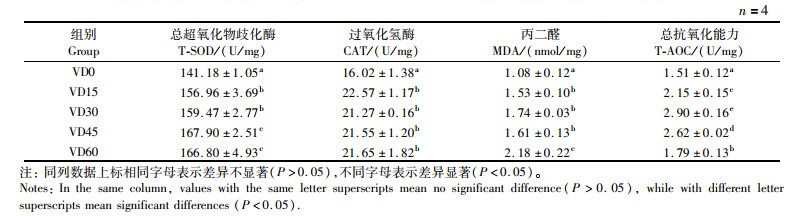
由表 6可知:添加维生素D3可以显著提高大口黑鲈肝脏中总超氧化物岐化酶活力、过氧化氢酶活力和总抗氧化能力(P < 0.05);与此同时,大口黑鲈肝脏中的丙二醛含量随着维生素D3添加量的增加而显著增加(P < 0.05)。
|
表 6 饲料维生素D3含量对大口黑鲈肝脏抗氧化功能的影响 Tab.6 Effect of dietary vitamin D3 on antioxidant function of liver of largemouth bass |
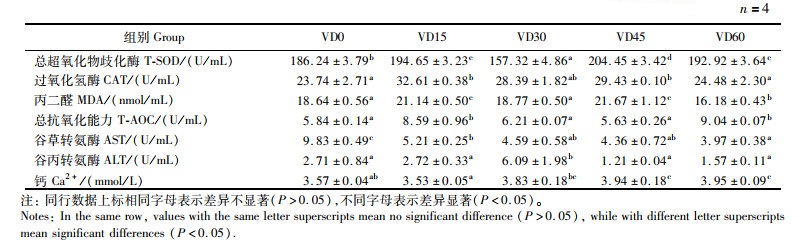
由表 7可知,随着维生素D3添加量的升高,大口黑鲈血清中总超氧化物歧化酶(T-SOD)活力、过氧化氢酶(CAT)活力和丙二醛(MDA)含量呈现先升高再降低再升高再降低的波浪式变化,总抗氧化能力(T-AOC)和谷草转氨酶(ALT)活力呈现先升高再降低再升高的趋势。VD60组SOD和T-AOC活力显著高于VD0组(P < 0.05)。与此同时,添加维生素D可以不同程度显著降低大口黑鲈血清中谷草转氨酶(AST)活力(P < 0.05)。血钙离子含量随着饲料中维生素D3含量的升高而升高,当饲料中维生素D3水平超过1 400 IU/kg时血钙含量均显著高于VD0组(P < 0.05)。
|
表 7 饲料维生素D3含量对大口黑鲈血清生化指标的影响 Tab.7 Effect of dietary vitamin D3 on serum biochemical parameters of largemouth bass |
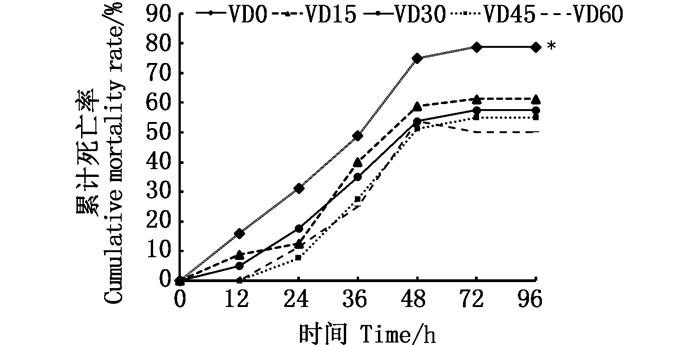
由图 1可知:大口黑鲈在感染嗜水气单胞菌后的12 h开始出现死亡,在12~48 h内死亡率显著上升,到72 h趋于平缓; 在所观察的4 d内,添加维生素D3的实验组其累计死亡率均显著低于VD0组(P < 0.05)。
|
*代表差异显著(P < 0.05,n=3)。 *representing a significant difference (P < 0.05, n=3). 图 1 抗感染实验累计死亡率 Fig. 1 Cumulative mortality from anti-infection experiments |
综上可知,在本实验条件下,添加维生素D3可以显著提高大口黑鲈增重率、特定生长率,降低饲料系数;也可以显著增加鱼体骨骼矿化程度,增加脊椎骨、肌肉钙磷累积量以及血清钙离子浓度,提高大口黑鲈肝脏和血清抗氧化能力以及机体抗感染能力。本研究中,尽管大口黑鲈的生长性能在添加维生素D3的各实验组间无显著差异,但增重率呈现随维生素D3含量增加而逐渐增大的趋势,预示大口黑鲈对维生素D3的最适需求量或超过本研究中设定的最大值。
3 讨论 3.1 维生素D3对大口黑鲈生长性能的影响对于维生素D的促生长作用早有报道。对海鲈幼鱼[11]、团头鲂[12]和青鱼[16](Mylopharyngodon piceus)的研究表明,饲料中适宜含量的维生素D3可显著改善实验鱼的生长性能,降低饲料系数和肝体比。在本实验中,饲料中添加不同含量的维生素D3显著提高了大口黑鲈的增重率和特定生长率,肝体比和饲料系数也有不同程度的下降,与所报道的研究结果基本一致[11],说明本研究中添加的维生素D3不过量。维生素D之所以能起到促进生长的作用,是因为其参与了机体的钙磷调节。对哺乳动物的研究[17]结果表明:维生素D能够引起肠道细胞膜中磷脂酰胆碱的含量以及其结构的改变,提高膜的通透性,加快钙的转运速度;之后通过钙依赖性结合蛋白(CaBP)的合成,加速钙和磷的吸收,血液中的钙和磷含量达到饱和,并维持在正常浓度,进而促进骨骼的生长及钙化,维持机体的正常发育。另一方面,1α-25(OH)2D3还能促进肾小管对钙和磷的重吸收,减少尿磷的排泄[1],对维持血液中钙磷浓度也起到了积极的作用。研究[18]发现,在适宜的范围内,增加饲料中维生素D含量有助于促进机体骨骼的矿化以及钙磷的沉积,低于或者高于这个范围都会使骨骼矿化异常。这也就解释了本实验及张璐等[11]、BARNETT[5]和周歧存等[19]研究中为何随着饲料中维生素D3含量的升高,实验鱼脊椎骨中粗灰分、钙和磷的含量以及大口黑鲈肌肉中钙和磷的含量呈增加趋势,但是低剂量的维生素D会使得鱼体头盖骨出现易碎的现象。如前所述,若维生素D也能在鱼类中按其特有的代谢方式保持血钙和血磷的浓度,则机体的生长就能得到保证。鳃上皮中的钙通道作为鱼体吸收钙的关键环节[20],其钙的转运受到1α-25(OH)2D3的控制[21]。尽管目前尚未证实鱼体通过肠道吸收钙和磷是否也受到1α-25(OH)2D3的调节,但实验鱼脊椎骨中粗灰分、钙和磷含量的增加以及肌肉中钙和磷含量的增加说明维生素D3对钙磷代谢具有直接或间接的调节作用[5, 19],因此能促进鱼体的生长。
3.2 维生素D3对大口黑鲈健康的影响总超氧化物歧化酶(T-SOD)是一种天然存在于机体内部的超氧自由基清除因子[22-23],它可以将有害的O2-·转化为H2O2,而过氧化氢酶(CAT)则进一步将H2O2分解成H2O和O2,从而减轻活性O2-·对机体造成的损伤。丙二醛(MDA)是在机体内部O2-·作用下生成的脂质过氧化产物,具有细胞毒性,它的含量间接地反映出机体细胞内部O2-·含量及其受到自由基攻击的严重程度[24]。总抗氧化能力(T-AOC)由酶促和非酶促两个体系组成,协同防护机体氧化,因此与机体的健康程度关系密切。本研究中,添加维生素D3使肝脏和部分组别的血液丙二醛含量增高,与张桐[25]就饲料中不同水平的维生素D3对松浦镜鲤幼鱼影响的研究结果一致,出现这一结果可能与机体脂肪含量升高、由免疫功能增强产生的氧自由基增加以及抗氧化能力的动态变化有关。研究[26]发现,维生素D3的活化形式对于体内脂肪酸氧化具有促进作用。这也间接证实了维生素D3能促成氧自由基的增加。与此同时,大口黑鲈肝脏中T-SOD、CAT和T-AOC显著升高,说明添加维生素D3使大口黑鲈肝脏具备了较强的抗氧化系统。而血清T-SOD、CAT、MDA和T-AOC等抗氧化指标的变化趋势虽与肝脏有所不同,但也较好地反映出饲料中添加维生素D对机体整体健康的促进作用。
在正常情况下,谷丙转氨酶(ALT)主要分布在肝细胞浆内,谷草转氨酶(AST)主要分布在肝细胞浆和肝细胞线粒体中。当肝细胞的通透性发生改变或者肝细胞破裂时,这两种酶就会从细胞中溢出进而进入血液循环,导致血液中转氨酶活力的上升[27]。血清ALT超标反映肝细胞膜的损伤,血清AST超标则表示肝细胞损伤严重至细胞器水平。本实验中,大口黑鲈摄食不同含量的维生素D3饲料后,ALT呈现不规则变化,虽然其机理目前尚不明确,但是VD45和VD60组血清ALT低于VD0组,说明饲料中添加一定量的维生素D3对保护大口黑鲈肝脏细胞膜具有积极的作用;值得一提的是,血清AST活力随着饲料维生素D3含量的增加持续降低,表明饲料维生素D3对保护肝脏线粒体产生了较为明显的效果。
研究表明:随维生素D3添加量的增加,黄鳝(Monopterus albus)脾指数呈现升高的趋势;添加水平为500~4 000 IU/kg时能显著提髙白细胞总数和中值细胞绝对值,添加水平为250~2 000 IU/kg时能显著提高中性粒细胞绝对数量;添加1 000 IU/kg的维生素D3能显著提高黄鳝血清IgM水平[28];添加500和1 000 IU /kg的维生素D3也能显著提高CD4 /CD8、溶菌酶活性及全血中性粒细胞、中值细胞和淋巴细胞数量,进而增强黄鳝对病菌的防御能力[29]。类似地,维生素D3在1 000~2 000 IU/kg添加范围内有利于团头鲂的生长,提高其非特异性免疫能力[12]。本研究中,添加维生素D3显著提高了大口黑鲈对嗜水气单胞菌的抗感染能力,推测与维生素D3增强机体的免疫力有关。
| [1] |
彭翔, 邵庆均. 维生素D在水产动物中的研究进展[J]. 饲料工业, 2010, 31(22): 47-49. PENG X, SHAO Q J. Research progress of vitamin D in aquatic animal[J]. Feed Industry, 2010, 31(22): 47-49. DOI:10.3969/j.issn.1001-991X.2010.22.014 |
| [2] |
DUSSO A S, BROWN A J, SLATOPOLSKY E. Vitamin D[J]. American Journal of Physiology-Renal Physiology, 2005, 289(1): 8-28. |
| [3] |
TAKEUCHI A, OKANO T, KOBAYASHI T. The existence of 25-hydroxyvitamin D3-1α- hydroxylase in the liver of carp and bastard halibut[J]. Life Sciences, 1991, 48(3): 275-282. DOI:10.1016/0024-3205(91)90355-F |
| [4] |
DARIAS M J, MAZURAIS D, KOUMOUNDOUROS G, et al. Overview of vitamin D and C requirements in fish and their influence on the skeletal system[J]. Aquaculture, 2011, 315(1/2): 49-60. |
| [5] |
BARNETT B J. Relative biopotency of dietary ergocalciferol and cholecalciferol and the role of and requirement for vitamin D in rainbow trout (Salmo gairdneri)[J]. The Journal of Nutrition, 1982, 112(11): 2011-2019. |
| [6] |
ANDREWS J W, MURAI T, PAGE J W. Effects of dietary cholecalciferol and ergocalciferol on catfish[J]. Aquaculture, 1980, 19(1): 49-54. DOI:10.1016/0044-8486(80)90006-X |
| [7] |
BROWN P B. Vitamin D requirement of juvenile channel catfish reared in calcium-free water[D]. Texas: Texas A & M University, 1988.
|
| [8] |
N RC. Nutrient requirements of fish and shrimp[M]. Washington: National Academy Press, 2011: 212-218.
|
| [9] |
HAGA Y, TAKEUCHI T, MURAYAMA Y, et al. Vitamin D3 compounds induce hypermelanosis on the blind side and vertebral deformity in juvenile Japanese flounder Paralichthys olivaceus[J]. Fisheries Science, 2004, 70(1): 59-67. DOI:10.1111/j.1444-2906.2003.00771.x |
| [10] |
TAVEEKIJAKARN P, MIYAZAKI T, MATSUMOTO M, et al. Histopathological and haematological changes in amago salmon, Oncorhynchus rhodurus (Jordan & McGregor), fed a vitamin-D-free diet[J]. Journal of Fish Diseases, 1996, 19(4): 289-294. DOI:10.1111/j.1365-2761.1996.tb00706.x |
| [11] |
张璐, 李静, 麦康森, 等. 饲料中不同维生素D含量对鲈鱼幼鱼生长性能和钙磷代谢的影响[J]. 动物营养学报, 2016, 28(5): 1402-1411. ZHANG L, LI J, MAI K S, et al. Effects of different dietary vitamin D contents on growth performance, calcium and phosphorus metabolism of juvenile Japanese seabass (Lateolabrax japonicas)[J]. Chinese Journal of Animal Nutrition, 2016, 28(5): 1402-1411. DOI:10.3969/j.issn.1006-267X.2016.05.016 |
| [12] |
王可宝.饲料中不同水平维生素D3对团头鲂生产性能、非特异性免疫及抗病原菌感染的影响[D].南京: 南京农业大学, 2011. WANG K B. Effects of dietary vitamin D3 levels on growth, non-specific immunity and anti-pathogenic of Wuchang break (Megalobrama amblycephala, yih)[D]. Nanjing: Nanjing Agricultural University, 2011. |
| [13] |
李二超, 陈立侨. 大口黑鲈的营养需要研究进展[J]. 现代农业科技, 2011(21): 312-316, 318. LI E C, CHEN L Q. Research advances on nutrient requirements of Micropterus salmoides[J]. Modern Agricultural Sciences and Technology, 2011(21): 312-316, 318. DOI:10.3969/j.issn.1007-5739.2011.21.198 |
| [14] |
AO AC. Official methods of analysis of the association of official analytical chemists[M]. 15th ed. Washington: Association of Official Analytical Chemist, 1990.
|
| [15] |
FOLCH J, LEES M, STANLEY G H S. A simple method for the isolation and purification of total lipides from animal tissues[J]. The Journal of Biological Chemistry, 1957, 226(1): 497-509. DOI:10.1016/S0021-9258(18)64849-5 |
| [16] |
吴成龙, 叶金云.维生素D对青鱼幼鱼生长、抗氧化和非特异性免疫力的影响[C]//2015年中国水产学会学术年会论文摘要集.北京: 中国水产学会, 2015: 367. WU C L, YE J Y. The effects of dietary vitamin D on the growth, antioxidant capacities and innate immune responses in juvenile Black carp Mylopharyngodon piceus[C]//Abstracts of Papers of 2015 Annual Meeting of Chinese Academy of Fisheries. Beijing: Chinese Fisheries Society, 2015: 367. |
| [17] |
LEE RUSSELL M. Vitamins in animal nutrition:comparative aspects to human nutrition[J]. BioScience, 1990, 40(9): 693-694. DOI:10.2307/1311443 |
| [18] |
杨玉菊.维生素D对奶牛骨代谢调节及细胞因子的影响[D].哈尔滨: 东北农业大学, 2001. YANG Y J. The effect of vitamin D on the bone metabolism and cytokines in cows[D]. Harbin: Northeast Agricultural University, 2001. |
| [19] |
周歧存, 麦康森. 皱纹盘鲍维生素D营养需要的研究[J]. 水产学报, 2004, 28(2): 155-160. ZHOU Q C, MAI K S. Studies on the nutritional requirement of vitamin D for Haliotis discus hannai Ino[J]. Journal of Fisheries of China, 2004, 28(2): 155-160. |
| [20] |
SHAHSAVARANI A, MCNEILL B, GALVEZ F, et al. Characterization of a branchial epithelial calcium channel (ECaC) in freshwater rainbow trout (Oncorhynchus mykiss)[J]. Journal of Experimental Biology, 2006, 209(10): 1928-1943. DOI:10.1242/jeb.02190 |
| [21] |
PIERSON P M, LAMERS A, FLIK G, et al. The stress axis, stanniocalcin, and ion balance in rainbow trout[J]. General and Comparative Endocrinology, 2004, 137(3): 263-271. DOI:10.1016/j.ygcen.2004.03.010 |
| [22] |
NICHOLS T L, WHITEHOUSE C A, AUSTIN F E. Transcriptional analysis of a superoxide dismutase gene of Borrelia burgdorferi[J]. FEMS Microbiology Letters, 2000, 183(1): 37-42. DOI:10.1111/j.1574-6968.2000.tb08930.x |
| [23] |
于平. 超氧化物歧化酶研究进展[J]. 生物学通报, 2006, 41(1): 4-6. YU P. Progress in the studies on superoxide dismutase[J]. Bulletin of Biology, 2006, 41(1): 4-6. DOI:10.3969/j.issn.0006-3193.2006.01.002 |
| [24] |
成艳波, 张月星, 董智勇, 等. 小麦蛋白替代鱼粉及大豆蛋白对日本黄姑鱼(Nibea japonica)和黑鲷(Sparus macrocephalus)血清生化指标及肝脏抗氧化指标的影响[J]. 渔业科学进展, 2017, 38(3): 106-114. CHENG Y B, ZHANG Y X, DONG Z Y, et al. Effects of dietary replacement of fish meal and soy protein by wheat gluten on plasma biochemical indices and liver anti-oxidative indices of Nibea japonica and Sparus macrocephalus[J]. Progress in Fishery Sciences, 2017, 38(3): 106-114. |
| [25] |
张桐.饲料中添加不同水平维生素D3对松浦镜鲤幼鱼影响的研究[D].上海: 上海海洋大学, 2011. ZHANG T. The study on effects of dietary vitamin D3 supplementation of juvenile mirror carp (C. carpio Songpu mirror carp)[D]. Shanghai: Shanghai Ocean University, 2011. |
| [26] |
PENG X Y, SHANG G H, WANG W Q, et al. Fatty acid oxidation in zebrafish adipose tissue is promoted by 1α, 25(OH)2D3[J]. Cell Reports, 2017, 19(7): 1444-1455. DOI:10.1016/j.celrep.2017.04.066 |
| [27] |
WANG Y, XIONG L, YANG K J, et al. Effect of beta-cypermethrin on GPT and GOT activities of crucian serum[J]. Agricultural Science & Technology, 2005, 6(1): 20-23. |
| [28] |
李超.日粮维生素D3添加水平对黄鳝生长性能、肌肉品质和免疫功能影响的研究[D].雅安: 四川农业大学, 2013. LI C. The effect of monopterus albus growth performance, muscle quality and immune function in different VD3 level added into dietary[D]. Yaan: Sichuan Agricultural University, 2013. |
| [29] |
黎德兵, 邵珊珊, 张龚炜, 等. 饲料中维生素D3添加水平对黄鳝生长性能及免疫功能的影响[J]. 动物营养学报, 2015, 27(4): 1145-1151. LI D B, SHAO S S, ZHANG G W, et al. Effects of vitamin D3 supplemental level on growth performance and immune function of Monopterus albus[J]. Chinese Journal of Animal Nutrition, 2015, 27(4): 1145-1151. DOI:10.3969/j.issn.1006-267x.2015.04.018 |
2. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


