2. 上海海洋大学水产与生命学院, 上海 201306;
3. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266237;
4. 莱州明波水产有限公司, 山东 莱州 261418
莱氏拟乌贼(Sepioteuthis lessoniana)属软体动物门(Mollusca)头足纲(Cephalopoda)枪形目(Teuthida)枪乌贼科(Loliginidae)拟乌贼属(Sepioteuthis), 是枪乌贼科中在印度洋-西太平洋海域分布最广的品种之一[1]。莱氏拟乌贼在中国的广东和闽南近海常有渔获,年产量约200 t, 具有体型大(最大体质量达5.6 kg)、肉厚、可食率较高、肉质细嫩鲜美且干制后为海味佳品等特点,具有极高的食用、营养和经济价值[2]。
雌性头足类生殖系统大多由卵巢、输卵管、缠卵腺和副缠卵腺组成[3], 其中副缠卵腺具有特殊的组织结构,并在生殖活动中发挥着重要作用,如副缠卵腺中的共生菌能够合成抗生素等物质,与缠卵腺的分泌物质共同形成受精卵的第3层卵膜,起到保护受精卵的作用[4], 显著提高了受精卵的孵化率。国内学者已对曼氏无针乌贼(Sepiella maindroni)[5]和金乌贼(Sepia esculenta)[6]副缠卵腺结构特征以及莱氏拟乌贼副缠卵腺与细菌的共生关系等进行了研究[7], 国外学者对欧洲横纹乌贼(Sepia officinalis)、虎斑乌贼(Sepia pharaonis)和莱氏拟乌贼等种类的副缠卵腺中共生菌的来源及鉴别做了大量研究[4, 8-10], 但未见关于莱氏拟乌贼副缠卵腺结构特征的研究报道。本文通过组织切片和透射电镜技术,揭示莱氏拟乌贼副缠卵腺的结构特征,并探讨其功能和作用,以期为养殖技术开发提供理论依据。
1 材料与方法 1.1 材料野生莱氏拟乌贼雌性成体样品于2019年8月采自福建海域(23°26′N~23°48′N和117°73′E~118°02′E), 采集时间为2019年8月,采集工具为底层拖网。实验样本共计5尾,样本体表无破损,平均胴长为(19.2±6.4)cm, 平均体质量为(430±76)g。莱氏拟乌贼性腺发育均处于成熟期。
1.2 方法 1.2.1 解剖结构观察将莱氏拟乌贼的腹面朝上放置于解剖板上,用镊子夹紧外套膜,然后用解剖剪刀将外套膜肌肉沿中线剪开,露出其生殖系统,对缠卵腺、副缠卵腺、输卵管腺和卵巢的位置、形态、大小和颜色等特征进行描述记录,并拍照。
1.2.2 石蜡切片样品准备解剖完成后,用解剖刀将副缠卵腺样品切割成小块,长、宽、高分别为0.5 cm左右,置于Bouin氏固定液中保存固定24 h后更换到质量浓度为70%的乙醇溶液保存。按照组织学研究方法[11], 对样品进行梯度乙醇溶液脱水、二甲苯透明、石蜡包埋。
石蜡包埋样品,使用KD-2508型轮转式切片机连续切片,切片厚度约为5 μm。石蜡切片经脱蜡干燥、H.E染色、中性树胶封片后,置于Nikon 80i正置显微镜下观察并拍照。
1.2.3 透射电镜样品的制备切取体积约为0.5~1.0 mm3的副缠卵腺实验样品,用质量分数为2.5%戊二醛固定4 h, PBS缓冲液冲洗3次,每次冲洗10 min, 质量分数为1%的锇酸4 ℃固定2 h。随后,经磷酸缓冲液漂洗,梯度乙醇溶液脱水,Epon812环氧树脂包埋,37、45、65 ℃温箱固化,每级温度固化24 h。
固化样品使用UltracutE超薄切片机半薄切片,切片厚度约70 nm。切片经醋酸铀和柠檬酸双重染色,置于JEM-1200EX的透射电镜中观察,拍照电压为80 kV。
2 结果 2.1 副缠卵腺的解剖结构莱氏拟乌贼具有副缠卵腺1对,左右对称,位于内脏团的中段,与缠卵腺紧密相连,前端紧贴墨囊,胴体腹面右侧副缠卵腺外缘接触到输卵管腺(图版Ⅰ)。性成熟后的副缠卵腺外表光滑,接近扁平状,近椭圆形,中间形成向内的凹陷。副缠卵腺整体呈米黄色,凹陷颜色较深,为橙黄色,近墨囊侧具有较多纹路,且有较多橙黄色斑块。

|
1. 莱氏拟乌贼内部构造;2. 副缠卵腺放大;3. 副缠卵腺背面;IS. 墨囊;G.鳃;ANG. 副缠卵腺;OG. 输卵管腺;NG.缠卵腺;OV.卵巢。 1. Internal structure of S. lessoniana; 2. Accessory nidamental gland; 3. Dorsal surface of the accessory nidamental gland; IS. Ink sac; G. Gill; ANG. Accessory nidamental gland; OG. Oviducal gland; NG. Nidamental gland; OV. Ovary. 图版 Ⅰ 莱氏拟乌贼副缠卵腺的解剖结构 Plate Ⅰ Anatomical structure of the accessory nidamental gland (ANG) of S. lessoniana |
副缠卵腺由腺壁组织、腺体小管和结缔组织组成(图版Ⅱ)。腺壁组织主要由单层柱状上皮和肌肉组织组成,肌肉层较厚,达300~400 μm(图版Ⅱ-1)。与肌肉组织紧密相连的是大量紧密排列的腺体小管,管腔形状大多不规则,少数呈圆形或椭圆形,管腔直径大小不等(图版Ⅱ-1, 2, 3)。管壁由单层柱状上皮细胞组成,管壁厚度均匀且基底较平滑,管腔内壁上着生大量微绒毛(图版Ⅱ-3, 4, 6)。大多数管腔内充满分泌物质,但有的管腔分泌物质较多,几乎充满整个管腔,有的管腔分泌物质较少(图版Ⅱ-1, 2, 5)。腺体小管外布满结缔组织,结缔组织中散布少量肌纤维和血管(图版Ⅱ-2, 5)。
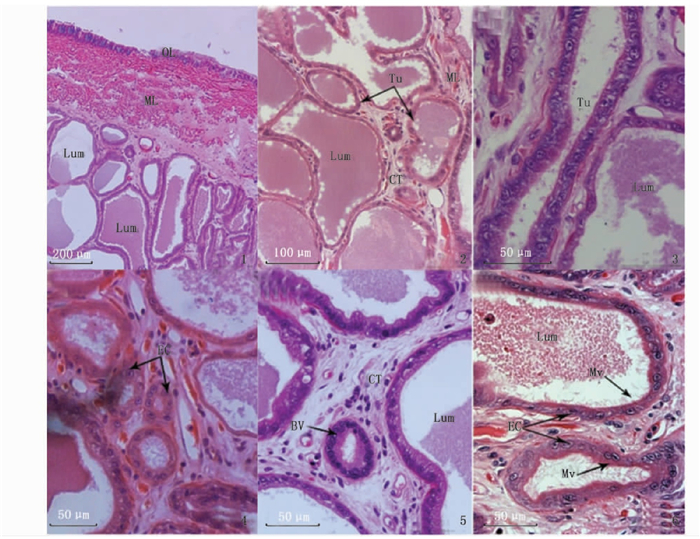
|
1. 副缠卵腺横切面, 示外膜层、肌肉层、管内腔, H.E×40;2. 腺体管道横切面, 示腺体管道, H.E×100;3.腺体小管纵切面, H.E×200;4. 腺体管道横切面, 示上皮细胞, H.E×100;5. 血管横切面, 示血管和结缔组织, H.E×200;6. 腺体管道横切面, 示微绒毛, H.E×200; CT. 结缔组织;ML. 肌肉层;Lum. 管内腔;EC. 上皮细胞. Mv. 微绒毛;OL. 腺壁;Bv. 血管;Tu. 腺体管道。 1. Transverse section of the accessory nidamental gland, shows the tunica adventitia, muscular layer, and lumen, H.E×200; 2. Transverse section of the tubules, shows tubules, H.E×100; 3. Longitudinal section of the glandular tubules, H.E×200; 4. Transverse section of the tubules, shows epithelial cells, H.E×100; 5. Transverse section of the blood vessels, shows blood vessel and connective tissue, H.E×200; 6. Transverse section of the tubules, shows mircrovilli, H.E×200; CT. Connective tissue; ML. Muscle layer; Lum. Lumen; EC. Epithelial cells; Mv. Microvilli; OL. Outer layer; Bv. Blood vessel; Tu. Tubules. 图版 Ⅱ 莱氏拟乌贼副缠卵腺的显微结构 Plate Ⅱ Microstructure of the accessory nidamental gland (ANG) of S. lessoniana |
腺体小管由单层上皮细胞构成,上皮细胞的基底光滑,外部为细胞外基质,由结缔组织、分泌颗粒等物质组成(图版Ⅲ-1)。上皮细胞的细胞核较大,大多呈椭圆形(图版Ⅲ-2), 细胞质的密度均匀,分布有大量的内质网、高尔基体和线粒体等细胞器;其中内质网数量很多,包括滑面内质网和粗面内质网(图版Ⅲ-1, 2, 5)。高尔基体由多层扁平囊组成,多平行排列呈弯弓状(图版Ⅲ-1, 3)。细胞质中的线粒体数量较多,电镜下形状不规则,多以长条形或椭圆形存在,其外膜平坦,内部可观察到嵴(图版Ⅲ-1, 4, 5, 7)。上皮细胞靠近管腔侧可观察到大量分泌球状体、少量嗜锇性颗粒和脂肪颗粒,在微绒毛和管腔中可见分泌物质(图版Ⅲ-1, 5, 6, 7)。管腔的上皮细胞上着生大量微绒毛,微绒毛长度约2~3 μm, 在微绒毛着生部位夹杂着少量纤毛,微绒毛与纤毛平行排列(图版Ⅲ-7), 纤毛具有典型的“9+2”结构特征(图版Ⅲ-8)。
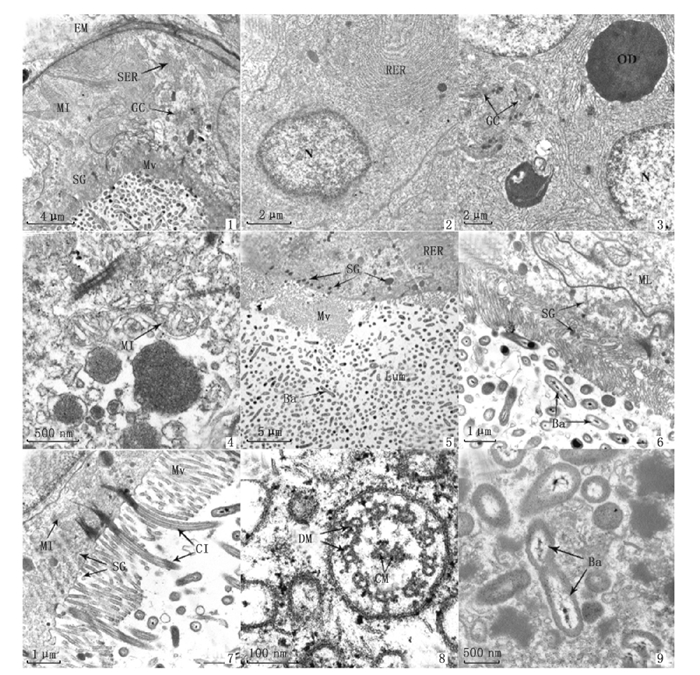
|
1. 腺体管道横切面;2. 上皮细胞细胞质,示高尔基复合体;3. 上皮细胞细胞质,示粗面内质网和细胞核;4. 纤毛和微绒毛;5. 上皮细胞和管腔;6. 上皮细胞细胞质,示线粒体;7. 管腔及细菌;8. 纤毛;9. 细菌; EM. 细胞外基质;MI. 线粒体;GC. 高尔基复合体;OD. 嗜锇性颗粒;Mv. 微绒毛;N. 细胞核;Ba. 细菌;SER. 滑面内质网;SG. 分泌球状体;CI. 纤毛;RER. 粗面内质网;Lum. 管内腔;DM. 双联体微管;CM. 中心微管。 1. Transverse section of the accessory nidamental gland; 2. The cytoplasm of epithelial cells, shows golgi complex; 3. The cytoplasm of epithelial cells, shows rough endoplasmic reticulum and nucleus; 4.Cilia and microvilli; 5.Epithelial cells and lumen; 6. The cytoplasm of epithelial cells, shows the mitochondria; 7. Lumen and bacteria; 8.Cilia; 9. Bacteria; EM. Extracellular matrix; MI. Mitochondria; GC. Golgi complex; OD. Osmiophilic granules; Mv. Microvilli; N. Nucleus; Ba. Bacteria; SER. Smooth endoplasmic reticulum; SG. Secretion globule; CI. Cilia; RER. Rough endoplasmic reticulum; Lum. Lumen; DM. Doublet microtubules; CM. Central microtubule. 图版 Ⅲ 莱氏拟乌贼副缠卵腺的超微结构 Plate Ⅲ Ultrastructure of the accessory nidamental gland (ANG) of S. lessoniana |
小管管腔中可观察到大量细菌,几乎充满整个管腔,细菌均为杆菌,外表光滑无鞭毛(图版Ⅲ-5, 6, 9)。此外,能够观察到正在进行分裂的细菌(图版Ⅲ-6, 9)。
3 讨论 3.1 副缠卵腺的解剖结构头足类中除开眼亚目(Oegopsida)外的其他种类具有副缠卵腺[12], 但副缠卵腺的形态、位置和颜色有较大差异。比如:金乌贼副缠卵腺呈耳状,位于缠卵腺上端,两者紧密相连呈“M”型,产卵期为白色夹杂橙黄色[6]; 中国枪乌贼(Loligo chinesis)副缠卵腺未性成熟时为淡黄色,性成熟后接近黄豆大小,朱红色斑点增多[13]; 欧洲横纹乌贼副缠卵腺颜色存在变化的过程,起初由白色向橙黄色转变,性成熟后为珊瑚红色,产卵结束变成粉红色[14]; 拟目乌贼(Sepia lycidas)副缠卵腺为橙黄色,紧紧将缠卵腺顶部包裹[15]。莱氏拟乌贼副缠卵腺近椭圆形,整体为米黄色,背部有较多橙黄色斑块。头足类不同品种间或同一品种不同发育阶段副缠卵腺颜色的差异,其原因可能与不同种类的副缠卵腺中共生菌种类不同,造成管腔内共生菌产生的色素沉着不同所致,这种颜色的变化可作为乌贼是否性成熟的标志[16-17]。
3.2 副缠卵腺显微结构特征与其他头足类相比较,莱氏拟乌贼副缠卵腺的显微结构具有以下特征:副缠卵腺中具有丰富的腺体小管,小管之间排列紧密,且管腔较大,莱氏拟乌贼属于分批产卵类型[18], 数量丰富的腺体管道和较大的管腔能够容纳大量的分泌物质和细菌,以满足管腔中的分泌物质随着卵子产出过程中的消耗;与曼氏无针乌贼[5]和金乌贼[6]一致,莱氏拟乌贼副缠卵腺腺体小管的管壁由单层上皮细胞构成,细胞呈扁平状,但腺体管道的粗细程度和管腔中分泌物含量具有差异,其原因可能取决于乌贼产卵阶段,产卵前期的腺体管道尚未分化完全,管道较细并且分泌物质较少,产卵盛期的腺体管道达到最粗且管腔充满分泌物质,产卵完成后的腺体管道中的分泌物质逐渐减少;腺体小管间充满结缔组织,其中夹杂少量血管,能够起到运输营养物质的作用,为上皮细胞分泌物质及微绒毛摆动提供能量。此外,与拟目乌贼[15]一致,莱氏拟乌贼副缠卵腺腺壁组织中也存在大量的肌纤维,且管腔间的结缔组织中存在少量肌纤维,从而对腺体起到支撑保护的作用。
3.3 副缠卵腺的超微结构 3.3.1 超微结构特征及作用分析超微结构分析显示,莱氏拟乌贼副缠卵腺属于分泌型腺体,腺体小管的上皮细胞发挥分泌功能,但与其他头足类相比较也具有一定差异。莱氏拟乌贼副缠卵腺的上皮细胞具有较多的分泌球状体,而曼氏无针乌贼[5]和金乌贼[6]副缠卵腺的上皮细胞中均存在大量体积较大的囊泡,囊泡中具球状小泡。莱氏拟乌贼缠卵腺管腔的纤毛分散排列且连续着生,与皮氏枪乌贼(Loligo pealei)[18]和福式枪乌贼(Loligo forbesi)[19]一致,而金乌贼、虎斑乌贼[8]和曼氏无针乌贼的纤毛着生不连续,其原因可能是枪乌贼科与乌贼科(Sepiidae)种群间发育差异导致[5, 20]。此外,在乳光枪乌贼(Loligo opalescens)副缠卵腺提取物中发现,成熟阶段的副缠卵腺中不饱和脂肪酸含量高于未成熟阶段,颜色越深的腺体抗菌活性越强[21]。分析认为,莱氏拟乌贼副缠卵腺成熟后,合成并分泌的脂类物质满足共生菌的营养需求,共生菌合成的抗菌物质导致腺体颜色加深,此外细胞质中含有少量嗜锇性沉淀物,也是细胞合成的分泌物质[16], 其具体作用还需要进行深入研究。
3.3.2 共生细菌的来源及作用在头足类的副缠卵腺中首次发现共生菌时,大多认为共生菌属于“垂直传递”, 即亲体副缠卵腺在分泌凝胶状物质时将细菌传递给下一代[8, 10]。但是,乳光枪乌贼在孵化后3个月才出现副缠卵腺上皮细胞,且在孵化后4个月副缠卵腺中才出现细菌,因此推测这些共生菌属于“水平传递”, 即从海洋环境中获得[21]。研究结果显示,莱氏拟乌贼副缠卵腺发育初期共生菌主要是γ-变形菌,随着腺体逐渐成熟,α-变形菌的比例逐渐上升,且在不同年份筛选出的α-变形菌纲中的菌种仍有区别[10]。因此,莱氏拟乌贼副缠卵腺的共生菌在不同生长阶段、不同年份均存在差异[10], 分析认为莱氏拟乌贼副缠卵腺共生菌为“水平传递”。
已有研究[22]发现,莱氏拟乌贼副缠卵腺提取物的抗菌活性在成熟期最强,其次是衰亡期,未成熟阶段则没有表现出抗菌活性。共生菌的作用:一方面副缠卵腺分泌物是卵膜的重要组成部分,在乌贼亲体产卵过程中,共生菌产生的抗菌物质随分泌物进入卵膜内,可使受精卵免受细菌或病原微生物的侵袭[23]; 另一方面在共生菌和多种酶的作用下,可使乌贼体内多余的含氮废物转化为氮气,进而扩散进入内壳后产生浮力[24]。
| [1] |
JEREB P, ROPER C F E. Cephalopods of the Indian Ocean. A review. Part I. Inshore squids (Loliginidae) collected during the International Indian Ocean Expedition[J]. Proceedings of the Biological Society of Washington, 2006, 119(1): 91-136. DOI:10.2988/0006-324X(2006)119[91:COTIOA]2.0.CO;2 |
| [2] |
董正之. 中国动物志软体动物门头足纲[M]. 北京: 科学出版社, 2001: 104-106. DONG Z Z. China fauna mollusks door cephalopod outline[M]. Beijing: Science Press, 2001: 104-106. |
| [3] |
刘必林, 陈新军. 头足类生殖系统及其在分类学上的应用[J]. 水产学报, 2010, 34(8): 1219-1226. LIU B L, CHEN X J. Cephalopods reproductive system and its application to taxonomy[J]. Journal of Fisheries of China, 2010, 34(8): 1219-1226. |
| [4] |
GRIGIONI S, BOUCHER-RODONI R, DEMARTA A, et al. Phylogenetic characterisation of bacterial symbionts in the accessory nidamental glands of the sepioid Sepia officinalis (Cephalopoda: Decapoda)[J]. Marine Biology, 2000, 136(2): 217-222. DOI:10.1007/s002270050679 |
| [5] |
王春琳, 王津伟, 余红卫, 等. 曼氏无针乌贼(Sepiella maindroni)副缠卵腺的组织学及超微结构[J]. 海洋与湖沼, 2010, 41(3): 391-395. WANG C L, WANG J W, YU H W, et al. Histology and ultrastructure of the accessory nidamental gland of Sepiella maindroni[J]. Oceanologiaet Limnologia Sinica, 2010, 41(3): 391-395. |
| [6] |
刘长琳, 赵法箴, 边力, 等. 金乌贼成体副缠卵腺的超显微结构[J]. 渔业科学进展, 2018, 39(3): 137-143. LIU C L, ZHAO F Z, BIAN L, et al. Ultrastructure of the accessory nidamental gland of adult Sepia esculenta[J]. Progress in Fishery Sciences, 2018, 39(3): 137-143. |
| [7] |
PIERANTONI U. Organiluminosi, organi, simbiotici e ghi and olani damentale accessor ianeice phalopodi[J]. Bull Soc Nat Napoli, 1918, 30: 30-36. |
| [8] |
NAIR J R, DEVIKA P, GEORGE M C, et al. Accessory nidamental gland of accessor Sepia pharaonisaccessor Ehrenberg (Mollusca: Cephalopoda): ultrastructure and function[J]. Asian Fisheries Science, 18: 255-263.
|
| [9] |
BUCHNER P. Symbiosis in luminous animals. Endosymbiosis of animals with plant microorganisms[M]. New York: Interscience Publishers, 1965: 543-571.
|
| [10] |
朱凯, 姚吉祥, 陈新军, 等. 南海鸢乌贼微型群肌肉和性腺组织能量积累及其分配[J]. 上海海洋大学学报, 2020, 29(6): 910-920. ZHU K, YAO J X, CHEN X J, et al. Energy accumulation of both somatic and reproductive tissues and the allocation to reproduction in the dwarf form individuals of Sthenoteuthis oualaniensis in the south China Sea[J]. Journal of Shanghai Ocean University, 2020, 29(6): 910-920. |
| [11] |
刘承英, 赵燕, 刘娟. 斑马鱼石蜡组织切片技术的优化[J]. 安徽农学通报, 2019, 25(9): 67-68. LIU C Y, ZHAO Y, LIU J. Optimization of paraffin tissue section technology for Zebrafish[J]. Anhui Agricultural Science Bulletin, 2019, 25(9): 67-68. |
| [12] |
JEREB P, ROPER C F E. Cephalopods of the world, An annotated and illustrated catalogue of cephalopod species known to date, Volume 1. Chambered nautiluses and sepioids(Nautilidae, Sepiidae, Sepiolidae, Sepiadariidae, Idiosepiidae and Spirulidae)[R]. Rome: FAO, 2005.
|
| [13] |
欧瑞木. 中国枪乌贼性腺成熟度分期的初步研究[J]. 海洋科学, 1983, 7(1): 44-46. OU R M. Preliminary study on the stages of gonad maturity of the squid, Loligo chinensisGray[J]. Marine Sciences, 1983, 7(1): 44-46. |
| [14] |
RICHRAD A, BRANDEN CVD, DECLEIR W. The cycle of activity in the nidamental glands from cephalopods[J]. Cyclic Phenomena in Marine Plants and Animals, 1979, 173-180. |
| [15] |
罗江, 蒋霞敏, 彭瑞冰, 等. 拟目乌贼生殖系统的组织学研究[J]. 水产学报, 2014, 38(7): 946-955. LUO J, JIANG X M, PENG R B, et al. Histology of reproductive system in accessor Sepia lycidasaccessor[J]. Journal of Fisheries of China, 2014, 38(7): 946-955. |
| [16] |
BLOODGOOD R A. The squid accessory nidamental gland: ultrastructure and association with bacteria[J]. Tissue and Cell, 1977, 9(2): 197-208. DOI:10.1016/0040-8166(77)90016-7 |
| [17] |
ATKINSON B G. Squid nidamental gland extract: Isolation of a factor inhibiting ciliaryactivity[J]. Journal of Experimental Zoology, 1973, 184(3): 335-340. DOI:10.1002/jez.1401840306 |
| [18] |
SIVASHANTHINI K, THULASITHA W S, CHARLES G A. Reproductive characteristics of squid Sepioteuthis lessoniana (Lesson, 1830) from the Northern Coast of Sri Lanka[J]. Journal of Fisheries and Aquatic Science, 2010, 5(1): 12-22. |
| [19] |
LUM-KONG A. A histological study of the accessory reproductive organs of female accessor Loligo forbesi accessor(Cephalopoda: Loliginidae)[J]. Journal of Zoology, 1992, 226(3): 469-490. DOI:10.1111/j.1469-7998.1992.tb07493.x |
| [20] |
林东明, 陈新军. 头足类生殖系统组织结构研究进展[J]. 上海海洋大学学报, 2013, 22(3): 410-418. LIN D M, CHEN X J. Research progress on histological structure of reproductive system in cephalopod[J]. Journal of Shanghai Ocean University, 2013, 22(3): 410-418. |
| [21] |
KAUFMAN M R, IKEDA Y, PATTON C, et al. Bacterial symbionts colonize the accessory nidamental gland of the Squid accessor Loligo opalescens accessor via horizontal transmission[J]. Biological Bulletin, 1998, 194(1): 36-43. DOI:10.2307/1542511 |
| [22] |
VENKATESAN V, SARAVANA R, MEENAKSHI S, et al. Antibacterial activity in the extracts of accessory nidamental gland of the Palk Bay squid Sepioteuthis lessoniana (Lesson, 1830) (Cephalopoda: Decapoda)[J]. Indian Journal of Fish, 2014, 61(4): 146-148. |
| [23] |
BARBIERI E, PASTER B J, HUGHES D, et al. Phylogenetic characterization of epibiotic bacteria in the accessory nidamental gland and egg capsules of the squid Loligo pealei (Cephalopoda: Loliginidae)[J]. Environmental Microbiology, 2001, 3(3): 151-167. DOI:10.1046/j.1462-2920.2001.00172.x |
| [24] |
BOUCHER-RODONI R, MANGOLD K. Ammonia production in cephalopods, physiological and evolutionary aspects[J]. Marine and Freshwater Behaviour and Physiology, 1995, 25(1/3): 53-60. |
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, Shandong, China;
4. Laizhou Mingbo Aquatic Products Co., Ltd, Laizhou 261418, Shandong, China
 2021,
Vol. 30
2021,
Vol. 30


