2. 上海海洋大学 海洋科学学院, 上海 201306;
3. 国家远洋渔业工程技术研究中心, 上海 201306;
4. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
5. 农业农村部大洋渔业开发重点实验室, 上海 201306;
6. 农业农村部大洋渔业资源环境科学观测实验站, 上海 201306
围网是东太平洋最主要的渔业捕捞方式, 其渔获量占总体的90%[1]。大眼金枪鱼(Thunnus obesus)、黄鳍金枪鱼(Thunnus albacares)和鲣(Katsuwonus pelamis)等热带金枪鱼是东太平洋围网渔业最主要的目标鱼种, 具有极高的商业价值[1-2]。围网渔业的捕捞对象是集群鱼类, 而金枪鱼集群根据行为特点可分为自由迁徙的自由鱼群、跟随海洋哺乳动物的鲸豚随附群以及随附于人工集鱼装置(fish aggregating device, FAD)等漂流物的漂流物随附群[3-4]。其中, 自由鱼群因具有灵敏活泼、游动迅速的特点, 具有很高的围网空网率, 但自由鱼群渔获个体组成大, 经济效益高[5-7]。相对地, 漂流物随附群会稳定地聚集在漂流物附近, 行为稳定, 更易捕获, 但其渔获组成多为幼鱼, 故捕捞漂流物随附群容易对种群资源的补充造成破坏[5, 8-9]。
目前, 东太平洋热带金枪鱼由区域渔业管理组织(regional fisheries management organisations, RFMO) “美洲间热带金枪鱼委员会(Inter-American Tropical Tuna Commission, IATTC)”负责管理。考虑到FAD渔法使用频率的不断增加及其对金枪鱼资源可能造成的负面影响, IATTC在2017年针对围网船队设定了公约水域内每年特定时段72 d的禁渔期以及特定水域(96°W ~ 110°W, 4°N ~ 3°S)内1个月的禁渔期[10]。此外, IATTC还根据船舶的体型大小设定了可携带的FAD数量上限[10]。IATTC在2019年发布的渔业年报指出, FAD网次数量的增加和围网渔获中大眼金枪鱼平均体质量的不断减小表明东太平洋大眼金枪鱼种群正处于不断增加的捕捞压力之下, 故各国船队应减少FAD网次, 将捕捞努力量转移至自由鱼群以减少对金枪鱼幼鱼的伤害[1]。为此, 以受FAD渔法影响最大的大眼金枪鱼为研究案例[11], 探究热带东太平洋大眼金枪鱼自由鱼群的栖息环境, 为其资源养护和管理提供参考依据。
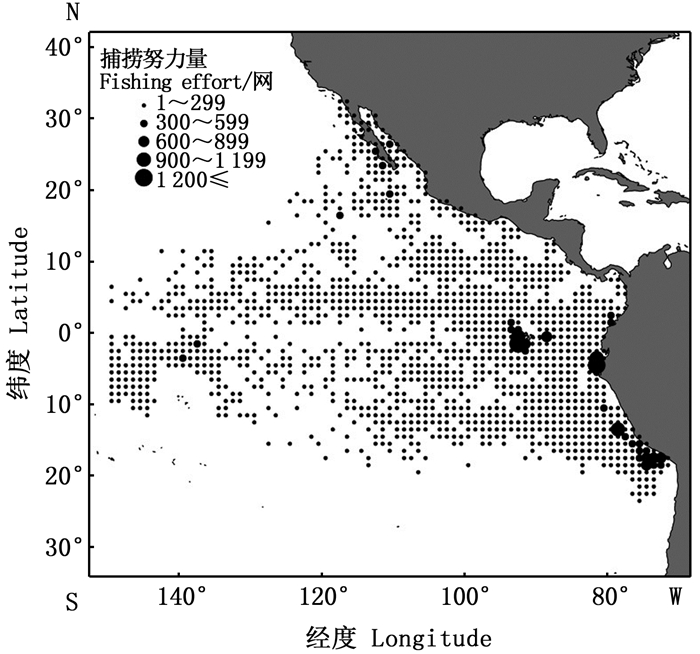
1 材料与方法 1.1 数据来源与预处理渔业数据来自IATTC官网, 包括经度(Lon)、纬度(Lat)、年份(Year)、月份(Month)、自由鱼群的投网次数以及大眼金枪鱼产量(t)。研究区域为东太平洋23.5°S~32.5°N, 71.5°W ~ 149.5°W海域, 空间分辨率为1°×1°, 时间序列涵盖2015—2017年的所有月份。研究区域内所有1°×1°栅格在2015—2017年的累计捕捞努力量如图 1所示。
|
图 1 2015—2017年东太平洋金枪鱼围网自由鱼群投网累积次数分布 Fig. 1 Distribution of accumulative number of unassociated sets of tuna purse fishery in the eastern Pacific Ocean from 2015 to 2017 |
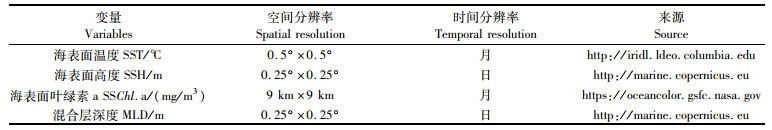
本研究基于历史文献, 选择海表面温度(sea surface temperature, SST)、海表面高度(sea surface height, SSH)、海表面叶绿素a浓度(sea surface chlorophyll-a, SSChl.a)和混合层深度(mixed layer depth, MLD)作为解释变量来研究大眼金枪鱼丰度与环境之间的关系[12-13]。环境数据源于卫星遥感数据, 数据来源、分辨率以及单位如表 1所示。环境数据下载后, 空间分辨率转换为1°×1°, 时间分辨率转换为月, 与渔业数据保持一致。数据匹配过程全部在R语言(版本3.6.0)中完成。
|
表 1 环境数据来源和摘要 Tab.1 Source and summary of environmental data |
在进行栖息地建模前, 采用方差膨胀因子(variance inflation factor, VIF)对环境变量进行多重共线性测试, 当VIF值大于3时, 认为变量存在多重共线性, 需要剔除[14]。
1.2 栖息地建模考虑到大眼金枪鱼自由鱼群的捕捞成功率很低, 产量为零值的数据占到了总体的89.73%, 是典型的“零膨胀(zero inflated)”数据类型, 故假设其产量数据服从对数正态分布, 使用二阶对数正态建模方法(又称“delta-lognormal方法”)建立其栖息地模型[15-16], 并计算出它的单位捕捞努力量渔获量, 即单一网次能捕获到的渔获量(t/网), 并作为标准化丰度指数。建模的第一阶段是分析大眼金枪鱼捕获成功的概率p, 第二阶段是估算非空网网次的密度对数值lny, 最终的标准化丰度指数计算公式如下:
 (1)
(1)
式中:D为大眼金枪鱼的密度; p为大眼金枪鱼捕获成功概率; y为非空网网次的渔获估计值。回归模型选用提升回归树模型(boosted regression tree, BRT), 该模型具有较为准确的预测能力, 能够容纳缺失值和不同数据类别的预测变量, 在处理因包含异常值和不相关因子所带来的影响以及交互作用的拟合等方面, BRT模型同样具有优势[17-18]。
BRT模型的拟合需要设置3个参数[17-18]:(1)学习率(learning rate, lr), 决定单棵决策树在模型建立过程中的相对贡献; (2)复杂性参数(tree complexity, tc), 控制单棵决策树的结点数量, 即分裂次数; (3)装袋分数(bagging fraction), 决定单棵决策树在训练时随机抽取的观测数据比例, 通常推荐0.50 ~ 0.75。本研究分别设定5个级别的lr(0.000 5, 0.001, 0.005, 0.01, 0.05)和tc(1, 2, 3, 4, 5), 并将装袋分数设置为0.75, 在尝试所有的参数组合来拟合模型后, 最终根据交叉验证残差偏差(cross-valitated residual deviance, cvDev)、交叉验证受试者工作特征曲线下面积(cross-validated area under the receiver operating characteristic curve, cvAUC)和偏差解释率(deviance explained)等模型拟合和预测效能指标来选择参数组合。模型建立后, 变量的相对重要性根据该变量被用来作为分裂结点的次数以及每次分裂对于决策树拟合的平均改善程度来估测[19]。待全部预测变量按照相对重要性的大小进行降序排列后, 可逐个剔除变量, 当变量的去除对模型残差偏差没有造成巨大改变时, 该变量不会被剔除[17]。BRT模型的建立及其预测变量选择分别基于R语言(版本3.6.0)dismo包中的gbm.step函数和gbm.simplify函数[20]完成。
2 结果 2.1 共线性检测与BRTs模型的参数选择共线性检测结果显示, 所有候选预测变量的VIF值都小于3, 表明变量不存在共线性问题, 故不需要剔除任何变量。学习率lr和复杂性参数tc的交叉组合测试结果显示:当lr=0.01, tc=4时, 第一阶段BRT模型效能最佳, 具有最低的cvDev值(0.48)和最高的cvAUC值(0.84)。当lr=0.005, tc=4时, 第二阶段BRT模型效能最佳, 具有最低的cvDev值(0.35)和最高的偏差解释率(69.86%)。
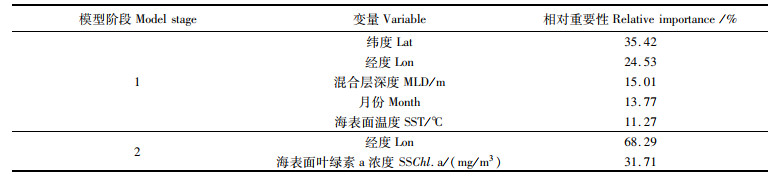
2.2 模型结果第一阶段BRT模型和第二阶段BRT模型经变量选择后保留的预测变量及其相对重要性如表 2所示。第一阶段模型的预测变量为纬度(Lat)、经度(Lon)、混合层深度(MLD)、月份(Month)和海表面温度(SST), 相对重要性最高的为空间因子, 纬度达到了35.42%, 经度达到了24.53%。第二阶段模型的预测变量为经度(Lon)和海表面叶绿素a浓度(SSChl.a), 经度的相对重要性更高, 达到了68.29%。
|
表 2 预测变量及其相对重要性 Tab.2 List of predictor variables retained in the two-stage BRTs and their relative importance |
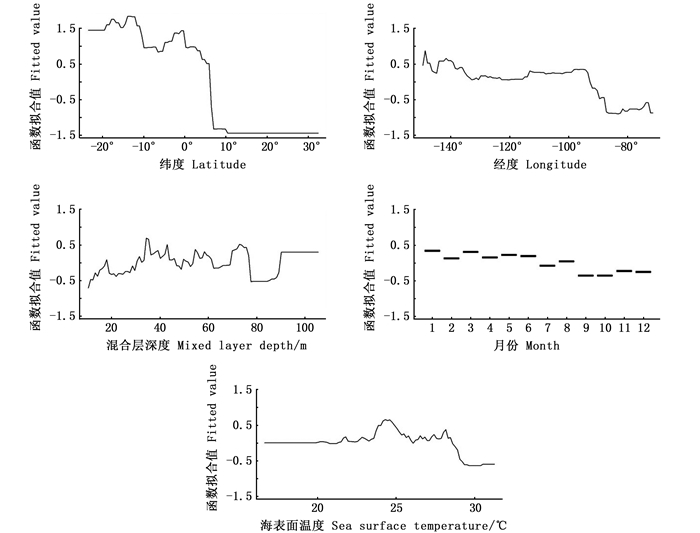
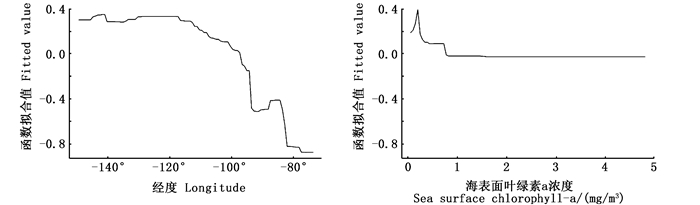
各环境变量对东太平洋大眼金枪鱼自由鱼群捕获成功率和丰度的影响如图 2和图 3所示。当纬度在8°N以北、经度在95°W以东时, 大眼金枪鱼自由鱼群捕获成功率会明显下降。混合层深度对于大眼金枪鱼捕获成功率的影响呈上下振荡的趋势, 而当混合层深度在80 m左右时, 大眼金枪鱼捕获成功率最小。月份对于大眼金枪鱼捕获成功率的影响总体上呈下降趋势, 但差异不大。当SST为24~27 ℃时, 大眼金枪鱼捕获成功率最大。经度对于大眼金枪鱼丰度的影响与捕获成功率相似, 当经度处于95°W以东时, 大眼金枪鱼丰度迅速下降。海表面叶绿素a浓度对大眼金枪鱼丰度的影响结果显示, 当叶绿素a浓度为0.2~0.3 mg/m3内时, 大眼金枪鱼丰度最高。
|
图 2 第一阶段BRT模型偏效应图 Fig. 2 Partial dependence plot for the first stage BRT model |
|
图 3 第二阶段BRT模型偏效应图 Fig. 3 Partial dependence plot for the second stage BRT model |
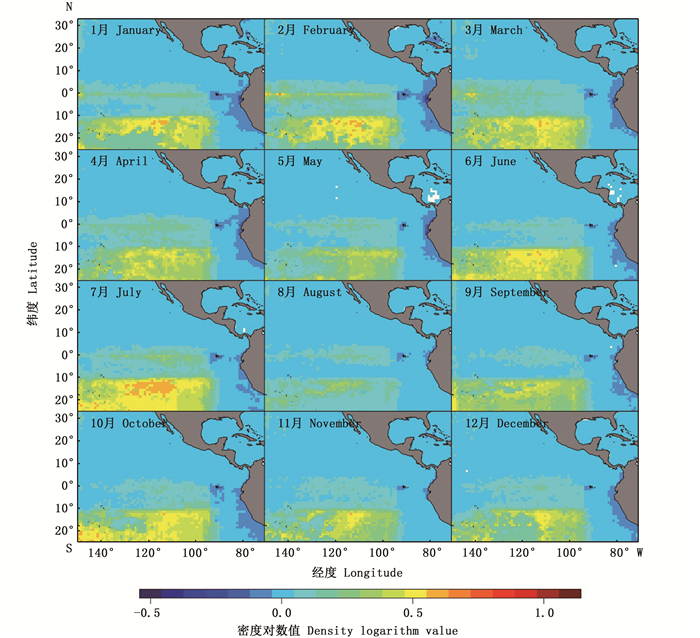
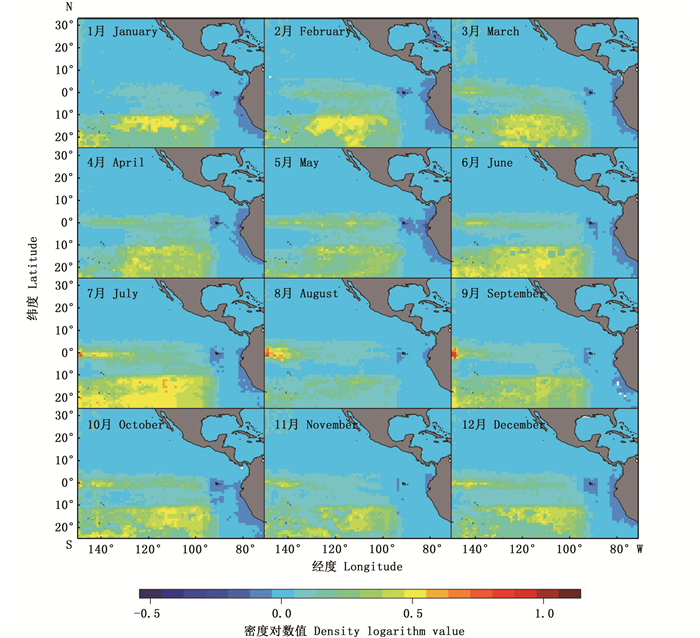
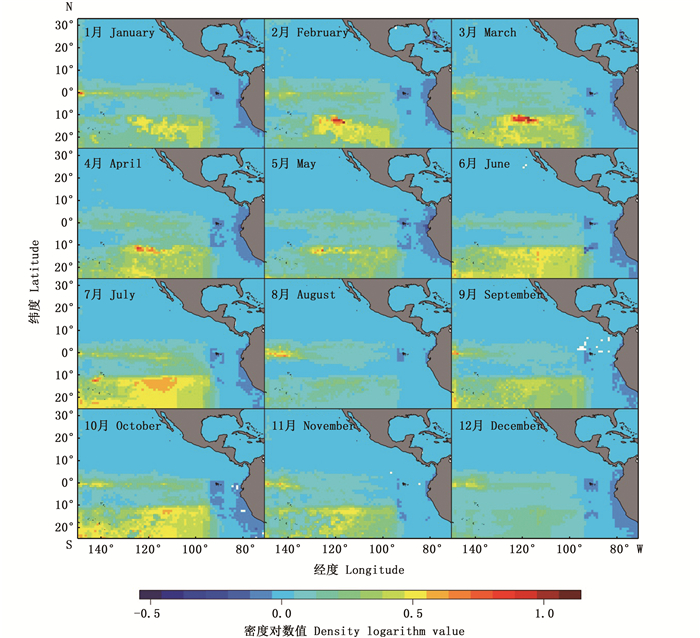
大眼金枪鱼自由鱼群在2015—2017年的空间分布特征与BRT模型偏效应图中经度和纬度对大眼金枪鱼捕获成功率和丰度的影响基本一致(图 4~6)。空间上, 大眼金枪鱼主要处于10°S以南、95°W以西的位置, 有小部分高密度鱼群出现在赤道位置附近, 整体上空间分布范围的年际变化很小。在不同年份和月份, 大眼金枪鱼丰度较高的空间位置有所差异。在2015年所有月份的空间栅格中, 2月份经度为143.5°W、纬度为0.5°S的栅格具有最高的丰度, 其对数值达到了0.65 t/网, 8月份的丰度对数平均值最低, 只有0.04 t/网, 而2015年的大眼金枪鱼丰度对数月平均值为0.08 t/网。在2016年7—9月东太平洋赤道附近的大眼金枪鱼丰度最高, 其中, 最高丰度出现在9月份, 经度为148.5°W、纬度为1.5°S的位置, 对数值达到0.85 t/网。2016年大眼金枪鱼丰度对数月平均值为0.08 t/网, 与2015年一致。2017年大眼金枪鱼丰度对数月平均值同样为0.08 t/网, 7月份最高, 达到了0.12 t/网, 8月份最低, 仅为0.05 t/网。最高值出现在3月份经度为116.5°W、纬度为12.5°S的位置, 丰度对数值为1.00 t/网。
|
图 4 2015年东太平洋大眼金枪鱼自由鱼群空间分布 Fig. 4 Spatial distribution of free swimming school for bigeye tuna in the eastern Pacific Ocean in 2015 |
|
图 5 2016年东太平洋大眼金枪鱼自由鱼群空间分布 Fig. 5 Spatial distribution of free swimming school for bigeye tuna in the eastern Pacific Ocean in 2016 |
|
图 6 2017年东太平洋大眼金枪鱼自由鱼群空间分布 Fig. 6 Spatial distribution of free swimming school for bigeye tuna in the eastern Pacific Ocean in 2017 |
时间序列上, 2015—2017年的大眼金枪鱼丰度对数月平均值年际间变化差异很小, 月间差异较大, 在5—8月有一个震荡期, 5月至7月逐渐上升至全年最高值, 但在8月份立刻下降到全年最低值(图 7)。
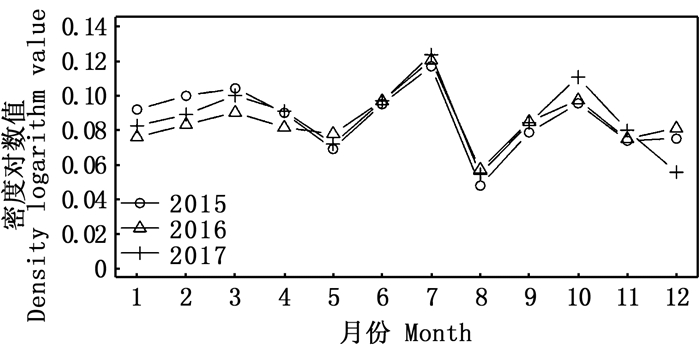
|
图 7 2015—2017年东太平洋大眼金枪鱼自由鱼群丰度月变化 Fig. 7 Monthly variation of abundance for bigeye tuna free swimming school in the eastern Pacific Ocean from 2015 to 2017 |
近些年来, 基于FAD渔法对随附鱼群进行围网捕捞的生产活动日益增长, 其渔获量已经超过了世界围网渔业总产量的60%, 该增长趋势主要是由于FAD被连续不断地投入使用、FAD渔法的技术革新、用以辅助FAD捕捞的卫星追踪素式浮标成本的减少等因素引起[21]。这种增长趋势同时也引起了RFMOs的关注和担忧。RFMOs认为FAD渔法的过度使用可能会导致:(1)大眼金枪鱼种群过高的捕捞死亡率; (2)小型黄鳍金枪鱼和大眼金枪鱼单位补充量渔获量下降; (3)兼捕、丢弃和幽灵捕捞等事件总体水平上升[22-24]; (4)拖曳固定式FAD对脆弱性珊瑚礁生态系统造成破坏[25-26]; (5)在生物学和生态学层面上, 对金枪鱼和中上层鱼类可能会造成潜在负面影响[27-29]。在此背景下, 一些围网船队开始尝试调整捕捞策略以应对RFMOs针对该问题出台的养护管理措施, 例如将捕捞努力量投入到金枪鱼自由鱼群的捕捞中[30]。本研究通过结合卫星遥感数据, 建立了大尺度的东太平洋大眼金枪鱼自由鱼群栖息地模型, 并探究了其时空分布特征, 研究结果可为东太平洋金枪鱼围网船队调整捕捞策略, 寻找金枪鱼自由鱼群提供帮助。
此前, 已有诸多学者对商业性金枪鱼物种的栖息地进行了研究, 这些研究主要使用RFMOs所收集的延绳钓或者围网渔业数据对金枪鱼栖息地进行了宏观的描述或是探讨FAD鱼群的栖息偏好[11-13, 25-26], 很少有针对金枪鱼自由鱼群栖息地展开的分析。因此, 相对于前人的工作, 本研究所展示的东太平洋大眼金枪鱼自由鱼群分布与环境之间的关系可能会有所差异。例如, ARRIZABALAGA等[12]在研究中使用了广义加性模型预测了6种商业性金枪鱼在全球尺度下的栖息偏好, 发现大眼金枪鱼丰度在热带与亚热带区域的差异并不明显, 这可能是由于使用了延绳钓渔业数据且并没有将FAD鱼群和自由鱼群区分开来所致。此外, 金枪鱼的分布特征在不同大洋间可能会存在差异。沈智宾等[31]利用中国延绳钓船队渔业数据基于SST和SSH构建了东太平洋大眼金枪鱼栖息地指数综合模型, 发现大眼金枪鱼多分布在SST为24~29 ℃和SSH为0.4~0.8 m的海域, SST的范围与本研究的结果非常相似, 但SSH并没有被二阶BRT模型认为是重要的影响因子, 这种变量筛选或许与建模方法的特点有关, 栖息地适宜性指数模型在变量的选择上有更强的人为主观性, 而BRT等回归模型则是通过一些统计准则来进行变量筛选的。HU等[13]利用IATTC延绳钓和围网渔业数据分析了FAD被广泛运用之前和之后的东太平洋金枪鱼栖息地状况, 认为渔业、渔法、鱼种类型和鱼类大小的不同都会影响东太平洋金枪鱼的栖息地偏好, 例如鲣幼体相较于成体更喜欢出现在赤道和沿岸上升流等初级生产力丰富的海域。在本研究中, 空间因子(经度和纬度)是对东太平洋大眼金枪鱼捕获成功率和丰度影响最大的因素, 而前人的研究中多是探讨水文环境对大眼金枪鱼分布的影响, 这种差异源于有些研究并没有将空间因子作为候选变量放入初始模型中, 因为经纬度这类空间变量通常是作为水文环境的间接代表因子来使用的, 其生态学意义还是在强调环境变化对物种分布的影响。对于金枪鱼围网捕获成功率而言, 网具性能往往是最大的影响因素[32], 但本研究由于数据获得性问题, 只在第1阶段模型中考虑了环境因素, 故无法有效地反映影响东太平洋大眼金枪鱼捕获成功率因子的偏效应。此外, 本研究还发现在不同年份和月份间, 大眼金枪鱼的空间分布尽管总体上比较稳定, 但有少许的鱼群会在某些月份集中出现在远离海岸的赤道海域附近, 例如2016年7—9月和2017年2—3月, 这种现象可能与金枪鱼自由鱼群的年龄组成、较强的游泳能力以及对初级生产力时空变化的响应有关[13, 33-34]。
在东大西洋和西印度洋海域, 有学者认为FAD渔法的使用会对鲣和黄鳍金枪鱼的摄食移动产生影响, 金枪鱼鱼群会随附在FAD周围从而停止前往初级生产力高的海域[11]。类似的现象也出现在西太平洋鲣的洄游表现上, 当ENSO(el niño southern oscillation)事件出现时, FAD鲣随附群的移动相对稳定, 而自由鱼群则会采取不同的洄游策略以应对气候变化[35]。这些研究都表明FAD渔法的使用会改变金枪鱼的生态学行为。因此, 十分有必要在对渔业数据进行集群类别的区分后再开展对于自由鱼群和FAD随附群的栖息地研究, 而该类研究有助于从生态学意义上探索FAD渔法对金枪鱼不同类别集群栖息地的影响, 以及帮助捕捞船队将捕捞努力量更多地投入到金枪鱼自由鱼群的捕捞当中, 从而减少对金枪鱼幼鱼的伤害。
本研究利用二阶段BRT模型探索了东太平洋大眼金枪鱼自由鱼群的栖息地特征, 发现其空间分布范围的年际变化十分稳定, 但月间变化有明显的差异。在2016年7—9月和2017年2—4月中, BRT模型预测的空间分布显示一些高度密集的自由鱼群分别栖息在远离海岸, 经度为150°W、纬度为0°的赤道海域和经度为120°W、纬度为10°S附近的海域。时间序列上, 大眼金枪鱼自由鱼群的丰度月平均值在7月份达到了最高值。基于这些结果, 建议在东太平洋作业的围网船队在捕捞时间和空间上做出相应的变化来调整捕捞策略。此外, 本研究尽管对东太平洋大眼金枪鱼的栖息环境进行了研究, 但由于数据的获得性问题, 仍有以下不足: (1)未能考虑溶解氧、水深等同样对大眼金枪鱼分布有重要影响的环境因子; (2)没有直接地比较FAD随附群和自由鱼群的栖息地差异。因此, 在之后的研究中, 应考虑以上因素, 进一步改善研究内容, 提供更为详细的金枪鱼自由鱼群分布特征。
| [1] |
Inter-American Tropical Tuna Commission (IATTC). Report on the tuna fishery, stocks, and ecosystem in the eastern Pacific Ocean in 2018[R]. Bilbao, Spain: Fishery Status Reports, 2019.
|
| [2] |
朱江峰. 运用SS3评估东太平洋大眼金枪鱼(Thunnus obesus)资源——复杂模型和简化模型的比较[J]. 渔业科学进展, 2017, 38(3): 12-21. ZHU J F. Stock assessment of big-eye tuna Thunnus obesus in eastern Pacific Ocean:a comparative study of the full and the simplified SS3 model[J]. Progress in Fishery Sciences, 2017, 38(3): 12-21. |
| [3] |
CASTRO J J, SANTIAGO J A, SANTANA-ORTEGA A T. A general theory on fish aggregation to floating objects:an alternative to the meeting point hypothesis[J]. Reviews in Fish Biology and Fisheries, 2002, 11(3): 255-277. |
| [4] |
FRÉON P, DAGORN L. Review of fish associative behaviour:toward a generalisation of the meeting point hypothesis[J]. Reviews in Fish Biology and Fisheries, 2000, 10(2): 183-207. DOI:10.1023/A:1016666108540 |
| [5] |
Secretariat of the Pacific Community (SPC). Technical aspects of tuna purse seine operations[R]. 21st regional technical meeting on fisheries of South Pacific Commission. Noumea, New Caledonia: SPC/Fisheries 21/Information Paper, 1989: 89-113.
|
| [6] |
ITANO D G. Notes on the improvement of fishing power and efficiency in the western tropical Pacific tuna purse seine fishery[R]. Hawaii: Standing Committee on Tuna and Billfish, 1998.
|
| [7] |
GILLETT R, MCCOY M A, ITANO D G. Status of the United States Western Pacific tuna purse seine fleet and factors affecting its future[R]. Honolulu: SOEST Publication, 2002: 64.
|
| [8] |
ITANO D G. A summary of operational, technical and fishery information on WCPD purse seine fisheries on floating objects[R]. Honolulu, USA: Scientific Committee Regular Session, 2007.
|
| [9] |
王学昉, 许柳雄, 官文江, 等. 金枪鱼围网沉降性能对自由鱼群捕获率的影响[J]. 中国水产科学, 2014, 21(5): 1048-1055. WANG X F, XU L X, GUAN W J, et al. The relationship between purse seine sinking performance and fishing success for free swimming tuna schools[J]. Journal of Fishery Sciences of China, 2014, 21(5): 1048-1055. |
| [10] |
Inter-American Tropical Tuna Commission (IATTC). Conservation measures for tropical tunas in the eastern Pacific Ocaen during 2018-2020 and amendment to resolution C-17-01[EB/OL]. Mexico, Mexico City: IATTC, 2017[2019-12-10].
|
| [11] |
DRUON J N, CHASSOT E, FLOCH L, et al. Preferred habitat of tropical tuna species in the eastern Atlantic and western Indian Oceans: a comparative analysis between FAD-associated and free-swimming schools[R]. Montpellier, France: 17th Working Party on Tropical Tunas, 2015.
|
| [12] |
ARRIZABALAGA H, DUFOUR F, KELL L, et al. Global habitat preferences of commercially valuable tuna[J]. Deep Sea Research Part Ⅱ:Topical Studies in Oceanography, 2015, 113: 102-112. DOI:10.1016/j.dsr2.2014.07.001 |
| [13] |
HU C, HARRISON D P, HINTON M G, et al. Habitat analysis of the commercial tuna of the eastern tropical Pacific Ocean[J]. Fisheries Oceanography, 2018, 27(5): 417-434. DOI:10.1111/fog.12263 |
| [14] |
SAGARESE S R, FRISK M G, CERRATO R M, et al. Application of generalized additive models to examine ontogenetic and seasonal distributions of spiny dogfish (Squalus acanthias) in the northeast (US) shelf large marine Ecosystem[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2014, 71(6): 847-877. DOI:10.1139/cjfas-2013-0342 |
| [15] |
CHANG J H, CHEN Y, HOLLAND D, et al. Estimating spatial distribution of American lobster Homarus americanus using habitat variables[J]. Marine Ecology Progress Series, 2010, 420(6): 145-156. |
| [16] |
FROESCHKE J T, FROESCHKE B F. Two-stage boosted regression tree model to characterize southern flounder distribution in Texas estuaries at varying population sizes[J]. Marine and Coastal Fisheries, 2016, 8(1): 222-231. DOI:10.1080/19425120.2015.1079577 |
| [17] |
ELITH J, LEATHWICK J R, HASTIE T. A working guide to boosted regression trees[J]. Journal of Animal Ecology, 2008, 77(4): 802-813. |
| [18] |
吴建辉, 戴黎斌, 戴小杰, 等. GAM模型和BRT模型在长江口鱼类群落多样性预测中的比较[J]. 应用生态学报, 2019, 30(2): 644-652. WU J H, DAI L B, DAI X J, et al. Comparison of generalized additive model and boosted regression tree in predicting fish community diversity in the Yangtze River estuary, China[J]. Chinese Journal of Applied Ecology, 2019, 30(2): 644-652. |
| [19] |
FRIEDMAN J F, MEULMAN J J. Multiple additive regression trees with application in epidemiology[J]. Statistics in Medicine, 2003, 22(9): 1365-1381. DOI:10.1002/sim.1501 |
| [20] |
HIJMANS R J, PHILLIPS S, LEATHWICK J, et al. dismo: species distribution modeling[EB/OL]. (2017-01-19). https: //CRAN.R-project.org/package=dismo.
|
| [21] |
LOPEZ J, MORENO G, SANCRISTOBAL I, et al. Evolution and current state of the technology of echo-sounder buoys used by Spanish tropical tuna purse seiners in the Atlantic, Indian and Pacific Oceans[J]. Fisheries Research, 2014, 155: 127-137. DOI:10.1016/j.fishres.2014.02.033 |
| [22] |
AMANDÉ M J, ARIZ J, CHASSOT E, et al. Bycatch of the European purse seine tuna fishery in the Atlantic Ocean for the 2003-2007 period[J]. Aquatic Living Resources, 2010, 23(4): 353-362. DOI:10.1051/alr/2011003 |
| [23] |
AMANDÉ M J, CHASSOT E, CHAVANCE P, et al. Precision in bycatch estimates:the case of tuna purse-seine fisheries in the Indian Ocean[J]. ICES Journal of Marine Science, 2012, 69(8): 1501-1510. DOI:10.1093/icesjms/fss106 |
| [24] |
FILMALTER J D, CAPELLO M, DENEUBOURG J L, et al. Looking behind the curtain:quantifying massive shark mortality in fish aggregating devices[J]. Frontiers in Ecology and the Environment, 2013, 11(6): 291-296. DOI:10.1890/130045 |
| [25] |
BALDERSON B, MARTIN L. Environmental impacts and causation of "beached" Drifting Fish Aggregating Devices around Seychelles Islands: a preliminary report on data collected by Island Conservation Society[R]. Mahe, Seychelles: IOTC, 2015.
|
| [26] |
MAUFROY A, CHASSOT E, JOO R, et al. Large-scale examination of spatio-temporal patterns of drifting Fish Aggregating Devices (dFADs) from tropical tuna fisheries of the indian and atlantic oceans[J]. PLoS One, 2015, 10(5): e0128023. DOI:10.1371/journal.pone.0128023 |
| [27] |
HALLIER J P, GAERTNER D. Drifting fish aggregation devices could act as an ecological trap for tropical tuna species[J]. Marine Ecology Progress Series, 2008, 353: 255-264. DOI:10.3354/meps07180 |
| [28] |
JAQUEMET S, POTIER M, MÉNARD F. Do drifting and anchored Fish Aggregating Devices (FADs) similarly influence tuna feeding habits? A case study from the western Indian Ocean[J]. Fisheries Research, 2011, 107(1/3): 283-290. |
| [29] |
MARSAC F, FONTENEAU A, MÉNARD F. Drifting FADs used in tuna fisheries: an ecological trap?[M]//LE GALL J Y, CAYRé P, TAQUET M. Pêche Thonière et Dispositifs de Concentration de Poisons. Ed. Ifremer. Normandie, France: Actes Colloq, 2000: 537-552.
|
| [30] |
MORGAN A C. Fish aggregating devices and tuna: impacts and management options[R]. Washington: Ocean Science Division, Pew Environment Group, 2011.
|
| [31] |
沈智宾, 陈新军, 汪金涛. 基于海表温度和海面高度的东太平洋大眼金枪鱼渔场预测[J]. 海洋科学, 2015, 39(10): 45-51. SHEN Z B, CHEN X J, WANG J T. Forecasting of bigeye tuna fishing ground in the eastern Pacific Ocean based on sea surface temperature and sea surface height[J]. Marine Sciences, 2015, 39(10): 45-51. |
| [32] |
DAI L B, WANG X F, STAPLES K W, et al. Factors Influencing Successful Fishing of Tuna Free-Swimming Schools in the Equatorial Western Pacific Ocean[J]. Turkish Journal of Fisheries and Aquatic Sciences, 2019, 20(5): 341-350. |
| [33] |
FULLER D W, SCHAEFER K M, HAMPTON J, et al. Vertical movements, behavior, and habitat of bigeye tuna (Thunnus obesus) in the equatorial central Pacific Ocean[J]. Fisheries Research, 2015, 172: 57-70. DOI:10.1016/j.fishres.2015.06.024 |
| [34] |
SCHAEFER K M, FULLER D W. Vertical movements, behavior, and habitat of bigeye tuna (Thunnus obesus) in the equatorial eastern Pacific Ocean, ascertained from archival tag data[J]. Marine Biology, 2010, 157(12): 2625-2642. DOI:10.1007/s00227-010-1524-3 |
| [35] |
WANG X F, CHEN Y, TRUESDELL S, et al. The large-scale deployment of fish aggregation devices alters environmentally-based migratory behavior of skipjack tuna in the western Pacific Ocean[J]. PLoS One, 2014, 9(5): e98226. DOI:10.1371/journal.pone.0098226 |
2. College of Marine Sciences, Shanghai Ocean University, Shanghai 201306, China;
3. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
4. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Shanghai Ocean University, Ministry of Education, Shanghai 201306, China;
5. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
6. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


