2. 浙江省近岸水域生物资源开发与保护重点实验室,浙江 温州 325005
凡纳滨对虾(Litopenaeus vannamei)俗称南美白对虾,隶属于十足目(Deeapoda)对虾科(Penaeidae)滨对虾属(Litopenaeus), 原产于中南美洲太平洋沿岸,是全球主要的对虾养殖品种[1, 2]。中国在1988年引进凡纳滨对虾,2000年后养殖面积迅速扩大,并取代斑节对虾(Penaeus monodon)、中国对虾(Fenneropenaeus chinensis)等品种,目前是我国重要的水产养殖大宗品种。中国每年凡纳滨对虾亲虾的需求量约150万对,除了从国外进口,大部分是养虾塘选留的“菜虾”[3]。近年来,国内陆续开展了凡纳滨对虾新品种的选育工作,目前已选育出“科海1号”[4]、“壬海1号”[5]等9个新品种,但自主选育品种的市场占有率一直不高。亲虾选育已经成为制约我国凡纳滨对虾产业健康发展的主要瓶颈。
导致国内凡纳滨对虾选育困境的原因:一是国外主要对虾选育公司的“育种者锁”(breeder lock)策略[6], 使得国内基础选育群体的遗传多样性偏低,如果选育方案控制不好,几代近交后,子代的目标性状会逐渐衰退[3]; 二是环境胁迫,特别是营养胁迫会改变选育群体的目标性状,同时这种改变会通过诸如DNA甲基化、组蛋白修饰、染色质重塑和非编码RNA调控等表观遗传修饰等方式影响子代基因表达[7-8]。研究[9]发现,给妊娠期的小鼠饲喂低蛋白质日粮,会导致子代小鼠的肝脏DNA高度甲基化,子代幼鼠个体显著变小,增大成年后患葡萄糖不耐受症和高血压症的几率。而用鱼油替代植物油,提高黄鳍鲷(Acanthopagrus latus)亲鱼日粮中的n-3多不饱和脂肪酸添加比例,会显著影响孵化3 d后的仔鱼存活率和脂肪细胞代谢[10]。
凡纳滨对虾选育群体的保种养成大致分为幼虾到商品虾规格阶段(0~10 g/尾)、中间养成阶段(10~40 g/尾)和促熟繁育阶段(40 g/尾以上)。幼虾到商品虾规格阶段,有关幼虾的虾片选择[11]、商品虾养殖中粗蛋白[12]和粗脂肪[13]需求的研究报道较多。促熟繁育阶段,有关不同鲜活饵料对凡纳滨对虾性腺发育的影响研究[14]也有报道。虽然在中间养成阶段凡纳滨对虾体质量快速增长,并开始积蓄能量为繁殖做准备,是下一代对虾选育和苗种繁育成败的关键时期。但目前关于凡纳滨对虾中间养成阶段的营养需求仍少有研究,相关知识严重匮乏。针对此问题,选择了对虾养殖和促熟培育中常用的4种饵料,对其进行营养价值评价,并对比分析其对中间养成阶段凡纳滨对虾生长、成活以及消化、生长相关基因表达的影响,以期为凡纳滨对虾选育中间养成阶段的饵料选择提供基础数据支撑。
1 材料与方法 1.1 实验材料凡纳滨对虾选自浙江省乐清市清江实验场构建的同一全同胞家系,挑选个体强壮、规格均一的对虾为实验对象,体质量为(10.30±1.61)g。4种实验饵料:饵料1产自宁波的凡纳滨对虾配合饲料(ZD); 饵料2产自泰国的亲虾软颗粒饲料(YW); 饵料3体质量为(246.14 ± 43.50)g的冰冻虎斑乌贼(Sepia pharaonis, SP), 购自乐清市蒲岐海鲜市场,投喂前将头足(去除口球、眼)和外套膜肌肉切成条状洗净;饵料4体质量为(2.18±0.35)g的活体双齿围沙蚕(Perineresis aibuhitensis, PA), 购自温岭市沙蚕养殖场,投喂前吐泥洗净。
1.2 实验方法 1.2.1 实验处理4种饵料投喂实验在面积为10 m2(3.7 m×2.7 m×1.2 m)的室内水泥池进行,气石密度为1个/m2, 每实验组设3个平行(100尾对虾/平行)。每天07:00、15:00和22:00各饱食投喂1次,以饵料少量剩余为准。定时查看对虾摄食及死亡情况,并及时捞出死亡对虾。养殖池每3天排污换水1次,换水量30%~50%, 实验用水为自然海水经沉淀、砂滤、海水反渗透膜处理得到的浓缩海水。实验期间水温为(28.8 ± 0.6) ℃、pH为8.3±0.2、盐度为29.8±0.4、溶解氧质量浓度为(5.7±0.6)mg/L。投喂实验持续60 d, 结束时逐尾统计各实验组对虾的数量和体质量(精确到0.01 g); 每个实验组随机选取12尾对虾(雌雄各6尾), 剥取肌肉,组织捣碎机搅碎混匀,-20 ℃冻存用于对虾肌肉氨基酸成分的测定;每个实验组随机选取6尾对虾(雌雄各3尾), 冰上解剖取肝胰腺和肌肉组织,液氮冻存后-80 ℃保存用于后续基因表达分析。
分别称取配合饲料和软颗粒饲料各600 g、取6只虎斑乌贼(将去除口球、眼的头足和外套膜肌肉切成条状后吸干表面水分)、称取600 g双齿围沙蚕吐泥洗净吸干表面水分后,用组织捣碎机搅碎混匀,-20 ℃密封保存,用于后续4种饵料营养成分的测定。
1.2.2 4种饵料营养成分及实验对虾肌肉氨基酸成分测定饵料营养成分测定:水分采用恒温干燥法(GB 5009.3—2010)测定;粗蛋白采用微量凯氏定氮法(GB 5009.5—2010)测定;粗脂肪采用索氏抽提法(GB 5009.6—2003)测定;灰分采用马弗炉灼烧法(GB 5009.4—2010)测定;色氨酸参照GB/T 15400—1994, 其他氨基酸参照GB/T 5009.124—2016, 用氨基酸自动分析仪(日本,L-8900)测定。
脂肪酸参照GB/T 5009.168—2016, 称取适量样品,加入100 mg焦性没食子酸、5粒沸石,再加入2 mL 95%乙醇混匀,加入盐酸溶液10 mL混匀。将烧瓶放入70~80 ℃水浴中水解40 min, 后加入10 mL 95%乙醇混匀。水解液转到分液漏斗中,振摇5 min, 静置10 min。将醚层提取液收集到250 mL烧瓶中。重复以上步骤提取水解液3次,最后用乙醚石油醚混合液冲洗分液漏斗,并收集到已恒重的烧瓶中,将烧瓶置水浴上蒸干,置(100±5)℃烘箱中干燥2 h。在脂肪提取物中,继续加入2 mL质量分数为2%氢氧化钠甲醇溶液,85 ℃水浴锅中水浴30 min, 加入3 mL质量浓度为14%三氟化硼甲醇溶液,于85 ℃水浴锅中水浴30 min。水浴完成降至室温后,离心管中加入1 mL正己烷,振荡萃取2 min之后,静置1 h, 等待分层。取上层清液100 μL, 用正己烷定容到1 mL。用0.45 μm滤膜过膜后上机测试。上样用气相色谱质谱联用仪(Finnigan Trace DSQ GC/MS, 美国)测定,其中色谱柱为CD-2560(100 m×0.25 mm×0.20 μm); 升温程序:130 ℃保持5 min, 以4 ℃/min的速率升温至240 ℃, 保持30 min。进样口温度:250 ℃; 载气流速:0.5 mL/min; 10∶1分流进样;检测器:FID; 检测器温度:250 ℃。
参考WHO/FAO的氨基酸评分模式[15], 以实验对虾肌肉的必需氨基酸比率(A/E)为标准,计算氨基酸评分(AAS)、必需氨基酸指数(EAAI) 和变异系数(CV):
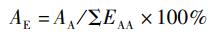 (1)
(1)
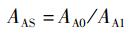 (2)
(2)
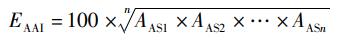 (3)
(3)
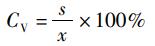 (4)
(4)
式中:AE为实验对虾肌肉的必需氨基酸比率,%; AA为单个必需氨基酸质量分数,%; ΣEAA为必需氨基酸总质量分数,%; AAS为氨基酸评分;AA0为饵料中某一必需氨基酸质量分数,%; AA1为凡纳滨对虾肌肉同种氨基酸质量分数,%; EAAI为必需氨基酸指数;n为参与比较的必需氨基酸个数;AAS1、AAS2和AASn为实验饵料的单一必需氨基酸评分;s为同一饵料的必需氨基酸AAS标准差;x为平均值。
1.2.3 4种饵料投喂对实验对虾生长和成活的影响不同饵料投喂实验组对虾的特定生长率(GR)和成活率(R):
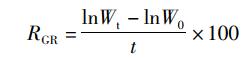 (5)
(5)
 (6)
(6)
式中:RGR为特定生长率,%/d; R为成活率,%; Wt为实验结束时对虾平均体质量,g; W0为实验起始时对虾平均体质量,g; t为实验天数,d; Nt为实验结束时对虾数量,只;N0为实验开始时对虾数量,只。
1.2.4 4种饵料投喂对实验对虾消化、生长相关基因表达的影响按照EASYspin Plus组织/细胞RNA快速提取试剂盒说明书对对虾组织样进行总RNA提取。RNA浓度和完整度经NanoDrop和凝胶电泳检测合格后,采用PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)反转录试剂盒制备cDNA模板,cDNA模板稀释后-20 ℃保存备用。
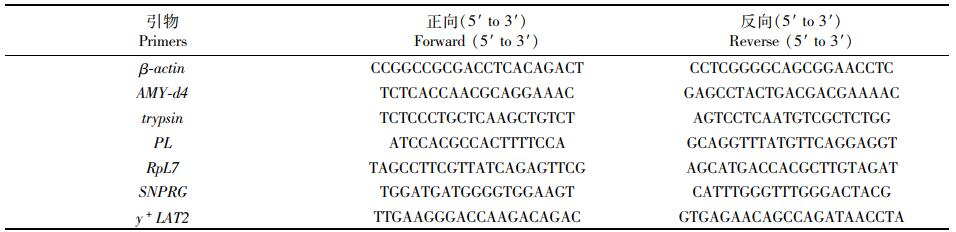
从NCBI数据库下载α-淀粉酶d4 (alpha-amylase, AMY-d4)、蛋白酶(trypsin)、胰脂肪酶(pancreatic lipase, PL)、核糖体蛋白L7(ribosomal protein L7, RpL7)、小核核糖核蛋白肽G(Small nuclear ribonucleoprotein polypeptide G, SNRPG)和y+L氨基酸转运载体-2(y+L amino acid transporter-2, y+LAT2)基因的序列,用Premier Premier 5.0设计引物并克隆测序验证特异性。参照ZHANG等[16]的方法,以β-actin为内参基因,用StepOnePlus荧光定量PCR(美国,ABI)检测各基因的相对表达水平。表达水平通过公式RTL = 1 000×2-ΔCT计算获得,其中ΔCT=CT目标基因-CTactin。所分析6个基因引物序列见表 1。
|
表 1 β-actin、AMY-d4、trypsin、PL、RpL7、SNPRG和y+LAT2基因的引物序列 Tab.1 Primers sequences for β-actin, AMY-d4, trypsin, PL, RpL7, SNPRG and y+LAT2 used |
用Excel 2010和SPSS 23对数据进行统计和方差分析,饵料营养成分结果以平均值(Mean)表示。实验对虾的生长、成活和基因表达结果以平均值±标准差(Mean±SD)表示,组间差异用LSD多重比较,显著水平为P < 0.05, 并用SigmaPlot 10.0作图。
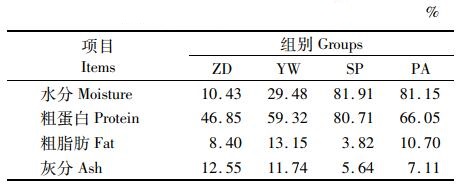
2 结果 2.1 4种饵料的营养成分比较分析由表 2(水分含量为鲜物质基础,粗蛋白、粗脂肪和灰分含量为风干基础)可知。软颗粒饲料的水分含量高于配合饲料,但低于虎斑乌贼和双齿围沙蚕。粗蛋白含量由高到低依次为虎斑乌贼、双齿围沙蚕、软颗粒饲料、配合饲料。粗脂肪含量由高到低依次为软颗粒饲料、双齿围沙蚕、配合饲料、虎斑乌贼。配合饲料和软颗粒饲料的灰分含量高于虎斑乌贼和双齿围沙蚕。
|
表 2 4种饵料的常规营养成分(质量分数) Tab.2 Nutrition components of the four diets investigated(mass fraction) |
由表 3可知,共检出18种氨基酸,必需氨基酸和总氨基酸含量从高到低依次为对虾肌肉、虎斑乌贼、双齿围沙蚕、软颗粒饲料、配合饲料。EAA/NEAA和EAA/TAA顺序相似,由高到低依次为双齿围沙蚕、虎斑乌贼、对虾肌肉、配合饲料、软颗粒饲料,其中对虾肌肉的EAA/NEAA和EAA/TAA与虎斑乌贼相近。

|
表 3 4种饵料与实验对虾肌肉氨基酸组成及含量(风干基础,质量分数) Tab.3 Composition and contents of amino acids in the four diets investigated (air-dry basis, mass fraction) |
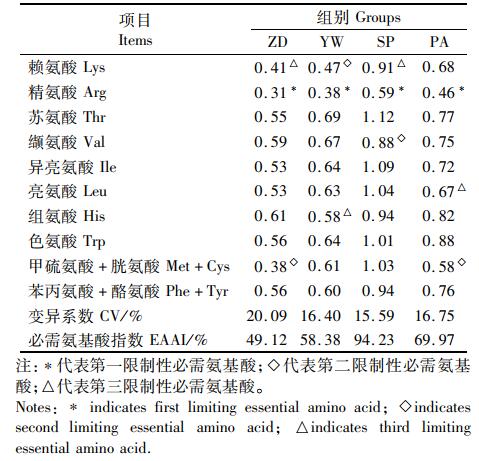
由图4可知,4种饵料的第一限制性氨基酸均为精氨酸(Arg), 而配合饲料的第二和第三限制性氨基酸分别为甲硫氨酸+胱氨酸(Met+Cys)和赖氨酸(Lys), 软颗粒饲料为Lys和组氨酸(His), 虎斑乌贼为缬氨酸(Val)和Lys, 双齿围沙蚕为Met+Cys和亮氨酸(Leu)。4种饵料的CV值由高到低依次为配合饲料、双齿围沙蚕、软颗粒饲料、虎斑乌贼,其中除配合饲料外的3种饵料CV值相近;而EAAI由高到低依次为虎斑乌贼、双齿围沙蚕、软颗粒饲料、配合饲料,其中虎斑乌贼的EAAI指数远高于其他饵料。
|
表 4 4种饵料的必需氨基酸AAS和EAAI评价 Tab.4 AAS and EAAI evaluation of the four diets investigated |
由表 5可知:软颗粒饲料的脂肪酸检出种类数最多(24种), 其他依次为配合饲料(22种)、双齿围沙蚕(17种)和虎斑乌贼(12种); 饱和脂肪酸(SFA)由高到低依次为虎斑乌贼、双齿围沙蚕、软颗粒饲料和配合饲料,同时4种饵料的SFA均以棕榈酸(C16∶0)和硬脂酸(C18∶0)为主。虎斑乌贼和配合饲料的单不饱和脂肪酸(MUFA)都高于双齿围沙蚕,低于软颗粒饲料。实验饵料的MUFA都以油酸[C18∶1(n-9)]为主。配合饲料和双齿围沙蚕的多不饱和脂肪酸(PUFA)都高于虎斑乌贼和软颗粒饲料,且除双齿围沙蚕外,PUFA中丰度最高的均为亚油酸[C18∶2(n-6)]、EPA[C20∶5(n-3)]和DHA[C22∶6(n-3)]。虎斑乌贼的EPA+DHA和∑n3/∑n6高于其他饵料组。

|
表 5 4种饵料的脂肪酸组成及质量分数 Tab.5 Composition and content mass fraction of fatty acid in the four diets investigated |
由表 6可知:特定生长率由高到低依次为双齿围沙蚕组、配合饲料和软颗粒饲料组、虎斑乌贼组,其中配合饲料组和软颗粒饲料组间差异不显著(P > 0.05), 其他组间均具显著差异(P < 0.05);同特定生长率类似,实验对虾的成活率由高到低也为双齿围沙蚕组、配合饲料组、软颗粒饲料组、虎斑乌贼组,虽然相邻组间的成活率差异不显著(P > 0.05), 但双齿围沙蚕组显著高于软颗粒饲料组和虎斑乌贼组(P < 0.05), 配合饲料组则显著高于虎斑乌贼组(P < 0.05)。

|
表 6 4种饵料投喂下实验对虾的生长和成活 Tab.6 Growth and survival rate of L. vannamei fed with four diets investigated |
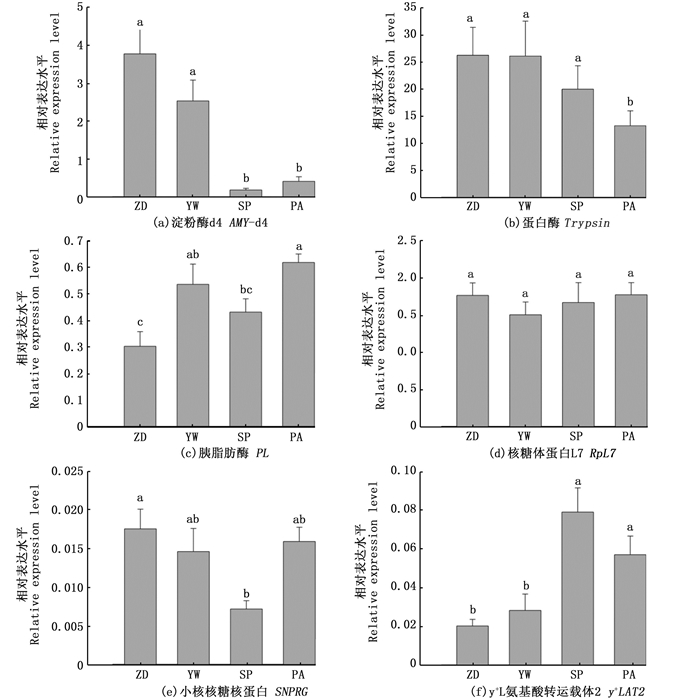
4种饵料投喂下,配合饲料组和软颗粒饲料组对虾的肝胰腺AMY-d4基因表达水平显著高于虎斑乌贼组和双齿围沙蚕组(P < 0.05), 见图 1a。虎斑乌贼组的trypsin基因表达水平显著最低(P < 0.05), 见图 1b, 而其他饵料组间表达差异不显著(P > 0.05)。实验对虾的PL基因表达水平由高到低依次为双齿围沙蚕组、软颗粒饲料组、虎斑乌贼组和配合饲料组,其中相邻组间无显著差异(P > 0.05), 相隔组间具显著性差异(P < 0.05), 见图 1c。4种饵料投喂对RpL7基因在对虾肌肉中的表达不具显著性影响(P > 0.05), 见图 1d。虎斑乌贼投喂下对虾的SNPRG基因表达显著低于配合饲料组(图 1e), 而其他饵料组间的表达差异不显著(P > 0.05)。虎斑乌贼组和双齿围沙蚕组的y+LAT2基因表达水平显著高于配合饲料组和软颗粒饲料组(P < 0.05), 见图 1f。
|
同一图中字母不同代表差异显著(P < 0.05), 相同则表示差异不显著(P > 0.05)。 Different letters indicate the mean values in the same figure are significantly different (P < 0.05), same letters indicate no significant difference (P > 0.05). 图 1 4种饵料投喂对实验对虾消化、生长相关基因表达的影响 Fig. 1 Expression levels of digestion and growth-related genes in shrimps fed with the four diets investigated |
饲料的营养价值与蛋白含量、氨基酸组成直接相关,特别是必需氨基酸的组成和含量[17-18]。黄文文等[12]以6种不同蛋白水平的饲料投喂两种规格的凡纳滨对虾发现,幼虾阶段和养成阶段的蛋白质需要量(质量分数)分别为38.6%和36.8%。李广丽等[19]用不同蛋白质水平的饲料投喂体长为(4.21±0.31)cm的凡纳滨对虾发现,蛋白质质量分数在42.37%~44.12%时对虾生长最快。曾雯娉[17]和MCVEY等[20]认为,凡纳滨对虾的限制性氨基酸为Lys、苯丙氨酸(Phe)和Arg, 需求量(质量分数)分别为2.05%、0.89%和2.16%。本研究中测试的4种实验饵料的粗蛋白和Lys、Phe和Arg含量均高于建议值,但限制性氨基酸种类与报道不同,可能是由于本研究中AAS评价标准为对虾肌肉导致。4种饵料中,虎斑乌贼具有显著高于其他组别的TAA和EAA含量,这与之前报道的乌贼科中杜氏枪乌贼(Loligo duvancelii)[21]、拟目乌贼(Sepia lycidas)[22]等的营养结论相一致。同时,虎斑乌贼和双齿围沙蚕的EAA/ NEAA、EAA/ TAA、EAAI、CV等指标都优于配合饲料和软颗粒饲料,显示虎斑乌贼和双齿围沙蚕的必需氨基酸评价相对更优。
脂肪是虾生长发育所需的必需脂肪酸、胆固醇和磷脂等的主要来源,不但参与脂溶性维生素的吸收和运输[23], 而且在蜕壳生长[24]、性腺发育[25]中起着重要作用。多不饱和脂肪酸特别是EPA、DHA是对虾的必需脂肪酸,由于对虾的自身合成能力有限,主要依靠外源获取[26]。脂肪添加水平不足会导致对虾蛋白利用率下降乃至代谢紊乱[27], 而添加过量也会导致体内脂肪酸重新合成受到抑制,影响对虾正常的生长发育和免疫应答[28]。DESHIMARU等[29]发现,与对照组相比在日粮中添加质量分数6%的豆油和鳕鱼肝油(1∶3或1∶1)混合物能显著促进日本囊对虾(Marsupenaeus japonicus)的生长。王猛强等[13]用6种不同粗脂肪水平的饲料投喂规格为(7.93±0.03) g/尾的凡纳滨对虾发现,适宜的粗脂肪质量分数为5.57%~7.86%。在本研究所测试的4种饵料中,配合饲料和双齿围沙蚕具有最高的PUFA。软颗粒饲料的粗脂肪质量分数偏高(13.15%), 而PUFA、EPA+DHA和∑n3/∑n6等指标则均偏低。虽然虎斑乌贼具有很高的EPA+DHA和∑n3/∑n6, 但其粗脂肪质量分数明显偏低(3.82%)。因此,本研究表明在所测试的4种饵料中,配合饲料和双齿围沙蚕的脂肪组成和含量相对更优。
4种饵料投喂下,实验对虾的生长和成活率由高到低依次为双齿围沙蚕、配合饲料、软颗粒饲料、虎斑乌贼。虽然虎斑乌贼的性腺和肝脏脂肪含量较高,且富含多不饱和脂肪酸[30], 但生产上作为鲜活饵料时,为防止水质败坏,一般只保留其头足和外套膜肌肉进行投喂。因此虎斑乌贼的投喂效果不佳可能与头足和外套膜肌肉中的粗脂肪含量过低有关,这与高晓兰等[30]对野生虎斑乌贼外套膜肌肉高蛋白质、低脂肪的评价相一致。软颗粒饲料的投喂效果不佳可能与粗脂肪含量过高,且脂肪酸组成评价相对较低有关。
3.2 4种饵料投喂对实验对虾消化、生长相关基因表达的影响水产动物对饵料组成有较高的敏感性,肝胰脏能根据饵料调节体内消化酶的活性,进而影响实验动物的生理状态[31-33]。适当含量的碳水化合物能降低对虾的蛋白需求而不影响其生长性能[34], 配合饲料和软颗粒饲料投喂下,对虾肝胰腺AMY-d4基因的高水平表达可能与人工饲料中的植物淀粉添加有关。有研究[34-35]认为,作为实验动物的一种适应本能,饵料的组成与对应的消化酶活性正相关,本研究中PL基因的表达水平同饵料脂肪含量大体一致,而trypsin基因的表达同实验饵料蛋白含量却不相关,有关原因还有待进一步研究。
SNRPG是细胞核内的一种与小核RNA结合的蛋白质多肽,而RpL7是构成核糖体60Sd亚基的成分。此前钱昭英[36]利用RNAi技术验证了SNRPG和RpL7基因可以正向调控对虾肌肉生长相关基因的表达。y+LAT2是参与细胞内外氨基酸转运的蛋白,主要转运碱性氨基酸和中性氨基酸[37, 38], 目前y+LAT2基因表达调控研究已在小鼠[39]和草鱼(Ctenopharyngodon idellus)[40]等物种中有所报道。本研究中,4种饵料投喂对对虾肌肉SNRPG和RpL7基因表达的影响同对虾的生长趋势相似,而且y+LAT2基因表达同实验饵料的碱性和中性氨基酸含量正相关,但氨基酸转运同对虾生长之间的内在关系仍有待进一步研究。
3.3 选育中间养成阶段凡纳滨对虾的饵料选择及风险评估凡纳滨对虾世代选育过程中,病害引入的风险评估和隔离是关键。对虾选育中间养成阶段长达3~ 4个月,尽管可以严格选择产地和进货渠道,但鲜活饵料仍然是病害引入的主要风险源。同时在选育养成中发现,投喂双齿围沙蚕的雄虾性腺会提早成熟,这会导致来年选育时雄虾精荚老化,打乱选育工作的安排。因此,在对虾选育中间养成阶段,选择与双齿围沙蚕营养相近的人工饲料更为稳妥,接近促熟繁育阶段时再逐渐用双齿围沙蚕替代。
| [1] |
ANSARI T M, MARR I L, TARIQ N. Heavy metals in marine pollution perspective: a mini review[J]. Journal of Applied Sciences, 2004, 4(1): 1-20. |
| [2] |
朱亦晨, 谭洪新, 罗国芝. 养殖密度对硝化型生物絮团系统中凡纳滨对虾生长和水质的影响[J]. 上海海洋大学学报, 2020, 29(1): 27-35. ZHU Y C, TAN H X, LUO G Z. Effect of different stocking density on growth performance of Litopenaeus vannamei and water quality in nitrifying bio-floc system[J]. Journal of Shanghai Ocean University, 2020, 29(1): 27-35. |
| [3] |
冀德伟, 胡利华, 闫茂仓, 等. 凡纳滨对虾野生群体F1与近交群体杂交和自交子代的抗逆、生长性状比较[J]. 中国水产科学, 2018, 25(6): 1227-1235. JI D W, HU L H, YAN M C, et al. A comparative study on stress resistance and growth among the inbred and hybrid offsprings of wild population F1 and inbreeding population of Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2018, 25(6): 1227-1235. |
| [4] |
于洋. 凡纳滨对虾分子标记的开发及其在遗传育种中的应用[D]. 青岛: 中国科学院海洋研究所, 2014: 58-69. YU Y. Development of molecular markers and their applications in selective breeding of the pacific white shrimp, Litopeneaus vannamei[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2014: 58-69. |
| [5] |
冯亚萍. 凡纳滨对虾抗WSSV性状遗传参数评估及与中国明对虾抗WSSV性状差异研究[D]. 上海: 上海海洋大学, 2017: 13-21. FENG Y P. Estimation of genetic parameters for white spot syndrome virus(WSSV)resistance traits in Litopenaeus vannmei and comparison of resistance to WSSV between Litopenaeus vannamei and Fenneropenaeus chinensis[D]. Shanghai: Shanghai Ocean University, 2017: 13-21. |
| [6] |
DOYLE R W. Inbreeding and disease in tropical shrimp aquaculture: a reappraisal and caution[J]. Aquaculture Research, 2016, 47(1): 21-35. DOI:10.1111/are.12472 |
| [7] |
DEANS C, MAGGERT K A. What do you mean, "epigenetic"?[J]. Genetics, 2015, 199(4): 887-896. DOI:10.1534/genetics.114.173492 |
| [8] |
COX B D. On the difficulty in getting out of historical ruts: Waddington and an argument for behavioral epigenetics[J]. New Ideas in Psychology, 2013, 31(3): 374-389. DOI:10.1016/j.newideapsych.2012.07.004 |
| [9] |
REES W D, HAY S M, BROWN D S, et al. Maternal protein deficiency causes hypermethylation of DNA in the livers of rat fetuses[J]. The Journal of Nutrition, 2000, 130(7): 1821-1826. DOI:10.1093/jn/130.7.1821 |
| [10] |
ZAKERI M, KOCHANIAN P, MARAMMAZI J G, et al. Effects of dietary n-3 HUFA concentrations on spawning performance and fatty acids composition of broodstock, eggs and larvae in yellowfin sea bream, Acanthopagrus latus[J]. Aquaculture, 2011, 310(3/4): 388-394. |
| [11] |
杨育凯, 林黑着, 杨其彬, 等. 3种虾片在凡纳滨对虾育苗中的效果评价[J]. 四川农业大学学报, 2017, 35(2): 266-272. YANG Y K, LIN H Z, YANG Q B, et al. Effect evaluation of three kinds of shrimp flake in the larval rearing of Litopenaeus vannamei[J]. Journal of Sichuan Agricultural University, 2017, 35(2): 266-272. |
| [12] |
黄文文, 郑昌区, 霍雅文, 等. 凡纳滨对虾不同生长阶段的蛋白质需要量[J]. 动物营养学报, 2014, 26(9): 2675-2686. HUANG W W, ZHENG C Q, HUO Y W, et al. Protein requirement of pacific white shrimp (Litopenaeus vannamei) during different growth stages[J]. Chinese Journal of Animal Nutrition, 2014, 26(9): 2675-2686. DOI:10.3969/j.issn.1006-267x.2014.09.029 |
| [13] |
王猛强, 郑昌区, 金敏, 等. 粗脂肪水平对2种规格凡纳滨对虾生长性能、饲料利用和非特异性免疫的影响[J]. 动物营养学报, 2014, 26(9): 2687-2697. WANG M Q, ZHENG C Q, JIN M, et al. Effects of dietary crude lipid level on growth performance, feed utilization and non-specific immunity of pacific white shrimp at two growth stages[J]. Chinese Journal of Animal Nutrition, 2014, 26(9): 2687-2697. DOI:10.3969/j.issn.1006-267x.2014.09.030 |
| [14] |
姚卫军, 黄翔鹄, 李活. 不同天然饵料对凡纳滨对虾亲虾性腺发育的影响[J]. 广东海洋大学学报, 2009, 29(4): 84-88. YAO W J, HUANG X H, LI H. Effect of various natural diets on broodstock's gonad development of Litopenaeus vannamei[J]. Journal of Guangdong Ocean University, 2009, 29(4): 84-88. DOI:10.3969/j.issn.1673-9159.2009.04.019 |
| [15] |
FAO/WHO Ad Hoc Expert Committee. Energy and protein requirements[R]. Rome: FAO and WHO, 1973: 40-72.
|
| [16] |
ZHANG M, HUANG X K, HU L H, et al. Effects of salinity fluctuation on gene expression profiles of female Litopenaeus vannamei broodstocks[J]. The Israeli Journal of Aquaculture-Bamidgeh, 2018, 70: 1476-1484. |
| [17] |
曾雯娉. 凡纳滨对虾幼虾对赖氨酸、蛋氨酸、精氨酸和苯丙氨酸需要量的研究[D]. 湛江: 广东海洋大学, 2012: 1-4. ZENG W P. Study on the requirements of lysine, methionine, arginine and phenylalanine for juvenile pacific white shrimp, Litopenaeus vannamei[D]. Zhanjiang: Guangdong Ocean University, 2012: 1-4. |
| [18] |
National Research Council. Nutrient requirements of fish and shrimp[M]. Washington, DC: The National Academies Press, 2011: 57-100.
|
| [19] |
李广丽, 朱春华, 周歧存. 不同蛋白质水平的饲料对南美白对虾生长的影响[J]. 海洋科学, 2001, 25(4): 1-4. LI G L, ZHU C H, ZHOU Q C. Effects of dietary protein level on the growth of Penaeus vannamei[J]. Marine Sciences, 2001, 25(4): 1-4. |
| [20] |
MCVEY J P, FOX L M. Hatchery techniques for penaeid shrimp utilized by Texas A & M-NMFS Galveston Laboratory program[M]//MCVEY J P. CRC Handbook of Mariculture, Vol. 1, Crustacean Aquaculture. Boca Raton, FL, USA: Chemical Rubber Company Press, 1983: 129-154.
|
| [21] |
杜少波, 胡超群, 沈琪, 等. 凡纳滨对虾亲虾常用天然饵料营养成分的比较研究[J]. 热带海洋学报, 2005, 24(1): 50-59. DU S B, HU C Q, SHEN Q, et al. A comparative study on biochemical composition of main natural diets for broodstock Litopenaeus vannamei[J]. Journal of Tropical Oceanography, 2005, 24(1): 50-59. DOI:10.3969/j.issn.1009-5470.2005.01.008 |
| [22] |
蒋霞敏, 彭瑞冰, 罗江, 等. 野生拟目乌贼不同组织营养成分分析及评价[J]. 动物营养学报, 2012, 24(12): 2393-2401. JIANG X M, PENG R B, LUO J, et al. Analysis and evaluation of nutrient composition in different tissues of wild Sepia lycidas[J]. Chinese Journal of Animal Nutrition, 2012, 24(12): 2393-2401. DOI:10.3969/j.issn.1006-267x.2012.12.014 |
| [23] |
CASTELL J D, COVEY J F. Dietary lipid requirements of adult lobsters, Homarus americanus (M. E.)[J]. The Journal of Nutrition, 1976, 106(8): 1159-1165. DOI:10.1093/jn/106.8.1159 |
| [24] |
CAVALLI R O, LAVENS P, SORGELOOS P. Performance of Macrobrachium rosenbergii broodstock fed diets with different fatty acid composition[J]. Aquaculture, 1999, 179(1/4): 387-402. |
| [25] |
SPAARGAREN D H, HAEFNER P A JR. Interactions of ovary and hepatopancreas during the reproductive cycle of Crangon crangon (L.). Ⅱ. Biochemical relationships[J]. Journal of Crustacean Biology, 1994, 14(1): 6-19. |
| [26] |
LIM C, AKO H, BROWN C L, et al. Growth response and fatty acid composition of juvenile Penaeus vannamei fed different sources of dietary lipid[J]. Aquaculture, 1997, 151(1/4): 143-153. |
| [27] |
姬红臣. 饲料对凡纳滨对虾生长、生化成分及养殖水质的影响[D]. 厦门: 厦门大学, 2005: 9-10. JI H C. The effects of formula feeds on the growth, biochemical compositions of Litopenaeus vannamei and water quality[D]. Xiamen: Xiamen University, 2005: 9-10. |
| [28] |
SARGENT J R, HENDERSON R J, TOCHER D R. The lipids[M]//HALVER J E. Fish Nutrition. 2nd ed. New York: Academic Press, 1989: 153-218.
|
| [29] |
DESHIMARU O, KUROKI K, YONE Y. The composition and level of dietary lipid appropriate for growth of prawn[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1979, 45: 591-594. DOI:10.2331/suisan.45.591 |
| [30] |
高晓兰, 蒋霞敏, 乐可鑫, 等. 野生虎斑乌贼不同组织营养成分分析及评价[J]. 动物营养学报, 2014, 26(12): 3858-3867. GAO X L, JIANG X M, LE K X, et al. Analysis and evaluation of nutritional components in different tissues of wild Sepia pharaonis[J]. Chinese Journal of Animal Nutrition, 2014, 26(12): 3858-3867. DOI:10.3969/j.issn.1006-267x.2014.12.041 |
| [31] |
BOLASINA S, PREZ A, YAMASHITA Y. Digestive enzymes activity during ontogenetic development and effect of starvation in Japanese flounder, Paralichthys olivaceus[J]. Aquaculture, 2006, 252(2/4): 503-515. |
| [32] |
SHAN X J, XIAO Z Z, HUANG W, et al. Effects of photoperiod on growth, mortality and digestive enzymes in miiuy croaker larvae and juveniles[J]. Aquaculture, 2008, 281(1/4): 70-76. |
| [33] |
王海英. 大菱鲆主要消化酶——蛋白酶、脂肪酶、淀粉酶的研究[D]. 青岛: 中国海洋大学, 2004: 4-5. WANG H Y. Digestive enzyme in turbot Scophthalmus maximus L. [D]. Qingdao: Ocean University of China, 2004: 4-5. |
| [34] |
胡毅. 凡纳滨对虾饲料配方优化及几种饲料添加剂的应用[D]. 青岛: 中国海洋大学, 2007: 18-20. HU Y. Optimum feed formula selection and some feed additive application on juvenile Litopenaeus vannamei[D]. Qingdao: Ocean University of China, 2007: 18-20. |
| [35] |
TAKII K, SHIMENO S, TAKEDA M. The effect of feeding stimulants in diet on some hepatic enzyme activities of eel[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1986, 52(12): 2131-2134. DOI:10.2331/suisan.52.2131 |
| [36] |
钱昭英. 凡纳滨对虾生长性能相关候选基因的分离鉴定、表达规律及调控功能研究[D]. 杨凌: 西北农林科技大学, 2014: 91-139. QIAN Z Y. Isolation, identification, expression and function studies of growth performance candidate genes in Litopenaeus vannamei[D]. Yangling: Northwest A & F University, 2014: 91-139. |
| [37] |
CHILLARÓ N J, ESTÉVEZ R, MORA C, et al. Obligatory amino acid exchange via systems bo, +-like and y+ L-like: a tertiary active transport mechanism for renal reabsorption of cystine and dibasic amino acids[J]. The Journal of Biological Chemistry, 1996, 271(30): 17761-17770. DOI:10.1074/jbc.271.30.17761 |
| [38] |
MEIER C, RISTIC Z, KLAUSER S, et al. Activation of system L heterodimeric amino acid exchangers by intracellular substrates[J]. The EMBO Journal, 2002, 21(4): 580-589. DOI:10.1093/emboj/21.4.580 |
| [39] |
DAVE M H, SCHULZ N, ZECEVIC M, et al. Expression of heteromeric amino acid transporters along the murine intestine[J]. The Journal of Physiology, 2004, 558(2): 597-610. DOI:10.1113/jphysiol.2004.065037 |
| [40] |
杨吉轩. 草鱼碱性氨基酸转运载体y+LAT1和y+LAT2的基因克隆及其mRNA表达研究[D]. 武汉: 华中农业大学, 2013: 14-51. YANG J X. Molecular cloning and expression analysis of cationic amino acid transporters y+LAT1 and y+LAT2 in Ctenopharyngodon idellus[D]. Wuhan: Huazhong Agricultural University, 2013: 14-51. |
2. Zhejiang Key Laboratory of Exploitation and Preservation of Coastal Bio-resource, Wenzhou 325005, Zhejiang, China
 2021,
Vol. 30
2021,
Vol. 30


