2. 上海冷链装备性能与节能评价专业技术服务平台, 上海 201306;
3. 上海水产品加工及贮藏工程技术研究中心, 上海 201306;
4. 食品科学与工程国家级实验教学示范中心, 上海 201306
缢蛏(Sinonovacula constricta)属于变温动物[1-2], 环境温度波动会直接对其抗氧化能力以及代谢功能产生巨大影响。环境温度快速且长期的变化会使缢蛏处于应激状态,导致机体抗氧化系统产生不可逆转的损伤,影响缢蛏代谢、生长[3]。研究[4]表明,贝类的死亡率、病害率与环境温度的升高有明显的线性相关性。不同种类的贝在不同生长环境中有各自的温度承受范围,在此范围内,随着环境温度的升高,贝类的生理代谢也有所提高,一旦超过此范围,贝类会产生强烈的氧化应激响应[5-6], 严重时会导致其死亡[7-8]。姜娓娓等[9]通过设置温度急性变化组和温度渐变组,分别将皱纹盘鲍(Haliotis discus)从15 ℃的室温下降温或升温至5、10、20、25 ℃进行温度胁迫,研究发现,急性温度胁迫显著影响了皱纹盘鲍的生理和生化活动;李艳红[10]发现,温度对近江牡蛎(Crassostrea ariakensis)鳃和消化腺中的过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)活性影响极显著;WANG等[11]也发现,冷、热应激均会引起绿贻贝(Perna viridis)死亡率和活性氧含量显著增加,而SOD、CAT和GSH-Px等抗氧化酶的活性只有在热胁迫后才有很大的提高。
虽然贝类保活研究逐渐受到关注,但目前有关环境因素变化对贝类的氧化应激响应及生理代谢研究仍鲜有报道。因此,笔者以缢蛏为研究对象,重点探究急性温度胁迫下贝类的氧化应激响应和生理代谢机制,旨在为贝类在养殖、运输和销售过程中的活性保持提供理论依据和数据参考。
1 材料与方法 1.1 实验材料实验所用缢蛏于2019年5月选购自上海市浦东新区南汇新城镇芦潮港集贸市场,平均生物学壳长为61 mm, 平均生物学壳宽为22 mm, 平均体质量为(13.0±0.5)g。挑选富有活力,体色正常,双壳完整的个体作为研究对象。
1.2 方法首先,按20‰±0.5‰的比例使用海水晶配置人工海水,并用人工海水清洗从市场购入的缢蛏,除去其表面泥沙后暂养在装有人工海水的塑料箱(长×宽×高为520 mm×350 mm×285 mm)中,暂养净化期间用增氧泵(3 W)对其持续增氧,使溶氧量维持在4 mg/L, 每隔3 h更换1次人工海水,暂养约12 h; 缢蛏的适宜生长温度为15~21 ℃, 最适宜生长温度为21 ℃, 实验将暂养水温维持在(20±1) ℃; 将暂养净化后的缢蛏从暂养箱中捞出并分为7组,每组100只,分别平铺(一层)在装有相同水量的7只小尺寸塑料箱(长×宽×高为400 mm×300 mm×120 mm)中,箱中水位刚好没过缢蛏,水温分别维持在4、10、15、20(对照)、25、30和35 ℃, 塑料箱分别置于相应温度的恒温恒湿箱(BPS-100CA, 上海一恒科学仪器有限公司)中,维持水温恒定(±0.5 ℃)。温度胁迫6 h后,将全部塑料箱取出,使水温缓慢回复至对照组温度(20 ℃)。
1.3 样品处理与指标测定实验在开始温度胁迫6、24 h后取样,每组随机取9只,并取缢蛏消化腺和鳃组织,用天平(AUW320, 上海亚津电子科技有限公司)称量质量后,置于装有质量分数为0.86%生理盐水的匀浆管中,缢蛏组织和生理盐水质量比为1∶9, 在冰浴条件下用匀浆机(FSH-2A, 江苏金怡仪器科技有限公司)匀浆,转速为7 000~8 000 r/min, 10 s/次,间隙30 s, 连续3~5次。将制备好的10%匀浆液用低温离心机(H-2050R, 湖南湘仪离心机仪器有限公司)在转速7 000r/min时离心20 min, 取上清液用于测定SOD、CAT和POD的活性,总蛋白、GSH、MDA、H2O2的含量和总抗氧化能力(total antioxidant capacity, T-AOC), 测定原理、实验步骤和计算方法均参照南京建成生物工程研究所试剂盒说明书。
1.4 数据处理采用SPSS 19.0软件对实验结果进行单因素方差分析(One-Way ANOVA)及Duncan氏多重比较,显著性水平设为0.05。
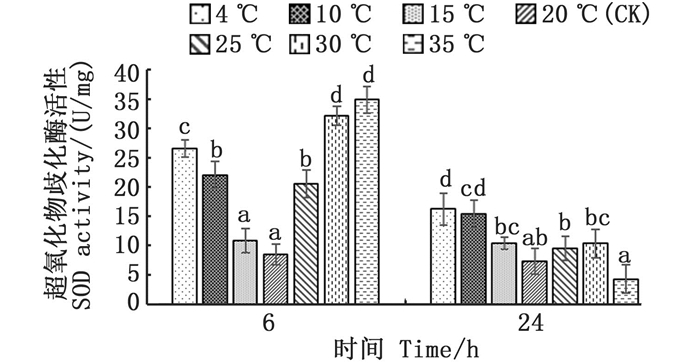
2 结果 2.1 急性温度胁迫下缢蛏的氧化应激响应 2.1.1 急性温度胁迫引起缢蛏超氧化物歧化酶活性的变化各温度胁迫组与对照组(20 ℃)温差越大,其SOD活性越高,其中:4、10 ℃, 6 h的低温胁迫组SOD活性显著升高(P < 0.05), 较对照组分别增长了213%、160%;25、30、35 ℃, 6 h的高温胁迫组SOD活性同样显著升高(P < 0.05), 较对照组分别增长了142%、279%、312%;在24 h回复至对照组温度后,各组SOD活性随之回落,高温各组均恢复至对照组水平(P > 0.05), 但4、10 ℃低温组仍显著高于20 ℃对照组(P < 0.05)。见图 1。
|
图中不同小写字母表示不同温度处理组间的差异显著(P < 0.05)。 Different lowercase letters indicate significant differences among different temperature treatments (P < 0.05). 图 1 温度胁迫对超氧化物歧化酶活性的影响 Fig. 1 Effect of temperature stress on superoxide dismutase(SOD) activity |
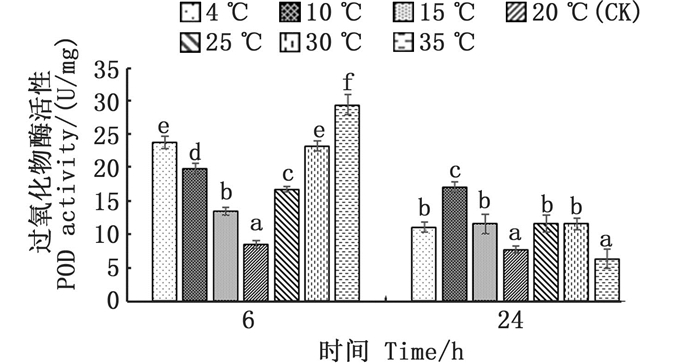
各温度胁迫组与对照组(20 ℃)温差越大,其POD活性越高,其中:4、10、15 ℃, 6 h的低温胁迫组POD活性显著升高(P < 0.05), 较对照组分别增长了180%、134%、59%;25、30、35 ℃, 6 h的高温胁迫组POD活性同样显著升高(P < 0.05), 较对照组分别增长了97%、174%、247%;在24 h回复至对照组温度后,各组POD活性随之回落,但除35 ℃高温组外,其他各组POD活性均显著高于对照组(P < 0.05)。见图 2。
|
图中不同小写字母表示不同温度处理组间的差异显著(P < 0.05)。 Different lowercase letters indicate significant differences among different temperature treatments (P < 0.05). 图 2 温度胁迫对过氧化物酶活性的影响 Fig. 2 Effect of temperature stress on peroxidase (POD) activity |
各温度胁迫组与对照组(20 ℃)温差越大,其CAT活性越高,其中:4、10、15 ℃, 6 h的低温胁迫组CAT活性显著升高(P < 0.05), 较对照组分别增长了348%、254%、79%;25、30、35 ℃, 6 h的高温胁迫组CAT活性显著升高(P < 0.05), 较对照组分别增长了186%、221%、293%;在24 h回复至对照组温度后,各组CAT活性有不同程度回落,其中4、35 ℃组的CAT活性依然显著高于对照组(P < 0.05)。见图 3。

|
图中不同小写字母表示不同温度处理组间的差异显著(P < 0.05)。 Different lowercase letters indicate significant differences among different temperature treatments (P < 0.05). 图 3 温度胁迫对过氧化氢酶活性的影响 Fig. 3 Effect of temperature stress on catalase(CAT) activity |
各温度胁迫组与对照组(20 ℃)温差越大,其T-AOC越低,其中:4、10、15 ℃, 6 h的低温胁迫组T-AOC显著降低(P < 0.05), 较对照组分别下降了63%、57%、18%;25、30、35 ℃, 6 h的高温胁迫组T-AOC显著下降(P < 0.05), 较对照组分别下降了57%、52%、77%;在24 h回复至对照组温度后,除25 ℃组有显著回升外,其他各组T-AOC变化均不明显。见图 4。

|
图中不同小写字母表示不同温度处理组间的差异显著(P < 0.05)。 Different lowercase letters indicate significant differences among different temperature treatments (P < 0.05). 图 4 温度胁迫对总抗氧化能力的影响 Fig. 4 Effect of temperature stress on total antioxidant capacity(T-AOC) |
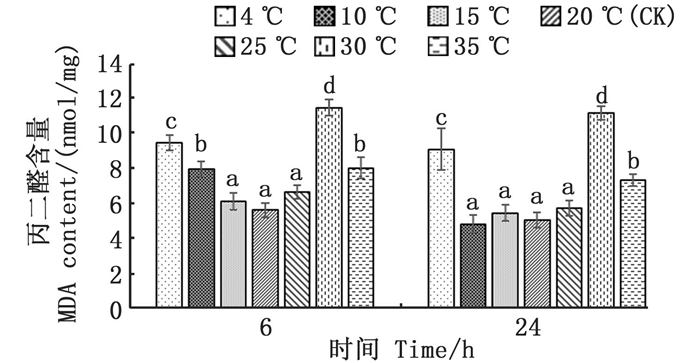
各温度胁迫组与对照组(20 ℃)温差越大,其MDA含量越高,其中:4、10 ℃, 6 h低温胁迫组的MDA含量显著升高(P < 0.05), 较对照组分别增长了68%、41%;30、35 ℃, 6 h高温胁迫组的MDA含量同样显著升高(P < 0.05), 较对照组分别增长了103%、43%;在24 h回复至对照组温度后,除10 ℃组的MDA含量有明显回落外,其他组MDA含量无明显变化。见图 5。
|
图中不同小写字母表示不同温度处理组间的差异显著(P < 0.05)。 Different lowercase letters indicate significant differences among different temperature treatments (P < 0.05). 图 5 温度胁迫对丙二醛含量的影响 Fig. 5 Effect of temperature stress on malondialdehyde(MDA) content |
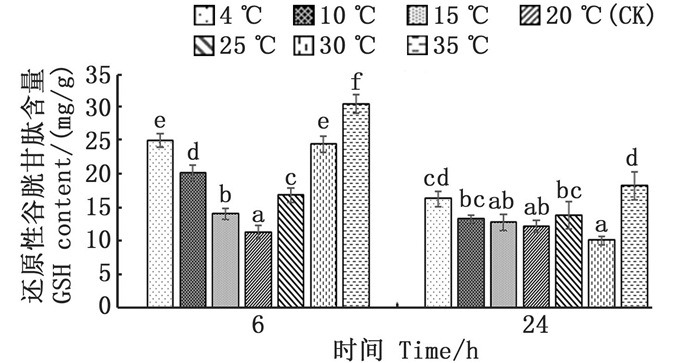
各温度胁迫组与对照组(20 ℃)温差越大,其GSH含量越高,其中4、10、15 ℃, 6 h低温胁迫组的GSH含量增长显著(P < 0.05), 较对照组分别增长了122%、79%、25%, 25、30、35 ℃, 6 h的高温胁迫组GSH含量显著升高(P < 0.05), 较对照组分别增长了49%、117%、170%;在24 h回复至对照组温度后,其GSH含量均有不同程度回落,但4、35 ℃组的GSH含量依然显著高于对照组(P < 0.05)。见图 6。
|
图中不同小写字母表示不同温度处理组间的差异显著(P < 0.05)。 Different lowercase letters indicate significant differences among different temperature treatments (P < 0.05). 图 6 温度胁迫对还原性谷胱甘肽含量的影响 Fig. 6 Effect of temperature stress on reduced glutathione (GSH) content |
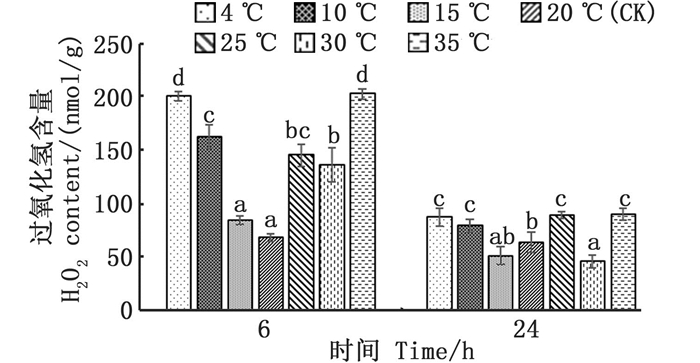
各温度胁迫组与对照组(20 ℃)温差越大,其H2O2含量越高,其中:4、10 ℃, 6 h的低温胁迫组H2O2含量显著升高(P < 0.05), 较对照组分别增长了187%、133%;25、30、35 ℃, 6 h的高温胁迫组H2O2含量同样显著升高(P < 0.05), 较对照组分别增长了109%、96%、190%;在24 h回复至对照组温度后,各组H2O2含量有不同程度回落,15 ℃组的H2O2含量已回复至对照组水平(P > 0.05)。见图 7。
|
图中不同小写字母表示不同温度处理组间的差异显著(P < 0.05)。 Different lowercase letters indicate significant differences among different temperature treatments (P < 0.05). 图 7 温度胁迫对过氧化氢含量的影响 Fig. 7 Effect of temperature stress on hydrogen peroxide(H2O2) content |
SOD是以超氧阴离子自由基(O2-)为底物的酶[12], 是最重要的特异性O2-清除剂。O2-和H+在SOD的催化作用下转化为H2O2和O2, 进而清除O2-, 终止氧自由基对机体氧化的连锁反应[13]。本实验发现:在不同高、低温胁迫下处理6 h后,各组SOD活性均高于或显著高于20 ℃对照组,且30、35 ℃高温组SOD活性均高于低温组,说明温度胁迫引起了缢蛏抗氧化系统的代谢失衡,机体内O2-等活性氧的大量生成促使SOD活性显著变化,且相比低温胁迫,SOD在高温胁迫下可能发挥了更大的作用;在24 h回复至对照组温度后,35 ℃组的SOD活性低于对照组,可能的原因是35 ℃的高温胁迫达到了缢蛏的致死温度,对缢蛏造成了严重的损伤,短期内难以恢复。李炼星等[14]以常温常盐下的群体繁育组幼蛏作空白对照,保持盐度不变,以0.25 ℃/h的速率升温后统计幼蛏死亡率,发现缢蛏半致死温度为36.5 ℃。
3.1.2 急性温度胁迫对缢蛏过氧化物酶活性的影响POD与CAT都能够催化以H2O2为氧化剂的氧化还原反应,使其变成H2O[15-16]。本实验发现:在不同的高、低温胁迫下处理6 h后,各组POD活性均显著高于20 ℃对照组(P < 0.05), 且相比低温胁迫,POD活性在高温胁迫下变化更为明显;在24 h回复至对照组温度后,除35 ℃组外的POD活性仍显著高于对照组(P < 0.05), 说明机体的抗氧化系统仍处于较强的应激状态,需要更长的时间恢复。
3.1.3 急性温度胁迫对缢蛏过氧化氢酶活性的影响CAT能够将SOD歧化反应产生的H2O2消除,分解为H2O和O2, 防止膜脂过氧化[17-19]。本实验发现:在不同高、低温胁迫下处理6 h后,各组CAT活性均显著高于20 ℃对照组(P < 0.05), 其中4 ℃低温组的CAT活性均显著高于25、30、35 ℃高温组(P < 0.05), 由于CAT的活性变化是机体在胁迫条件下免疫能力强弱的重要指标[19], 因此可以通过测定机体内CAT活性的变化来反映环境胁迫对生物的影响程度,由此也可推测,相比高温胁迫,CAT活性在低温胁迫下可能变化更为强烈;在24 h回复至对照组温度后,其中4 ℃组的CAT活性仍显著高于对照组(P < 0.05), 同样可以验证推测,低温胁迫对CAT的影响更大,需要更长的时间才能逐渐接近对照组水平。朱孟凯等[20]发现,凡纳滨对虾(Litopenaeus vannamei)在15 ℃低温胁迫组的CAT活性达到对照组的3.23倍(P < 0.05), 相比高温胁迫,低温胁迫诱导对虾CAT活性上升更为显著,推测这可能是对虾肝胰腺器官应对温度变化的一种保护性反应,随着胁迫时间延长,CAT活性降低,对虾体内H2O2积累增多,使机体细胞容易遭受H2O2毒害[21]。
3.1.4 急性温度胁迫对缢蛏总抗氧化能力的影响T-AOC是衡量机体抗氧化能力的综合指标,机体抗氧化系统有酶促与非酶促2个体系,酶促体系包括:SOD、CAT等,非酶促体系包括:维生素、氨基酸和金属蛋白质[22-23]。本实验发现:在不同高、低温胁迫下处理6 h后,各组T-AOC均显著低于20 ℃对照组(P < 0.05), 与温度胁迫程度呈负相关关系,说明在20 ℃时缢蛏具有最高的抗氧化能力,其他各组因受温度胁迫作用,氧化代谢体系受损,抗氧化能力下降明显;在24 h回复至对照组温度后,25 ℃温度胁迫组的T-AOC有较大的恢复,但其他组T-AOC基本保持不变,说明抗氧化系统仍然处于应激状态,需要更长的时间恢复。曹善茂等[12]发现,T-AOC在温度从15 ℃降至5 ℃时显著下降,表明温度胁迫对岩扇贝(Crassadoma gigantea)幼贝鳃组织中T-AOC有着明显的抑制作用。
3.2 急性温度胁迫对缢蛏生理代谢的影响 3.2.1 急性温度胁迫对缢蛏丙二醛含量的影响急性温度胁迫影响机体内活性氧(ROS)的变化,氧自由基(O2-)等活性氧能攻击生物膜中多不饱和脂肪酸(PUFA), 影响机体脂质过氧化作用,造成脂质过氧化产物含量发生变化[24]; MDA是细胞膜脂过氧化作用的产物之一,因此,可通过MDA含量多少来间接判断机体受到活性氧损伤的程度[25]。本实验发现:在不同高、低温胁迫下处理6 h后,各组MDA含量均高于或显著高于20 ℃对照组,因此判断无论高温或低温,在胁迫下都发生了细胞膜脂质过氧化;在24 h回复至对照组温度后,各个温度胁迫组的MDA含量并没有恢复,基本维持原来的水平,说明抗氧化调节系统并没有恢复,前期的胁迫导致细胞膜损伤,暂时无法修复,且恢复时间可能与应激程度有关。刘玲等[26]发现,在温度突变组,血清中MDA含量在32 ℃时先上升再下降,且变化幅度显著大于其他各组,其他各组均为逐渐降低的状态,肝脏中的MDA含量均呈先升高再降低趋势,说明温度突变对鼠龙斑(Cromileptes altivelis Valencienne ♀×Epinephelus lanceolatus ♂)幼鱼抗氧化性影响明显,胁迫时间延长可能对鱼体肝脏抗氧化体系有损害作用,在实际生产过程中,应该减少急性温度胁迫对鱼体造成的应激反应。
3.2.2 急性温度胁迫对缢蛏还原性谷胱甘肽含量的影响GSH是一种低分子清除剂,可以清除O2-、H2O2、LOOH及重金属等[27], GSH是反映机体受环境因素影响的重要指标[28]。本研究发现:在不同高、低温胁迫下处理6 h后,各组GSH含量均显著高于20 ℃对照组(P < 0.05), 且高温胁迫对于促进GSH生成更显著,TU等[29]研究发现,温度胁迫会导致斑节对虾(Penaeus monodon)的GSH含量增加以保护生物体免受氧化损伤,与本实验研究结果相似;在24 h回复至对照组温度后,各个温度胁迫组的GSH含量均有恢复,其中35 ℃组的GSH含量仍显著高于对照组(P < 0.05), 同样可以验证推测,高温胁迫对机体影响更大,更多的GSH产生以保护机体维持氧化系统的平衡。
3.2.3 急性温度胁迫对缢蛏过氧化氢含量的影响抗氧化酶SOD、CAT、POD和底物GSH之间具有协同作用[30]。需氧生物在氧化还原循环中往往产生大量超氧自由基(O2-)、羟自由基(OH-)、过氧化氢(H2O2)等活性氧。首先SOD可将O2-和H+催化生成O2和H2O2, 其活性同样受到O2-的调控,SOD催化产生的H2O2在POD、CAT的催化作用下生成H2O和O2, GSH同时与H2O2生成氧化性谷胱甘肽(glutathiol, GSSG)和H2O。生物体在长期的进化过程中,在SOD、CAT和POD等多种酶的作用下形成了1套完整的抗氧化系统来清除体内多余的活性氧[31]。本实验发现:在不同高、低温胁迫下处理6 h后,各组H2O2含量均高于或显著高于20 ℃对照组,与温度胁迫程度呈负相关,且与SOD、CAT等酶的变化趋势相同,说明在温度胁迫下,抗氧化系统积极促使各抗氧化酶活性提高以消除机体累积的活性氧,保证机体氧化代谢维持正常水平。
4 结论急性温度胁迫下缢蛏的氧化应激响应与生理代谢变化的研究表明:低温和高温胁迫均会引起缢蛏鳃和消化腺中抗氧化酶系统的失衡,导致活性氧含量的显著变化,且相比低温胁迫,高温胁迫的影响更为剧烈;SOD、CAT、POD和GSH在机体应对温度胁迫导致的氧化损伤中起到不同的作用,并共同维持机体抗氧化酶系统的平衡运转;当极端环境温度变化超过缢蛏的耐受极限,达到致死温度(36.5 ℃左右)时,机体的抗氧化系统严重失衡,并在各胁迫组温度回复后,35 ℃组的SOD活性、T-AOC均低于20 ℃对照组,POD活性恢复到对照组水平,但仍显著低于其他组,说明造成了不可修复的氧化损伤,影响其正常的生理活动。
| [1] |
徐凤山, 张素萍. 中国海产双壳类图志[M]. 北京: 科学出版社, 2008: 211-213. XU F S, ZHANG S P. An illustrated bivalvia mollusca fauna of China seas[M]. Beijing: Science Press, 2008: 211-213. |
| [2] |
吕昊泽. 缢蛏、光滑河蓝蛤和河蚬对盐度的适应性及碳、氮收支研究[D]. 上海: 上海海洋大学, 2014. LYU H Z. Study on the adaptability to salinity, the budgets of carbon and nitrogen of Sinonovacula constricta, Potamocorbula laevis, Corbicula fluminea[D]. Shanghai: Shanghai Ocean University, 2014. |
| [3] |
MARTÍNEZ-ÁLVAREZ R M, MORALES A E, SANZ A. Antioxidant defenses in fish: biotic and abiotic factors[J]. Reviews in Fish Biology and Fisheries, 2005, 15(1/2): 75-88. DOI:10.1007/s11160-005-7846-4 |
| [4] |
雷忻, 关鹏周, 贾向荣, 等. 辛基酚胁迫对雄性泥鳅抗氧化酶及卵黄蛋白原的影响[J]. 生态学报, 2015, 35(8): 2502-2508. LEI X, GUAN P Z, JIA X R, et al. Incidence of antioxidant enzymes and vitellogenin induced in male loach (Misgurnus anguillicaudatus) exposed to octylphenol[J]. Acta Ecologica Sinica, 2015, 35(8): 2502-2508. |
| [5] |
杨红生, 张涛, 王萍, 等. 温度对墨西哥湾扇贝耗氧率及排泄率的影响[J]. 海洋学报, 1998, 20(4): 91-96. YANG H S, ZHANG T, WANG P, et al. Effects of temperature on oxygen consumption and ammonia-N excretion of the Southern Bay-scallop Argopecten irradians concentricus[J]. Acta Oceanologica Sinica, 1998, 20(4): 91-96. |
| [6] |
叶博, 程之扬, 彭茂潇, 等. 急性pH和碳酸盐碱度对缢蛏存活率、Na+/K+-ATPase活性及血淋巴吞噬能力的影响[J]. 水产学报, 2019, 43(8): 1723-1732. YE B, CHENG Z Y, PENG M X, et al. Effects of pH and carbonate alkalinity on survival rate, Na+/K+-ATPase activity and phagocytic ability of the razor clam (Sinonovacula constricta) [J]. Journal of Fisheries of China, 2019, 43(8): 1723-1732. |
| [7] |
林君卓, 许振祖. 温度和盐度对文蛤幼体生长发育的影响[J]. 福建水产, 1997(1): 27-33. LIN J Z, XU Z Z. The effects of temperature and salinity on the development of Meretrix meretrix larvae[J]. Journal of Fujian Fisheries, 1997(1): 27-33. |
| [8] |
刘贤德, 闫玉华, 王志勇, 等. 杂色鲍对高温和低盐耐受力的初步研究[J]. 集美大学学报(自然科学版), 2008, 13(4): 301-303. LIU X D, YAN Y H, WANG Z Y, et al. A preliminary study on tolerance to high temperature and low salinity of Haliotis diversicolor Reeve[J]. Journal of Jimei University (Natural Science), 2008, 13(4): 301-303. DOI:10.3969/j.issn.1007-7405.2008.04.003 |
| [9] |
姜娓娓, 方建光, 李加琦, 等. 温度胁迫对皱纹盘鲍生理和生化活动的影响[J]. 中国水产科学, 2017, 24(2): 220-230. JIANG W W, FANG J G, LI J Q, et al. Effects of temperature change on physiological and biochemical activities of Haliotis discus hannai Ino[J]. Journal of Fishery Sciences of China, 2017, 24(2): 220-230. |
| [10] |
李艳红. 温度和铜离子对近江牡蛎抗氧化物酶活力及相关基因表达的影响[D]. 湛江: 广东海洋大学, 2013. LI Y H. Combined effects of temperature and copper ion on activity of antioxidant enzymes and expression of asssociated genes in Crassostrea ariakensis[D]. Zhanjiang: Guangdong Ocean University, 2013. |
| [11] |
WANG J, DONG B, YU Z X, et al. The impact of acute thermal stress on green mussel Perna viridis: oxidative damage and responses[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2018, 222: 7-15. |
| [12] |
曹善茂, 王潇, 刘钢, 等. 温度胁迫对岩扇贝幼贝抗氧化酶活力的影响[J]. 大连海洋大学学报, 2018, 33(2): 223-227. CAO S M, WANG X, LIU G, et al. Effects of water temperature on antioxidant enzyme activity of juvenile rock scallop Crassadoma gigantea[J]. Journal of Dalian Ocean University, 2018, 33(2): 223-227. |
| [13] |
李亚男, 张海滨. 海洋无脊椎动物抗氧化酶研究进展[J]. 海洋通报, 2018, 37(3): 241-253. LI Y N, ZHANG H B. Progress in antioxidant enzymes study of marine invertebrates[J]. Marine Science Bulletin, 2018, 37(3): 241-253. |
| [14] |
李炼星, 杜文俊, 王成东, 等. 缢蛏家系生长和耐热、耐高盐性能的对比研究[J]. 上海海洋大学学报, 2016, 25(4): 515-521. LI L X, DU W J, WANG C D, et al. Comparative analysis of growth and heat tolerance, salt tolerance traits among Sinonovacula constricta families[J]. Journal of Shanghai Ocean University, 2016, 25(4): 515-521. |
| [15] |
李维信, 廖晓岗, 唐宜, 等. 镉对大鼠睾丸的损伤及锌保护作用的超微结构研究[J]. 解剖学报, 1988, 19(1): 74-78. LI W X, LIAO X G, TANG Y, et al. Ultrastructural studies of the injurious action of cadmium and protective action of zinc on rat testis[J]. Acta Anatomica Sinica, 1988, 19(1): 74-78. |
| [16] |
周顺伍. 动物生物化学[M]. 3版. 北京: 中国农业出版社, 1999. ZHOU S W. Animal biochemistry[M]. 3rd ed. Beijing: China Agricultural Press, 1999. |
| [17] |
孙金辉, 徐赟霞, 季延滨, 等. 温度骤降对南美白对虾仔虾抗氧化机能的影响[J]. 天津农学院学报, 2008, 15(3): 7-10, 28. SUN J H, XU Y X, JI Y B, et al. Effects of sudden drop in temperature on activities of antioxidant enzymes of Litnpenaeus vannamei[J]. Journal of Tianjin Agricultural University, 2008, 15(3): 7-10, 28. |
| [18] |
刘冰, 梁婵娟. 生物过氧化氢酶研究进展[J]. 中国农学通报, 2005, 21(5): 223-224, 232. LIU B, LIANG C J. Recent advances of catalase in organism[J]. Chinese Agricultural Science Bulletin, 2005, 21(5): 223-224, 232. |
| [19] |
陈昌生, 王淑红, 纪德华, 等. 氨氮对九孔鲍过氧化氢酶和超氧化物歧化酶活力的影响[J]. 上海水产大学学报, 2001, 10(3): 218-222. CHEN C S, WANG S H, JI D H, et al. Effects of ammonia-N on activities of CAT and SOD in Haliotis diversicolor supertexta[J]. Journal of Shanghai Fisheries University, 2001, 10(3): 218-222. |
| [20] |
朱孟凯, 姚翠鸾. 温度胁迫对凡纳滨对虾肝胰腺氧代谢及能量代谢的影响[J]. 水产学报, 2015, 39(5): 669-678. ZHU M K, YAO C L. The impact of temperature stress on the oxygen metabolism and energy metabolism in the hepatopancreas of shrimp Litopenaeus vannamei[J]. Journal of Fisheries of China, 2015, 39(5): 669-678. |
| [21] |
ZHOU J, WANG L, XIN Y, et al. Effect of temperature on antioxidant enzyme gene expression and stress protein response in white shrimp, Litopenaeus vannamei[J]. Journal of Thermal Biology, 2010, 35(6): 284-289. |
| [22] |
林丽花, 谢丽曲, 王长康, 等. 发酵豆粕对1-4周龄黄羽肉鸡生长性能、消化酶活性、抗氧化能力和免疫器官指数的影响[J]. 福建农林大学学报(自然科学版), 2013, 42(4): 403-409. LIN L H, XIE L Q, WANG C K, et al. Effects of fermented soybean meal on growth performance, digestive enzyme, antioxidant ability and immune organ index of 1-4 weeks old yellow broilers[J]. Journal of Fujian Agriculture and Forestry University(Natural Science Edition), 2013, 42(4): 403-409. |
| [23] |
李智, 彭茂潇, 叶博, 等. 急性低盐度对缢蛏存活率、Na+/K+-ATPase活性以及血淋巴细胞吞噬能力的影响[J]. 上海海洋大学学报, 2020, 29(4): 489-495. LI Z, PENG M X, YE B, et al. Effects of acute low salinity on Sinonovacula constricta survival rate, Na+/K+-ATPase activity and phagocytosis of hemocytes[J]. Journal of Shanghai Ocean University, 2020, 29(4): 489-495. |
| [24] |
刘浩明, 董迎辉, 霍礼辉, 等. Cu2+对缢蛏稚贝的急性毒性及对抗氧化酶活力和丙二醛含量的影响[J]. 中国水产科学, 2012, 19(1): 182-187. LIU H M, DONG Y H, HUO L H, et al. Acute toxicity of Cu2+ and its effects on antioxidant enzymes in Sinonovacula constricta juveniles[J]. Journal of Fishery Sciences of China, 2012, 19(1): 182-187. |
| [25] |
王晓晨, 敖娜, 都健, 等. GLP-1对非酒精性脂肪性肝病大鼠氧化应激损伤的干预[C]//中华医学会第十三次全国内分泌学学术会议. 重庆, 2014. WANG X C, AO N, DU J, et al. Influence of GLP-1 on oxidative stress injury in non-alcoholic fatty liver disease rats[C]//Proceedings of the 13rd Annual Meeting of Chinese Society of Endocrinology. Chongqing, 2014. |
| [26] |
刘玲, 陈超, 李炎璐, 等. 短期温度胁迫对驼背鲈(♀)×鞍带石斑鱼(♂)杂交子代幼鱼抗氧化及消化酶活性的影响[J]. 渔业科学进展, 2018, 39(2): 59-66. LIU L, CHEN C, LI Y L, et al. Effects of short-term temperature stress on antioxidant and digestive enzymes of hybrid progeny (Cromileptes altivelis Valenciennes ♀ × Epinephelus lanceolatus ♂)[J]. Progress in Fishery Sciences, 2018, 39(2): 59-66. |
| [27] |
鲁雅琴, 宋焱峰, 侯一平. 还原型谷胱甘肽对大鼠局灶性脑梗死后丙二醛、谷胱甘肽过氧化物酶、超氧化物歧化酶表达的影响[J]. 中国康复理论与实践, 2006, 12(11): 923-925. LU Y Q, SONG Y F, HOU Y P. Effect of reduced glutathione on expression of malondialdehyde, glutathione peroxidase and superoxide dismutase after focal cerebral infarction in rats[J]. Chinese Journal of Rehabilitation Theory and Practice, 2006, 12(11): 923-925. |
| [28] |
POMPELLA A, VISVIKIS A, PAOLICCHI A, et al. The changing faces of glutathione, a cellular protagonist[J]. Biochemical Pharmacology, 2003, 66(8): 1499-1503. |
| [29] |
TU H T, SILVESTRE F, BERNARD A, et al. Oxidative stress response of black tiger shrimp (Penaeus monodon) to enrofloxacin and to culture system[J]. Aquaculture, 2008, 285(1/4): 244-248. |
| [30] |
杨唐斌, 梅尚筠. 应激反应与抗氧化酶[J]. 航天医学与医学工程, 1994, 7(1): 75-78. YANG T B, MEI S J. Stress response and antioxidant enzymes[J]. Space Medicine & Medical Engineering, 1994, 7(1): 75-78. |
| [31] |
程元恺. 脂质过氧化与抗氧化酶[J]. 工业卫生与职业病, 1993, 19(4): 254-256. CHENG Y K. Lipid peroxidation and antioxidant enzymes[J]. Industrial Health and Occupational Diseases, 1993, 19(4): 254-256. |
2. Shanghai Professional Technology Service Platform on Cold Chain Equipment Performance and Energy Saving Evaluation, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquatic Product Processing & Preservation, Shanghai 201306, China;
4. National Experimental Teaching Demonstration Center for Food Science and Engineering, Shanghai 201306, China
 2021,
Vol. 30
2021,
Vol. 30


