2. 中国水产科学研究院黄海水产研究所, 山东 青岛 266071;
3. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266071
脂肪作为三大营养物质之一, 是鱼类生长、发育和繁殖所必需的营养物质。当饲料脂肪水平适宜时, 能显著提高鱼类的生长性能和饲料利用率[1-2]; 饲料脂肪利用效率的降低会影响鱼的新陈代谢, 增加饵料系数, 降低蛋白质效率[3-5]; 尤其是饲料中高水平的脂肪在不能被有效利用时, 会造成肝脏中脂肪累积[6], 诱发脂肪肝, 从而降低鱼类的生长性能、免疫能力和抗病能力[7], 甚至造成鱼类死亡。
目前, 添加剂对鱼类脂肪代谢的影响已成为一个研究热点, 而胆汁酸作为一种非营养性添加剂, 在水产饲料中的应用已显示出一定的潜力。众多国内外学者对外源性胆汁酸的作用已做过大量研究, 表明胆汁酸具有较强的表面活性, 能降低水油两相间的表面张力, 促进脂类与脂溶性物质的消化与吸收[8-9], 促进脂肪代谢, 有利于水产动物的生长[10-13]及维持胆固醇动态平衡[14], 还可以改善肠道微生物群系的多样性[15], 增加肠道管壁厚度、肠绒毛高度及密度[16], 维护肠道微生态环境[17], 保护肠道健康。红鳍东方鲀(Takifugu rubripes)肉质鲜嫩、口味鲜美, 在中国、日本和韩国是一种具有较高经济价值的海水养殖鱼类。红鳍东方鲀的肝脏是储存脂肪的重要场所, 脂肪含量很高。孙阳等[18]发现随着饲料脂肪水平的增加, 红鳍东方鲀的肝体比和脏体比都不断增加, 肝功能障碍逐渐加剧。肝功能受损势必会影响脂肪的代谢吸收, 最终影响河鲀的生长及存活。本实验旨在探讨外源胆汁酸添加对红鳍东方鲀脂肪酸组成和抗氧化能力的影响, 以期为胆汁酸的脂肪代谢调节作用补充基础数据。
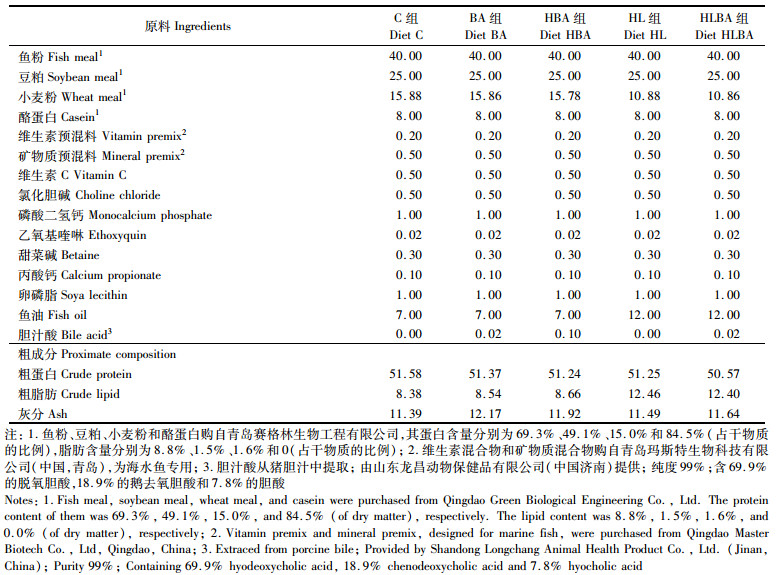
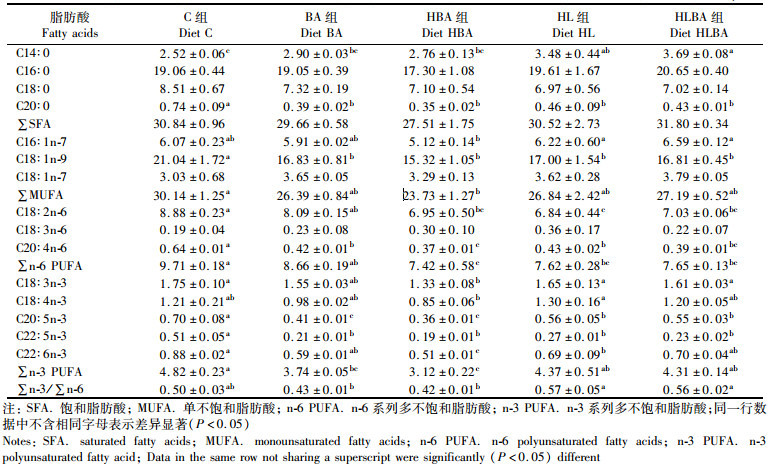
1 材料与方法 1.1 实验饲料配方与制作本实验以鱼粉、豆粕和小麦粉为主要蛋白源, 以鱼油作为主要的脂肪源, 根据河鲀适宜脂肪需求[19], 配制蛋白质量分数约为51%, 脂肪质量分数约为8%的基础饲料(C组)。通过在基础饲料中分别添加0.02%(BA组)及0.10%(HBA组)的胆汁酸(山东龙昌动物保健品有限公司, 山东济南, 纯度99%, 包含69.9%的脱氧胆酸、18.9%的鹅去氧胆酸和7.8%的胆酸)来配制含不同胆汁酸剂量的饲料处理组。另外, 通过在对照组基础上增加鱼油含量增设一高脂饲料组(脂肪质量分数为12.5%, HL组), 并通过在HL组添加0.02%的胆汁酸获得高脂+胆汁酸处理组(HLBA组)。饲料按照实验室标准程序制作、包装和储存[20]。实验饲料使用实验室小型单螺杆挤压机制成直径3 mm的颗粒饲料。饲料配方和饲料脂肪酸组成分别见表 1及表 2。通过对饲料脂肪酸组成的分析发现, 饲料中胆汁酸的添加对C16: 0、C20: 0及C16: 1n-7具有一定的降低效应, 而且, HBA组明显降低了一些n-3系列脂肪酸如C18: 4n-3、C20: 5n-3及C22: 6n-3的含量。
|
表 1 实验饲料组成及营养水平(%干物质) Tab.1 Formulation and proximate composition of the experimental diets (% dry matter basis) |

|
表 2 实验饲料的脂肪酸组成(%总脂肪酸) Tab.2 Fatty acid compositions of the experimental diets (% total fatty acids) |
本实验以初始体质量为14 g的红鳍东方鲀幼鱼(购自河北唐山海都水产有限公司)为实验对象, 在山东省海阳市黄海水产有限公司进行周期为56 d的养殖实验。开始实验前, 实验用鱼在玻璃缸(200 L)中暂养7 d, 然后用指甲钳剪掉牙齿尖头, 避免互相咬尾, 剪牙7 d后正式开始实验。实验开始时, 将实验鱼随机分到15个玻璃缸(200 L)中, 每组3个重复, 每缸25尾鱼。采用经砂滤的自然海水, 在室内进行流水养殖, 每天饱食投喂3次(时间分别为8:00, 14:00和20:00)。养殖实验在山东省海阳市的自然光周期和环境温度下进行。养殖过程中, 水温为20~27 ℃, 盐度为30~31, pH为7.4~8.2, 溶解氧为5~7 mg/L。每天及时清除残饵和粪便, 并定期对养殖用缸进行刷洗。
1.3 样品采集养殖实验结束后, 将实验鱼饥饿24 h, 用丁香酚(体积分数为1: 10 000)将鱼麻醉, 统计每缸鱼的数量并称量。每缸中随机取6尾鱼, 逐一称量。利用1 mL的一次性注射器从尾椎静脉取血, 注入1.5 mL离心管, 使血液在室温条件下凝结2 h, 4 ℃条件下凝结6 h, 之后进行离心(836 g, 4 ℃离心10 min), 吸取上清液获得血清样品。取完血后将鱼解剖, 收集肝脏和肌肉样品。所有样品立即置于液氮中保存, 然后再转移到-80 ℃冰箱中储存备用。本实验中, 实验鱼的平均终末质量为66.6 g, 平均饲料效率为0.93[21]。
1.4 样品分析 1.4.1 血清抗氧化指标测定血清丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)和谷胱甘肽还原酶(GR)活性均采用南京建成生物与工程研究所试剂盒测定。详细步骤参见试剂盒说明书。
1.4.2 脂肪酸分析饲料及鱼体组织脂肪酸的测定参考MOURENTE等[22]气相色谱法。将冻干后的样品分别用KOH-甲醇和HCL-甲醇酯化(72 ℃水浴), 然后用正己烷萃取甲酯化的脂肪酸, 上机测定。气相色谱采用安捷伦HP6890, 石英毛细管色谱柱(惠普007-CW), 并配备火焰电离检测器。柱温从150到200 ℃以每分钟15 ℃程序升温, 然后从200到250 ℃以每分钟2 ℃升温。进样口和检测器温度均为250 ℃。
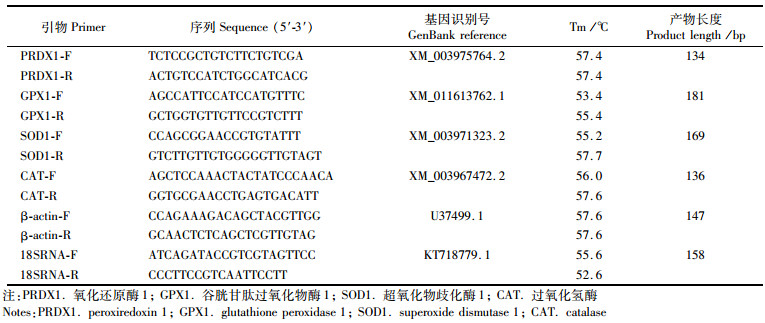
1.4.3 肝脏抗氧化相关基因表达使用RNAiso Plus (TaKaRa, 中国, 大连)提取肝脏中的总RNA, 然后使用PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒(TaKaRa)反转录成cDNA。根据GenBank中相关基因的序列号设计特异性定量PCR引物(表 3)。内参基因选取β-actin及18S RNA(二者Ct值取平均值作为内参)。利用4倍梯度稀释法确定所有引物的扩增效率为95%~105%。标准曲线的拟合度R2值大于0.99。使用SYBR® Premix Ex TaqTM (TaKaRa)及罗氏定量PCR仪(Roche LightCycler 96)进行荧光定量PCR实验。反应体系包括2 μL cDNA模板, 10 μL SYBR® Premix Ex TaqTM (2×), 0.8 μL上游引物(10 μmol/L), 0.8 μL下游引物(10 μmol/L)及6.4 μL纯水。PCR程序设定:95 ℃, 5 min; 40个循环:95 ℃, 5 s; 55 ℃, 20 s; 72 ℃, 10 s。绘制溶解曲线(从58 ℃到95 ℃每分钟升高1.85 ℃)以确定PCR产物的特异性。每样品3重复。mRNA的相对表达量采用2-ΔΔCT法计算。
|
表 3 引物序列 Tab.3 Sequences of the primers used in this study |
用SPSS 16.0软件对实验各处理组的数据进行单因素方差分析(ANOVA), 当不同处理组之间存在显著差异(P<0.05)时, 采用Tukey法进行均值间多重比较, 所有数值用平均值±标准误表示。
2 结果 2.1 组织脂肪酸组成 2.1.1 肝脏脂肪酸组成由表 4可知:C16: 0、C18: 0及总饱和脂肪酸在各组之间无显著差异(P>0.05);C14:0含量在HLBA组显著高于C、BA和HBA组(P<0.05), HL组显著高于C组(P<0.05), 其他组间不存在显著差异(P>0.05), 总体来看, 高脂和胆汁酸添加都具有升高C14:0的趋势; C20:0在C组显著高于其他组(P<0.05), 其中HBA组最低, C18:1n-9在C组显著高于其他组(P<0.05);C16:1n-7在HL和HLBA组显著高于HBA组(P<0.05), 其他组间没有显著差异(P>0.05);C18:2n-6在C组显著高于HL、HBA及HLBA组, BA组显著高于HL组(P<0.05);C20:4n-6在C组显著高于其他组(P<0.05), 其中HBA组最低, 显著低于BA组和C组。
|
表 4 肝脏脂肪酸组成(%总脂肪酸, n=3) Tab.4 Fatty acid compositions in the liver of tiger puffer fed experimental diets (% total fatty acids, n=3) |
总体来看, 胆汁酸的添加降低了n-3多不饱和脂肪酸(n-3 PUFA)的含量:HBA组的C18: 3n-3含量显著低于C、HL、HLBA组(P<0.05);C18: 4n-3在HL组显著高于HBA组(P<0.05);C20:5n-3含量的显著(P<0.05)差异:C>HL和HLBA>BA和HBA; C22:5n-3在C组显著高于其他组(P<0.05);C22:6n-3在HBA组最低, 显著低于其他处理组(P<0.05)。
在适宜脂肪水平下分别添加0.02%和0.10%胆汁酸, 肝脏中的C20:0、C16:1n-7、C18:1n-9、C18:2n-6、C20:4n-6、C18:3n-3、C18:4n-3、C20:5n-3和C22:6n-3都具有随着胆汁酸添加量增加而降低的趋势。
2.1.2 肌肉脂肪酸组成由表 5可知:C14:0、C16:0、C18:0和总饱和脂肪酸含量在各组之间均不存在显著差异(P>0.05);C组的C16:1n-7和C18:1n-9含量显著高于HBA、HL和HLBA组(P<0.05), C16:1n-7、C18:1n-9和C18:1n-7含量均具有随着胆汁酸添加而降低的趋势; 与适宜脂肪组相比, 高脂组C18:2n-6含量和总n-6脂肪酸含量降低, 而n-3/n-6比例升高; C20:4n-6在BA组显著低于C组。C20:5n-3和C22:6n-3及总n-3脂肪酸含量在各组之间均不存在显著差异(P>0.05)。

|
表 5 肌肉脂肪酸组成(%总脂肪酸, n=3) Tab.5 Fatty acid compositions in the muscle of tiger puffer fed experimental diets (% total fatty acids, n=3) |
由表 6可知:丙二醛在各组之间不存在显著差异(P>0.05);谷胱甘肽过氧化物酶活性有被胆汁酸和高脂升高的趋势, 且在HL组显著高于对照组(P<0.05);超氧化物歧化酶活性在高脂组显著高于对照组(P<0.05), BA和HBA组比对照组略有提高, 但差异不显著; 谷胱甘肽还原酶活性在对照组(C)和BA组显著高于HBA、HL和HLBA组(P<0.05)。

|
表 6 不同饲料处理组血清中抗氧化相关指标 Tab.6 Anti-oxidation related parameters in serum of tiger puffer fed experimental diets |
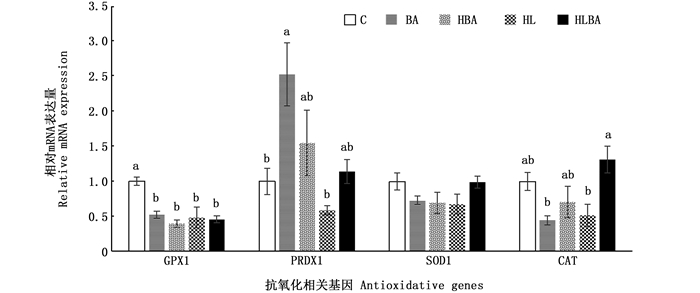
如图 1所示:肝脏中谷胱甘肽过氧化物酶1(GPX1)的mRNA表达量在对照组显著高于其他组(P<0.05);肝脏中氧化还原酶1(PRDX1)的mRNA表达量在BA组最高, 显著高于对照组和高脂组(P<0.05);过氧化氢酶的基因表达量在HLBA组最高, 显著高于BA组和HL组(P<0.05);肝脏超氧化物歧化酶1(SOD1)的mRNA表达量在各处理组间没有显著性差异(P>0.05)。
|
同一基因不同的数据柱间具有不同上标字母表示显著性差异(P<0.05);GPX1.谷胱甘肽过氧化物酶1; PRDX1.氧化还原酶1; SOD1.超氧化物歧化酶1; CAT.过氧化氢酶 For each gene, values in bars that do not have the same letter are significantly different (P < 0.05). GPX. glutathione peroxidase; PRDX1. peroxiredoxin 1; SOD. superoxide dismutase; CAT. catalase 图 1 饲料处理对肝脏中抗氧化相关基因表达的影响(n=3) Fig. 1 Effects of dietary bile acid supplementation on the relative mRNA expression of antioxidative proteins in the liver of experimental fish (n=3) |
本研究表明胆汁酸的添加在饲料阶段就影响了脂肪酸的组成, 尤其是添加高比例的胆汁酸降低了一些饱和脂肪酸(如C16:0)、单不饱和脂肪酸(如C16:1n-7和C18:1n-7)及n-3系列脂肪酸(如C18:4n-3、C20:5n-3及C22:6n-3)的含量。因为胆汁酸并不与脂肪酸发生直接的化学反应导致脂肪酸含量降低, 因此, 推测胆汁酸对饲料相关脂肪酸的降低是因为胆汁酸的乳化作用影响了这些脂肪酸测定时前处理过程中脂肪酸的萃取, 导致一部分长链脂肪酸因为胆汁酸的乳化作用而没有被充分萃取出来。因为胆汁酸在构型上有亲水性和疏水性两个侧面, 这种构型使胆汁酸盐具有乳化的功能[23]。而乳化后, 一部分脂肪酸(尤其是亲水性差的长链脂肪酸)的亲水性增加,阻碍了其被脂溶性溶剂的萃取,推测饲料脂肪酸的测定中,链长短于14C的中短链脂肪酸含量增加,但因为本实验采用的测定方法中没有低于14C的脂肪酸标准品,因此该部分脂肪酸没有在数据表格中体现出来(但计算时作为总脂肪酸的一部分算进分母中)。
在鱼体组织的总体脂肪酸组成上,鱼类肝脏和肌肉中的脂肪酸组成与饲料密切相关[24-25]。与肝脏相比, 肌肉中SFA含量与其相当, 但MUFA含量却低得多。但在有关大菱鲆(Scophthalmus maximus)[20]、罗非鱼(Oreochromis niloticus)[26]、石斑鱼(Epinephelus malabaricus)[27]及大西洋大比目鱼(Hippoglossus hippoglossus)[28]等研究中发现,这些鱼的肌肉脂肪酸中通常含有大量的MUFA,说明在选择利用脂肪酸供能方面,红鳍东方鲀与其他鱼类可能存在差异。
胆汁酸对组织脂肪酸含量的影响与其对饲料脂肪酸含量的影响趋势大体是一致的。胆汁酸的乳化作用同样可以用来解释胆汁酸对肝脏和肌肉中相关脂肪酸(尤其是长链脂肪酸)含量降低的原因。当然, 鱼体中相关饱和脂肪酸和单不饱和脂肪酸含量的降低也可能与胆汁酸促进脂肪酸氧化供能的作用有关[29]。胆汁酸作为一种非营养性饲料添加剂, 在脂肪消化和脂肪吸收方面都具有不可替代的作用, 只有当胆固醇酯、甘油三酯、磷脂等在胆汁酸盐的乳化作用下形成混合微团才能被消化吸收[23]。另外有研究[30]表明, 乳化剂对短链不饱和脂肪酸为主的脂肪类型乳化效果不大, 但是对长链及饱和脂肪酸为主的脂肪类型乳化效果十分明显, 这或许可以部分解释本实验中添加高剂量的胆汁酸对C20:5n-3和C22:6n-3等长链多不饱和脂肪酸的影响更为明显的原因。
另外,与适宜脂肪组相比, 高脂组n-6脂肪酸含量降低, 这主要与鱼油中n-6脂肪酸含量低有关。与肌肉相比, 胆汁酸的添加对红鳍东方鲀肝脏脂肪酸影响较大。这主要是因为对红鳍东方鲀来说, 肝脏是其储存脂肪的主要部位。
3.2 饲料中添加胆汁酸对抗氧化能力的影响鱼类自身具有一套抗氧化系统, 可以除去自身氧化产物, 维护机体动态平衡[31], 其中就包括超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)、谷胱甘肽还原酶(GR)等[22]。SOD能够清除有危害性的活性氧, 通过催化歧化作用将过氧化物自由基转变成过氧化氢和氧[32]。谷胱甘肽有还原型(GSH)和氧化型(GSSG)两种形式, 谷胱甘肽还原酶(GR)可以将GSSG催化反应成GSH, 从而为细胞内活性氧(ROS)的清除提供还原力, GSH在谷胱甘肽过氧化物酶(GPX)和谷胱甘肽硫转移酶的作用下, 自身又被氧化为GSSG, 如此循环以缓解环境对生物体的氧化损伤[33]。
在本实验条件下, 在C组的基础上添加0.02%和0.10%的胆汁酸, 尽管差异不显著, 但血清中SOD和GPX的活性均高于对照组。这说明适量的胆汁酸水平可以在一定程度上提高红鳍东方鲀的抗氧化能力, 类似的结果在牛蛙(Rana catesbeiana)[33]的研究中也得到了证实。但是过高的胆汁酸添加可能具有一定的细胞毒性, 损伤肝脏机能, 抑制SOD基因的表达, 影响抗氧化能力[34]。本研究中未见SOD和GPX活性的显著下降, 表明即使0.10%的胆汁酸添加量可能也未过量。胆汁酸的抗氧化作用在其他的水产养殖动物如牙鲆(Paralichthys olivaceus)[35]、大口黑鲈(Micropterus salmoides)[36]和罗氏沼虾(Macrobrachium rosenbergii)[37]中也得到了证实。胡田恩等[33]研究发现饲料中添加适量胆汁酸可以增强牛蛙肝脏氨基酸代谢能力和不依赖于酯酶的脂肪调节能力, 最终的结果也会降低机体的抗氧化压力。
与SOD和GPX相反, 在对照组中添加0.10%的胆汁酸降低了谷胱甘肽还原酶的活性。在动物机体内, 谷胱甘肽还原酶主要维持GSH和GSSG之间的动态平衡[38], 造成GR活性降低的原因可能主要是氧化压力降低。在大菱鲆[39]的研究中也有类似的发现。
另外, 需要注意的是, 与对照组相比, 饲料高脂同样引起了血清SOD和GPX活性的升高, 甚至引起了血清丙二醛含量的升高(虽然不是显著性升高)。丙二醛(MDA)是脂肪过氧化的重要产物之一, MDA含量增加是脂质过氧化反应增强的重要表现, 也是衡量肝脏健康情况的重要指标。往往肝脏受损越严重, 组织和血液中的丙二醛含量就越高[40-41]。丙二醛的升高表明高脂引起的SOD和GPX活性升高可能主要与氧化压力升高有关。高脂同样引起了GR的降低, 可能是因为该水平(12.5%)下的高脂已经对机体的氧化还原系统造成了严重损伤。而且, 在高脂水平下, 胆汁酸的添加并未明显改善机体的抗氧化能力, 这更加证明了高脂对机体氧化还原系统的破坏。在欧洲鳗鲡(Anguilla anguilla)[42]、大口黑鲈(Micropterus salmoides)[36]和牛蛙[33]的相关胆汁酸研究中发现,过量的胆汁酸也会引起MDA的升高,这与本研究中的相关结果有所不同。
在抗氧化相关基因表达方面, 胆汁酸对抗氧化相关基因表达的影响与其对血清抗氧化蛋白活性的影响并不一致, 适量(0.02%)胆汁酸添加提高了氧化还原酶(PRDX1)的mRNA表达, 这表明了其在基因表达水平上对抗氧化能力的提高。然而, 对照组的GPX1的基因表达量显著高于其他组。这可能主要是因为GPX活性的升高对基因表达的抑制作用。值得一提的是, 在高脂组, 胆汁酸的添加显著升高了过氧化氢酶(CAT)的基因表达量, 这与在大菱鲆[43]的研究结果一致, 该研究发现在高脂饲料应用时添加胆汁酸对抗氧化能力具有提高作用。
综上所述, 饲料中胆汁酸的添加(尤其是高水平添加)降低了饲料及鱼体组织中多种长链脂肪酸的含量, 这可能与脂肪酸测定过程中胆汁酸的乳化作用对脂肪萃取的影响有关。胆汁酸的乳化作用可能降低了亲水性差的长链脂肪酸从水相溶液中向正己烷的萃取速率。胆汁酸对抗氧化酶活性的影响与其对抗氧化相关基因表达的影响存在差异。胆汁酸对鱼类抗氧化能力的影响机理值得进一步研究。
| [1] |
王朝明, 罗莉, 张桂众, 等. 饲料脂肪水平对胭脂鱼生长性能、肠道消化酶活性和脂肪代谢的影响[J]. 动物营养学报, 2010, 22(4): 969-976. WANG C M, LUO L, ZHANG G Z, et al. Effects of dietary lipid levels on growth performance, intestinal digestive enzyme activities and lipid metabolism of Chinese sucker (Myxocyprinus asiaticus)[J]. Chinese Journal of Animal Nutrition, 2010, 22(4): 969-976. |
| [2] |
ELLIS S C, REIGH R C. Effects of dietary lipid and carbohydrate levels on growth and body composition of juvenile red drum, Sciaenops ocellatus[J]. Aquaculture, 1991, 97(4): 383-394. DOI:10.1016/0044-8486(91)90330-A |
| [3] |
韩光明, 张家宏, 寇祥明, 等. 饲料中蛋白质和脂肪水平对胭脂鱼生长性能及体组成的影响[J]. 动物营养学报, 2015, 27(11): 3587-3596. HAN G M, ZHANG J H, KOU X M, et al. Effects of Dietary Protein and lipid levels on growth performance and body composition of Chinese sucker (Myxocyprinus asiaticus)[J]. Chinese Journal of Animal Nutrition, 2015, 27(11): 3587-3596. |
| [4] |
宋理平, 冒树泉, 马国红, 等. 饲料脂肪水平对许氏平鲉脂肪沉积、血液生化指标及脂肪代谢酶活性的影响[J]. 水产学报, 2014, 38(11): 1879-1888. SONG L P, MAO S Q, MA G H, et al. Effects of dietary lipid level on lipid deposition, blood biochemistry indices and lipid metabolic enzyme activities of Sebastes schlegeli[J]. Journal of Fisheries of China, 2014, 38(11): 1879-1888. |
| [5] |
CHOU R L, SU M S, CHEN H Y. Optimal dietary protein and lipid levels for juvenile Cobia (Rachycentron canadum)[J]. Aquaculture, 2001, 193(1/2): 81-89. |
| [6] |
WATANABE T. Lipid nutrition in fish[J]. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry, 1982, 73(1): 3-15. DOI:10.1016/0305-0491(82)90196-1 |
| [7] |
胡海滨, 钱雪桥, 解绶启, 等. 中成鱼阶段卵形鲳鲹对饲料蛋白质和脂肪的适宜需求量[J]. 上海海洋大学学报, 2019, 28(4): 566-576. HU H B, QIAN X Q, XIE S Q, et al. Dietary protein and lipid optimum requirements for on-growing golden pompano (Trachinotus ovatus)[J]. Journal of Shanghai Ocean University, 2019, 28(4): 566-576. |
| [8] |
SIRVENT A, CLAUDEL T, MARTIN G, et al. The farnesoid X receptor induces very low density lipoprotein receptor gene expression[J]. FEBS Letters, 2004, 566(1/3): 173-177. |
| [9] |
WATANABE M, HOUTEN S M, WANG L, et al. Bile acids lower triglyceride levels via a pathway involving FXR, SHP, and SREBP-1c[J]. Journal of Clinical Investigation, 2004, 113(10): 1408-1418. DOI:10.1172/JCI21025 |
| [10] |
JIANG M, WEN H, GOU G W, et al. Preliminary study to evaluate the effects of dietary bile acids on growth performance and lipid metabolism of juvenile genetically improved farmed tilapia (Oreochromis niloticus) fed plant ingredient-based diets[J]. Aquaculture Nutrition, 2018, 24(4): 1175-1173. DOI:10.1111/anu.12656 |
| [11] |
周书耘, 刘永坚, 梁海鸥, 等. 饲料中添加胆汁酸对军曹鱼生长及体组成的影响[J]. 南方水产, 2010, 6(4): 20-25. ZHOU S Y, LIU Y J, LIANG H O, et al. Effect of bile acids on growth and body composition of cobia (Rachycentron canadum)[J]. South China Fisheries Science, 2010, 6(4): 20-25. |
| [12] |
曾本和, 廖增艳, 向枭, 等. 胆汁酸对草鱼(Ctenopharyngodon idellus)的生长性能、肌肉营养成分及消化酶活性的影响[J]. 渔业科学进展, 2017, 38(2): 99-106. ZENG B H, LIAO Z Y, XIANG X, et al. Effects of bile acids on growth performance, muscle composition and digestive enzyme activities of Ctenopharyngodon idellus[J]. Progress in Fishery Sciences, 2017, 38(2): 99-106. |
| [13] |
谭永刚, 魏文志, 曾党胜. 饲料中添加胆汁酸对异育银鲫生长性能的影响[J]. 广东饲料, 2008, 17(1): 25-26. TAN Y G, WEI W Z, ZENG D S. Effects of bile acid supplemented in feed on growth performance of Carassius auratus gibelio[J]. Guangdong Feed, 2008, 17(1): 25-26. |
| [14] |
叶元土, 蔡春芳, 许凡, 等. 灌喂氧化鱼油使草鱼肠道黏膜胆固醇胆汁酸合成基因通路表达上调[J]. 水生生物学报, 2015, 39(1): 90-100. YE Y T, CAI C F, XU F, et al. Feeding grass carp (Ctenopharyngodon Idellus) with oxidized fish oil up-regulates the gene expression in the cholesterol and bile acid synthesis pathway in intestinal mucosa[J]. Acta Hydrobiologica Sinica, 2015, 39(1): 90-100. |
| [15] |
陈昊杰.胆汁酸对草鱼生长、脂质代谢及肠道微生物区系的影响[D].咸阳.西北农林科技大学, 2016: 1-41. CHEN H J. Influence of bile acids on the growth performance, lipid metabolism and the intestinal microbiota in Grass carp, Ctenopharyngodon idella[D]. Xianyang: Northwest A & F University, 2016: 1-41. |
| [16] |
曾本和, 向枭, 周兴华, 等. 高脂饲料中胆汁酸水平对齐口裂腹鱼肠道组织结构及脂肪代谢酶活性的影响[J]. 水产学报, 2016, 40(9): 1340-1348. ZENG B H, XIANG X, ZHOU X H, et al. Effect of bile acid level in high lipid diet on the intestinal structure and lipid metabolic enzymes activities of juvenile Schizothorax prenanti[J]. Journal of Fisheries of China, 2016, 40(9): 1340-1348. |
| [17] |
李灏, 姜颖, 贺福初. 胆汁酸功能及其与肠道细菌相互关系[J]. 中国生物化学与分子生物学报, 2007, 23(10): 817-822. LI H, JIANGN Y, HE F C. Bile acids function and their interaction with gut bacteria[J]. Chinese Journal of Biochemistry and Molecular Biology, 2007, 23(10): 817-822. |
| [18] |
孙阳, 姜志强, 李艳秋, 等. 饲料脂肪水平对红鳍东方鲀幼鱼生长、体组成及血液指标的影响[J]. 天津农学院学报, 2013, 20(3): 14-18. SUN Y, JIANG Z Q, LI Y Q, et al. Effects of dietary lipid levels on growth, body composition and blood parameters of juvenile Takifugu rubripes[J]. Journal of Tianjin Agricultural University, 2013, 20(3): 14-18. |
| [19] |
KIKUCHI K, FURUTA T, IWATA N, et al. Effect of dietary lipid levels on the growth, feed utilization, body composition and blood characteristics of tiger puffer Takifugu rubripes[J]. Aquaculture, 2009, 298(1/2): 111-117. |
| [20] |
XU H G, MU Y C, ZHANG Y, et al. Graded levels of fish protein hydrolysate in high plant diets for turbot (Scophthalmus maximus):effects on growth performance and lipid accumulation[J]. Aquaculture, 2016, 454: 140-147. DOI:10.1016/j.aquaculture.2015.12.006 |
| [21] |
LIAO Z B, SUN B, ZHANG Q G, et al. Dietary bile acids regulate the hepatic lipid homeostasis in tiger puffer fed normal or high-lipid diets[J]. Aquaculture, 2020, 519: 734935. DOI:10.1016/j.aquaculture.2020.734935 |
| [22] |
MOURENTE G, TOCHER D R, DIAZ E, et al. Relationships between antioxidants, antioxidant enzyme activities and lipid peroxidation products during early development in Dentex dentex eggs and larvae[J]. Aquaculture, 1999, 179(1/4): 309-324. |
| [23] |
杨汉博. 胆汁酸——脂肪消化促进剂[J]. 饲料广角, 2008(11): 49-50. YANG H B. Bile acid-fat digestion promote[J]. Feed China, 2008(11): 49-50. |
| [24] |
TOCHER D R, BELL J G, DICK J R, et al. Effects of dietary vegetable oil on Atlantic salmon hepatocyte fatty acid desaturation and liver fatty acid compositions[J]. Lipids, 2003, 38(7): 723-732. DOI:10.1007/s11745-003-1120-y |
| [25] |
韩光明, 王爱民, 徐跑, 等. 饲料脂肪水平对吉富罗非鱼体脂沉积及脂肪酸组成的影响[J]. 中国水产科学, 2011, 18(2): 338-349. HAN G M, WANG A M, XU P, et al. Effects of dietary lipid levels on fat deposition and fatty acid profiles of GIFT, Oreochromis niloticus[J]. Journal of Fishery Sciences of China, 2011, 18(2): 338-349. |
| [26] |
LIU W, WEN H, LUO Z. Effect of dietary protein levels and feeding rates on the growth and health status of juvenile genetically improved farmed tilapia (Oreochromis niloticus)[J]. Aquaculture International, 2018, 26: 153-167. DOI:10.1007/s10499-017-0202-6 |
| [27] |
WU F C, TING Y Y, CHEN H Y. Docosahexaenoic acid is superior to eicosapentaenoic acid as the essential fatty acid for growth of grouper, Epinephelus malabaricus[J]. The Journal of Nutrition, 2002, 132(1): 72-79. DOI:10.1093/jn/132.1.72 |
| [28] |
MARTINS D A, VALENTE L M P, LALL S P. Apparent digestibility of lipid and fatty acids in fish oil, poultry fat and vegetable oil diets by Atlantic halibut, Hippoglossus hippoglossus L.[J]. Aquaculture, 2009, 294(1/2): 132-137. |
| [29] |
陈昊杰, 田晶晶, 周继术, 等. 高脂日粮添加胆汁酸对草鱼组织脂肪酸组成的影响[J]. 西北农业学报, 2017, 26(1): 14-24. CHEN H J, TIAN J J, ZHOU J S, et al. High-lipid diet supplemented with bile acids affects the tissue fatty acid profile in grass carp, Ctenopharyngodon idella[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2017, 26(1): 14-24. |
| [30] |
卫玲娟.不同水平的乳化剂和米糠油对肉鸡生长性能、屠宰性能和营养物质利用率的影响[D].邯郸: 河北工程大学, 2018: 1-41. WEI L J. Different levels of emulsifiers and rice bran oil on growth performance, slaughter performance and apparent nutrient use efficiency in broilers[D]. Handan: Hebei University of Engineering, 2018: 1-41. |
| [31] |
乔洪金, 胡冬雪, 胡文靖, 等. 饲料中添加鼠尾藻粉对大菱鲆幼鱼生长、体成分、抗氧化和非特异免疫参数的影响[J]. 上海海洋大学学报, 2019, 28(1): 109-116. QIAO H J, HU D X, HU W J, et al. Effects of dietary Sargassum thunbergii powder on growth performance, body composition, antioxidation and non-specific immune parameters of juvenile turbot[J]. Journal of Shanghai Ocean University, 2019, 28(1): 109-116. |
| [32] |
何志刚, 刘文革, 伍远安, 等. 饲料脂肪水平对芙蓉鲤鲫形体指标、组织脂肪含量与脂肪酸组成的影响[J]. 饲料研究, 2016(6): 36-41. HE Z G, LIU W G, WU Y A, et al. Effect of dietary lipid levels on serum biochemical indices, immune responses and antioxidant capacity of juvenile Furong Crucian Carp (Furong Carp♀×Red Crucian Carp♂)[J]. Feed Research, 2016(6): 36-41. |
| [33] |
胡田恩, 王玲, 张春晓, 等. 饲料中胆汁酸添加水平对牛蛙肝脏化学组成、抗氧化和代谢酶活力的影响[J]. 淡水渔业, 2016, 46(1): 66-72. HU T E, WANG L, ZHANG C X, et al. Effects of dietary bile acids on chemical composition, antioxidant and metabolic enzymes activity of liver for Rana catesbeiana[J]. Freshwater Fisheries, 2016, 46(1): 66-72. |
| [34] |
刘海映, 张红, 陈雷, 等. 盐度胁迫下口虾蛄Mn-SOD基因的表达分析[J]. 大连海洋大学学报, 2014, 29(1): 17-21. LIU H Y, ZHANG H, CHEN L, et al. The expression of Mn-SOD gene in larval mantis shrimp Oratosquilla oratoria under salinity stress[J]. Journal of Dalian Ocean University, 2014, 29(1): 17-21. |
| [35] |
ALAM M S, TESHIMA S, ISHIKAWA M, et al. Methionine requirement of juvenile Japanese flounder Paralichthys olivaceus estimated by the oxidation of radioactive methionine[J]. Aquaculture Nutrition, 2001, 7(3): 201-209. DOI:10.1046/j.1365-2095.2001.00171.x |
| [36] |
张露露.胆汁酸在大口黑鲈饲料中有效性及耐受性评价[D].泰安: 山东农业大学, 2015: 1-36. ZHANG L L. Efficacy and tolerance assessment of bile acid in Micropterus salmoides[D]. Tai'an: Shandong Agricultural University, 2015: 1-36. |
| [37] |
马俊霞.胆汁酸对罗氏沼虾生长和脂肪代谢影响的研究[D].广州.华南农业大学, 2008: 1-40. MA J X. Effects of bile acid on growth and lipometabolism of Macrobrachium rosenbergii[D]. Guangzhou: South China Agricultural University, 2008: 1-40. |
| [38] |
李国明, 孙育萍, 王国霞, 等. 饲料中添加谷胱甘肽对花鲈幼鱼生长性能、血清生化指标和抗氧化能力的影响[J]. 动物营养学报, 2019, 31(7): 3207-3217. LI G M, SUN Y P, WANG G X, et al. Effects of dietary glutathione on growth performance, serum biochemical indices and antioxidant capacity of juvenile Lateolabrax japonicus[J]. Chinese Journal of Animal Nutrition, 2019, 31(7): 3207-3217. |
| [39] |
李晓美, 鲍枳月, 吴立新, 等. 还原型谷胱甘肽对大菱鲆生长及抗氧化能力的影响[J]. 水产科学, 2019, 38(3): 289-295. LI X M, BAO Z Y, WU L X, et al. Effects of dietary reduced glutathione on growth and antioxidation capacity of turbot Scophthalmus maximus[J]. Fisheries Science, 2019, 38(3): 289-295. |
| [40] |
MOURENTE G, TOCHER D R, DIAZ-SALVAGO E, et al. Study of the n-3 highly unsaturated fatty acids requirement and antioxidant status of Dentex dentex larvae at the Artemia feeding stage[J]. Aquaculture, 1999, 179(1/4): 291-307. |
| [41] |
王成强, 徐后国, 梁萌青, 等. 饲料亚麻酸含量对大规格鲈鱼生长性能、抗氧化指标和血清生化指标的影响[J]. 动物营养学报, 2016, 28(10): 3123-3133. WANG C Q, XU H G, LIANG M Q, et al. Effects of dietary α-linolenic acid content on growth performance, antioxidant indices and serum biochemical indices of large size Japanese seabass (Lateolabrax japonicus)[J]. Chinese Journal of Animal Nutrition, 2016, 28(10): 3123-3133. |
| [42] |
赵盼月.饲料中添加胆汁酸对欧洲鳗鲡幼鱼生长、血清生化指标、肠道菌群及肝脏代谢的影响[D].厦门: 集美大学, 2019: 1-40. ZHAO P Y. Effects of dietary bile acid supplementation on growth performance, serum biochemical parameters, intestinal flora and liver metabolism of juvenile European eel (Anguilla anguilla)[D]. Xiamen: Jimei University, 2019: 1-40. |
| [43] |
孙建珍.添加胆汁酸对大菱鲆(Scophthalmus maximus)幼鱼脂肪利用能力的影响[D].上海: 上海海洋大学, 2014: 1-48. SUN J Z. Effects of dietary bile acid on lipid utilization capacity of juvenile turbot (Scophthalmus maximus)[D]. Shanghai: Shanghai Ocean University, 2014: 1-48. |
2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, Shandong, China;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, Shandong, China
 2020,
Vol. 29
2020,
Vol. 29


