2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306
β-防御素是一类富含半胱氨酸的阳离子小分子抗菌肽,是大多数生物免疫系统中的重要蛋白质免疫因子,也是脊椎动物来源的3种防御素(α-、β-和θ-防御素)中数量最多的一种[1]。β-防御素由3股β折叠结构组成,其多肽链的N端为信号肽区域,位于C端的成熟肽区域含有6个高度保守的半胱氨酸残基,它们通常以Cys1-Cys5、Cys2-Cys4和Cys3-Cys6的配对方式在空间上形成3对二硫键以稳定其结构和赋予其生物学活性[2]。对于哺乳动物β-防御素的研究起始较早,由DIAMOND等[3]最早从牛气管黏膜上皮细胞中分离,随后又从牛粒性白细胞中纯化出13种同源肽[4],它们显示了抑制金黄色葡萄球菌(Staphylococcus aureus)和大肠杆菌(Escherichia coli)的活性。之后,有报道称人体内的β-防御素可通过多种方式参与其免疫机制,包括增强巨噬细胞吞噬作用和促进T细胞成熟等[5]。近几年的研究发现,人乳中分泌的β-防御素能够抵御引起婴儿腹泻的常见病原体[6],且乳羊的乳腺炎抗性性状也与β-防御素有关[7];最近又有学者报道人源β-防御素除了能够杀灭细菌还是一种肿瘤抑制因子[8]。较之哺乳动物,鱼类栖息于更易遭受病原微生物污染的水域环境,而β-防御素则是其抵御环境污染的关键性免疫因子之一。迄今已经从斑马鱼(Danio rerio)[9]、虹鳟(Oncorhynchus mykiss)[10]、褐牙鲆(Paralichthys olivaceus)[11]、点带石斑鱼(Epinephelus coioides)[12]和鲤(Cyprinus carpio L.)[13]等硬骨鱼类中分离到β-防御素基因;近来有报道称对斑点叉尾
虽然β-防御素在机体的免疫系统中发挥重要作用,但它在生物细胞中的表达量甚微,牛中性粒细胞中以2.2 mg/1010细胞存在[4],人体血浆中仅以纳摩尔的水平存在[15]。如果通过化学合成途径则不宜大量制备且成本高,而利用重组DNA技术构建β-防御素的生物合成体系,则可实现对其规模化的制备。鉴于此,有学者通过重组毕赤酵母(Pichia pastoris)实现了人源和猪源β-防御素的生物合成[16-17];近期又有对蓝狐(Vulopex lagopus)β-防御素进行重组DNA表达的报道[18]。此外,有学者相继以点带石斑鱼和斑马鱼的β-防御素基因为目标,初步实现了基于重组毕赤酵母的β-防御素的生物合成[19-20]。在过去的几年中,WANG等[21]从鳜鱼(Siniperca chuatsi)脾脏中克隆到β-防御素基因,试图通过构建原核表达载体在大肠杆菌M15中进行表达,但获得的重组蛋白并没有活性。大肠杆菌表达系统对多肽链的后期加工存在诸多限制,例如不利于翻译后折叠修饰、蛋白质易形成不溶性包涵体而丧失活性。相比之下,毕赤酵母作为真核表达宿主,除了有助于多肽链空间构象的形成以获得具有生物学活性的重组蛋白之外,其营养要求低、易于高密度培养、可实现目的蛋白的分泌表达以方便后续处理,因此,被认为是外源蛋白质生物合成的良好宿主[22]。本研究根据上述鳜鱼脾脏来源的β-防御素基因信息[21],构建了产鳜鱼β-防御素的重组毕赤酵母菌株。
1 材料与方法 1.1 材料毕赤酵母X-33、表达载体pPICZαA和博来霉素购自Invitrogen公司(美国);RNAiso plus试剂、克隆载体pMD-19T simple、Taq DNA聚合酶、限制性内切酶(Xho Ⅰ、Xba Ⅰ、Sac Ⅰ)和T4 DNA连接酶购自TaKaRa公司(日本);大肠杆菌DH5α、DNA分子量标准、DNA割胶回收试剂盒、质粒提取试剂盒、酵母DNA提取试剂盒和BCA蛋白质浓度测定试剂盒购自天根生物科技有限公司(北京);胰蛋白胨和酵母粉购自OXOID公司(英国);YNB(无氨基酵母氮源)购自BIOSHARP公司(美国);蛋白质分子量标准购自中科瑞泰生物科技有限公司(北京);Western blot试剂盒购自康为世纪生物科技有限公司(北京)。其他试剂均为国产分析纯。用于抑菌活性测定的金黄色葡萄球菌、枯草芽孢杆菌(Bacillus subtilis)和副溶血性弧菌(Vibrio parahemolyticus)均为本实验室保藏。PCR引物由上海生工生物工程有限公司合成。大肠杆菌培养基LB、毕赤酵母培养基YPD、选择培养基MM和MD、诱导表达培养基BMG和BMM见Invitrogen公司毕赤酵母操作手册。
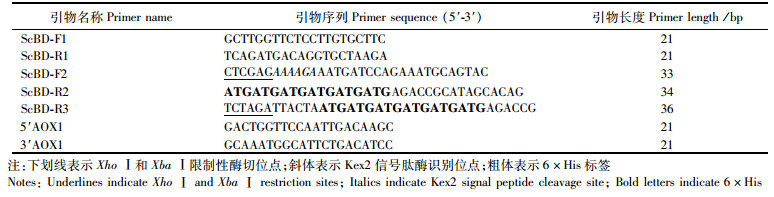
1.2 方法 1.2.1 目的基因的获取使用RNAiso plus试剂提取鳜鱼脾脏总RNA。第一链cDNA的合成参照Fast King cDNA Dispelling RT Super Mix试剂盒(天根生化科技有限公司,北京)说明书进行。根据鳜鱼β-防御素的全长cDNA序列(GenBank登录号:FJ876152.1)设计引物如表 1所示。先以第一链cDNA为模板,使用引物ScBD-F1和ScBD-R1扩增编码鳜鱼β-防御素成熟肽的基因;以该基因为模板,使用引物ScBD-F2和ScBD-R2扩增5′端含Xho Ⅰ酶切位点和Kex2信号肽酶识别位点、3′端含6×His标签的基因;再以此基因为模板,使用引物ScBD-F2和ScBD-R3扩增3′端含Xba Ⅰ酶切位点和2个终止密码子的目的基因ScBD;将其与质粒pMD-19T连接后转入大肠杆菌DH5α中,37 ℃培养过夜,挑选阳性菌落送上海生工生物工程有限公司测序。
|
表 1 PCR引物序列 Tab.1 Sequences of PCR primers |
使用Xho Ⅰ和Xba Ⅰ对重组克隆质粒pMD-19T- ScBD和表达载体pPICZαA进行双酶切,随后连接并转入大肠杆菌DH5α感受态细胞;通过菌落PCR和双酶切验证重组表达载体pPICZαA-ScBD是否构建成功。
确证的pPICZαA-ScBD经Sac Ⅰ线性化处理后,以体积比1:8与毕赤酵母X-33感受态细胞混匀后转入0.2 cm电转杯中,冰浴5 min后电击(1.5 kV、25 μF、200 Ω)5 ms;立即加入600 μL 1 mol/L山梨醇,28 ℃孵育2 h后离心,菌体涂布于含100 μg/mL博来霉素的YPD平板上,28 ℃培养3~4 d;挑取部分菌落分别接种于含1 000 μg/mL博来霉素的YPD平板和MD、MM平板上以筛选甲醇利用快速型高拷贝酵母转化子。对筛选到的转化子提取基因组DNA,使用载体上的通用引物5′AOX1和3′AOX1(表 1)进行PCR鉴定。另外,将pPICZαA转化至毕赤酵母X-33中作为阴性对照。
1.2.3 重组菌株的诱导表达选取一株酵母转化子接种至5 mL YPD培养基中,28 ℃、250 r/min培养24 h,取500 μL转接至50 mL BMG培养基中培养至OD600为2.0~4.0,离心收集菌体重悬于50 mL BMM培养基中,在28 ℃、250 r/min的条件下,用1%的甲醇诱导表达96 h,每隔24 h取样用于Tricine-SDS-PAGE分析。另一方面,设置甲醇体积浓度为0%、0.5%、0.75%、1%、1.25%、1.5%和2%,诱导表达96 h后分别取样同上进行分析。使用BCA试剂盒测定蛋白质浓度。
1.2.4 重组菌株产物的分析及活性验证在最合适表达条件下扩大培养至750 mL,培养液上清经切向回流超滤器(赛多利斯VIVAFLOW200)浓缩后,使用Profina蛋白质纯化仪(BIO-RAD,美国)进行镍离子亲和层析。按照Western Blot试剂盒说明书对纯化产物进行Western Blot分析,由上海中科新生命生物科技有限公司对纯化产物进行MALDI-TOF/TOF质谱鉴定。
通过平板涂布法[23]和浊度法[24]验证表达产物是否具有抑菌活性。将枯草芽孢杆菌、副溶血性弧菌和金黄色葡萄球菌分别接种于5 mL LB培养基中,于37 ℃、150 r/min培养至OD600=0.2(5×107 CFU/mL),再将其稀释至5×106 CFU/mL作为实验菌液。平板涂布法操作步骤:取1 μL实验菌液与100 μL浓缩30倍的培养液上清混合,在37 ℃下孵育2 h后取30 μL涂布于LB平板上,37 ℃培养24 h后观察菌落生长情况;以浓缩30倍的X-33/pPICZαA的培养液上清作为阴性对照。浊度法操作如下:100 μL实验菌液与150 μL浓缩的培养液上清于96孔板中混合,37 ℃孵育24 h和48 h后使用酶标仪(BioTeK®,美国)测OD600;以100 μg/mL氨苄青霉素作为阳性对照,阴性对照同上;每组实验重复3次。抑制率(%)=(实验组吸光值-阴性对照吸光值)/(阳性对照吸光值-阴性对照吸光值)×100%。使用SPSS 19.0软件进行统计学分析。
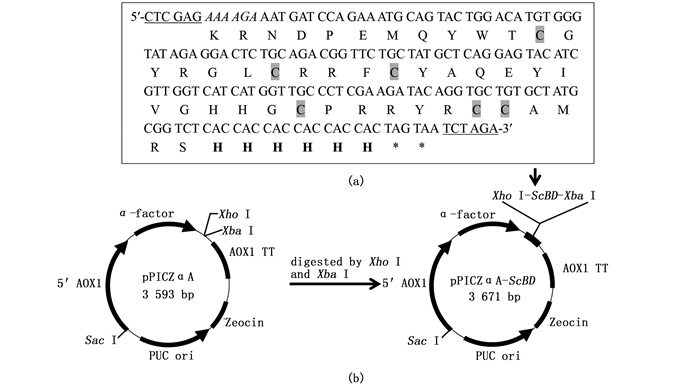
2 结果与分析 2.1 重组表达载体的构建使用表 1中所列引物,通过3次PCR,依次扩增到193、159和171 bp的片段。最后一次PCR获得的171 bp片段即添加了相关位点的编码鳜鱼β-防御素成熟肽的基因ScBD。DNA测序显示(图 1a):除去相关位点,目的基因编码了由43个氨基酸残基组成的鳜鱼β-防御素成熟肽,内含6个高度保守的半胱氨酸残基,它们可以在空间上形成3对二硫键以稳定多肽的空间结构并赋予其生物学活性。经ExPASy软件(http://web.expasy.org/compute.pi/)预测,ScBD的理论分子量为6.35 ku,pI为9.3。
|
下划线表示Xho Ⅰ和Xba Ⅰ限制性酶切位点;斜体表示Kex 2信号肽酶识别位点;粗体表示6×His标签;阴影表示半胱氨酸残基;*表示终止密码子 Underlines indicate Xho Ⅰ and Xba Ⅰ restriction sites; Italic indicates Kex2 signal peptide cleavage site; Bold letters indicate 6×His; Cysteine residues are shaded; Star indicates stop code 图 1 目的基因的核苷酸和推断的氨基酸序列(a)以及重组表达载体pPICZαA-ScBD的构建图(b) Fig. 1 Nucleotide and deduced amino acid sequences of the target gene (a) as well as schematic representation of the recombinant expression vector pPICZαA-ScBD (b) |
如图 1b所示,利用Xho Ⅰ和Xba Ⅰ将ScBD与表达载体pPICZαA连接后转入大肠杆菌,随后使用载体上的通用引物5′AOX1和3′AOX1进行菌落PCR验证,结果显示在近700 bp处的条带与预期分子量673 bp相符。进一步使用Xho Ⅰ和Xba Ⅰ对pPICZαA-ScBD进行双酶切,结果显示在100~200 bp的分子量位置处的1个条带与171 bp的预期分子量相符。
2.2 重组菌株的筛选及目的蛋白的诱导表达线性化的“pPICZαA-ScBD”电转入毕赤酵母X-33后,利用含高浓度博来霉素的抗性培养基筛选到8株长势良好的酵母转化子;提取其基因组DNA为模板,以5′AOX1和3′AOX1为引物进行PCR,8株转化子均扩增到近700 bp的1个条带,与673 bp的预期分子量相符,证明pPICZαA-ScBD已成功嵌入酵母转化子的染色体中。
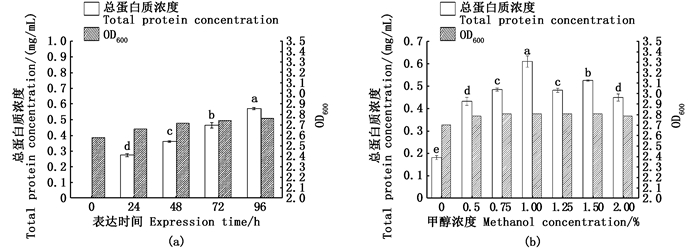
选择1株转化子用于甲醇诱导表达。图 2a是发酵培养0~96 h的培养液上清的Tricine-SDS-PAGE结果,可以发现在96 h时目的蛋白的表达量明显增加,对比图 3a,96 h时的总蛋白质浓度也是呈现最高状态(P < 0.05),故选择其作为发酵培养时间。另一方面,图 2b显示了不同甲醇浓度诱导表达的培养液上清的Tricine-SDS-PAGE结果:甲醇浓度为1%时,目的蛋白最明显,此甲醇浓度下总蛋白质浓度也最高(图 3b)。在上述实验的基础上,扩大发酵培养液至750 mL,于28 ℃、250 r/min的条件下,用1%甲醇诱导表达96 h;培养液上清经镍离子亲和层析获得分子量近7.8 ku的纯化产物(图 4a),经BCA法测定该纯化产物的蛋白质浓度为0.47 mg/mL,推算至表达量为2.53 mg/L。由于该纯化产物的分子量较重组ScBD的理论分子量(6.4 ku)偏高,故通过Western blot分析对其进行初步验证,结果显示在近10 ku处有单一杂交条带(图 4b),证明目的蛋白羧基端携带的6×His标签与抗His标签的鼠单克隆抗体发生了免疫反应;但该杂交条带的分子量明显高于重组ScBD的理论分子量,其原因可能与使用的彩虹预染超低分子量蛋白质标准有关,进一步的MALDI-TOF/TOF质谱鉴定证明了该推测。

|
M.蛋白质分子量标准 M.Protein marker 图 2 不同的表达时间(a)和甲醇浓度(b)下培养液上清的Tricine-SDS-PAGE分析 Fig. 2 Tricine-SDS-PAGE analysis of the culture medium supernatants at different expression time (a) and methanol concentration (b) |
|
相同字母表示总蛋白质浓度之间无显著差异,不同字母表示总蛋白质浓度之间具有显著差异(P < 0.05);数据表示平均值±标准差,n=3 The same letter indicates that there is not statistical difference between the total protein concentrations, and different letters indicate that there are statistical differences between the total protein concentrations (P < 0.05); Data were shown as mean ±SD, n=3 图 3 不同的表达时间(a)和甲醇浓度(b)下培养液上清的总蛋白质浓度和OD600的变化 Fig. 3 Changes in total protein concentration and OD600 of the culture medium supernatants at different expression time (a) and methanol concentration (b) |

|
M.蛋白质分子量标准;CK.X-33/pPICZαA转化子的培养液上清;1.纯化产物;2.X-33/pPICZαA-ScBD转化子的培养液上清 M.Protein marker; CK.Culture medium supernatant of X-33/pPICZαA; 1.Purified product; 2.Culture medium supernatant of X-33/pPICZαA-ScBD 图 4 纯化产物的Tricine-SDS-PAGE(a)和Western blot(b)分析 Fig. 4 Tricine-SDS-PAGE (a) and Western blot (b) analysis for the purified product |
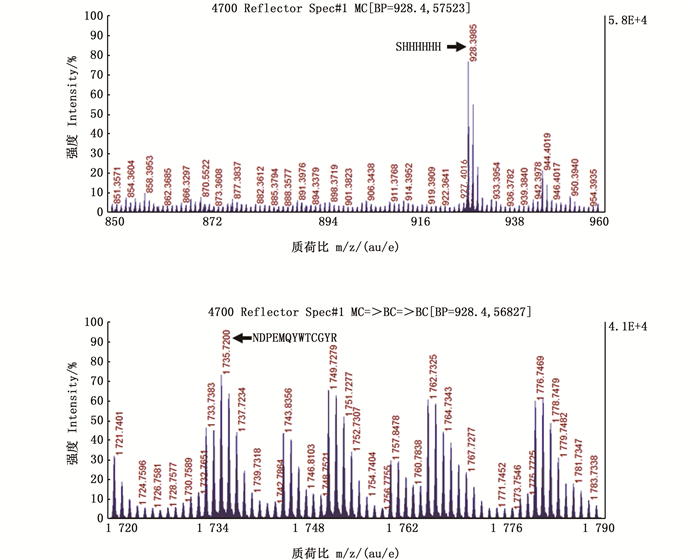
纯化产物的MALDI-TOF/TOF质谱分析(图 5)显示,在m/z为799~1 790范围内捕捉到2个肽段,m/z 928.398 5和m/z 1 735.720 0分别代表自N端起45~51位的氨基酸残基序列(SHHHHHH)和3~15位的氨基酸残基序列(NDPEMQYWTCGYR);该2个肽段的氨基酸序列分别与相应位置的理论序列相符,证明纯化产物即为预期的重组ScBD。
|
大写英文字母指示氨基酸序列 Capital letters indicate amino acid sequences 图 5 纯化产物的MALDI-TOF/TOF质谱分析 Fig. 5 MALDI-TOF/TOF analysis for the purified product |
平板涂布法检测结果显示(图 6a):与阴性对照(X-33/pPICZαA重组菌株的培养液上清)和空白(PBS)相比,X-33/pPICZαA-ScBD重组菌株的培养液上清与革兰氏阳性的金黄色葡萄球菌和枯草芽孢杆菌及革兰氏阴性的副溶血性弧菌作用2 h后涂的平板上,3种细菌的菌落数均明显减少。另一方面,基于浊度法的抑菌实验结果显示(图 6b):X-33/pPICZαA-ScBD重组菌株的培养液上清与上述3种细菌作用24 h后的抑制率分别为94.34%、75.1%和80.86%;作用48 h后对枯草芽孢杆菌和副溶血性弧菌的抑制率上升为86.97%和85.92%。

|
1.用X-33/pPICZαA的培养液上清处理的细菌;2.用X-33/pPICZαA-ScBD的培养液上清处理的细菌;3.用PBS处理的细菌。数据表示平均值±标准差,n=3 1.Treated bacteria using the culture medium supernatant of X-33/pPICZαA; 2. Treated bacteria using the culture medium supernatant of X-33/pPICZαA-ScBD; 3. Treated bacteria using PBS. Data were shown as mean ±SD, n=3 图 6 基于平板涂布法(a)和浊度法(b)的毕赤酵母重组菌株产物的抑菌活性 Fig. 6 Antibacterial activity of product from P. pastoris recombinant strain based on the plate coating method (a) and turbidimetric method (b) |
近年来,因沿海港湾和河流等水域遭受病原微生物和有机农药的污染,水产养殖环境污染的问题日渐突出,为增强鱼贝类等水产生物的抵抗力而采取的主要措施是服用过量抗生素,其直接后果就是频发水产品质量安全问题。因此,开发能替代或部分替代抗生素的无残留、无微生物耐药性的天然抗菌剂不失为良好的解决途径。β-防御素作为大多数硬骨鱼类内源性的重要蛋白质防御因子,是开发天然抗菌剂的候选。本研究首次实现了基于毕赤酵母重组菌株的鳜鱼β-防御素的生物合成。鱼类β-防御素成熟肽的相对分子质量为4.5~5.4 ku,通常,这种外源小分子蛋白质对宿主菌株会有潜在的危害,可能导致宿主细胞经历“自杀”现象[25];另一方面,它们易被宿主自身产生的酶降解,因此,通过生物表达系统较难获得高产的重组小分子蛋白质。本研究在28 ℃、250 r/min条件下,使用1%甲醇诱导表达96 h,获得表达量为2.53 mg/L的重组ScBD;此前关于重组毕赤酵母产经密码子优化过的斑马鱼β-防御素的表达研究显示表达量为2.3 mg/L[20]。这两项研究结果表明该方法能有效合成β-防御素,但产量较低。近年来,关于提高小分子蛋白质表达量的研究有多个报道,有学者[26]构建了含4拷贝的马蹄蟹horseshoe crab Tachyplesin 1(TP-1)抗菌肽基因的表达载体,将其在毕赤酵母GS115中表达后发酵液中的重组TP-1质量浓度达到27.24~29.53 mg/L;另有学者将抗乙肝病毒表面抗原单链抗体(HBscFv)的基因与γ干扰素(IFNγ)的基因串联,在毕赤酵母X-33中进行融合表达,获得表达量为15 mg/L的重组融合蛋白HBscFv-IFNγ[27]。因此,进一步的研究将构建含多拷贝鳜鱼β-防御素基因ScBD的表达载体或与其他相对分子质量较大的抗菌肽基因进行融合表达,以期提高表达量。
使用毕赤酵母作为异源表达宿主合成外源蛋白质,在实验室研究和工业生产中已有广泛应用。通常,培养基的组成与细胞的生长和外源基因的表达密切相关,因BMGY/BMMY培养基含酵母浸出物和蛋白胨而有利于表达产物的稳定和产量的提高,故被作为发酵培养时的首选[28];然而,在以往的研究发现其导致杂蛋白的数量也越多。与之相比,BMG/BMM培养基以含硫酸铵、无氨基酸的YNB作为氮源、甲醇作为唯一碳源,使发酵培养液的成分大大简化,也方便了培养液的后续处理。本研究在实验室摇瓶发酵阶段使用BMG/BMM培养基,通过重组毕赤酵母实现了小分子ScBD的胞外表达,为今后使用此培养基进行高密度发酵提供了极其重要的参考依据。另一方面,抑菌实验证明了含重组ScBD的培养液上清对革兰氏阳性的金黄色葡萄球菌、枯草芽孢杆菌以及革兰氏阴性的副溶血性弧菌具有明显的抑菌活性,该结果预示了含重组ScBD的培养液上清可直接作为生产天然抗菌剂的原液而无需对发酵上清进行繁琐的纯化处理,这将大大简化产品的生产工艺以符合大规模制备的要求。本研究结果为鱼类来源天然小分子抗菌肽的进一步开发提供了可资参考的技术途径,后续将在本研究的基础上进一步增加目的基因拷贝数以提高重组毕赤酵母产鳜鱼β-防御素的产量。
| [1] |
YANG D, BIRAGYN A, KWAK W L, et al. Mammalian defensins in immunity:more than just microbicidal[J]. Trends in Immunology, 2002, 23(6): 291-296. DOI:10.1016/S1471-4906(02)02246-9 |
| [2] |
TRAN D, TRAN P A, TANG Y Q, et al. Homodimeric θ-defensins from Rhesus macaque leukocytes:isolation, synthesis, antimicrobial activities, and bacterial binding properties of the cyclic peptides[J]. The Journal of Biological Chemistry, 2002, 277(5): 3079-3084. DOI:10.1074/jbc.M109117200 |
| [3] |
DIAMOND G, ZASLOFF M, ECK H, et al. Tracheal antimicrobial peptide, a cysteine-rich peptide from mammalian tracheal mucosa:peptide isolation and cloning of a cDNA[J]. Proceedings of the National Academy of Sciences of the United States of America, 1991, 88(9): 3952-3956. DOI:10.1073/pnas.88.9.3952 |
| [4] |
SELSTED M E, TANG Y Q, MORRIS W L, et al. Purification, primary structures, and antibacterial activities of β-defensins, a new family of antimicrobial peptides from bovine neutrophils[J]. Journal of Biological Chemistry, 1993, 268(9): 6641-6648. |
| [5] |
SUAREZ-CARMON M, HUBERT P, DELVENNE P, et al. Defensins:"simple" antimicrobial peptides or broad-spectrum molecules?[J]. Cytokine & Growth Factor Reviews, 2015, 26(3): 361-370. |
| [6] |
BARICELLI J, ROCAFULL M A, VÁZQUEZ D, et al. β-defensin-2 in breast milk displays a broad antimicrobial activity against pathogenic bacteria[J]. Jornal de Pediatria, 2015, 91(1): 36-43. DOI:10.1016/j.jped.2014.05.006 |
| [7] |
TOLONE M, MASTRANGELO S, DI GERLANDO R, et al. Association study between β-defensin gene polymorphisms and mastitis resistance in valle del belice dairy sheep breed[J]. Small Ruminant Research, 2016, 136: 18-21. DOI:10.1016/j.smallrumres.2015.12.037 |
| [8] |
ÁLVAREZ Á H, VELÁZQUEZ M M, PRADO MONTES DE OCA E. Human β-defensin 1 update:potential clinical applications of the restless warrior[J]. International Journal of Biochemistry & Cell Biology, 2018, 104: 133-137. |
| [9] |
ZOU J, MERCIER C, KOUSSOUNADIS A, et al. Discovery of multiple beta-defensin like homologues in teleost fish[J]. Molecular Immunology, 2007, 44(4): 638-647. DOI:10.1016/j.molimm.2006.01.012 |
| [10] |
CASADEI E, WANG T H, ZOU J, et al. Characterization of three novel β-defensin antimicrobial peptides in rainbow trout (Oncorhynchus mykiss)[J]. Molecular Immunology, 2009, 46(16): 3358-3366. DOI:10.1016/j.molimm.2009.07.018 |
| [11] |
NAM B H, MOON J Y, KIM Y O, et al. Multiple β-defensin isoforms identified in early developmental stages of the teleost Paralichthys olivaceus[J]. Fish & Shellfish Immunology, 2010, 28(2): 267-274. |
| [12] |
GUO M L, WEI J G, HUANG X H, et al. Antiviral effects of β-defensin derived from orange-spotted grouper (Epinephelus coioides)[J]. Fish & Shellfish Immunology, 2012, 32(5): 828-838. |
| [13] |
VAN DER MAREL M, ADAMEK M, GONZALEZ S F, et al. Molecular cloning and expression of two β-defensin and two mucin genes in common carp (Cyprinus carpio L.) and their up-regulation after β-glucan feeding[J]. Fish & Shellfish Immunology, 2012, 32(3): 494-501. |
| [14] |
ZHU J Y, WANG H, WANG J, et al. Identification and characterization of a β-defensin gene involved in the immune defense response of channel catfish, Ictalurus punctatus[J]. Molecular Immunology, 2017, 85: 256-264. DOI:10.1016/j.molimm.2017.03.009 |
| [15] |
BENSCH K W, RAIDA M, MÄGERT H J, et al. hBD-1:a novel β-defensin from human plasma[J]. FEBS Letters, 1995, 368(2): 331-335. DOI:10.1016/0014-5793(95)00687-5 |
| [16] |
CHEN Z J, WANG D M, CONG Y G, et al. Recombinant antimicrobial peptide hPAB-β expressed in Pichia pastoris, a potential agent active against methicillin-resistant Staphylococcus aureus[J]. Applied Microbiology and Biotechnology, 2011, 89(2): 281-291. |
| [17] |
PENG Z X, WANG A R, FENG Q Y, et al. High-level expression, purification and characterisation of porcine β-defensin 2 in Pichia pastoris and its potential as a cost-efficient growth promoter in porcine feed[J]. Applied Microbiology and Biotechnology, 2014, 98(12): 5487-5497. DOI:10.1007/s00253-014-5560-7 |
| [18] |
铁宇娟, 刘陶林, 蔡卉, 等. 蓝狐β-防御素1基因(vBD1)的真核表达及其抑菌活性分析[J]. 中国预防兽医学报, 2019, 41(5): 468-473. TIE Y J, LIU T L, CAI H, et al. Eukaryotic expression and antimicrobial activity of β-defensin 1(vBD1) from blue fox (Vulpes lagopus)[J]. Chinese Journal of Preventive Veterinary Medicine, 2019, 41(5): 468-473. |
| [19] |
金俊琰, 周莉, 桂建芳. 石斑鱼β-防御素的酵母表达及其产物抗菌活性分析[J]. 水生生物学报, 2011, 35(5): 739-744. JIN J Y, ZHOU L, GUI J F. The yeast expression of grouper β-defensin and antibacterial activity of the recombinant protein[J]. Acta Hydrobiologica Sinica, 2011, 35(5): 739-744. |
| [20] |
TAO Y, SONG C F, LI W. Expression of the zebrafish β-defensin 3 mature peptide in Pichia pastoris and its purification and antibacterial activity[J]. Applied Biochemistry and Microbiology, 2017, 53(6): 661-668. DOI:10.1134/S0003683817060126 |
| [21] |
WANG G L, LI J H, ZOU P F, et al. Expression pattern, promoter activity and bactericidal property of β-defensin from the mandarin fish Siniperca chuatsi[J]. Fish & Shellfish Immunology, 2012, 33(3): 522-531. |
| [22] |
DALY R, HEARN M T W. Expression of heterologous proteins in Pichia pastoris:a useful experimental tool in protein engineering and production[J]. Journal of Molecular Recognition, 2005, 18(2): 119-138. DOI:10.1002/jmr.687 |
| [23] |
郑平. 环境微生物学实验指导[M]. 杭州: 浙江大学出版社, 2005: 37-40. ZHENG P. Laboratory manual for environmental microbiology[M]. Hangzhou: Zhejiang University Press, 2005: 37-40. |
| [24] |
YANG D L, WANG Q, CAO R W, et al. Molecular characterization, expression and antimicrobial activities of two c-type lysozymes from manila clam Venerupis philippinarum[J]. Developmental & Comparative Immunology, 2017, 73: 109-118. |
| [25] |
DENG T, GE H R, HE H H, et al. The heterologous expression strategies of antimicrobial peptides in microbial systems[J]. Protein Expression and Purification, 2017, 140: 52-59. DOI:10.1016/j.pep.2017.08.003 |
| [26] |
LI H M, ALI Z, LIU X L, et al. Expression of recombinant tachyplesin I in Pichia pastoris[J]. Protein Expression and Purification, 2019, 157: 50-56. DOI:10.1016/j.pep.2019.01.012 |
| [27] |
LIANG M H, ZHOU S S, JIANG J G. Construction, expression and characterization of a fusion protein HBscFv-IFNγ in Komagatella (Pichia) pastoris X33[J]. Enzyme and Microbial Technology, 2017, 102: 74-81. DOI:10.1016/j.enzmictec.2017.04.001 |
| [28] |
INVITROGEN C. pPICZαA, B, and C Pichia expression vectors for selection on ZeocinTM and purification of secreted, recombinant proteins[R]. America: Invitrogen, 2010.
|
2. Shanghai Engineering Research Center of Aquatic Product Processing & Preservation, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


