磷虾是一类主要分布于南半球、生存在海洋中的一类甲壳浮游动物,种类繁多,生物资源量大,人们一般习惯称生活在南极水域的磷虾为南极磷虾[1]。南极磷虾(Euphausia superba)隶属于节肢动物门(Arthropoda)甲壳动物纲(Crustacea)磷虾目(Euphausiacea)磷虾属(Euphausia)磷虾(Euphausia superba),是企鹅、海豹、鲸类等动物的食物来源[2-3]。这种虾个体较小,成年个体约5~6 cm,身体由头胸部和腹部两部分组成,呈半透明红色,一般以群居生活,以微小浮游植物为食,是一种嗜冷水性动物[1]。南极磷虾死亡后,即使在低温的环境下也极易自溶、黑化,这与虾体内存在高效的酶系统有密切的关系[4-5]。目前已经发现的南极磷虾蛋白酶主要有8种,内切酶以胰蛋白酶为主,外切酶以羧肽酶为主[6],具体包括3种丝氨酸类胰蛋白酶(TL I, TL II, TL III)、1种丝氨酸类胰凝乳蛋白酶(CL)、2种羧肽酶A和两种羧肽酶B[7]。羧肽酶A的分子量约为24~28 ku,羧肽酶B的分子量约为24~28 ku[8]。
羧肽酶是一种可专一性地从肽链的C端开始逐个降解释放出游离氨基酸的肽链外切酶,在医药、食品等领域应用广泛。在医药领域,因羧肽酶与机体的生化反应关系密切,故可通过体内羧肽酶的检测达到诊断和治疗疾病的目的,例如羧肽酶对阿尔茨海默病[9]和肿瘤[10]等疾病的诊断治疗;在食品工业上,羧肽酶可用于制备高F值寡肽、食品和饲料中赭曲霉素的去除、用作脱苦味剂等。目前,商用羧肽酶的获取主要来源于猪、牛等的胰脏,数量有限,价格昂贵[11]。南极磷虾不仅生物资源巨大,且具有适冷性特点,但目前尚未充分开发利用。本文对南极磷虾羧肽酶进行了分离纯化并对其酶学性质进行了研究,以期为南极磷虾羧肽酶的开发应用提供参考。
1 材料与方法 1.1 实验材料本研究用南极磷虾于2018年捕获于南极渔场48.1区,由辽宁省大连海洋渔业集团公司提供,运输至实验室后立即放入超低温冰箱(-80 ℃)贮藏备用。
1.2 试剂与仪器 1.2.1 主要试剂三(羟甲基)氨基甲烷(Tris)、硫酸铵、乙二胺四乙酸(EDTA)、1, 10-菲啰啉、低分子量标准蛋白、氯化铁、氯化钙、氯化锌、氯化镁、氯化镍、无水硫酸铜、磷酸氢二钠、柠檬酸、甘氨酸、氢氧化钠、DTT购于国药;十二烷基苯磺酸钠(SDS)购于生工;苯甲基磺酰氟(PMSF)、四水氯化锰、β-巯基乙醇购于麦克林;脲酰-L-苯丙氨酸(Hippuryl-L-phenylalanine)、DEAE-琼脂糖凝胶FF购于上海源叶生物科技有限公司;SephadexTM-G100凝胶过滤柱购于美国GE Healthcare公司;蛋白定量测试盒购于南京建成生物工程研究所。
1.2.2 主要仪器主要仪器包括H2050R台式高速冷冻离心机(湘仪离心机仪器有限公司)、层析柜(上海沪西分析仪器厂有限公司)、JB-1A型磁力搅拌器(上海精密科学仪器有限公司)、UV-1800PC紫外可见分光光度计(上海美谱达仪器有限公司)、DYCZ-24D垂直电泳槽(北京市六一仪器厂)、TS-2000A脱色摇床(海门市其林贝尔仪器制造有限公司)、双列四孔恒温水浴锅(上海慧泰仪器制造有限公司)、pH计(梅特勒-托利多仪器有限公司)。
1.3 实验方法 1.3.1 粗酶液的制备参考杭虞杰等[12]的方法,略作改变。取-80 ℃贮藏的南极磷虾,按照1:2比例将南极磷虾加入到预冷的0.05 mol/L pH 8.0 Tris-HCl缓冲液中,经组织捣碎机捣碎,4 ℃静置4 h。取匀浆液于冷冻离心机11 000 r/min离心30 min,弃去沉淀,收集上清液,即为粗酶液。
1.3.2 酶活测定参照FOLK等[13]的方法略作改变,进行羧肽酶活性测定。以脲酰-L-苯丙氨酸为底物,用缓冲液为含0.1 mol/L NaCl的0.025 mol/L pH 8.0 Tris -HCl溶解,测其在254 nm处5 min内分光光度值的变化。该条件下吸光度每增加0.001即为1个酶活单位(U)。
1.3.3 蛋白质浓度测定采用考马斯亮蓝法测定蛋白质浓度。
1.3.4 南极磷虾羧肽酶纯化粗酶液4 ℃静置2 h,于冷冻离心机12 000 r/min离心15 min,收集上清液并分别用20%~80%饱和度硫酸铵进行分级沉淀,测定羧肽酶酶活性及蛋白含量。
取1.5×40 cm层析柱,装柱后将凝胶柱固定于4 ℃的层析柜中。用3倍柱体积的pH 8.0 0.025 mol/L Tris-HCl缓冲液以1.0 mL/min平衡层析柱,直至UV280成一条直线。取经50%饱和度的硫酸铵初分离的酶液经透析除盐后,过0.22 μm滤膜,上DEAE-琼脂糖凝胶FF阴离子交换层析柱,以0.025 mol/L pH 8.0的Tris-HCl缓冲液和0~0.5 mol/L的NaCl进行梯度洗脱,每2 min收集1管,绘制洗脱曲线。将用于后续研究的洗脱液透析除盐后,冻干备用。
取1.5×40 cm层析柱,装柱后将凝胶柱固定于4 ℃的层析柜中。用3倍柱体积的0.025 mol/L pH 8.0 Tris-HCl缓冲液以0.5 mL/min平衡层析柱,直至UV280成一条直线。将收集的DEAE-琼脂糖凝胶FF阴离子交换柱层析最大活性峰样品,过0.22 μm滤膜,上样SephadexTM G-100凝胶柱,用0.025 mol/L pH 8.0的Tris-HCl缓冲液进行洗脱,每10 min收集1管,绘制洗脱曲线。将用于后续研究的洗脱液透析除盐后,冻干备用。
采用SDS- PAGE不连续电泳的方法,用考马斯亮蓝R-250进行染色,检验酶的纯度并测定酶的分子量。SDS-PAGE电泳中使用的分离胶浓度为12%,浓缩胶为5%。浓缩胶电流设置为15 mA,分离胶为30 mA。
1.3.5 南极磷虾羧肽酶酶学性质分析温度梯度设置范围为4~70 ℃(每隔10 ℃设置1个梯度)。将纯化后南极磷虾羧肽酶用0.025 mol/L pH 8.0 Tris-HCl缓冲液溶解,置于水浴锅中保温15 min后,加入底物溶液,测相对酶活,每组实验重复3次。
温度梯度的设置为4、25、37和40 ℃,将纯化后南极磷虾羧肽酶用0.025 mol/L pH 8.0 Tris-HCl缓冲液溶解,在各个温度下分别保温30 min、1 h、2 h、4 h、8 h、12 h,分别测出不同温度及保温时间下的相对酶活,每组实验重复3次。
在30 ℃下,将纯化后的南极磷虾羧肽酶酶液分别置于pH 5.0~10.0缓冲液中(每隔0.5设置1个梯度)。测定不同pH缓冲液条件下相对酶活,每组实验重复3次。不同pH缓冲液为磷酸氢二钠-柠檬酸(pH 5.0~6.5)、Tris-HCl(pH7.0~9.0)和甘氨酸-氢氧化钠(pH 9.0~10.0)。
向南极磷虾羧肽酶中分别加入1.0、5.0和10.0 mmol/L的金属离子溶液,包括Ca2+、Fe3+、Cu2+、Ni2+、Mn2+、Zn2+和Mg2+。在同一条件下,向纯化后的南极磷虾羧肽酶中加入上述金属离子溶液,保温15 min,测定其相对酶活,每组实验重复3次。
分别配制1.0和10.0 mmol/L的化学抑制剂溶液,包括二硫苏糖醇(DTT)、β-巯基乙醇(βME)、乙二胺四乙酸(EDTA)、1, 10-菲啰啉、苯甲基磺酰氟(PMSF)。在同一条件下,向纯化后的南极磷虾羧肽酶酶液加入上述化学抑制剂溶液,保温15 min,测定其相对酶活,每组实验重复3次。
在最适反应条件下,改变底物脲酰-L-苯丙氨酸的浓度[S],测定酶促反应的初速度V0,采用Lineweaver-Burk双倒数法作图,以1/V对1/[S]作图,横坐标截距为-1/Km,纵坐标截距为1/Vmax。
1.4 统计分析实验数据采用SPSS 25.0进行方差分析、Origin 8.5作图。每项实验数据的测定采用3个平行。
2 结果 2.1 羧肽酶的分离纯化 2.1.1 硫酸铵分级沉淀高浓度的盐离子在蛋白质溶液中可与蛋白质竞争水分子,从而破坏蛋白质表面水化膜,降低溶解度,使蛋白从溶液中沉淀出来,从而达到蛋白质粗分离[1]。本研究以10%为1个浓度梯度,对不同硫酸铵浓度下南极磷虾羧肽酶的盐析效果进行了研究。由图 1可见,南极磷虾羧肽酶的酶活和蛋白含量随硫酸铵浓度的增加而增加,至50%硫酸铵饱和度时最高,随后因盐浓度的增加会导致蛋白变性而使酶失活,故选择50%硫酸铵饱和度粗分离的样品进行后续纯化。

|
图 1 不同浓度硫酸铵作用下粗酶蛋白含量及酶活 Fig. 1 Protein content and enzymatic activity extraction at different concentraction of (NH4)2SO4 |
DEAE-琼脂糖凝胶FF阴离子交换柱层析是通过带电的溶质分子与离子交换层析介质中可交换的阴离子进行交换而达到的分离纯化的目的。结果如图 2所示,出现6个酶活性峰,在NaCl浓度为0.4 mol/L时,有最大吸收峰,且酶活性和蛋白含量最高,因此收集NaCl浓度0.4 mol/L下的洗脱液进行后续纯化。

|
图 2 DEAE-琼脂糖凝胶FF阴离子交换柱层析结果 Fig. 2 Result of chromatography with DEAE- agarose gel FF anion exchange column |
SephadexTM G-100凝胶层析是以被分离物质相对分子质量差异为基础的一种层析分离法,利用一定孔径大小的多孔凝胶作固定相,从而达到分离的目的。其结果如图 3所示,经酶活性测定结果显示,只有一个酶活性峰,该峰具有较高活性,且蛋白含量也较高,位于29~42管处,故收集该峰样品,经透析除盐后冻干备用。

|
图 3 SephadexTM G-100凝胶层析结果 Fig. 3 Result of chromatography with SephadexTM G-100 gel columm |
对经SephadexTM G-100凝胶层析纯化后的南极磷虾羧肽酶进行SDS-PAGE分析,结果如图 4b所示,在30 ku位置出现了1条清晰的条带。经与试验前期南极磷虾羧肽酶粗酶液图 4a作比对,显示经过硫酸铵分级沉淀、阴离子柱、凝胶层析分离纯化后,得到了电泳纯水平的南极磷虾羧肽酶。
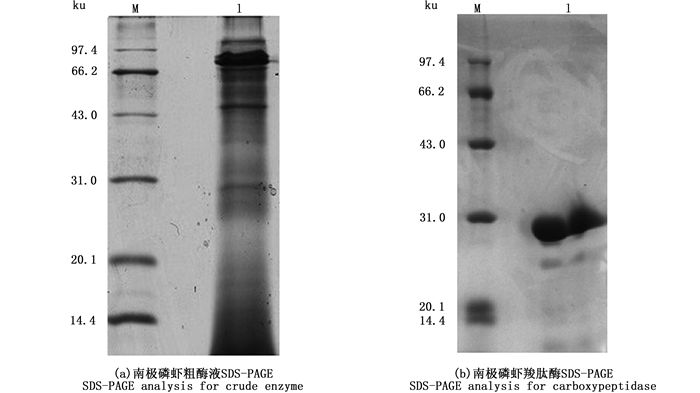
|
图 4 SDS-PAGE电泳结果 Fig. 4 Result of SDS-PAGE electrophoresis |
将纯化的南极磷虾羧肽酶进行酶活最适温度分析,结果如图 5所示。在0~30 ℃,南极磷虾羧肽酶酶活随着温度的升高而上升;当温度高于30 ℃时,其活性随着温度的升高而降低;至70 ℃时,相对酶活性仅为20%。因此,本研究纯化所得的南极磷虾羧肽酶的最适反应温度为30 ℃,比猪胰[14]、牛胰[15]等陆生恒温动物羧肽酶最适反应温度低,这可能与南极磷虾长期生活在低温环境有一定关系。
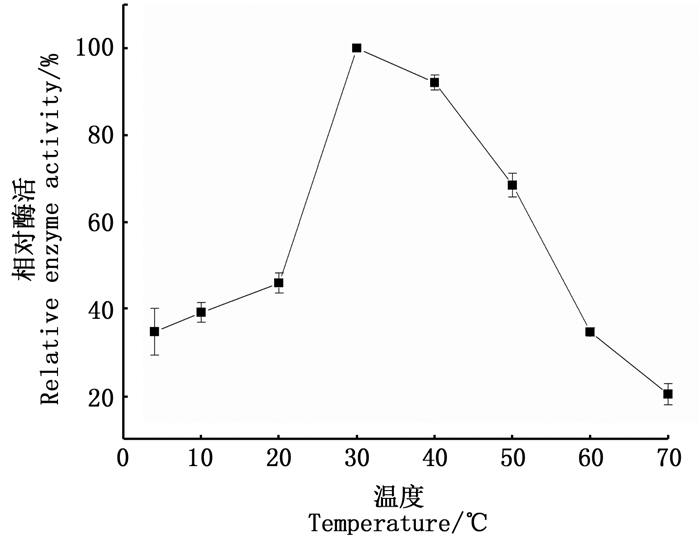
|
图 5 不同温度对南极磷虾羧肽酶酶促反应速率的影响 Fig. 5 Enzymatic reaction rates of E.superba carboxypeptidase at different temperatures |
在pH 8.0条件下,将纯化的南极磷虾羧肽酶进行热稳定性分析。结果如图 6所示,在4 ℃、25 ℃、30 ℃、40 ℃下,当保温不超过2 h时其活性保持80%以上,当保温2 h后其活性迅速下降,原因可能是南极磷虾羧肽酶自溶能力较强,热稳定性较差。但当活性降至原30%后,在4 ℃下活性丧失速度较其他温度变小,这可能与南极磷虾的生存环境有关,南极磷虾是常年生活在南极这样极端低温环境中的一种嗜冷生物,它们栖居于南极海域的冰下,生活的水域温度一般维持在-1.7 ℃至-3 ℃[4],在进化过程中形成了适应寒冷环境的能力,使其在低温环境中酶活保持相对稳定来维持其生存需要。
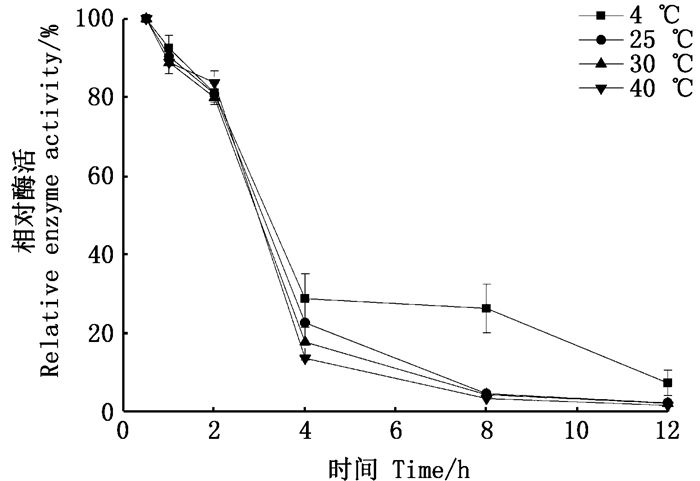
|
图 6 不同时间对南极磷虾羧肽酶稳定性的影响 Fig. 6 Enzyme stabilities of E.superba carboxypeptidase at different time |
酶活性一般受pH的影响,通常酶只有在一定pH范围内才表现它的活性[16],缓冲液的酸碱度通过影响酶的空间构象或酶分子活性中心有关基团的解离或是中间产物的解离状态而改变酶的活性。将纯化的南极磷虾羧肽酶进行最适pH分析,结果如图 7所示。在pH 5.0~10.0范围内南极磷虾羧肽酶都显示不同程度的活性,而在pH 5.0~8.0酶活性随着pH的增升高而增大,至pH 8.0时达到最高,随后酶活性随着pH的增大而降低,故本研究中纯化得到南极磷虾羧肽酶最适pH为8.0。
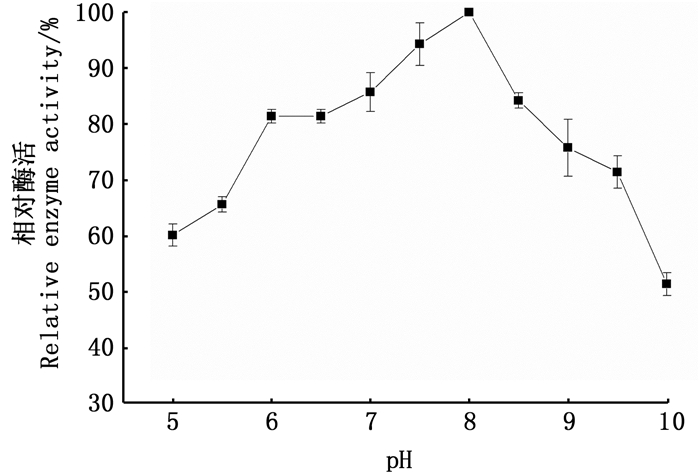
|
图 7 不同pH对南极磷虾羧肽酶活性的影响 Fig. 7 Enzymatic activities of E.superba carboxypeptidase at different pH |
在同一条件下,不同金属离子对南极磷虾羧肽酶活性的影响如图 8所示。不同金属离子对南极磷虾羧肽酶活性影响不同,同一金属离子的不同浓度对羧肽酶酶活性影响也不同,浓度越高,抑制或激活作用越明显。在这些金属离子中,Mg2+、Zn2+、Mn2+、Ni2+对其具有激活作用:当浓度为1 mmol/L时,Zn2+的激活作用较显著;当浓度为5 mmol/L时,Mn2+的激活作用较显著;当浓度为10 mmol/L时,Mg2+激活作用较显著。Ca2+、Fe3+和Cu2+起抑制作用,在不同浓度下Cu2+的抑制效果都是最显著的。

|
图 8 不同金属离子对南极磷虾羧肽酶活性的影响 Fig. 8 Enzymatic activities of E.superba carboxypeptidase with different metal ions |
在同一条件下,将纯化的南极磷虾羧肽酶进行不同化学抑制剂作用下其酶活性影响的分析。结果如图 9所示,不同化学抑制剂对南极磷虾羧肽酶酶活影响不同,同一化学抑制剂的不同浓度对羧肽酶的酶活性影响也不同。对巯基有修饰作用的抑制剂DTT、β-巯基乙醇对其有明显抑制作用;金属蛋白酶抑制剂EDTA、1, 10-菲罗啉对羧肽酶活性有明显的抑制作用,且随抑制剂浓度的增加,抑制效果就越明显;丝氨酸蛋白酶抑制剂PMSF对纯化的南极磷虾羧肽酶抑制作用并不强烈。由上述结果推测,本研究纯化所得南极磷虾羧肽酶具有典型的金属蛋白酶特性。

|
图 9 不同化学抑制剂对南极磷虾羧肽酶活性的影响 Fig. 9 Enzymatic activities of E.superba carboxypeptidase with different chemical inhibitors |
在30 ℃、pH 8.0条件下,以不同浓度梯度的脲酰-L-苯丙氨酸为底物,测定南极磷虾羧肽酶的Km和Vmax。通过Lineweaver-Buck得到拟合曲线公式为y=0.001 2x+0.203 7,R2=0.994 7,根据公式计算得到酶促反应最大速度Vmax为4.909 1 U/min,米氏常数Km为0.005 9 mg/mL。
3 讨论近年来,由于南极磷虾资源量丰富且体内蛋白质降解酶系统呈现高效性的特点,成为生物活性物的热点研究领域之一,据报道其体内的蛋白酶即使在较低温度下仍具有较高的活性,不仅存在严重的自溶现象,并且能够迅速降解各种蛋白质的特点,且对复杂蛋白质的降解活性均高于目前其他同类商品酶[17]。羧肽酶为南极磷虾体内一种重要的蛋白酶,对其进行深入研究对理解南极磷虾体内独特的蛋白酶系具有指导意义,也为后续的开发应用提供参考。
本研究以南极磷虾为原料,通过粗酶提取、DEAE琼脂糖凝胶FF阴离子交换层析和SephadexTMG100凝胶层析分离纯化出了一种羧肽酶,经SDS-PAGE显示该酶的分子量约为30 ku,这与JSÖDHAL等[18]等通过毛细管电泳的方法测得的南极磷虾羧肽酶分子量的结果相符。但陆兆新等人[19]从曲霉发酵液中提取得到的羧肽酶分子量为15.9 ku,这可能是因为从曲霉发酵液中纯化出的可能是一种新型的羧肽酶,或者因物种不同,导致了分子量间存在的差异。
对分离纯化的羧肽酶进行酶学性质研究,发现该酶的最适温度为30 ℃,较其他猪胰、牛胰纯化得到的羧肽酶最适温度偏低,且在很低的温度(0~10 ℃)下仍有一定的催化活性,说明该酶可能是一种适冷酶[20],具有适冷性。本研究中南极磷虾羧肽酶动力学常数Km较其他鸵鸟[21]、海星幽门盲肠[22]等来源羧肽酶低,说明南极磷虾羧肽酶对底物的亲和力较强。
金属离子对南极磷虾羧肽酶作用的研究结果显示,Mg2+、Zn2+、Mn2+、Ni2+对其具有激活作用,而Ca2+、Fe3+、Cu2+起抑制作用。这与XU等[23]和许大洲等[24]研究的金属羧肽酶性质结论大致相似。已知金属蛋白酶家族活性中心一般存在于Zn2+[25],本研究中,在金属离子浓度为1 mmol/L时,Zn2+的激活作用最强;而Mg2+是作为酶促反应的重要辅助因子,所以只有当浓度达到一定程度时,具有激活作用[26],因此随着浓度的增加,当浓度达到10 mmol/L时,Mg2+激活作用最显著。因此,南极磷虾羧肽酶具有金属羧肽酶特性。另外,本研究中的羧肽酶的最适pH为8.0。研究表明,金属羧肽酶在中性或弱碱性条件下具有极大活性[11],进一步证实了南极磷虾羧肽酶具备典型的金属蛋白酶特性。金属蛋白酶参与了人体的许多重要生理过程,如消化吸收、血管生成等作用,在医药应用方面具有广阔空间。
对各种化学抑制剂对南极磷虾羧肽酶活性进行研究发现:对巯基有修饰作用的抑制剂DTT、β-巯基乙醇对其活性有明显抑制作用,说明其酶的活性中心存在二硫键;金属蛋白酶抑制剂EDTA、1, 10-菲罗啉对羧肽酶活性也同样有明显的抑制作用,且随浓度的增大而不断增强,进一步证实其具有金属蛋白酶特性;丝氨酸蛋白酶抑制PMSF对该羧肽酶抑制作用并不强烈。
4 结论目前人们主要从动物器官组织中生产获得商业化的羧肽酶,成本高、量少、操作困难,造成其售价昂贵,限制了羧肽酶功能的开发与应用。南极大磷虾资源丰富,本研究发现南极磷虾羧肽酶具有金属酶属性,且具备一定的适冷性和高活性特点,本研究以期通过对其获取并进行酶学性质研究,为南极磷虾羧肽酶后续分子生物学领域研究及医药、食品工业等方面应用推广提供参考。
| [1] |
向宇.南极大磷虾(Euphausia superba)胰蛋白酶样酶分离纯化、酶学性质探索及其生物学活性研究[D].青岛: 中国海洋大学, 2011. XIANG Y. Purification and enzymatic characteristics of trypsin-like enzymes from Euphausia superba & research on its biological activities[D]. Qingdao: Ocean University of China, 2011. http://cdmd.cnki.com.cn/article/cdmd-10423-1011231115.htm |
| [2] |
杨栋.太平洋磷虾蛋白酶的生物化学和组织化学研究[D].青岛: 中国海洋大学, 2003. YANG D. Studies on bioehemical and histochemical of proteolytie enzymes from Euphausia pacific[D]. Qingdao: Ocean University of China, 2003. |
| [3] |
刘志东, 王鲁民, 陈雪忠, 等. 南极磷虾蛋白的研究进展[J]. 食品与发酵工业, 2017, 43(7): 242-251. LIU Z D, WANG L M, CHEN X Z, et al. Research progress on the protein derived from Antarctic krill (Euphausia superba Dana)[J]. Food and Fermentation Industries, 2017, 43(7): 242-251. |
| [4] |
周婷婷, 王锡昌, 李燕. 南极磷虾胰蛋白酶的结构分析及适冷性机制研究[J]. 现代食品科技, 2016, 32(5): 27-33. ZHOU T T, WANG X C, LI Y. Structure and cold-adaptation mechanism of trypsin purified from the Krill (Euphausia superba Dana, 1852)[J]. Modern Food Science and Technology, 2016, 32(5): 27-33. |
| [5] |
SJÖDAHL J, EMMER Å, VINCENT J, et al. Characterization of proteinases from Antarctic krill (Euphausia superba)[J]. Protein Expression and Purification, 2002, 26(1): 153-161. |
| [6] |
张鹏.南极大磷虾胰蛋白酶分离纯化及其促进创伤修复作用研究[D].青岛: 中国海洋大学, 2012. ZHANG P. Purification of trypsins from Euphausia superba and study on cutaneous wound healing[D]. Qingdao: Ocean University of China, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10423-1012506434.htm |
| [7] |
王琨.南极磷虾胰蛋白酶的分离纯化及酶学性质研究[D].大连: 大连理工大学, 2013. WANG K. Purification and characterization of the trypsin from Euphausia superba[D]. Dalian: Dalian University of Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10141-1013199073.htm |
| [8] |
燕梦雅, 陈雪忠, 刘志东, 等. 南极磷虾来源酶的研究进展[J]. 食品工业科技, 2017, 38(9): 368-373. YAN M Y, CHEN X Z, LIU Z D, et al. Research progress in enzyme derived from Antarctic krill[J]. Science and Technology of Food Industry, 2017, 38(9): 368-373. |
| [9] |
MURTHY S R K, DUPART E, AL-SWEEL N, et al. Carboxypeptidase E promotes cancer cell survival, but inhibits migration and invasion[J]. Cancer Letters, 2013, 341(2): 204-213. DOI:10.1016/j.canlet.2013.08.011 |
| [10] |
EDGE M, FORDER C, HENNAM J, et al. Engineered human carboxypeptidase B enzymes that hydrolyse hippuryl-L-glutamic acid:Reversed-polarity mutants[J]. Protein Engineering, Design and Selection, 1998, 11(12): 1229-1234. DOI:10.1093/protein/11.12.1229 |
| [11] |
吴静, 闵柔, 邬敏辰, 等. 羧肽酶研究进展[J]. 食品与生物技术学报, 2012, 31(8): 793-801. WU J, MIN R, WU M C, et al. Research progresses on the carboxypeptidase[J]. Journal of Food Science and Biotechnology, 2012, 31(8): 793-801. DOI:10.3969/j.issn.1673-1689.2012.08.002 |
| [12] |
杭虞杰, 李学英, 杨宪时, 等. 南极磷虾蛋白酶分离纯化及部分性质研究[J]. 食品与发酵工业, 2011, 37(10): 92-95. HANG Y J, LI X Y, YANG X S, et al. Partial purification and characterization of protease from Antarctic krill (Euphausia superba)[J]. Food and Fermentation Industries, 2011, 37(10): 92-95. |
| [13] |
FOLK J E, PIEZ K A, CARROLL W R, et al. Carboxy-peptidase B 4. Purification and characterization of the porcine enzyme[J]. Journal of Biological Chemistry, 1960, 235(8): 2272-2277. |
| [14] |
FOLK J E, SCHIRMER E W. The porcine pancreatic carboxypeptidase a system Ⅰ. Three forms of the active enzyme[J]. Journal of Biological Chemistry, 1963, 238(12): 3884-3894. |
| [15] |
BRADLEY G, NAUDÉ R J, MURAMOTO K, et al. Ostrich (Struthio camelus) carboxypeptidase A:purification, kinetic properties and characterization of the pancreatic enzyme[J]. International Journal of Biochemistry, 1994, 26(4): 555-564. DOI:10.1016/0020-711X(94)90014-0 |
| [16] |
李加儿, 张建强, 许晓娟, 等. 温度和pH值对斜带髭鲷蛋白酶、淀粉酶活性的影响[J]. 渔业科学进展, 2009, 30(3): 7-12. LI J E, ZHANG J Q, XU X J, et al. Effects of temperature and pH on the protease and amylase activities in skewband grunt Hapalogenys nitens[J]. Progress in Fishery Sciences, 2009, 30(3): 7-12. DOI:10.3969/j.issn.1000-7075.2009.03.002 |
| [17] |
孙松, 严小军. 南极大磷虾的生物活性物质及其用途研究进展[J]. 极地研究, 2001, 13(3): 213-216. SUN S, YAN X J. Active substances in the Antarctic krill[J]. Chinese Journal of Polar Research, 2001, 13(3): 213-216. |
| [18] |
SJÖDAHL J, EMMER Å, KARLSTAM B, et al. Separation of proteolytic enzymes originating from Antarctic krill (Euphausia superba) by capillary electrophoresis[J]. Journal of Chromatography B:Biomedical Sciences and Applications, 1998, 705(2): 231-241. DOI:10.1016/S0378-4347(97)00552-5 |
| [19] |
陆兆新, 冯红霞, 吕凤霞, 等. 曲霉羧肽酶的分离纯化研究[J]. 食品与发酵工业, 2003, 29(12): 27-30. LU Z X, FENG H X, LYU F X, et al. Purification and characterization of carboxypeptidase from Aspergillus sp.[J]. Food and Fermentation Industries, 2003, 29(12): 27-30. DOI:10.3321/j.issn:0253-990X.2003.12.006 |
| [20] |
王军仁.南极大磷虾(Euphausia superba)胰蛋白酶适冷性酶学性质及结构特征分析[D].青岛: 中国海洋大学, 2013. WANG J R. Enzymology properties and structural characteristics analysis on cold-adapted trypsin from Antarctic krill (Euphausia superba)[D]. Qingdao: Ocean University of China, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10423-1013368982.htm |
| [21] |
BRADLEY G, NAUDÉ R J, MURAMOTO K, et al. Ostrich (Struthio camelus) carboxypeptidase B:purification, kinetic properties and characterization of the pancreatic enzyme[J]. International Journal of Biochemistry & Cell Biology, 1996, 28(5): 521-529. |
| [22] |
KISHIMURA H, HAYASHI K. Isolation and characteristics of carboxypeptidase B from the pyloric ceca of the starfish Asterias amurensis[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2002, 133(2): 183-189. DOI:10.1016/S1096-4959(02)00130-6 |
| [23] |
XU D G, GUO H. Quantum mechanical/molecular mechanical and density functional theory studies of a prototypical zinc peptidase (carboxypeptidase A) suggest a general acid-general base mechanism[J]. Journal of the American Chemical Society, 2009, 131(28): 9780-9788. DOI:10.1021/ja9027988 |
| [24] |
许大洲, 王树英, 金坚, 等. 在大肠杆菌中融合表达重组羧肽酶抑制剂[J]. 食品与生物技术学报, 2006, 25(6): 119-123. XU D Z, WANG S Y, JIN J, et al. Fusion expression of recombinant carboxypeptidase inhibitor in Escherichia coli[J]. Journal of Food Science and Biotechnology, 2006, 25(6): 119-123. DOI:10.3321/j.issn:1673-1689.2006.06.026 |
| [25] |
秦日甜, 卢玉丽, 梁高丽, 等. 镰刀菌Q7-31T金属蛋白酶FQME14的分离纯化及鉴定[J]. 生物技术通报, 2018, 34(4): 161-167. QIN R T, LU Y L, LIANG G L, et al. Isolation, purification and identification of metalloprotease FQME14 from Fusarium sp. Q7-31T[J]. Biotechnology Bulletin, 2018, 34(4): 161-167. |
| [26] |
潘道东, 李敏. 嗜酸乳杆菌细胞壁蛋白酶的分离纯化及酶学性质的研究[J]. 中国食品学报, 2012, 12(4): 48-56. PAN D D, LI M. Purification and enzymatic characterization of cell-envelope proteinase from Lactobacillus acidophilus[J]. Journal of Chinese Institute of Food Science and Technology, 2012, 12(4): 48-56. DOI:10.3969/j.issn.1009-7848.2012.04.008 |
 2020,
Vol. 29
2020,
Vol. 29


