2. 华中农业大学 水产学院, 湖北 武汉 430070
在鱼类早期发育过程中,各组织和器官发生了剧烈的结构和生理变化,各部分的生长速度不同步差异较大,视为异速生长[1]。在不同发育阶段中这种生长模式可以保证对生存至关重要的器官和组织得到优先发育,以提高仔鱼的成活率[1-2]。一般认为,对机体生存起主要作用的器官和系统,如呼吸系统、摄食器官和运动系统等优先得到发育,而那些对存活作用较低的器官则迟后发育[2],在早期发育过程中明确其生长模式可有助于提高仔鱼的成活率、制定合理的幼鱼苗培育策略,同时分析仔鱼的环境偏好,加强对渔业资源的保护。
拉萨裂腹鱼(Schizothorax waltoni Regan)主要分布在雅鲁藏布江干、支流,是我国特有的典型的适应流水环境的鱼类[3],水电等设施的建设会导致水体的流动性减缓,从而威胁其生存。同时过度捕捞的现象也较为严重,在部分地区表现出渔获物小型化,表明该鱼的资源已开始衰退,亟需加强对渔业资源的管理[4]。目前对拉萨裂腹鱼的研究比较少,其生物学研究资料仅见于分类和演化[5]、年龄与生长[6]和简单的食性组成分析[7]等,而对其早期发育的生长模式还未见研究。本研究以拉萨裂腹鱼仔、稚鱼为对象,研究了其异速生长情况,探明其早期生活史阶段的生长规律,为丰富拉萨裂腹鱼的基础生物学数据、规模化人工繁育和资源保护提供理论依据。
1 材料与方法 1.1 材料来源实验用拉萨裂腹鱼受精卵为课题组繁育,亲鱼捕自雅鲁藏布江流域,空运至四川省水产研究所卧龙基地进行繁育,共获得5万余枚受精卵。孵化用水为从上游导入过滤后的溶洞水,水质清澈,实验期间水温恒定为(13±1)℃,气泵充氧,溶氧保持在7.0 mg/L以上。育苗盆为圆形玻璃钢盆,直径1.2 m,水深0.2 m,随着鱼苗的长大,密度逐渐降低,由50尾/L降低至10尾/L。每个育苗盆从顶部提供过滤溶洞水,排水孔位于育苗盆的中央底部,覆盖孔径为300 μm的纱网,防止幼苗丢失,24 h流水养殖,每日曝气。4日龄仔鱼出现口裂后,开始投喂开口饵料轮虫(Brachionus rotundiformis)和蛋黄,8日龄仔鱼开始平游后开始投喂丰年虫无节幼体。23日龄开始投喂微饲料S1料(山东升索微粒子配合饲料,蛋白含量>50%), 同时减少丰年虫无节幼体的投喂量。
1.2 实验方法仔鱼出膜当天为0日龄仔鱼,出膜后每天固定时间(上午9:00—10:00)取样10~20尾,实验共持续91 d。用Olympus SZ61体式解剖镜对仔稚鱼进行观察和拍照。记录各发育期的主要形态、行为特征。用ToupView软件测量仔稚鱼全长、头长、头高、眼径、吻长、体高、肛前长、肛后长、尾鳍长、胸鳍长、背鳍长、臀鳍长、腹鳍长等指标,精确到0.01 mm。其中胸鳍出膜后已经分化,自0日龄开始测量,其余各鳍分化后开始分别测量。鳍长是指各鳍外侧基部起点至最长鳍条末端的直线距离。测量仔、稚鱼时先用40 mg/L MS-222麻醉。共测量仔、稚鱼1 215尾,对拉萨裂腹鱼的生长模式进行分析。测量指标见图 1。

|
1.全长;2.头长;3.头高;4.眼径;5.吻长;6.体高;7.肛前长;8.肛后长;9.尾鳍长;10.背鳍长;11.臀鳍长;12.腹鳍长;13.胸鳍长。 1.Totle length; 2.Head length; 3.Head height; 4.Eye diameter; 5.Snout length; 6.Body height; 7.Pre-anal length; 8.Post-anal length; 9.Caudal fin length; 10.Dorsal fin length; 11.Anal fin length; 12.Pelvic fin length; 13.Pectoral fin length. 图 1 拉萨裂腹鱼形态度量学指标示意图 Fig. 1 Morphometric measurement of S.waltoni Regan |
仔、稚鱼日龄与全长的关系[8]:
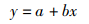 (1)
(1)
式中:x为仔、稚鱼的日龄,d;y为相应日龄仔、稚鱼的全长,mm;a为y轴截距;b为异速生长指数。
异速生长模型[1]:
 (2)
(2)
式中:x为仔、稚鱼的全长,mm;y为与自变量x相对应的各器官的长度,mm;a为y轴截距;b为异速生长指数。b=1为等速生长;b>1为正异速生长;b < 1为负异速增长。异速生长模型中的不同生长阶段以拐点分开,生长方程分别为y=a1xb1,y=a2xb2。对b1、b2是否等于1进行t检验,同时对b1、b2是否存在差异进行t检验(95%置信区间)。采用SPSS 22.0软件的非线性回归参数拟合过程,并结合OriginPro 2016软件的非线性回归参数进行分段拟合,以决定系数R2最大及残差平方和最小作曲线拟合的标准,同时求得拐点值。
用SPSS 22.0软件进行显著性分析,P < 0.05表示差异显著;用OriginPro 2016软件作生长曲线图。
2 结果 2.1 仔、稚鱼的全长拉萨裂腹鱼仔鱼初孵时的全长为10.71 mm,经过90 d培育后长至42.88 mm。仔、稚鱼期间根据生长率分为2个阶段(图 2):第一阶段为0~28日龄,此阶段的生长率为0.29 mm/d;第二阶段为28~90日龄,生长率为0.41mm/d。2个阶段的生长率差异显著(P < 0.05)。仔、稚鱼在28日龄前生长较缓慢,而后生长变快,28日龄为拉萨裂腹鱼仔、稚鱼生长的转折点。
|
图 2 拉萨裂腹鱼仔、稚鱼日龄与全长关系 Fig. 2 Correlation between day post hatch and total length of larval and juvenile S.waltoni Regan |
拉萨裂腹鱼从前向后分别以鳃盖末端和肛门为界,纵向依次测量头长、肛前长和肛后长,横向测量头高和体高, 各部的生长情况见图 3。

|
图 3 拉萨裂腹鱼身体各部的异速生长曲线 Fig. 3 Allometric growth curve of body parts in larval and juvenile S.waltoni Regan |
头长的生长拐点出现在24~25日龄(全长为18.12mm),拐点前头长的异速生长指数b1=2.26,显著大于1(P < 0.05),即拐点前头长表现为正异速生长;拐点后生长指数b2=1.01,与1之间差异不显著(P>0.05),即拐点后头长表现为等速生长。肛前长的生长拐点出现在36~37日龄(全长为21.55 mm):拐点前肛前长的异速生长指数b1=0.81,显著小于1(P < 0.05),即拐点前肛前长表现为负异速生长;拐点后生长指数b2=0.98,与1之间差异不显著(P>0.05),即拐点后肛前长表现为等速生长。肛后长的生长拐点出现在37~38日龄(全长为21.75 mm),拐点前肛后长的异速生长指数b1=1.36,显著大于1(P < 0.05),即拐点前肛后长表现为正异速生长;拐点后生长指数b2=1.04,与1之间差异不显著(P>0.05),即拐点后肛后长表现为等速生长。头高在40~41日龄时出现生长拐点(全长为22.66 mm):拐点前头高的异速生长指数b1=1.67,显著大于1(P < 0.05),即拐点前头高表现为正异速生长;拐点后生长指数b2=0.96,与1之间差异不显著(P>0.05),即拐点后头高表现为等速生长。体高在49~50日龄时出现生长拐点(全长为24.97 mm):拐点前体高的异速生长指数b1=1.43,显著大于1(P < 0.05),即拐点前体高表现为正异速生长;拐点后生长指数b2=1.18,与1之间差异不显著(P>0.05),即拐点后体高表现为等速生长。
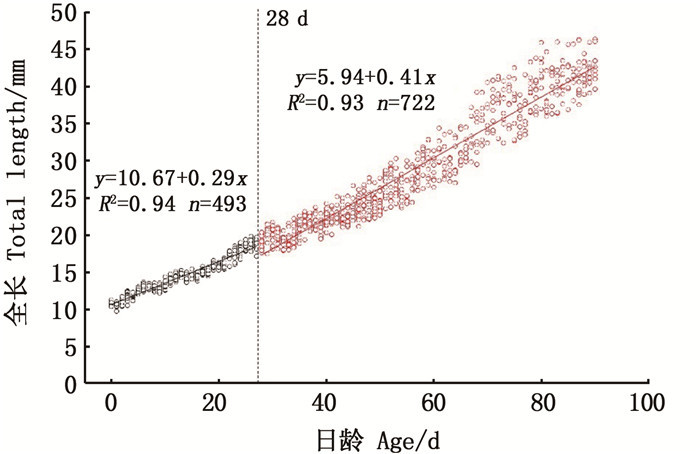
眼径的生长拐点出现在18~19日龄(全长为16.42 mm),拐点前眼径的异速生长指数b1=1.61,显著大于1(P < 0.05),即拐点前眼径表现为正异速生长;拐点后生长指数b2=1.06,与1之间差异不显著(P>0.05),即拐点后眼径表现为等速生长。吻长在42~43日龄时出现生长拐点(全长为23.07 mm):拐点前吻长的异速生长指数b1=1.77,显著大于1(P < 0.05),即拐点前吻长表现为正异速生长;拐点后生长指数b2=1.18,与1之间差异不显著(P>0.05),即拐点后吻长表现为等速生长。见图 4。
|
图 4 拉萨裂腹鱼头部器官的异速生长曲线 Fig. 4 Allometric growth curve of head organs in larval and juvenile S.waltoni Regan |
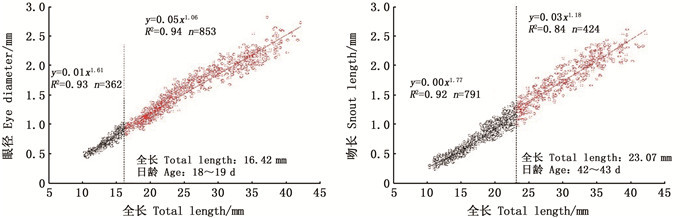
胸鳍长在18~19日龄时出现生长拐点(全长为16.49 mm):拐点前胸鳍长的异速生长指数b1=3.95,显著大于1(P < 0.05),即拐点前胸鳍长表现为正异速生长;拐点后生长指数b2=1.13,与1之间差异不显著(P>0.05),即拐点后胸鳍长表现为等速生长。背鳍长在39~40日龄时出现生长拐点(全长为22.29 mm):拐点前背鳍长的异速生长指数b1=1.55,显著大于1(P < 0.05),即拐点前背鳍长表现为正异速生长;拐点后生长指数b2=1.09,与1之间差异不显著(P>0.05),即拐点后背鳍长表现为等速生长。臀鳍长在43~44日龄时出现生长拐点(全长为23.32 mm),臀鳍长的异速生长指数b1=3.18、b2=1.35,均显著大于1(P < 0.05),即拐点前后臀鳍长均表现为正异速生长,在拐点后生长指数明显变小。腹鳍长在46~47日龄时出现生长拐点(全长为24.23 mm),拐点前后腹鳍长的异速生长指数b1=3.78、b2=1.45,均显著大于1(P < 0.05),即拐点前后腹鳍长也均表现为正异速生长,拐点后生长指数同样明显变小。尾鳍长在37~38日龄时出现生长拐点(全长为21.83 mm):拐点前尾鳍长的异速生长指数b1=1.93,显著大于1(P < 0.05),即拐点前尾鳍长表现为正异速生长;拐点后生长指数b2=1.14,与1之间差异不显著(P>0.05),即拐点后尾鳍长表现为等速生长。见图 5。
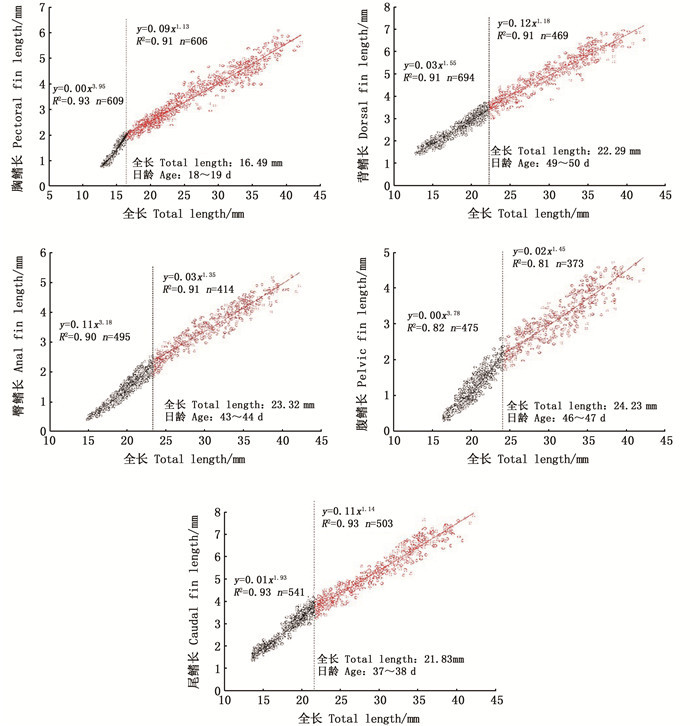
|
图 5 拉萨裂腹鱼运动相关器官的异速生长曲线 Fig. 5 Allometric growth curve of swimming organs in larval and juvenile S.waltoni Regan |
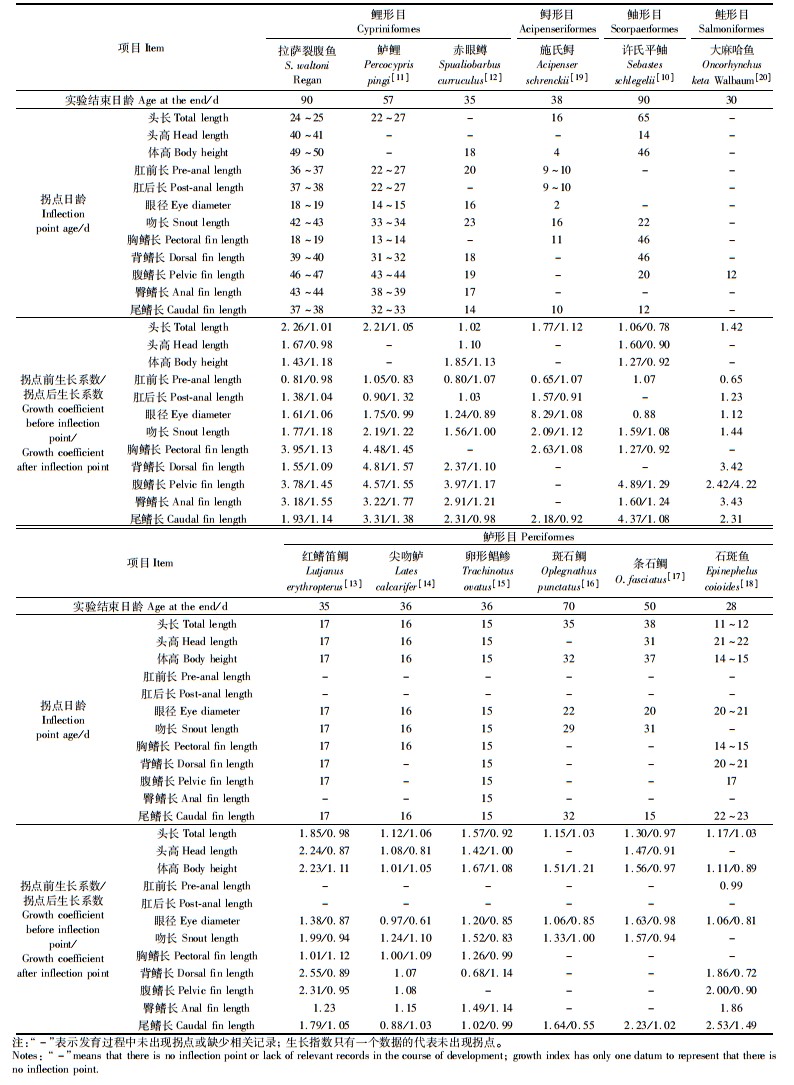
通过比较发现,眼径、胸鳍长、尾鳍长和头长的拐点是比较早出现的,但不同的鱼拐点出现的前后顺序是不同的。眼径最先出现拐点的有拉萨裂腹鱼、鲈鲤(Percocypris pingi)、斑石鲷(Oplegnathus punctatus)和施氏鲟(Acipenser schrenckii),胸鳍长最先出现拐点的有拉萨裂腹鱼和鲈鲤,尾鳍长最先出现拐点有赤眼鳟(Spualiobarbus curruculus)、条石鲷(O.fasciatus)和许氏平鲉(Sebastes schlegelii),头长最先出现拐点的有石斑鱼(Epinephelus coioides)。在拐点前所有鱼的头长、头高、体高、眼径、吻长均保持正异速生长,拐点后等速生长或负异速生长。多数鱼类胸鳍长、背鳍长、腹鳍长、臀鳍长和尾鳍长表现为拐点前正异速生长,拐点后为生长系数略低的正异速生长或匀速生长,例外的是红鳍笛鲷(Lutjanus erythropterus)和尖吻鲈(Lates calcarifer)胸鳍长在拐点前为均速生长;尖吻鲈的尾鳍长在拐点前为负异速生长;斑石鲷的尾鳍长在拐点后为负异速生长;卵形鲳鲹(Trachinotus ovatus)在拐点前为负异速生长;大麻哈鱼(Oncorhynchus keta Walbaum)腹鳍长拐点后生长系数大于拐点前。肛前长多数表现为拐点前负异速生长,拐点后均速生长,肛后长多数表现为拐点前正异速生长,拐点后匀速生长,鲈鲤的肛前长与肛后长的生长状况则相反。笔者推测这跟鱼的体型和其所处的生存环境是密切联系的。从开口摄食到卵黄消失为内源性营养向外源性营养的过渡期,是鱼类早期发育的重要临界期[9],不同鱼类早期全长的异速生长方式与鱼类的大小、生活习性及生殖方式密切相关,这是不同鱼类长期进化的结果[10]。见表 1。
|
表 1 不同鱼类拐点日龄及拐点前后生长速度比较 Tab.1 Comparison of the growth rates of different fish inflection points before and after inflection points |
拉萨裂腹鱼仔、稚鱼的生长分为2个阶段(小于28日龄、28~90日龄),2个阶段的生长率差异显著(P < 0.05)。28日龄为拉萨裂腹鱼由慢速生长到快速生长的转折点。这与饲料的转换密切相关,23日龄卵黄吸收完全后开始配合投喂人工饲料,同时各器官快速分化发育完善,各鳍基本形成,仔鱼由混合营养阶段进入对外营养仔鱼阶段,摄食和消化能力接近成鱼,这与刘立明等[21]对黑鲪(Sebastodes fuscescens)研究结果一致。
3.3 拉萨裂腹鱼的异速生长 3.3.1 鱼体各部分的异速生长拉萨裂腹鱼仔、稚鱼的头部和尾部的生长快于躯干部、头长、肛前长、肛后长。鱼类的躯干部是消化系统所在的部位,其大多数的鱼类中表现为负异速生长,仅在少数鱼类的异速生长中表现为正异速生长[9],推测其原因可能与仔鱼在内源性营养阶段内主要营养源是卵黄囊,仔鱼消化系统发育相对迟缓有关。
头部是鱼类神经系统、呼吸系统、摄食器官以及视觉器官等所在的重要部位,发育一般较早[17, 19],拉萨裂腹鱼的头高和头长在早期阶段也呈现正异速生长。头部的优先发育可以提高仔、稚鱼应对环境压力的能力,对仔鱼的生长非常重要。随着仔、稚鱼的生长发育,头部内各器官逐步发育完善,头部生长开始减缓,头长和头高表现为等速生长。何滔等[17]认为仔鱼的头高和头长的生长拐点存在差异,这可能由不同鱼类头部的外部形态不同引起。
研究[21]表明鱼体各内脏器官的生长发育,例如鳔的充气和消化系统的发育等均可以增加体高。拉萨裂腹鱼的体高在仔稚鱼发育期间,均表现为正异速生长,拐点前生长较快,拐点后生长减慢,这与许氏平鲉[10]、条石鲷[17]等结果一致,表明在仔稚鱼期间内脏器官在持续发育。
3.3.2 头部器官的异速生长头部器官主要测量了眼径和吻长。视觉是仔、稚鱼的摄食和逃避敌害的重要功能器官,因此眼在仔鱼早期发育中是最优先发育的器官之一,本实验中所有的测量指标中眼最先达到拐点(18~19日龄),这与条石鲷[17]、西伯利亚鲟(Acipenser baeri)[23]、石斑鱼[18]等多种鱼的早期发育一致,这促使眼睛充分发育,以提高早期仔鱼在开口期摄食外源食物和逃避敌害的能力。但也有例外,日本七鳃鳗(Lampetra japonica)的眼径为等速生长,原因是其生存在黑暗环境,摄食方式不需要依靠眼睛寻找食物[24]。仔鱼的摄食能力与其吻长、口裂的发育密切相关,吻长在42~43日龄才出现生长拐点,这保证了口的充分发育,以适应不同的饵料环境。
位于头部的摄食、呼吸、视觉等器官在较短时间内快速发育,有利于提高仔鱼早期的生存能力。各器官发育逐步完全后,生长速度减慢。
3.3.3 游泳器官的异速生长拉萨裂腹鱼仔、稚鱼的臀鳍和腹鳍在拐点前后均表现为正异速生长,但是其生长指数在拐点后明显减小,其余鳍在拐点前为正异速生长,拐点后为等速生长;运动器官的正异速生长使拉萨裂腹鱼仔鱼的游泳能力得到大幅提高。各鳍的快速发育对仔鱼的游泳、摄食、集群有重要意义。初孵仔鱼靠尾部摆动和鳍褶平衡,游泳能力较弱,胸鳍的出现大大提高了仔鱼的游泳能力[25]。拉萨裂腹鱼的胸鳍在孵化前就已分化,表明胸鳍是其早期重要的游泳器官,其在18~19日龄出现生长拐点,且在拐点前异速生长指数b1高达3.95,胸鳍的快速发育和生长对仔鱼的快速游动、摄食和逃避敌害等意义重大。
3.4 仔、稚鱼异速生长与环境的适应性仔、稚鱼阶段在鱼类生活史中,由于其对环境因子和外界压力比较敏感,属于死亡率最高的阶段[9]。由于受到自身生理因素和环境因子的共同作用, 早期鱼类的各关键器官在形态学、生理学等方面都会经历显著的变化[26]。仔、稚鱼在不同的发育阶段对环境压力的响应有差别,仔鱼从孵化后至卵黄囊消失,营养方式由内源性营养向外源性营养转变期间,要求摄食和呼吸能力尽快提高,头部器官表现为正异速生长;进入外源性营养仔鱼期和稚鱼期后,逃避敌害和捕食能力需要加强,这时运动器官的快速生长满足了这一需求。
拉萨裂腹鱼主要分布在青藏高原雅鲁藏布江流域,该区域的地层皱褶断裂、水系不通导致了鱼类的地理隔离和生殖隔离,物种的分化明显。同时,该地区空气干燥稀薄,有较强太阳的辐射,全年的气温均较低,昼夜温差比较大,流域内生境贫瘠,水源主要为雪山融水,地表径流所带入的营养物质少,不适宜浮游生物的生长繁殖,同时自然繁育季节水温低,饵料生物贫乏等对鱼类的形态和生理代谢等都有深远的影响[27]。拉萨裂腹鱼仔、稚鱼全长由慢速生长到快速生长的转折点为28日龄,其多数外部器官均具有异速生长特点。眼径出现生长拐点最早,发育最快,提高了早期仔鱼在开口期摄食和躲避敌害的能力;吻长的拐点出现较晚,保持了较高速的生长,以适应不同阶段的饵料环境;胸鳍的拐点出现较早,在拐点前生长速度非常快(b=3.95),有利于早日平游,背鳍、臀鳍、腹鳍和尾鳍生长拐点出现较晚,其中臀鳍和腹鳍长在拐点前后相对全长均呈现正异速生长,各鳍的正异速生长有助于仔鱼在早期强化游泳能力、摄食和逃避敌害。拉萨裂腹鱼仔鱼的异速生长模式,保证了呼吸、摄食、消化、游泳等各重要功能器官的充分发育,以适应多变的环境,有效地保障了其早期的生存,可为育苗生产和野生早期资源的保护提供技术支撑。
| [1] |
SNIK G M J V, BOOGAART J G M, OSSE J W M. Larval growth patterns in Cyprinus carpio and Clarias gariepinus with attention to the finfold[J]. Journal of Fish Biology, 1997, 50(6): 1339-1352. |
| [2] |
OSSE J W M, BOOGAART J G M V. Fish larvae, development, allometric growth and the aquatic environment[J]. ICES Mar Sci Symp, 1995(201): 21-34. |
| [3] |
伍献文. 中国鲤科鱼类志(上卷)[M]. 上海: 上海科学技术出版社, 1964. WU X W. Annals of Cyprinidae in China (Volume I)[M]. Shanghai: Shanghai Science and Technology Press, 1964. |
| [4] |
刘海平, 牟振波, 蔡斌, 等. 供给侧改革与科技创新耦合助推西藏渔业资源养护[J]. 湖泊科学, 2018, 30(1): 266-278. LIU H P, MU Z B, CAI B, et al. Coupling supply-side structure reform and technological innovation boosting the fishery resource conservation process in Tibet[J]. J Lake Sci, 2018, 30(1): 266-278. |
| [5] |
曹文宣. 珠穆朗玛峰地区鱼类, 珠穆朗玛峰地区科学考察报告(生物与高原生理)[M]. 北京: 科学出版社, 1974. CAO W X. Fish in Mt. Everest and scientific investigation report on Mt. Everest (biology and plateau physiology)[M]. Beijing: Science Press, 1974. |
| [6] |
郝汉舟.拉萨裂腹鱼的年龄和生长研究[D].武汉: 华中农业大学, 2005. HAO H Z. Age and growth of Lasa Schizothorax [D]. Wuhan: Huazhong Agricultural University, 2005. |
| [7] |
强季.六种裂腹鱼类摄食消化器官及食性的研究[D].武汉: 华中农业大学, 2008: 1-54. QIANG J. Study on the digestive organs and feeding habits of six Schizothorax species[D]. Wuhan: Huazhong Agricultural University, 2008: 1-54. |
| [8] |
CHOO C K, LIEW H C. Morphological development and allometric growth patterns in the juvenile seahorse Hippocampus kuda Bleeker[J]. J Fish Biol, 2006, 69(2): 426-445. DOI:10.1111/j.1095-8649.2006.01105.x |
| [9] |
殷名称. 鱼类早期生活史研究与其进展[J]. 水产学报, 1991, 15(4): 348-358. YIN M C. Research and development of fish early life history[J]. Journal Fisheries of China, 1991, 15(4): 348-358. |
| [10] |
席丹, 张秀梅, 吕红健, 等. 许氏平鲉早期异速生长模式的研究[J]. 中国海洋大学学报(自然科学版), 2014, 44(12): 28-34. XI D, ZHANG X L, LYU H J, et al. Study on the early allometric growth model of Sebastes schlegeli[J]. Periodical of Ocean University of China, 2014, 44(12): 28-34. |
| [11] |
何勇凤, 吴兴兵, 朱永久, 等. 鲈鲤仔鱼的异速生长模式[J]. 动物学杂志, 2013, 48(1): 8-15. HE Y F, WU X B, ZHU Y J, et al. Allometric growth pattern of Percocypris pingi pingi larvae[J]. Chinese Journal of Zoology, 2013, 48(1): 8-15. |
| [12] |
陈方灿, 李新辉, 李捷, 等. 珠江肇庆江段赤眼鳟开口后仔、稚鱼的异速生长分析[J]. 广东农业科学, 2015, 42(3): 103-109. CHEN F C, LI X H, LI J, et al. Allometric growth of Spualiobarbus curriculus larvae and juveniIles in Zhaoqing reach of Pearl River[J]. Guangdong Agricultural Science, 2015, 42(3): 103-109. DOI:10.3969/j.issn.1004-874X.2015.03.023 |
| [13] |
程大川, 马振华, 江世贵. 红鳍笛鲷仔、稚鱼异速生长[J]. 水生生物学报, 2017, 41(1): 206-213. CHENG D C, MA Z H, JIANG S G. Allometric growth in larval and juvenile Crimson snapper[J]. Acta Hydrobiologica Sinica, 2017, 41(1): 206-213. |
| [14] |
刘亚娟, 程大川, 周胜杰, 等. 尖吻鲈仔、稚鱼异速生长研究[J]. 海洋渔业, 2018, 40(2): 179-188. LIU Y J, CHENG D C, ZHOU S J, et al. Allometric growth in larval and juvenile Lates calcarifer[J]. Marine Fisheries, 2018, 40(2): 179-188. DOI:10.3969/j.issn.1004-2490.2018.02.007 |
| [15] |
杨其彬, 马振华, 程大川, 等. 卵形鲳鲹仔稚鱼异速生长的研究[J]. 水产科学, 2017, 36(3): 259-266. YANG Q B, MA Z H, CHENG D C. Allometric growth in larva and juvenile Golden pompano Trachinotus ovatus[J]. Fisheries science, 2017, 36(3): 259-266. |
| [16] |
王雨福, 肖志忠, 刘清华, 等. 斑石鲷早期发育的异速生长模式[J]. 海洋科学, 2016, 40(5): 43-48. WANG Y F, XIAO Z Z, LIU Q H, et al. Allometric growth pattern during early ontogeny of spotted knifejaw (Oplegnathus punctatus)[J]. Marine Sciences, 2016, 40(5): 43-48. |
| [17] |
何滔, 肖志忠, 刘清华, 等. 条石鲷早期发育阶段的生长模式[J]. 水产学报, 2012, 36(8): 1242-1248. HE T, XIAO Z Z, LIU Q H, et al. Allometric growth in rock bream larvae[J]. Journal Fisheries of China, 2012, 36(8): 1242-1248. |
| [18] |
吴水清, 李加儿, 区又君, 等. 斜带石斑鱼(♀)×鞍带石斑鱼(♂)杂交子代仔、稚鱼的异速生长[J]. 中国水产科学, 2014, 21(3): 503-510. WU S Q, LI J E, QU Y J. Allometric growth of hybrid grouper (Epinephelus coioides ♀×E. lanceolatus ♂) larvae and juveniles[J]. Journal of Fishery Sciences of China, 2014, 21(3): 503-510. |
| [19] |
马境, 章龙珍, 庄平, 等. 施氏鲟仔鱼发育及异速生长模型[J]. 应用生态学报, 2007, 18(12): 2875-2882. MA J, ZHANG L Z, ZHUANG P, et al. Development and allometric growth patterns of larval Acipenser schrenckii[J]. Chinese journal of Applied Ecology, 2007, 18(12): 2875-2882. |
| [20] |
宋洪建, 刘伟, 王继隆, 等. 大麻哈鱼卵黄囊期仔鱼异速生长及其生态学意义[J]. 水生生物学报, 2013, 37(2): 329-335. SONG H J, LIU W, WANG J L. Allometric growth during yolk-sac larvae of Chum salmon and consequent ecological signifiance[J]. Acta Hydrobilogica Sinica, 2013, 37(2): 329-335. |
| [21] |
刘立明, 姜海滨, 王茂剑, 等. 黑鲪仔、稚、幼鱼生长、发育与成活率变化的研究[J]. 中国海洋大学学报(自然科学版), 2013, 43(3): 25-31. LIU L M, JIANG H B, WANG M J, et al. Study on the growth, development and survival rate of larval, juvenile and young Sebastodes fuscescens[J]. Periodical of Ocean University of China, 2013, 43(3): 25-31. |
| [22] |
单秀娟, 窦硕增. 鮸鱼(Miichthys miiuy)仔、稚鱼发育生长方式及其生态学意义[J]. 海洋与湖沼, 2009, 40(6): 714-719. SHAN X J, DOU S Z. Allometric growth of croaker Miichthys miiuy larvae and juveniles and its ecological implication[J]. Oceanologia et Limnologia Sinica, 2009, 40(6): 714-719. DOI:10.3321/j.issn:0029-814X.2009.06.007 |
| [23] |
庄平, 宋超, 章龙珍, 等. 全人工繁殖西伯利亚鲟仔稚鱼发育的异速生长[J]. 生态学杂志, 2009, 28(4): 681-687. ZHUANG P, SONG C, ZHANG L Z, et al. Allometric growth of artificial bred Siberian sturgeon Acipenser baeri larvae and juveniles[J]. Chinese Journal of Ecology, 2009, 28(4): 681-687. |
| [24] |
李军, 韩英伦, 徐磊, 等. 日本七鳃鳗胚胎发育及卵黄囊期仔鱼的异速生长[J]. 水生生物学报, 2017, 41(6): 1207-1217. LI J, HAN Y L, XU L, et al. Embryological stages and allometric growth during yolksac larvae of Lampetra japonica[J]. Acta Hydrobiologica Sinica, 2017, 41(6): 1207-1217. |
| [25] |
庄平, 李大鹏, 王明学, 等. 养殖密度对史氏鲟稚鱼生长的影响[J]. 应用生态学报, 2002, 13(6): 735-738. ZHUANG P, LI D P, WANG X M, et al. Effect of stocking density on growth of juvenile Acipenser schrenckii[J]. Chinese journal of applied ecology, 2002, 13(6): 735-738. DOI:10.3321/j.issn:1001-9332.2002.06.022 |
| [26] |
GLUCKMANN I, HURIAUX F, FOCANT B, et al. Postembryonic development of the cephalic skeleton in Dicentrarchus labrax(Pisces, Perciformes, Serranidae)[J]. Bulletin of Marine Science, 1999, 65(1): 11-36. |
| [27] |
谢从新, 霍斌, 魏开建, 等. 雅鲁藏布江中游裂腹鱼类生物学与资源保护[M]. 北京: 科学出版社, 2019. XIE C X, HUO B, WEI K J, et al. Biology and resource conservation of Schizothorax in the middle reaches of the Yarlung Zangbo River[M]. Beijing: Science Press, 2019. |
2. College of Fishery, Huazhong Agriculture University, Wuhan 430070, Hubei, China
 2021,
Vol. 30
2021,
Vol. 30


