2. 青岛海洋科学与技术国家实验室海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266071;
3. 大洋渔业资源可持续开发省部共建教育部重点实验室, 上海 201306;
4. 国家远洋渔业工程技术研究中心, 上海 201306;
5. 农业农村部大洋渔业开发重点实验室, 上海 201306;
6. 农业农村部大洋渔业资源环境科学观测实验站, 上海 201306
鸢乌贼(Sthenoteuthis oualaniensis)是广泛分布于热带和亚热带海域的经济头足类, 具有生长速度快和资源量丰富的特性[1]。鸢乌贼属于大洋性柔鱼类, 是海洋生态系统中的重要生态物种, 在物质交换与能量流动中扮演着重要的角色[1-2]。同时, 鸢乌贼是重要的海洋经济种类, 在海洋渔业中处于重要位置[3]。在我国南海, 鸢乌贼年可捕量大[4], 已经成为重点捕捞的渔业对象之一, 其作业渔具主要为渔法简便且易操作的灯光罩网[5]。根据形态学特征[6-7]和种群遗传结构[8]分析, 南海鸢乌贼可划分为中型群和微型群两个群体, 前者体型较大、背部有发光器, 后者体型小、背部无发光器。相较于中型群, 微型群个体生命周期较短、生长速度更快[9], 所处的营养生态位较低、营养层级的宽度较小[10]。
能量积累及其生殖投入分配是自然生物个体繁殖策略的重要组成部分, 有效地协调能量积累与投入分配是生物个体获得最优繁殖适合度的一种选择适应性过程[11]。类似于其他异养生物, 头足类的能量积累来源于食物的消化与吸收, 所积累能量供给个体的生长、性腺发育和常规新陈代谢等[11]。然而, 头足类为终生一次繁殖产卵, 其性腺发育所需要的能量投入大[1], 个体如何平衡摄取能量在各组织之间或者各项生命活动之间的投入分配是一项重要研究内容[12]。通常, 生物个体的生殖投入是生长与繁衍活动的博弈过程[13]。目前, 鸢乌贼基础生物学及其繁殖策略方面的研究多集中于印度洋海域[14-16], 针对南海鸢乌贼群体繁殖策略的研究相对较少, 尤其缺乏对其能量积累及其生殖投入分配的认知。为此, 开展鸢乌贼能量积累与分配的研究可以明确该群体的能量投入策略, 丰富鸢乌贼繁殖生物学研究, 为其所处食物网的能量流动过程研究积累资料。鸢乌贼微型群是南海鸢乌贼的重要组成群体, 本研究通过测定微型群个体不同组织的能量密度, 分析不同性腺发育时期肌肉和性腺等组织的能量积累过程, 初步量化该型群个体的能量积累及其组织间的投入分配, 以期探讨其生殖投入策略, 为深入认识该种类的渔业生物学提供参考, 并为可持续开发利用南海鸢乌贼种类资源提供科学基础。
1 材料与方法 1.1 材料来源鸢乌贼样本采自南海海域灯光罩网船的作业渔获物, 采集时间为2017年4—6月, 采集海域为111°15'36″E ~115°52'12″E和9°11'16.8″N ~11°22'55.2″N。根据体型大小、胴体背部有无发光器[6-7], 初步划分鸢乌贼样本为中型群和微型群, 随后分开收纳并置于-20 ℃环境下冷冻保存。
1.2 生物学测定鸢乌贼样本于实验室室温下解冻后, 再次比对样本体型大小、观察胴体背部是否有发光器, 确定筛选出微型群样本, 并进行生物学数据测定。实验样本解剖鉴定性别, 依据阿根廷滑柔鱼性腺发育判定标准[17], 结合实验观察, 将鸢乌贼微型群个体划分为Ⅰ~Ⅷ期。其中:Ⅰ期和Ⅱ期性腺发育程度较低, 为性腺发育前期; Ⅲ期卵巢中可见成熟卵子, 为生理性发育期; Ⅳ~Ⅵ期为性腺成熟期, 卵巢中卵母细胞进一步发育, 输卵管可见成熟卵子; Ⅶ期为排卵繁殖期; Ⅷ期为繁殖后期。生物学数据测定包括, 胴长(mantle length, ML, 精确至1 mm)、体质量(body mass, BM, 精确至0.1 g), 以及胴体(mantle)、尾鳍(fin)、足腕(arms)等肌肉组织质量和卵巢(ovary)、缠卵腺(nidamental gland)、输卵管复合体(oviducal complex)、精巢(Testis)、精荚复合体(spermatophoric complex)等性腺组织质量。肌肉组织质量和性腺组织质量测定精确至0.001 g。
研究共测定微型群雌性个体51尾, 其中Ⅰ期样本8尾、Ⅱ期样本9尾、Ⅲ期样本11尾、Ⅳ期样本4尾、Ⅴ期样本12尾和Ⅵ期样本7尾; 微型群雄性个体62尾, 其中Ⅰ期样本5尾、Ⅱ期样本5尾、Ⅲ期样本5尾、Ⅳ期样本11尾、Ⅴ期样本15尾、Ⅵ期样本11尾和Ⅶ期样本10尾。
1.3 组织能量密度测定采集的胴体、足腕和尾鳍等肌肉组织, 雌性个体的卵巢、缠卵腺和输卵管复合体, 雄性个体的精巢和精荚复合体等性腺组织, 称取湿质量后置于Christ Alpha 1-4/LD plus干燥机中干燥至质量恒定(精确至0.001 g), 干燥样品置于Retsch MM400研磨机中研磨粉碎, 随后使用氧弹热量仪(Calorimeter Parr6100, Parr Instrument Company, Moline, IL, USA)测定组织能量密度(energy density, Ed, 单位kJ/g)。每个肌肉组织、性腺组织的能量密度均单独测定。在性腺发育前期, 雌性个体的缠卵腺、输卵管复合体, 雄性个体的精荚复合体等性腺组织偏小, 没有达到氧弹热量仪对组织能量密度测定的分量要求(≈0.5 g); 因此, 本研究只测定了Ⅲ~Ⅵ期卵巢组织的能量密度、Ⅳ~Ⅵ期缠卵腺、输卵管复合体的组织能量密度、Ⅱ~Ⅶ期精荚复合体的组织能量密度。
1.4 统计分析组织能量积累(tissue energy accumulation, Ea)和相对组织能量积累(relative tissue energy accumulation, Re)通过以下公式[18-19]进行计算:
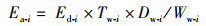 (1)
(1)
 (2)
(2)
式中:Ea-i为某组织能量积累, kJ; Ed-i为某组织能量密度, kJ/g; Tw-i为某组织的总湿质量, g; Dw-i为某组织能量密度测定样品冷冻干燥后的干质量, g; Ww-i为某组织能量密度测定样品冷冻干燥前的湿质量, g; Re-i为某组织相对能量积累, %; TE-i为实验样本个体的总能量积累(total energy, 单位kJ), 计算为实验样本个体胴体、足腕、尾鳍, 以及性腺组织等组织能量积累之和, kJ; i指代胴体、足腕、尾鳍、卵巢、缠卵腺、输卵管复合体、精巢或者精荚复合体等组织。
利用Model Ⅱ线性回归方法[20], 分别进行胴体、尾鳍、足腕、全体性腺组织(雌性为卵巢、缠卵腺、输卵管复合体, 雄性为精巢、精荚复合体)的组织能量积累与个体胴长的线性回归分析, 随后根据回归参数计算每个组织能量积累的残差值并求取标准化残差值。标准化残差值代表个体组织质量特征, 正值时表征组织的质量状况较好, 负值时表征质量状况较差[21]。同时, 进行每个肌肉组织能量积累的标准化残差值与性腺组织能量积累的标准化残差值之间的相关性分析, 探讨肌肉组织与性腺组织之间是否存在能量流动[22], 正相关关系表征两种组织之间无能量流动, 负相关关系则表征两种组织之间存在能量交流。
1.5 数据处理数据分析处理均在SPSS 20.0、Excel 2007和R平台中实现, 实验数据以平均值±标准差(Mean±SD)表示。利用单因素方差分析(ANOVA)检验每个组织的组织能量密度、组织能量积累、组织质量特征等在不同性腺发育时期的差异性, 并利用Tukey HSD检验进行差异性的比较分析; 利用Pearson相关性方法进行每个肌肉组织质量特征与性腺组织质量特征的相关性分析。统计学显著性水平为P < 0.05。
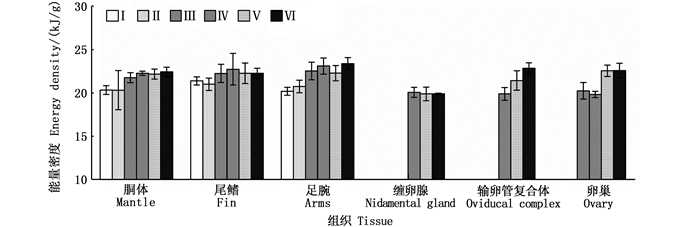
2 结果与分析 2.1 组织能量密度分析显示:微型群雌性个体胴体、尾鳍、足腕、缠卵腺、输卵管复合体和卵巢等的组织能量密度值分别为(21.53±1.38)、(21.96±1.14)、(21.97±1.38)、(19.94±0.62)、(21.61±1.37)、(21.51±1.44) kJ/g; 组织能量密度值以足腕为最大, 其次为尾鳍、输卵管复合体、胴体、卵巢, 以缠卵腺为最小(F=9.15, P < 0.01)。随着性腺的发育, 胴体、尾鳍、足腕、输卵管复合体和卵巢的组织能量密度增长显著(胴体, F=5.90, P < 0.01;尾鳍, F=2.82, P < 0.05;足腕, F=16.72, P < 0.01;输卵管复合体, F=11.18, P < 0.01;卵巢, F=24.66, P < 0.01), 缠卵腺的组织能量密度则稳定(F=0.12, P > 0.05)。见图 1。
|
图 1 不同性腺成熟度鸢乌贼微型群雌性个体肌肉组织和性腺组织的能量密度 Fig. 1 Energy density of somatic and reproductive tissues in female individuals of dwarf form of S. oualaniensis according to different maturity stages |
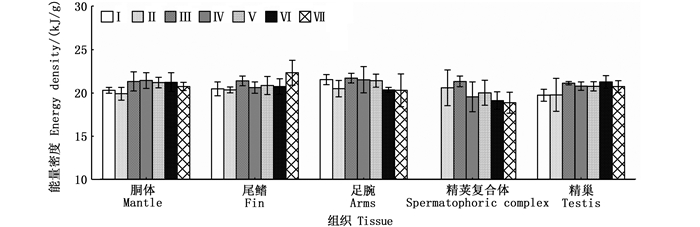
相比较于雌性, 雄性个体胴体、尾鳍、足腕、精荚复合体、精巢等的组织能量密度值较小, 分别为(20.96±0.92)、(20.95±1.14)、(20.98±1.25)、(19.67±5.57)和(20.67±0.91)kJ/g。其中, 组织能量密度值以足腕为最大, 其次为胴体、尾鳍、精巢, 以精荚复合体为最小(F=12.89, P < 0.01)。随着性腺的发育, 各组织的组织能量密度值均存在显著性差异(胴体, F=2.96, P < 0.05;尾鳍, F=4.06, P < 0.05;足腕, F=2.35, P < 0.05;精荚复合体, F=2.71, P < 0.05;精巢, F=3.29, P < 0.05)。其中, 精荚复合体和精巢的组织能量密度随着性腺的发育分别呈现降低和升高的趋势。见图 2。
|
图 2 不同性腺成熟度鸢乌贼微型群雄性个体肌肉组织和性腺组织的能量密度 Fig. 2 Energy density of somatic and reproductive tissues in male individuals of dwarf form of S. oualaniensis according to different maturity stages |
分析显示, 微型群雌性个体每个组织的能量积累均高于雄性。雌性个体的肌肉组织总能量为(60.16~219.49)kJ, 其中胴体、尾鳍和足腕的组织能量积累分别为(43.82~144.24)、(3.85~24.25)和(9.78~55.87)kJ; 性腺组织总能量为(0.58~41.99)kJ, 其中缠卵腺、输卵管复合体和卵巢的组织能量积累分别为(0.71~9.13)、(0.49~9.76)、(0.58~23.97)kJ。微型群雄性个体肌肉组织的总能量为(22.26~79.87)kJ, 胴体、尾鳍和足腕的组织能量积累分别为(15.82~53.35)、(1.43~9.03)和(5.00~20.77)kJ; 性腺组织的总能量为(0.35~3.53)kJ, 精荚复合体和精巢的总能量分别为(0.19~1.94)和(0.35~1.99)kJ。
在性腺成熟度Ⅰ~Ⅵ期, 雌性个体肌肉和性腺组织的能量持续增加积累(图 3)。肌肉组织能量积累在每级性腺成熟度之间存在显著性差异(胴体, F=13.40, P < 0.01;尾鳍, F=19.97, P < 0.01;足腕, F=17.82, P < 0.01)。各肌肉组织在Ⅰ~Ⅴ期时能量积累相对平缓, 至Ⅴ~Ⅵ期时能量积累增加显著(P < 0.05)。性腺组织能量积累随着性腺发育显著增加(缠卵腺, F=10.19, P=0.01;输卵管复合体, F=9.54, P=0.01;卵巢, F=39.84, P < 0.01);Tukey HSD检验显示, 缠卵腺和输卵管复合体在Ⅳ~Ⅴ期与Ⅵ期之间存在显著性差异(P < 0.01), 卵巢在Ⅲ期与Ⅴ期间、Ⅰ~Ⅴ期与Ⅵ期间存在显著性差异(P < 0.01)。

|
图 3 不同性腺成熟度鸢乌贼微型群雌性个体肌肉组织和性腺组织的能量积累 Fig. 3 Tissue energy accumulation of somatic and reproductive tissues in female individuals of dwarf form of S. oualaniensis according to different maturity stages |
与雌性个体相似, 雄性个体肌肉和性腺组织的能量积累亦随着性腺发育(Ⅰ~Ⅶ期)不断增加(图 4), 每个组织的能量积累随着性腺发育变化显著(胴体, F=16.29, P < 0.01;尾鳍, F=20.94, P < 0.01;足腕, F=6.76, P < 0.01;精荚复合体, F=15.50, P < 0.01;精巢, F=25.94, P < 0.01)。其中, 足腕和精巢的组织能量积累在Ⅵ~Ⅶ期呈现降低趋势, 尾鳍的组织能量积累的增长趋势较为平缓。

|
图 4 不同性腺成熟度鸢乌贼微型群雄性个体肌肉组织和性腺组织的能量积累 Fig. 4 Energy accumulation of somatic and reproductive tissues in male individuals of dwarf form of S. oualaniensis according to different maturity stages |
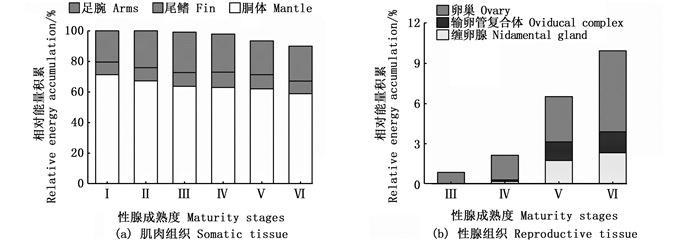
在同一性腺成熟度等级下, 微型群个体肌肉组织的相对组织能量积累较高, 性腺组织的相对组织能量积累相对较低(图 5和6)。其中:雌性个体肌肉组织Ⅰ~Ⅵ期的相对组织能量积累为90.06%~100.00%, 性腺组织Ⅲ~Ⅵ期的相对组织能量积累为0.86%~9.94%;雄性个体Ⅰ~Ⅶ期肌肉组织和性腺组织的相对组织能量积累分别为95.21%~98.45%和1.55%~4.79%。
|
图 5 不同性腺成熟度鸢乌贼微型群雌性个体肌肉组织和性腺组织的相对组织能量积累 Fig. 5 Relative energy accumulation of somatic and reproductive tissues in female individuals of dwarf forms of S. oualaniensis according to different maturity stages |
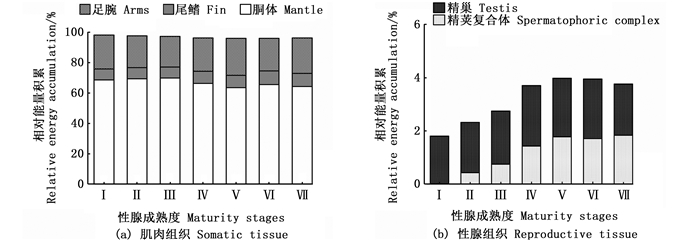
|
图 6 不同性腺成熟度鸢乌贼微型群雄性个体肌肉组织和性腺组织的相对组织能量积累 Fig. 6 Relative energy accumulation of somatic and reproductive tissues in male individuals of dwarf form of S. oualaniensis according to different maturity stages |
在性腺成熟度Ⅰ~Ⅵ期, 雌性个体肌肉组织的相对组织能量积累逐步下降, 性腺组织的相对组织能量积累逐步增加。其中, 肌肉组织中以胴体相对组织能量积累下降最为明显, 性腺组织中以卵巢相对组织能量积累增加最大, 见图 5。雄性个体肌肉组织的相对组织能量积累在性腺成熟度Ⅰ~Ⅶ期呈先下降后上升趋势, 性腺组织的相对组织能量积累变化趋势则与之相反, 两者在Ⅴ期分别达到最小值和最大值, 随后均在Ⅵ~Ⅶ期处于相对稳定的状态。同时, 肌肉组织中以胴体的相对组织能量积累下降最为明显, 性腺组织中以精荚复合体的相对组织能量积累增加最大, 见图 6。
2.4 组织能量分配微型群雌性和雄性个体每个肌肉组织、性腺组织能量积累与胴长呈显著的线性相关关系(P < 0.01), 相关系数R2均大于0.3, 并且雌性个体每个组织能量积累与胴长的相关性均高于雄性个体, 见表 1。

|
表 1 鸢乌贼微型群雌雄个体肌肉和性腺的组织能量积累与胴长的Model Ⅱ回归参数表 Tab.1 Model Ⅱ regression results of energy accumulation of somatic and reproductive tissues regressed on mantle length for both female and male individuals of dwarf form of S. oualaniensis |
组织能量积累与胴长关系的标准化残差值分析显示:雌性个体胴体在Ⅰ期、Ⅱ期、Ⅴ期和Ⅵ期时的质量特征良好; 尾鳍组织在Ⅳ~Ⅵ期时质量特征良好, 足腕组织在Ⅱ期、Ⅲ期和Ⅵ期时质量特征良好, 性腺组织在Ⅰ期、Ⅴ期和Ⅵ期时质量特征良好; 雄性个体胴体在Ⅳ期、Ⅵ期和Ⅶ期时质量特征良好, 尾鳍组织在Ⅵ~Ⅶ期时质量特征良好, 足腕组织在Ⅳ~Ⅶ期时质量特征良好, 性腺组织在Ⅳ~Ⅶ期时质量特征良好。随着性腺发育, 雌性个体性腺组织的质量特征变化显著(F=3.67, P < 0.01), Ⅱ~Ⅲ期时质量特征较差, Ⅵ期时质量特征显著改善(P < 0.05)。雄性个体尾鳍和性腺的质量特征随着性腺发育显著变化(性腺, F=6.64, P < 0.01;尾鳍, F=4.78, P < 0.01), 均呈现改善的趋势。
相关性分析显示:雌性个体肌肉组织与性腺组织之间的标准化残差值均呈显著的正相关关系(Pearson相关性:Ema-ML residuals与Ere-ML residuals, R2=0.55, P < 0.01;Efin-ML residuals与Ere-ML residuals, R2=0.64, P < 0.01;Earm-ML residuals与Ere-ML residuals, R2=0.49, P < 0.01), 见图 7a; 雄性个体肌肉组织与性腺组织之间的标准化残差值亦均呈显著的正相关关系(Pearson相关性:Ema-ML residuals与Ere-ML residuals, R2=0.42, P < 0.01;Efin-ML residuals与Ere-ML residuals, R2=0.57, P < 0.01;Earm-ML residuals与Ere-ML residuals, R2=0.41, P < 0.01), 见图 7b。结果表明, 微型群雌性个体肌肉组织与性腺组织之间均不存在能量的交流。

|
图 7 鸢乌贼微型群雌性(a)和雄性(b)个体肌肉组织能量-胴长残差与和性腺组织能量-胴长残差的关系 Fig. 7 Relationships between residuals of somatic tissue energy regressed on mantle length and residuals of gonadal tissue energy on mantle length for female (a) and male (b) individuals of dwarf form of S. oualaniensis |
在海洋生态系统中, 能量密度体现了鱼体自身的发育状况和对环境变化的适应性特征, 可以反映鱼体中的能量储备水平、营养及生长状况[23-25]。研究表明, 在不同性腺成熟度下, 南海鸢乌贼微型群个体肌肉组织和性腺组织(除缠卵腺外)的组织能量密度存在显著性差异。肌肉组织能量密度的变化可解释为鸢乌贼微型群个体生长发育过程中栖息环境及其生理状态的改变所致, 这是因为鱼体肌肉组织能量密度受制于水域环境和自身生理状态等因素的影响和调节[26-27], 诸如食物丰度、栖息水温和生理活动等因素[28-29]。性腺组织能量密度的变动则多与这些组织发育过程中物质组成的变化密切相关。比如, 卵巢在发育过程中不断发育产生卵母细胞, 随之卵黄、脂肪等营养物质含量发生变动导致组织能量密度变化[30-31]。在鱼类的研究中, 也发现性腺发育等繁殖活动是影响组织能量密度变动的重要因素[32]。
同时, 鸢乌贼微型群个体性腺的组织能量积累滞后于肌肉的组织能量积累, 这可能是头足类性腺发育滞后于个体生长的生活史策略所致[1]。通常, 在生长发育前期, 头足类个体主要以体细胞的生长为主, 性腺的发育相对缓慢, 此时摄食能量更多地投入用于肌肉组织生长; 在生长发育后期, 性腺组织发育迅速, 此时摄食能量甚至肌肉组织存贮的能量将投入性腺组织生长发育, 性腺组织能量积累随之增加[2]。再则, 生长发育过程中海洋环境的波动变化和饵料丰度的变化等均影响着肌肉组织和性腺组织的能量积累[11], 并一定地延滞摄入能量对性腺发育的投入分配[33]。然而, 鸢乌贼微型群个体是否亦存在摄入能量随外界环境波动和饵料丰度等而延滞生殖投入, 仍需后续实验研究的佐证。
此外, 头足类生命周期短、生长速率快, 不同种类的繁殖策略具有特殊性[2], 进而引起不同组织之间能量积累及其投入分配的差异性[33-34]。随着性腺发育, 南海鸢乌贼微型群肌肉组织和性腺组织持续积累能量, 并且两个组织之间与胴长关系的标准化残差值呈显著的正相关关系, 表明两组织之间没有显著的能量交流迹象[22]。研究结果与HARMAN等[14]的研究结果相一致, 并一定地佐证了鸢乌贼为多次产卵者, 产卵期间保持体细胞活性以完成多次产卵活动[14, 35]。同时, 研究结果与鸢乌贼中型群雄性个体的肌肉组织和性腺组织的组织能量积累情况相一致[36], 生殖投入来源倾向于外源性投入。
3.2 组织能量积累的雌雄差异性研究发现, 鸢乌贼微型群雌雄个体在总的生殖能量积累和每个性腺发育时期的能量分配上均存在差异, 表明雌雄个体在组织能量积累及其生殖分配上具有差异性。在大洋性头足类中, 相较于雄性个体, 雌性个体在繁殖活动中起着主导作用[37], 负责交配后的配子授精、卵团生成、并寻找适宜场所排放卵团等活动[38]。同时, 雌性个体具有纳精囊或在鳃基部存储精荚[1-2], 授精、排卵活动的持续时间相对较长, 往往可持续1~2个月[39], 产卵方式也因卵巢卵母细胞的成熟模式不同而形式多样[35]。这些繁殖活动使得雌性个体需要更多的能量积累及其生殖投入[31-32]。既有研究已经表明:鸢乌贼是典型的雌雄二态型头足类[1], 雄性个体体型小, 雌性个体体型可达雄性个体的二倍[14, 40]; 雌性亲体的繁殖力大, 在鳃基部存储精荚[1-2], 产卵期间进行多次排卵活动且保持摄食和能量积累[14]。因此, 鸢乌贼雌、雄性个体组织能量积累及其生殖分配的差异性是雌、雄性个体在生长发育及其繁殖过程中的角色作用不同所致, 并与雌性个体多次产卵策略相关[14]。这种差异性也较为普遍地存在于其它大洋性头足类中, 如茎柔鱼(Dosidicus gigas)[41]和阿根廷滑柔鱼(Illex argentinus)[42-43]等, 也表明大洋性头足类组织能量积累及其生殖投入分配存在一定的共性。
综上所述, 鸢乌贼微型群的肌肉组织能量积累在性腺发育后期继续增长, 生殖投入倾向于外源性, 即性腺发育的能量直接来源于食物摄取及其能量转化[14, 35]。这种能量积累及生殖投入分配模式可能是鸢乌贼生长发育贯穿于整个生命周期的生活史策略所致, 持续的能量积累和外源性的生殖投入既为繁殖活动提供了必需的能量, 也为其他生命活动的正常进行提供了保障。值得注意的是, 鸢乌贼的群体结构复杂, 不同型群具有不同的生命周期[1], 在组织能量积累及其生殖投入分配上也可能存在型群特殊性。因此, 今后需要增加补充其他型群个体在能量积累方面的研究, 以丰富对该种类基础生物学尤其是繁殖生物学的认知, 也为可持续开发该种类资源[44]提供生物学基础。
| [1] |
JEREB P, ROPER C F E. Cephalopods of the world:an annotated and illustrated catalogue of cephalopod species known to date. Volume 2. Myopsid and Oegopsid Squids[M]. Rome:FAO, 2010:269-318.
|
| [2] |
BOYLE P, RODHOUSE P G. Cephalopods:ecology and fisheries[M]. Oxford, UK: Wiley-Blackwell, 2005: 205-258.
|
| [3] |
HEDGEPETH J B. Annotated references to techniques capable of assessing the roles of cephalods in the eastern tropical Pacific Ocean, with emphasis on pelagic squids[M]. La Jolla, California: National Marine Fisheries Service, Southwest Fisheries Center, 1983: 1-74.
|
| [4] |
CHEN G B, ZHANG J, YU J, et al. Hydroacoustic scattering characteristics and biomass assessment of the purpleback flying squid[Sthenoteuthis oualaniensis, (Lesson, 1830)] from the deepwater area of the south China Sea[J]. Journal of Applied Ichthyology, 2013, 29(6): 1447-1452. DOI:10.1111/jai.12360 |
| [5] |
张鹏, 杨吝, 张旭丰, 等. 南海金枪鱼和鸢乌贼资源开发现状及前景[J]. 南方水产, 2010, 6(1): 68-74. ZHANG P, YANG L, ZHANG X F, et al. The present status and prospect on exploitotion of tuna and squid fishery resources in south China Sea[J]. South China Fisheries Science, 2010, 6(1): 68-74. |
| [6] |
ZUYEV G, NIGMATULLIN C, CHESALIN M, et al. Main results of long-term worldwide studies on tropical nektonic oceanic squid genus Sthenoteuthis: an overview of the Soviet investigations[J]. Bulletin of Marine Science, 2002, 71(2): 1019-1060. |
| [7] |
朱凯, 王雪辉, 张鹏, 等. 南海南部鸢乌贼中型群与微型群形态学差异及其判别分析[J]. 热带海洋学报, 2016, 35(6): 82-88. ZHU K, WANG X H, ZHANG P, et al. A study on morphological variations and discrimination of medium and dwarf forms of purple flying squid Sthenoteuthis oualaniensis in the southern South China Sea[J]. Journal of Tropical Oceanography, 2016, 35(6): 82-88. |
| [8] |
李敏, 张鹏, 张俊, 等. 南海鸢乌贼的遗传差异:种群分化还是种间分化[J]. 中国水产科学, 2019, 26(1): 133-140. LI M, ZHANG P, ZHANG J, et al. Genetic differentiation of the purpleback flying squid, Sthenoteuthis oualaniensis, in the south China Sea:population or species divergence[J]. Journal of Fishery Sciences of China, 2019, 26(1): 133-140. |
| [9] |
招春旭, 陈昭澎, 何雄波, 等. 基于耳石微结构的南海春季鸢乌贼日龄、生长与种群结构的研究[J]. 水生生物学报, 2017, 41(4): 884-890. ZHAO C X, CHEN Z P, HE X B, et al. Age, growth and population structure of purple back flying squid, Sthenoteuthis oualaniensis in the south china sea in spring based on statolith microstructure[J]. Acta Hydrobiologica Sinica, 2017, 41(4): 884-890. |
| [10] |
黄佳兴, 龚玉艳, 徐姗楠, 等. 南海中西部海域鸢乌贼中型群和微型群的营养生态位[J]. 应用生态学报, 2019, 30(8): 2822-2828. HUANG J X, GONG Y Y, XU S N, et al. Trophic niche of medium-form and dwarf-form of purple flying squid Sthenoeuthis oualaniensis in the central and western south China Sea[J]. Chinese Journal of Applied Ecology, 2019, 30(8): 2822-2828. |
| [11] |
陈新军, 刘必林. 渔业资源生物学[M]. 北京: 科学出版社, 2017. CHEN X J, LIU B L. Fishery resources biology[M]. Beijing: Science Press, 2017. |
| [12] |
WELLS M J, CLARKE A. Energetics:the costs of living and reproducing for an individual Cephalopod[J]. Philosophical Transactions of the Royal Society of London. Series B:Biological Sciences, 1996, 351(1343): 1083-1104. DOI:10.1098/rstb.1996.0095 |
| [13] |
GILLOOLY J F, BAYLIS J R. Reproductive success and the energetic cost of parental care in male smallmouth bass[J]. Journal of Fish Biology, 1999, 54(3): 573-584. DOI:10.1111/j.1095-8649.1999.tb00636.x |
| [14] |
HARMAN R F, YOUNG R E, REID S B, et al. Evidence for multiple spawning in the tropical oceanic squid Stenoteuthis oualaniensis (Teuthoidea:Ommastrephidae)[J]. Marine Biology, 1989, 101(4): 513-519. DOI:10.1007/BF00541653 |
| [15] |
张鹏, 晏磊, 杨炳忠, 等. 春季南沙海域鸢乌贼种群结构特征的研究[J]. 南方水产科学, 2015, 11(5): 11-19. ZHANG P, YAN L, YANG B Z, et al. Population structure of purpleback flying squid (Sthenoteuthis oualaniensis) in Nansha area in spring[J]. South China Fisheries Science, 2015, 11(5): 11-19. |
| [16] |
CHEMBIAN A J. Studies on the biology, morphometrics and biochemical composition of the ommastrephid squid, Sthenoteuthis oualaniensis (Lesson, 1830) of the south west coast of India[D]. Kochi, Kerala, India: Cochin University of Science and Technology, 2013: 1-18.
|
| [17] |
林东明, 陈新军, 方舟. 西南大西洋阿根廷滑柔鱼夏季产卵种群繁殖生物学的初步研究[J]. 水产学报, 2014, 38(6): 843-852. LIN D M, CHEN X J, FANG Z. Preliminary study on reproductive biology of summer spawning stock of Illex argentinus in the southwestern Atlantic Ocean[J]. Journal of Fisheries of China, 2014, 38(6): 843-852. |
| [18] |
STEINHART G B, SANDRENE M E, WEAVER S, et al. Increased parental care cost for nest-guarding fish in a lake with hyperabundant nest predators[J]. Behavioral Ecology, 2005, 16(2): 427-434. |
| [19] |
VILLEGAS-RÍOS D, ALONSO-FERNÁNDEZ A, DOMÍNGUEZ-PETIT R, et al. Energy allocation and reproductive investment in a temperate protogynous hermaphrodite, the ballan wrasse Labrus bergylta[J]. Journal of Sea Research, 2014, 86: 76-85. DOI:10.1016/j.seares.2013.11.010 |
| [20] |
LEGENDRE P. Model Ⅱ regression user's guide, R edition[J]. Cran.R-Project.Org, 1998, 4: 1-14. |
| [21] |
STEVENSON R D, WOODS JR W A. Condition indices for conservation:new uses for evolving tools[J]. Integrative and Comparative Biology, 2006, 46(6): 1169-1190. DOI:10.1093/icb/icl052 |
| [22] |
JACKSON G D, SEMMENS J M, PHILLIPS K L, et al. Reproduction in the deepwater squid Moroteuthis ingens, what does it cost?[J]. Marine Biology, 2004, 145(5): 905-916. DOI:10.1007/s00227-004-1375-x |
| [23] |
崔奕波. 草鱼生物能量学研究进展[J]. 中国科学基金, 1989, 12(1): 9-13. CUI Y B. Progress in the study of bioenergetics of the grass carp[J]. Bulletin of National Natural Science Foundation of China, 1989, 12(1): 9-13. |
| [24] |
JONSSON N, JONSSON B. Body composition and energy allocation in life-history stages of brown trout[J]. Journal of Fish Biology, 1998, 53(6): 1306-1316. DOI:10.1111/j.1095-8649.1998.tb00250.x |
| [25] |
RIKARDSEN A H, ELLIOTT J M. Variations in juvenile growth, energy allocation and life-history strategies of two populations of Arctic charr in north Norway[J]. Journal of Fish Biology, 2000, 56(2): 328-346. DOI:10.1111/j.1095-8649.2000.tb02110.x |
| [26] |
ROSA R, COSTA P R, PEREIRA J, et al. Biochemical dynamics of spermatogenesis and oogenesis in Eledone cirrhosa and Eledone moschata (Cephalopoda:Octopoda)[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2004, 139(2): 299-310. DOI:10.1016/j.cbpc.2004.08.002 |
| [27] |
高晓兰, 蒋霞敏, 乐可鑫, 等. 野生虎斑乌贼不同组织营养成分分析及评价[J]. 动物营养学报, 2014, 26(12): 3858-3867. GAO X L, JIANG X M, LE K X, et al. Analysis and evaluation of nutritional components in different tissues of wild Sepia pharaonis[J]. Chinese Journal of Animal Nutrition, 2014, 26(12): 3858-3867. |
| [28] |
CUI Y, HUNG S S O, ZHU X. Effect of ration and body size on the energy budget of juvenile white sturgeon[J]. Journal of Fish Biology, 1996, 49(5): 863-876. DOI:10.1111/j.1095-8649.1996.tb00085.x |
| [29] |
BALLESTRAZZI R, LANARI D, D'AGARO E, et al. The effect of dietary protein level and source on growth, body composition, total ammonia and reactive phosphate excretion of growing sea bass (Dicentrarchus labrax)[J]. Aquaculture, 1994, 127(2/3): 197-206. |
| [30] |
CLARKE A, RODHOUSE P G, GORE D J. Biochemical composition in relation to the energetics of growth and sexual maturation in the ommastrephid squid Illex argentinus[J]. Philosophical Transactions of the Royal Society of London. Series B:Biological Sciences, 1994, 344(1308): 201-212. DOI:10.1098/rstb.1994.0061 |
| [31] |
林东明, 陈新军, 魏嫣然, 等. 阿根廷滑柔鱼雌性个体肌肉和性腺组织能量积累及其生殖投入[J]. 水产学报, 2017, 41(1): 70-80. LIN D M, CHEN X J, WEI Y R, et al. Energy accumulation of both somatic and reproductive tissues and its allocation to reproduction in Argentinean short-fin squid (Illex argentinus)[J]. Journal of fisheries of China, 2017, 41(1): 70-80. |
| [32] |
崔奕波. 鱼类生物能量学的理论与方法[J]. 水生生物学报, 1989, 13(4): 369-383. CUI Y B. Bioenergetics of fishes:theory and methods[J]. Acta Hydrobiologica Sinica, 1989, 13(4): 369-383. |
| [33] |
JACKSON G D, MLADENOV P V. Terminal spawning in the deepwater squid Moroteuthis ingens (Cephalopoda:Onychoteuthidae)[J]. Journal of Zoology, 1994, 234(2): 189-201. DOI:10.1111/j.1469-7998.1994.tb06067.x |
| [34] |
MCGRATH B, JACKSON G. Egg production in the arrow squid Nototodarus gouldi (Cephalopoda:Ommastrephidae), fast and furious or slow and steady?[J]. Marine Biology, 2002, 141(4): 699-706. DOI:10.1007/s00227-002-0864-z |
| [35] |
ROCHA F, GUERRA Á, GONZÁLEZ Á F. A review of reproductive strategies in cephalopods[J]. Biological Reviews, 2001, 76(3): 291-304. DOI:10.1017/S1464793101005681 |
| [36] |
朱凯, 张立川, 陈新军, 等. 南海鸢乌贼中型群雄性个体肌肉和性腺组织能量积累及其分配[J]. 热带海洋学报, 2019, 38(4): 41-51. ZHU K, ZHANG L C, CHEN X J, et al. Energy accumulation and allocation of somatic and reproductive tissues in medium form of male Sthenoteuthis oualaniensis in the south China Sea[J]. Journal of Tropical Oceanography, 2019, 38(4): 41-51. |
| [37] |
OKUTANI T, NAKAMURA I, SETI K. An unusual egg-brooding behavior of an oceanic squid in the Okhotsk Sea[J]. Venus, 1995, 54(3): 237-239. |
| [38] |
NIGMATULLIN C M, ARKHIPKIN A I, SABIROV R M. Age, growth and reproductive biology of diamond-shaped squid Thysanoteuthis rhombus (Oegopsida:Thysanoteuthidae)[J]. Marine Ecology Progress Series, 1995, 124(1/3): 73-87. |
| [39] |
BRUNETTI N, IVANOVIC M, LOUGE E, et al. Estudio de la biología reproductiva y de la fecundidad en dos subpoblaciones del calamar (Illex argentinus).[Reproductive biology and fecundity of two stocks of the squid (Illex argentinus)][J]. Frente Marítimo, 1991, 8: 73-84. |
| [40] |
CHEMBIAN A J, MATHEW S. Population structure of the purpleback squid Sthenoteuthis oualaniensis (Lesson, 1830) along the south-west coast of India[J]. Indian Journal of Fisheries, 2014, 61(3): 20-28. |
| [41] |
韩飞, 陈新军, 林东明, 等. 东太平洋赤道海域茎柔鱼体征生长及生殖投入[J]. 水产学报, 2019, 43(12): 2511-2522. HAN F, CHEN X J, LIN D M, et al. Body condition and reproductive investment of Dosidicus gigas in the equatorial waters of eastern Pacific Ocean[J]. Journal of Fisheries of China, 2019, 43(12): 2511-2522. |
| [42] |
LIN D M, CHEN X J, CHEN Y, et al. Sex-specific reproductive investment of summer spawners of Illex argentinus in the southwest Atlantic[J]. Invertebrate Biology, 2015, 134(3): 203-213. DOI:10.1111/ivb.12088 |
| [43] |
林东明, 孙程婕, 宣思鹏, 等. 雌性阿根廷滑柔鱼性腺发育阶段的脂肪酸组成及其变化[J]. 上海海洋大学学报, 2019, 28(3): 409-418. LIN D M, SUN C J, XUAN S P, et al. Fatty acid composition and its changes during sexual maturation in female Illex argentinus[J]. Journal of Shanghai Ocean University, 2019, 28(3): 409-418. |
| [44] |
陈新军. 世界头足类资源开发现状及我国远洋鱿钓渔业发展对策[J]. 上海海洋大学学报, 2019, 28(3): 321-330. CHEN X J. Development status of world cephalopod fisheries and suggestions for squid jigging fishery in China[J]. Journal of Shanghai Ocean University, 2019, 28(3): 321-330. |
2. Laboratory for Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266071, Shandong, China;
3. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
5. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
6. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


