2. 上海海洋大学 上海市水产养殖工程技术研究中心, 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
微藻是一类个体微小、分布广泛的初级生产者,富含色素、蛋白质、脂质和碳水化合物等营养物质,蕴含巨大的开发潜力,在水产养殖、生物医药和能源环境等领域发挥着重要作用。当前大多数藻类的培养以光合自养为主,通过在光照下吸收CO2进行生长,然而在藻细胞生长后期,由于细胞的自我遮挡,大大降低了光的有效性和微藻对光的利用率,从而限制了微藻的生物量生产和营养物质的积累,如何获得高密度和高品质的微藻生物量越来越成为限制微藻产业化发展的重要因素。
碳是微藻生长和细胞合成所必需的营养元素,许多微藻类具有膜传输系统,不仅能够以CO2为无机碳源进行生长,还能够利用葡萄糖、乙酸盐、甘油、蔗糖和果糖等有机碳来为生长提供能量[1-4],提高底物营养的转化效率和微藻生物量,从而实现高密度培养。不同种类的碳源对微藻生长有不同影响[5-6],其中葡萄糖是许多微藻生长所需的最佳有机碳源,以葡萄糖为碳源进行兼养培养,原始小球藻(Chlorella protothecoides)最大生长速率是自养条件下的10倍[7],杜氏盐藻(Dunaliella salina FACHB 435)生物量是自养的2.2倍[8]。微藻的生长速率除了与碳源的种类有关外,越来越多报道指出不同C/N也会对微藻生长产生影响,如扁藻(Tetraselmis chuii)在C/N为12时生物量能够达到最大值1.37 g/L,高于或低于12时均有所降低[9]。藻细胞内生化组分也会受C/N的影响,C/N较高时,往往有利于脂质和碳水化合物的合成,反之,有利于含氮化合物的合成[10-11]。
本实验以绿球藻(Chlorococcum sp.)为研究对象,前期的研究表明该株绿球藻耐高温和高氨氮能力强,能够在温度30~40 ℃,氨氮含量100~300 mg/L条件下生长,对养猪场废水净化效果显著,而且该株绿球藻脂质含量高,C16和C18系列脂肪酸丰富,在提炼生物柴油方面也有较高的应用价值[12],因此,实现高密度培养对于其进一步研究和产业化应用至关重要。在前期研究的基础上,探究了不同C/N对绿球藻生长和细胞组分的影响,为该绿球藻的大规模培养和产业化应用提供理论基础。
1 材料与方法 1.1 藻株实验所用藻株为绿球藻,来自上海海洋大学生物饵料实验室。
1.2 实验设计取指数增长期的绿球藻藻液,经3 000 r/min离心弃上清,收集藻细胞,并用灭菌去离子水清洗3次,去除营养盐,然后接种到1 000 mL的灭菌三角烧瓶中,初始接种密度为3×106个/mL。实验共设计6组(C/N分别为0:1、3:1、6:1、9:1、12:1和15:1),每组3个平行,共18个样品。为了避免营养缺乏可能造成的影响,实验所用的f/2培养基[13]的所有营养组分都以2倍浓度添加,保持营养液中氮磷比值不变,通过添加不同浓度的无水葡萄糖使得碳原子与氮原子之比为3:1、6:1、9:1、12:1和15:1,进行兼养培养,并以不添加葡萄糖的自养培养0:1组做对照。实验在光照培养箱中进行,温度(35±2) ℃,光照3 000 lx,光照周期12L:12D,每天定时摇藻4次,实验共进行7 d。
实验期间,每天统计藻细胞生长情况,测定藻细胞密度和培养液中葡萄糖含量,计算藻细胞特定生长率。实验结束后,测定各组藻细胞生物量、色素、蛋白质、总脂、碳水化合物和脂肪酸含量。
1.3 测定指标和方法 1.3.1 绿球藻细胞密度、特定生长率和生物量测定采用XB-K-25血球计数板测定绿球藻细胞密度,每个样品重复测定3次,并根据以下公式计算绿球藻细胞的特定生长率K。
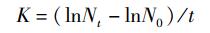 (1)
(1)
式中:N0为初始藻细胞密度,个/mL;Nt为经过时间t后藻细胞密度,个/mL;t为培养时间,d。
培养结束后,将藻液摇匀后取100 mL,经恒重后的混合纤维素脂微孔滤膜(孔径0.45 μm)抽滤,之后将含有藻液的微孔滤膜置于85 ℃烘箱中烘干至质量恒定,用公式(2)计算生物量(B):
 (2)
(2)
式中:B为生物量,g/L; W0为微孔滤膜的质量,g;W1为含有藻液的微孔滤膜的质量,g;V为测定生物量所需藻液体积,L。
1.3.2 绿球藻细胞组分含量的测定实验结束后,取一定体积的藻液,离心后用去离子水清洗3次,获取藻泥,利用甲醇提取绿球藻色素,并采用分光光度计法[14-15]测定色素含量,根据以下公式分别计算叶绿素a(Pa)、叶绿素b(Pb)、类胡萝卜素(Pc)含量:
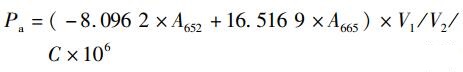 (3)
(3)
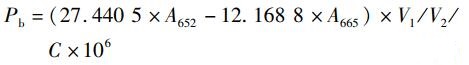 (4)
(4)
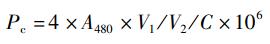 (5)
(5)
式中:A480、A652、A665分别是在波长为480、652、665 nm下测定的吸光度;V1为甲醇提取液体积,mL;V2为测定藻液体积,mL; C为藻细胞密度,个/mL。
将剩余藻液离心,离心后的上清液经0.22 μm滤膜过滤用于测定培养液中葡萄糖质量浓度。所获藻泥用去离子水反复清洗3次,置于-40 ℃条件下冷冻干燥,用于测定碳水化合物、总脂和蛋白质质量浓度,绿球藻碳水化合物和培养液中葡萄糖质量浓度的测定采用苯酚-硫酸法[16],用公式(6)计算培养液中葡萄糖的利用率。蛋白质质量浓度的测定采用福林-酚法[17],总脂质量浓度采用氯仿甲醇法[15],之后采用BF3甲酯化法[18]测定脂肪酸质量浓度,并用Agilent-7890A型气相色谱仪联合Agilent-5975C质谱仪分析脂肪酸。最后根据脂肪酸标准品的分析图谱、保留时间以及质谱的分析对样品脂肪酸进行定性分析,并按照峰面积归一化法计算各脂肪酸的相对质量分数。
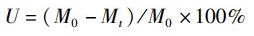 (6)
(6)
式中:U为葡萄糖利用率,%;M0为培养液中葡萄糖的初始质量浓度,mg/L;Mt为培养t天后培养液中葡萄糖质量浓度,mg/L;t为培养时间,d。
1.4 数据处理与分析所有数据以平均值±标准差(Mean ± SD)表示,通过单因素方差分析和Duncan’s多重比较来评估各组实验数据之间的差异,P<0.05表示数据之间有显著性差异。所有数据都使用SPSS 17.0进行分析和处理。
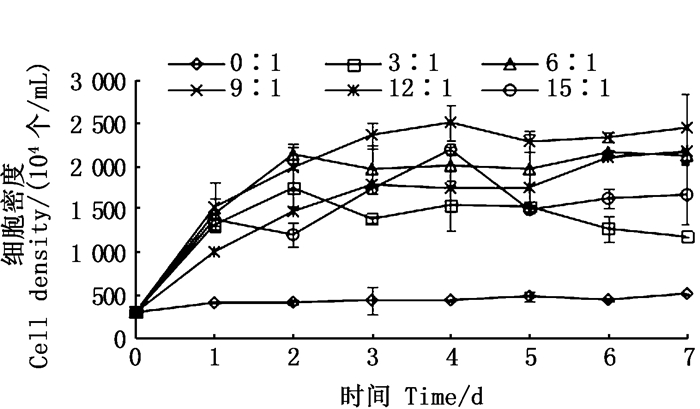
2 结果与分析 2.1 不同C/N对绿球藻细胞密度和特定生长率的影响由图 1可知,随着培养时间的增加,0:1组绿球藻细胞从初始的300×104个/mL增长到517.5×104个/mL,仅增长了200×104个/mL。在兼养条件下,绿球藻细胞密度经过指数增长期后达到最大值,其中3:1组和6:1组分别于实验第2天达到最大值1 741×104个/mL和2 131×104个/mL,分别是自养条件下的3.4和4.1倍,9:1和15:1组分别于实验第4天达到最大值2 500×104个/mL和2 185×104个/mL,分别是自养条件下的4.8和4.2倍,12:1组在第7天达到最大值2 165×104个/mL,是自养条件下的4.1倍。由此可知,当C/N为9:1时,绿球藻具有最佳的生长效果。
|
图 1 不同C/N对绿球藻细胞密度的影响 Fig. 1 Effects of various C/N ratios on cell density for Chlorococcum sp. |
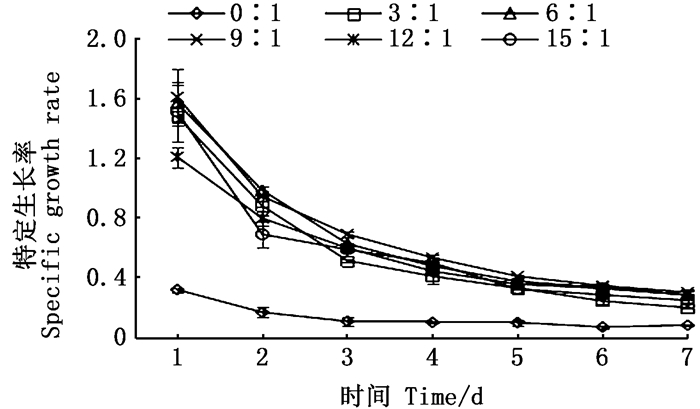
由图 2可知,随着培养时间的增加,各实验组绿球藻细胞特定生长率均表现为逐渐降低的趋势,其中0:1组明显低于其他各组,因此在兼养条件下培养能够提高绿球藻特定生长率。
|
图 2 不同C/N对绿球藻特定生长率的影响 Fig. 2 Effects of various C/N ratios on specific growth rate for Chlorococcum sp. |
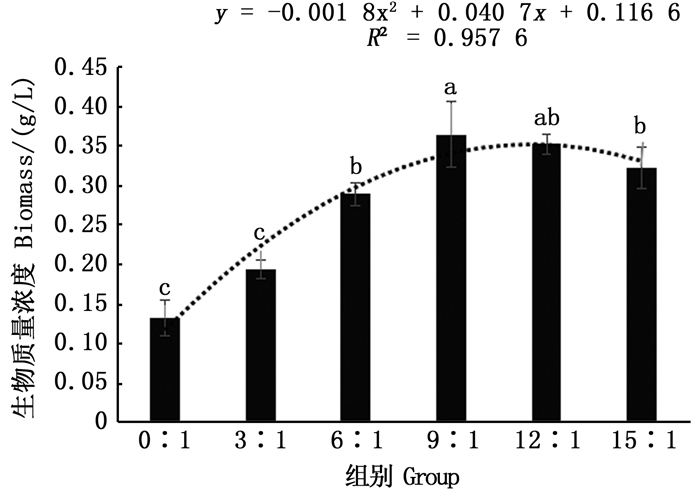
培养液中不同C/N对绿球藻生物量的影响不同,如图 3所示,随着C/N的增加,绿球藻生物量表现为先增加后降低的趋势,与0:1组相比,只有3:1组生物量无显著提高(P>0.05),其余各组均显著提高(P<0.05),其中9:1组达到最大值0.36 g/L,较0:1组提高了2倍左右,C/N高于9:1后绿球藻生物量不再增加,甚至有所下降,因此,培养液中适宜的C/N能够提高绿球藻生物量。对不同C/N条件下绿球藻生物量含量进行回归分析,得y=-0.001 8x2+0.040 7 x+0.116 6,R2=0.957 6,由此可计算出绿球藻获得最大生物量所需最佳C/N为11:1。
|
相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05) Values with the same letter superscripts mean no significant difference(P>0.05), while with different superscripts mean significant difference(P < 0.05) 图 3 不同C/N对绿球藻细胞生物质量浓度的影响 Fig. 3 Effects of various C/N ratios on dry weight biomass for Chlorococcum sp. |
由图 4可知,培养液中添加葡萄糖能够降低绿球藻细胞中色素含量,随着C/N的增加,叶绿素a、叶绿素b、类胡萝卜素和总色素(叶绿素a +叶绿素b +类胡萝卜素)含量逐渐降低,0:1组叶绿素a、叶绿素b、类胡萝卜素和总色素含量均显著高于其他各组(P < 0.05)。与0:1组相比,3:1、6:1、9:1、12:1和15:1组藻细胞总色素含量分别降低了20%、34%、43%、48%、58%。

|
相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05) Values with the same no or little letter superscripts mean no significant difference(P > 0.05), while with no same little letter superscripts mean significant difference(P < 0.05) 图 4 不同C/N对绿球藻色素组成的影响 Fig. 4 Effects of various C/N ratios on pigments content for Chlorococcum sp. |
由图 5可知,不同C/N对绿球藻细胞蛋白质、总脂和碳水化合物质量分数的影响不同,在兼养条件下,随着C/N的增加,绿球藻细胞蛋白质和总脂质量分数均表现为逐渐降低的趋势,当C/N为15:1时分别达到最小值35.54%和6.66%,显著低于其他各组(P<0.05)。碳水化合物质量分数表现为先增加后降低的趋势,在9:1组达到最大值30.57%,显著高于其他各组(P<0.05)。与自养条件相比,兼养条件下绿球藻各组碳水化合物质量分数均显著增加(P<0.05)。
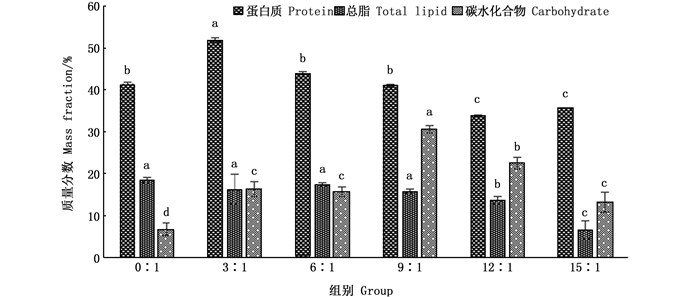
|
不同字母表示组间差异显著(P<0.05) Different letters represent significent differences between groups 图 5 不同C/N对绿球藻蛋白质、总脂和碳水化合物质量分数的影响 Fig. 5 Effect of various C/N ratios on concents of protein, total lipid andcarbohydrate for Chlorococcum sp. |
由图 6可知,在兼养条件下,各实验组培养液中葡萄糖质量分数随着培养时间的增加逐渐降低,最终接近0 mg/L,并且随着C/N的增加,对葡萄糖的消耗时间延长,这表明C/N的增加可以延长绿球藻生长时间。实验各组对葡萄糖的利用率如图 7所示,3:1、6:1、9:1、12:1和15:1组对葡萄糖利用率分别达到90.83%、94.82%、89.91%、93.03%和93.46%,各组之间无显著差异(P>0.05),表明在不同C/N条件下,绿球藻对培养液中的葡萄糖均有较好的利用效果。

|
图 6 不同C/N对培养液中葡萄糖质量浓度的影响 Fig. 6 Effect of various C/N ratios on glucose mass concentration |
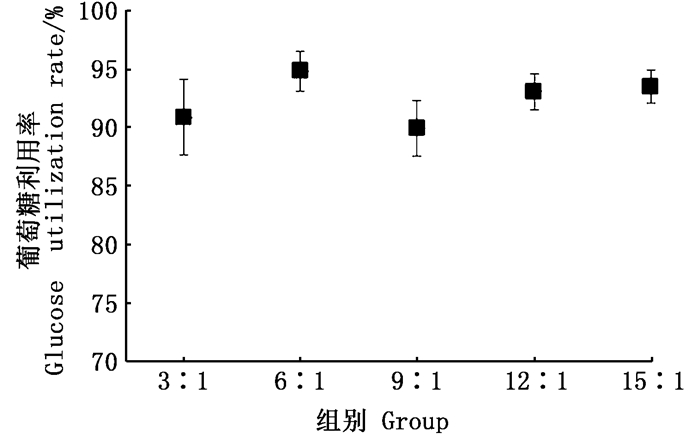
|
图 7 不同C/N对培养液中葡萄糖利用率的影响 Fig. 7 Effect of various C/N ratios on glucose utilization rate |
绿球藻脂肪酸质量分数测定结果见表 1。绿球藻中含有较高的多不饱和脂肪酸(PUFA),主要是亚麻酸(ALA)和亚油酸(LA),饱和脂肪酸(SFA)和单不饱和脂肪酸(MUFA)质量分数较少,主要是C16和C18系列脂肪酸。研究结果表明,随着C/N的增加,绿球藻细胞中SFA质量分数逐渐升高,在C/N为15:1时达到最大值20.72%,与12:1组无显著差异(P>0.05),但显著高于其他各组(P<0.05),主要表现在C16:0和C18:0这两种脂肪酸水平上。MUFA质量分数表现为先降低后增加的趋势,在C/N为15:1时达到最大值14.61%,显著高于其他各组(P<0.05),主要是C16:1和C18:1这两种脂肪酸。PUFA随着C/N比的增加而降低,在C/N为15:1时达到最小值64.67%,显著低于其他各组(P<0.05),主要表现在C16:3n3和C18:3n3等n-3 PUFA上。
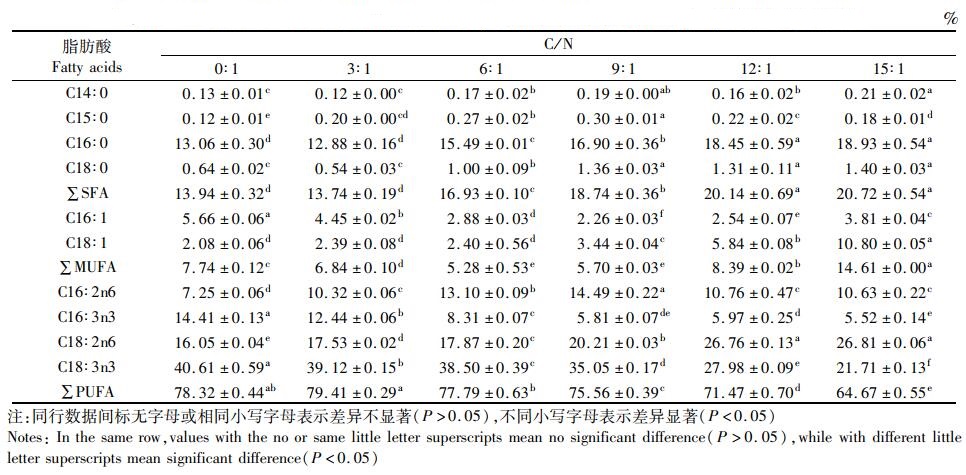
|
表 1 不同C/N对绿球藻脂肪酸的影响(总脂肪酸) Tab.1 Effect of different C/N radios on fatty acid of Chlorococcum sp. (Total fatty acid) |
兼养培养是获得微藻高密度和高生物量生产力的有效途径。在培养液中添加葡萄糖能够显著提高绿球藻的细胞密度、特定生长率和生物量。这是因为在兼养条件下微藻可以利用有机碳源和光源两种能源进行生长,叶绿体光合作用和葡萄糖氧化作用可以同时发生[19-20],一方面光合作用产生的ATP能够加速葡萄糖的代谢[21],另一方面葡萄糖代谢产生的CO2为光合作用提供碳源,进而提高CO2/O2比值,促进RuBisco羧化酶/加氧酶的羧化反应和光合碳固定反应[22],因此在光合作用和葡萄糖氧化的共同刺激下,绿球藻生长加快,藻细胞密度和生物量提高[23-24]。然而,过高的C/N也会导致绿球藻细胞生长密度下降,这与在普通小球藻(Chlorella vulgaris)[25]、扁藻[9]、莱茵衣藻(Chlamydomonas reinhardtii)[26]的研究结果一致,这种生长减少一方面是底物抑制造成的[8, 27],另一方面,随着有机碳质量分数的增加,ATP用于有机碳同化的需求会限制光合作用碳还原过程,从而导致藻细胞生长抑制[26, 28]。
绝大多数微藻无法利用葡萄糖等有机碳进行生长[9],该绿球藻在自养条件下生长缓慢,生物量产量低,但在兼养条件下,各实验组在1~4 d内几乎将培养液中的葡萄糖全部吸收利用,而且对葡萄糖的利用率均达到90%以上,获得较高的藻细胞密度和生物量,表明该绿球藻能够以葡萄糖为碳源进行兼养生长,因此,在今后的生产中可以通过向培养液中添加葡萄糖实现该绿球藻的大规模培养,缩短培养周期。
3.2 对绿球藻细胞组分含量的影响与自养培养相比,兼养培养对微藻细胞组分类型和含量存在影响。培养液中添加葡萄糖能够改变微藻细胞碳分配代谢途径[29],C/N能够通过控制微藻蛋白质、总脂和碳水化合物的合成来调节微藻细胞的营养组分,一定的C/N通常可以成为碳限制或氮限制的转折点[30],如在异养条件下,扁藻在C/N为12时生物量达到最大值,多糖质量分数达到最小值[9],一种小球藻(Chlorella sorokiniana)在C/N为20时总脂质量分数最低,高于或低于20时总脂质量分数增加[31]。在兼养条件下,随着C/N的增加,绿球藻蛋白质和总脂质量分数逐渐降低,没有出现转折点,但当C/N为9:1时,绿球藻碳水化合物质量分数、生物量达到最大值,高于或低于9:1时绿球藻碳水化合物质量分数和生物量降低,因此C/N为9:1可能是绿球藻碳水化合物质量分数、生物量积累的转折点。
在兼养条件下,随着C/N的增加,叶绿素质量分数逐渐降低,蛋白质质量分数由51.92%下降到35.54%,其原因在于随着C/N的增加,碳供应过量,氮成为限制性因素,从而导致微藻细胞内自身积累的蛋白质、叶绿素及其他含氮化合物质量分数降低[15, 32-35],这与许多研究结果相符,如在氮缺乏条件下,小球藻叶绿素a质量分数降低,扁藻蛋白质质量分数由46%下降到10%[36]。氮限制的增加往往造成微藻中的能量转向非含氮化合物的生成,如脂质[37-38]和碳水化合物[15, 36],也有研究[39]表明在培养液中添加有机碳源对脂质质量分数无影响,如在兼养条件下,小球藻CCTCC M209220的脂质质量分数由26%提高到45%,微绿球藻(Nannochloropsis oculata CCMP 525)和杜氏盐藻(Dunaliella salina FACHB 435)脂质质量分数几乎没有变化[8],因此微藻细胞组分质量分数与微藻种类也有一定关系。本研究结果表明,随着C/N的增大,碳水化合物质量分数显著增加,脂质质量分数下降,原因可能是碳水化合物是藻类细胞中与脂质合成竞争的主要物质[40],随着C/N的增加,绿球藻代谢更加倾向于碳水化合物的合成,而不是脂质的积累。
3.3 对绿球藻脂肪酸组成和含量的影响培养条件的变化通常会影响藻类脂质成分的变化。研究表明碳氮元素的质量分数和比例对微藻脂肪酸的组成存在影响,较低的C/N有利于PUFA的合成,尤其是三烯酸[31],而氮质量分数的缺乏或限制有利于SFA的合成[41-42],如在三角褐指藻(Phaeodactylum tricornutum)培养液中补充有机碳源,SFA和MUFA的比例增加,PUFA的比例降低[43],在兼养条件下,随着葡萄糖质量分数的增大,粉核油球藻(Pinguiococcus pyrenoidosus)的SFA提高,PUFA质量分数降低[44],在氮限制条件下,小球藻和三角褐指藻的PUFA质量分数降低[10, 31]。本研究结果表明,在兼养条件下随着C/N的增加,绿球藻细胞中C16:0和C18:1等SFA和MUFA质量分数升高,C18:3n3等PUFA质量分数下降,其原因可能是随着C/N的增加,色素体减少,进而导致甘油酯和磷脂质量分数降低,细胞器膜结构减少[45],由于藻细胞中绝大多数PUFA位于极性脂中,因此当膜结构减少时,PUFA质量分数相应降低。另一方面,PUFA主要是在自养条件下产生的[46-47],在脂肪酸的代谢途径中,分子氧参与脂肪酸的去饱和过程[48],在兼养条件下,葡萄糖氧化分解产生较多的CO2,O2质量分数相对较低,限制了脂肪酸的去饱和过程,从而降低了脂肪酸的不饱和度,最终导致PUFA的合成减少,SFA和MUFA合成增加。
综上所述:绿球藻对葡萄糖有较高的利用率,当C/N为9:1时,绿球藻细胞密度和生物量达到最大值;在兼养条件下,随着C/N的增加,绿球藻蛋白质和脂质质量分数降低,碳水化合物质量分数先增加后降低,在C/N为9:1时达到最大值;随着C/N的增加,有利于饱和脂肪酸和单不饱和脂肪酸的生成,但不利于多不饱和脂肪酸的生成。
| [1] |
YANG C, HUA Q, SHIMIZU K. Energetics and carbon me-tabolism during growth of microalgal cells under photoautotrophic, mixotrophic and cyclic light-autotrophic/dark-heterotrophic conditions[J]. Biochemical Engineering Journal, 2000, 6(2): 87-102. DOI:10.1016/S1369-703X(00)00080-2 |
| [2] |
CERÓN-GARCÍA M C, FERNÁNDEZ-SEVILLA J M, SÁNCHEZ-MIRÓN A, et al. Mixotrophic growth of Phaeodactylum tricornutum on fructose and glycerol in fed-batch and semi-continuous modes[J]. Bioresource Technology, 2013, 147: 569-576. DOI:10.1016/j.biortech.2013.08.092 |
| [3] |
GIM G H, KIM J K, KIM H S, et al. Comparison of biomass production and total lipid content of freshwater green microalgae cultivated under various culture conditions[J]. Bioprocess and Biosystems Engineering, 2014, 37(2): 99-106. |
| [4] |
REN H Y, LIU B F, MA C, et al. A new lipid-rich microalga Scenedesmus sp. strain R-16 isolated using Nile red staining:effects of carbon and nitrogen sources and initial pH on the biomass and lipid production[J]. Biotechnology for Biofuels, 2013, 6(1): 143. |
| [5] |
刘晓娟, 段舜山, 李爱芬. 有机碳源和氮源对三角褐指藻生长的影响[J]. 水生生物学报, 2008, 32(2): 252-257. LIU X J, DUAN S S, LI A F. Effects of organic carbon sources and nitrogen sources on the growth of Phaeodactylum tricornutum[J]. Acta Hydrobiologica Sinica, 2008, 32(2): 252-257. DOI:10.3321/j.issn:1000-3207.2008.02.018 |
| [6] |
王星宇, 黄旭雄. 不同碳源对球等鞭金藻生长和细胞组成的影响[J]. 山东农业大学学报(自然科学版), 2016, 47(4): 506-513. WANG X Y, HUANG X X. Effect of different carbon sources on growth and biochemical composition of Isochrysis galbana[J]. Journal of Shandong Agricultural University (Natural Science Edition), 2016, 47(4): 506-513. DOI:10.3969/j.issn.1000-2324.2016.04.005 |
| [7] |
HEREDIA-ARROYO T, WEI W, HU B. Oil Accumulation via Heterotrophic/Mixotrophic Chlorella protothecoides[J]. Applied Biochemistry & Biotechnology, 2010, 162(7): 1978-1995. |
| [8] |
WAN M X, LIU P, XIA J L, et al. The effect of mixotrophy on microalgal growth, lipid content, and expression levels of three pathway genes in Chlorella sorokiniana[J]. Applied Microbiology & Biotechnology, 2011, 91(3): 835-844. |
| [9] |
LU L, WANG J, YANG G P, et al. Heterotrophic growth and nutrient productivities of Tetraselmis chuii using glucose as a carbon source under different C/N ratios[J]. Journal of Applied Phycology, 2017, 29(1): 15-21. DOI:10.1007/s10811-016-0919-z |
| [10] |
NEGI S, BARRY A N, FRIEDLAND N, et al. Impact of nitrogen limitation on biomass, photosynthesis, and lipid accumulation in Chlorella sorokiniana[J]. Journal of Applied Phycology, 2016, 28(2): 803-812. DOI:10.1007/s10811-015-0652-z |
| [11] |
BEN-AMOTZ A, AVRON M. Accumulation of metabolites by halotolerant algae and its industrial potential[J]. Annual Review of Microbiology, 1983, 37(1): 95-119. DOI:10.1146/annurev.mi.37.100183.000523 |
| [12] |
穆亮亮, 黄旭雄, 蔡敬, 等. 温度对一株耐高氨氮绿球藻生长及油脂特性的影响[J]. 上海海洋大学学报, 2016, 25(5): 692-699. MU L L, HUANG X X, CAI J, et al. The effect of temperature on the growth and lipid characteristics of a high amonia tolerant microalgae, Chlorococcum sp.[J]. Journal of Shanghai Ocean University, 2016, 25(5): 692-699. |
| [13] |
GUILLARD R R L, RYTHER J H. Studies of marine planktonic diatoms:I. Cyclotella nana hustedt, and detonula confervacer (cleve) gran[J]. Canadian Journal of Microbiology, 1962, 8(2): 229-239. |
| [14] |
RITCHIE R J. Consistent sets of spectrophotometric chlorophyll equations for acetone, methanol and ethanol solvents[J]. Photosynthesis Research, 2006, 89(1): 27-41. DOI:10.1007/s11120-006-9065-9 |
| [15] |
PRUVOST J, VAN VOOREN G, LE GOUIC B, et al. Systematic investigation of biomass and lipid productivity by microalgae in photobioreactors for biodiesel application[J]. Bioresource Technology, 2011, 102(1): 150-158. DOI:10.1016/j.biortech.2010.06.153 |
| [16] |
DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356. |
| [17] |
LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1): 265-275. |
| [18] |
WEN W, HUANG X X, CHEN Q K, et al. Temperature effects on early development and biochemical dynamics of a marine fish, Inimicus japonicus[J]. Journal of Experimental Marine Biology and Ecology, 2013, 442: 22-29. DOI:10.1016/j.jembe.2013.01.025 |
| [19] |
XU F, HU H H, CONG W, et al. Growth characteristics and eicosapentaenoic acid production by Nannochloropsis sp. in mixotrophic conditions[J]. Biotechnology Letters, 2004, 26(1): 51-53. DOI:10.1023/B:BILE.0000009460.81267.cc |
| [20] |
YU H F, JIA S R, DAI Y J. Growth characteristics of the cyanobacterium Nostoc flagelliforme in photoautotrophic, mixotrophic and heterotrophic cultivation[J]. Journal of Applied Phycology, 2009, 21(1): 127-133. DOI:10.1007/s10811-008-9341-5 |
| [21] |
HEREDIAARROYO T, WEI W, RUAN R, et al. Mixo-trophic cultivation of Chlorella vulgaris and its potential application for the oil accumulation from non-sugar materials[J]. Biomass & Bioenergy, 2011, 35(5): 2245-2253. |
| [22] |
郎筱宇, 刘志媛, 徐梦, 等. 葡萄糖对小球藻(Chloralla sp. HN08)光合作用和生长的影响[J]. 微生物学报, 2017, 57(4): 550-559. LANG X Y, LIU Z Y, XU M, et al. Effects of glucose on photosynthesis and growth of Chloralla sp. HN08 cells[J]. Acta Microbiologica Sinica, 2017, 57(4): 550-559. |
| [23] |
YAMANE Y I, UTSUNOMIYA T, WATANABE M, et al. Biomass production in mixotrophic culture of Euglena gracilis under acidic condition and its growth energetics[J]. Biotechnology Letters, 2001, 23(15): 1223-1228. DOI:10.1023/A:1010573218863 |
| [24] |
MOHAN S V, DEVI M P. Fatty acid rich effluent from acidogenic biohydrogen reactor as substrate for lipid accumulation in heterotrophic microalgae with simultaneous treatment[J]. Bioresource Technology, 2012, 123: 627-635. DOI:10.1016/j.biortech.2012.07.004 |
| [25] |
LIANG Y N, SARKANY N, CUI Y. Biomass and lipid productivities of Chlorella vulgaris under autotrophic, heterotrophic and mixotrophic growth conditions[J]. Biotechnology Letters, 2009, 31(7): 1043-1049. DOI:10.1007/s10529-009-9975-7 |
| [26] |
HEIFETZ P B, FÖRSTER B, OSMOND C B, et al. Effects of acetate on facultative autotrophy in Chlamydomonas reinhardtii assessed by photosynthetic measurements and stable isotope analyses[J]. Plant Physiology, 2000, 122(4): 1439-1446. DOI:10.1104/pp.122.4.1439 |
| [27] |
IP P F, WONG K H, CHEN F. Enhanced production of astaxanthin by the green microalga Chlorella zofingiensis in mixotrophic culture[J]. Process Biochemistry, 2004, 39(11): 1761-1766. DOI:10.1016/j.procbio.2003.08.003 |
| [28] |
SILABAN A, BAI R, GUTIERREZ-WING M T, et al. Effect of organic carbon, C:N ratio and light on the growth and lipid productivity of microalgae/cyanobacteria coculture[J]. Engineering in Life Sciences, 2014, 14(1): 47-56. |
| [29] |
颜日明, 张志斌, 曾庆桂, 等. 聚球藻7942混养培养中碳代谢与能量利用[J]. 生物工程学报, 2010, 26(9): 1239-1248. YAN R M, ZHANG Z B, ZENG Q G, et al. Carbon metabolism and energetic utilization of Synechococcus sp. PCC7942 under mixotrophic condition[J]. Chinese Journal of Biotechnology, 2010, 26(9): 1239-1248. |
| [30] |
ERIKSEN N T. The technology of microalgal culturing[J]. Biotechnology Letters, 2008, 30(9): 1525-1536. DOI:10.1007/s10529-008-9740-3 |
| [31] |
CHEN F, JOHNS M R. Effect of C/N ratio and aeration on the fatty acid composition of heterotrophic Chlorella sorokiniana[J]. Journal of Applied Phycology, 1991, 3(3): 203-209. DOI:10.1007/BF00003578 |
| [32] |
BREUER G, LAMERS P P, MARTENS D E, et al. The impact of nitrogen starvation on the dynamics of triacylglycerol accumulation in nine microalgae strains[J]. Bioresource Technology, 2012, 124: 217-226. DOI:10.1016/j.biortech.2012.08.003 |
| [33] |
LYU J M, CHENG L H, XU X H, et al. Enhanced lipid production of Chlorella vulgaris by adjustment of cultivation conditions[J]. Bioresource Technology, 2010, 101(17): 6797-6804. DOI:10.1016/j.biortech.2010.03.120 |
| [34] |
THOMAS W H, SEIBERT D L R, ALDEN M, et al. Yields, photosynthetic efficiencies and proximate composition of dense marine microalgal cultures. Ⅱ. Dunaliella primolecta and Tetraselmis suecica experiments[J]. Biomass, 1984, 5(3): 211-225. DOI:10.1016/0144-4565(84)90023-4 |
| [35] |
周芷薇, 高保燕, 雷学青, 等. 低氮胁迫对两种魏氏藻生长和油脂积累的影响[J]. 可再生能源, 2015, 33(5): 777-783. ZHOU Z W, GAO B Y, LEI X Q, et al. The effects of low-nitrogen stress on the growth and lipid accumulation of Vischeria helvetica and Vischeria punctata[J]. Renewable Energy Resources, 2015, 33(5): 777-783. |
| [36] |
BONDIOLI P, BELLA L D, RIVOLTA G, et al. Oil production by the marine microalgae Nannochloropsis sp. F&M-M24 and Tetraselmis suecica F&M-M33[J]. Bioresource Technology, 2012, 114: 567-572. DOI:10.1016/j.biortech.2012.02.123 |
| [37] |
GRIFFITHS M J, VAN HILLE R P, HARRISON S T L. Lipid productivity, settling potential and fatty acid profile of 11 microalgal species grown under nitrogen replete and limited conditions[J]. Journal of Applied Phycology, 2012, 24(5): 989-1001. DOI:10.1007/s10811-011-9723-y |
| [38] |
HSIEH C H, WU W T. Cultivation of microalgae for oil production with a cultivation strategy of urea limitation[J]. Bioresource Technology, 2009, 100(17): 3921-3926. DOI:10.1016/j.biortech.2009.03.019 |
| [39] |
窦晓, 陆向红, 卢美贞, 等. 碳源种类及碳氮比对眼点拟微绿球藻生长密度、油脂含量和脂肪酸组成的影响[J]. 生物工程学报, 2013, 29(3): 358-369. DOU X, LU X H, LU M Z, et al. Effects of carbon source and concentration on the growth density, lipid accumulation and fatty acid composition of Nannochloropis oculata[J]. Chinese Journal of Biotechnology, 2013, 29(3): 358-369. |
| [40] |
WANG Z T, ULLRICH N, JOO S, et al. Algal lipid bodies:stress induction, purification, and biochemical characterization in wild-type and starchless Chlamydomonas reinhardtii[J]. Eukaryotic Cell, 2009, 8(12): 1856-1868. DOI:10.1128/EC.00272-09 |
| [41] |
REGNAULT A, CHERVIN D, CHAMMAI A, et al. Lipid composition of Euglena gracilis in relation to carbon-nitrogen balance[J]. Phytochemistry (Oxford), 1995, 40(3): 725-733. DOI:10.1016/0031-9422(95)00268-C |
| [42] |
SUEN Y, HUBBARD J S, HOLZER G, et al. Total lipid production of the green alga Nannochloropsis sp. QⅡ under different nitrogen regimes[J]. Journal of Phycology, 1987, 23(s2): 289-296. DOI:10.1111/j.1529-8817.1987.tb04137.x |
| [43] |
刘晓娟, 段舜山, 李爱芬. 有机碳源对三角褐指藻生长、胞内物质和脂肪酸组分的影响[J]. 生物工程学报, 2008, 24(1): 147-152. LIU X J, DUAN S S, LI A F. Effects of organic carbon source on growth, biochemical components and fatty acid composition of Phaeodactylum tricornutum[J]. Chinese Journal of Biotechnology, 2008, 24(1): 147-152. DOI:10.3321/j.issn:1000-3061.2008.01.024 |
| [44] |
李爱芬, 刘然, 刘晓娟, 等. 碳源对粉核油球藻生长和脂肪酸组成特性的影响[J]. 水生生物学报, 2009, 33(3): 461-467. LI A F, LIU R, LIU X J, et al. Effects of carbon sources on growth and fatty acid composition of Pinguiococcus pyrenoidosus CCMP 2078[J]. Acta Hydrobiologica Sinica, 2009, 33(3): 461-467. |
| [45] |
PIORRECK M, BAASCH K H, POHL P. Biomass production, total protein, chlorophylls, lipids and fatty acids of freshwater green and blue-green algae under different nitrogen regimes[J]. Phytochemistry, 1984, 23(2): 207-216. DOI:10.1016/S0031-9422(00)80304-0 |
| [46] |
CHEN G Q, JIANG Y, CHEN F. Fatty acid and lipid class composition of the eicosapentaenoic acid-producing microalga, Nitzschia laevis[J]. Food Chemistry, 2007, 104(4): 1580-1585. DOI:10.1016/j.foodchem.2007.03.008 |
| [47] |
DAY J D, EDWARDS A P, RODGERS G A. Development of an industrial-scale process for the heterotrophic production of a micro-algal mollusc feed[J]. Bioresource Technology, 1991, 38(2/3): 245-249. |
| [48] |
RADWAN S S, MANGOLD H K. Biochemistry of lipids in plant cell cultures[M]//Advances in Biochemical Engineering. Berlin, Heidelberg:Springer, 1980, 16:109-133.
|
2. Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


