2. 上海海洋大学 水产动物遗传育种中心上海市协同创新中心, 上海 201306;
3. 上海海洋大学 上海水产养殖工程技术研究中心, 上海 201306
内陆水域通常被分为含盐水(盐碱水)和淡水,水域盐度低于0.5则是淡水,而我国盐碱水域含盐量往往在0.5~15不等。超过100多个国家内陆存在盐碱土和盐碱水域[1]。我国内陆水资源丰富,开展水产养殖历史悠久。盐度是限制海洋经济无脊椎动物移植内陆水域的首要影响因素[2]。挑选广盐性海洋经济贝类进行内陆水域养殖具有巨大产业前景。开展广盐性海洋贝类盐度耐受研究具有重要意义。
目前,盐度对海洋无脊椎动物生存和生长的影响主要集中在最适生长盐度的探索上。普遍认为对低盐耐受能力极强的凡纳滨对虾(Litopenaeus vannamei)来说其最适生长盐度是20左右[3]。按盐度耐受性来区分海水贝类可分为广盐性和狭盐性贝类,河口滩涂贝类有一定的耐低盐能力。叶莹莹等[4]和杨鹏等[5]研究表明厚壳贻贝(Mytilus coruscus)和翡翠贻贝(Perna viridis)幼虫的最适存活盐度下限均为15。曹伏君等[6]研究了文蛤(Meretrix meretrix)稚贝的低盐耐受极限为盐度5。谭杰等[7]研究了大珠母贝(Pinctada maxima)稚贝的最低耐受盐度为16.8。虽然不同的海洋无脊椎动物对低盐存在相对范围的耐受,但是大部分物种难以承受内陆淡水的盐度甚至是内陆盐碱水的盐度,而部分甲壳类和海洋滩涂贝类是极具移植内陆养殖潜力的物种。
缢蛏(Sinonovacula constricta)是属于软体动物门(Mollusca)瓣鳃纲(Lamellibranchia)异齿亚纲(Heterodonta)帘蛤目(Veneroida)灯塔蛤科(Pharellidae)缢蛏属(Sinonovacula)的一种经济海水贝类,广泛分布于西太平洋的潮间带和河口地区,是我国年产量较大的海水经济贝类之一,具有繁殖周期短等特点[8]。缢蛏可以适应广温广盐的环境条件,是抗逆性研究的热点之一[9]。但目前的研究中,对于缢蛏低盐胁迫下的生理及酶活等的影响并未见报道。因此,在本次实验中,研究了急性低盐胁迫对缢蛏的存活率、生长、免疫及渗透压相关酶活的影响,为内陆低盐或淡水水域养殖缢蛏和选育耐低盐缢蛏品种提供依据。
1 材料与方法 1.1 实验材料实验所用缢蛏取自浙江台州市三门县东航水产育苗科技有限公司。采集后的缢蛏在室内暂养7 d,暂养盐度为8。其中缢蛏稚贝平均壳长(0.210±0.058) cm,缢蛏亚成体(指一龄缢蛏处于稚贝以后至商品规格前的生长阶段)平均壳长为(2.133±0.128) cm,缢蛏成体平均壳长为(4.495±0.246) cm。经过暂养后随机挑选健康有活力的缢蛏用于低盐急性胁迫实验。实验用的不同盐度的人工海水为海盐(红海海盐,Red Sea Fish Pharm Ltd, Israel)和蒸馏水配制而成。盐度使用精密数字盐度仪(MASTER-α, ATAGO)测量,水温控制在20~22 ℃。实验在长方体塑料箱(长×宽×高=41 cm×32 cm×10 cm)中进行,实验水体为2 L。实验周期为48 h,在实验过程中每天更换50%的实验用水并去除动物排泄物。最后统计各组缢蛏的存活率、Na+/K+-ATPase(NKA)活性和血淋巴细胞吞噬率。实验中观察到缢蛏的壳张开、壳外套膜脱离以及对外界刺激无响应作为判断其死亡的标准。
1.2 实验设计 1.2.1 缢蛏急性低盐胁迫实验参考预实验结果和养殖区域水质资料,盐度为8经常能在养殖池塘出现,故设置对照组盐度为8。盐度梯度设6个组,分别为8.0、4.0、2.0、1.0、0.5和0。每个盐度梯度设计3个平行组(每组30只个体)。急性胁迫实验开始后分别在第2、4、8、12、24和48 h统计死亡个体数,最终处理数据计算48 h半致死盐度(48 h-LC50)。
1.2.2 成体缢蛏在低盐胁迫下Na+/K+-ATPase (NKA)活性和血淋巴细胞吞噬能力由于成体缢蛏更容易获得实验所需的血淋巴组织样品,因此本实验使用成体缢蛏来评估低盐胁迫对NKA酶活性和血淋巴细胞吞噬能力的影响。通过对实验1.2.1节结果的分析与计算,获得成体的48 h-LC50为盐度0.75,因此该部分实验设置盐度梯度组别为对照组(8.0)、2.0、0.75和0。每个盐度梯度设计3个平行组(每组30只个体)。分别在急性低盐胁迫后0、12和24 h进行取样检测鳃组织NKA活性和血淋巴细胞吞噬能力。在0 h取18只缢蛏鳃组织,6只为一组分3组测量NKA活性;同样在0 h取18只缢蛏血淋巴组织后分离获得血淋巴细胞,6只为一组分3组测量血淋巴细胞吞噬率。然后将各平行组30只缢蛏进行低盐胁迫,其余各个时间点每组分别取6只缢蛏分3组进行鳃组织NKA活性和血淋巴细胞吞噬率的测定。
1.3 分析方法 1.3.1 存活率和半致死浓度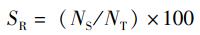 (1)
(1)
式中:SR存活率,%;NS存活数,只;NT总数,只。半致死浓度(LC50):采用直线内插法计算LC50[10]。以LC50作为急性胁迫指标。
1.3.2 Na+/K+-ATPase (NKA)活性的测定鳃组织样品匀浆后用生理盐水稀释10倍,2 500 r/min,离心10 min,取上清获得组织蛋白溶液,采用考马斯亮蓝法[11]测定蛋白含量。参考WHEALTY等[12]通过测定全酶反应体系和NKA的活力被乌本苷抑制反应体系中底物ATPNa2释放出无机磷(P)量的差值来计算NKA酶活性。NKA活性检测使用试剂盒并参照说明书进行操作(南京建成生物工程研究所,南京)。每一个活性单位U[μmol/(mg·h)]为每小时每毫克蛋白微摩尔无机磷。
1.3.3 血淋巴细胞吞噬作用从缢蛏围心腔处采取血淋巴液[13],心脏组织颗粒用40 μm孔径组织筛去除,最终获得均匀血淋巴组织液。血淋巴组织液中加入直径1 μm的改性羧酸荧光微球(黄绿色荧光,FLUOROSPHERES®,INVITROGEN),血淋巴组织液与改性羧酸荧光微球体积比为40 μL:1 μL,在黑暗室温下孵育1 h [14]。测量血淋巴细胞对荧光微球的吞噬使用流式细胞仪(BD C6Plus, BD BIOSCINCES公司)进行操作分析。设置血淋巴组织液对照组,其血淋巴细胞浓度与实验组相同未添加荧光微球。将对照组用流式细胞仪进行分析,获得血淋巴细胞浓度并设定阈值。对照细胞的荧光值被设定为阈值(Gate A), 用荧光强度阈值对实验组中的血淋巴细胞进行吞噬能力分析。各实验组和对照组均进行3次重复实验。
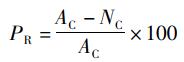 (2)
(2)
式中:PR为吞噬率,%;AC为所有细胞;NC为未吞噬的细胞。
1.3.4 统计分析使用SIGMAPLOT 12.3软件进行统计分析和制图。使用ANOVA单因素方差分析和TUKEY检验确定处理组之间的显著差异。
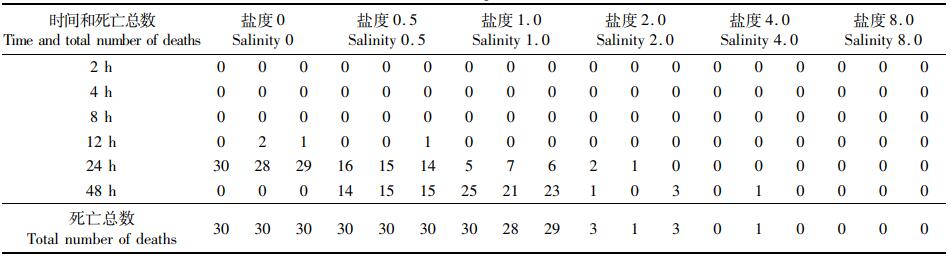
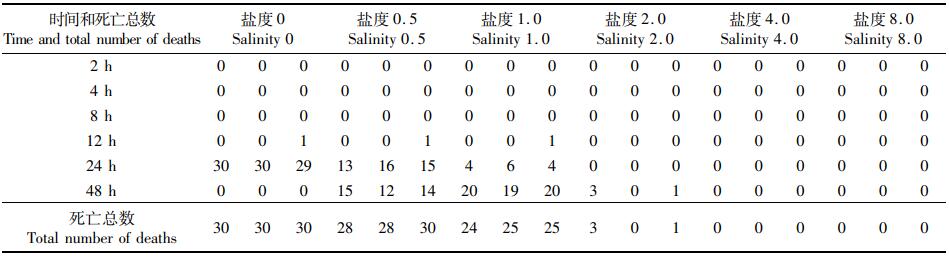
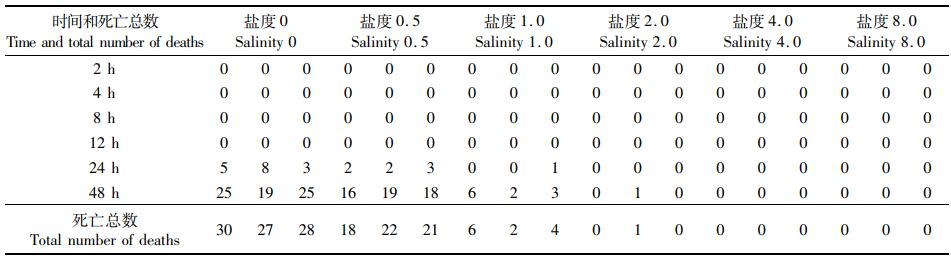
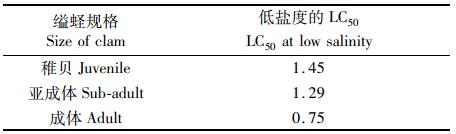
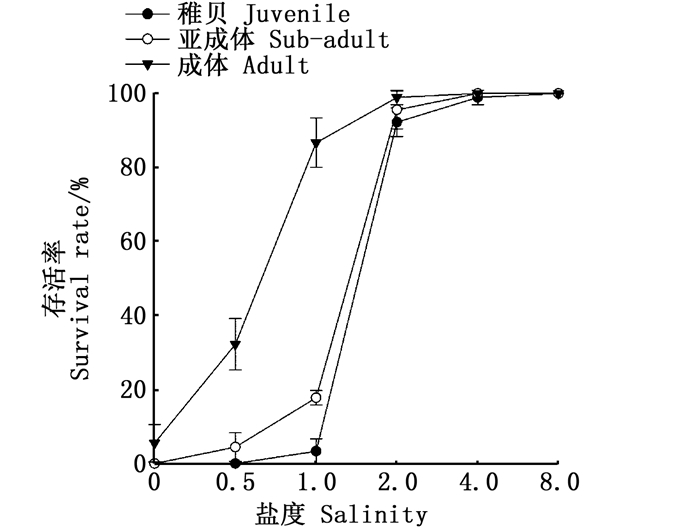
2 结果 2.1 不同规格缢蛏在不同盐度下的急性胁迫实验图 1显示:在盐度为2~8时,3种规格的缢蛏的存活率均接近于100%;而从盐度为1开始,随着盐度的降低,缢蛏的存活率不断降低,并在降低的过程中,成体的存活率始终是最高的,其次是亚成体,而缢蛏稚贝的存活率在各个盐度都是3组中最低的。缢蛏亚成体和稚贝在盐度为0时,存活率几乎为0。在实验的过程中,对缢蛏的死亡率进行计算和观察,缢蛏稚贝在盐度为1胁迫48 h时个体全部死亡(表 1),亚成体在盐度为0.5胁迫48 h时个体全部死亡(表 2),而缢蛏成体在盐度为0胁迫48 h时仍有个别个体存活(表 3)。本实验中,稚贝、亚成体和成体缢蛏的LC50低盐度分别为1.45、1.25和0.75(表 4)。
|
表 1 缢蛏稚贝急性胁迫下个体致死分布 Tab.1 Individual lethal distribution of juvenile razor clam under acute stress |
|
表 2 缢蛏亚成体急性胁迫下个体致死分布 Tab.2 Individual lethal distribution of sub-adult razor clam under acute stress |
|
表 3 缢蛏成体急性胁迫下个体致死分布 Tab.3 Individual lethal distribution of adult razor clam under acute stress |
|
表 4 各规格缢蛏半致死盐度 Tab.4 Semi-lethal salinity |
|
图 1 急性低盐胁迫对不同大小规格缢蛏的存活率的影响 Fig. 1 Effect of acute low salt stress on the survival rate of different size razor clam |
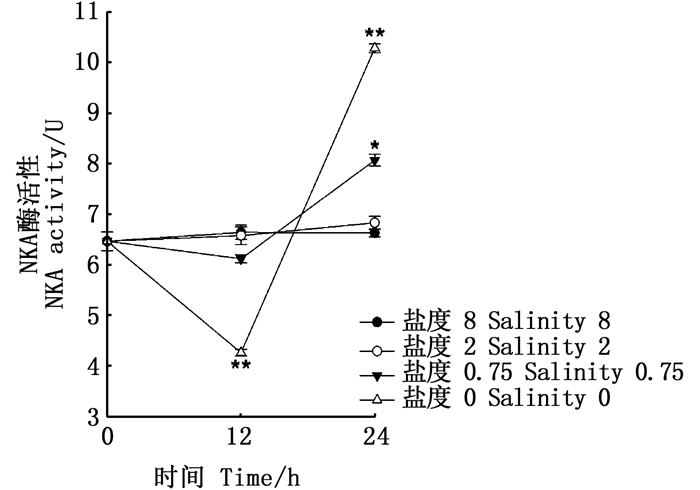
图 2显示:在盐度为2到8时,成体缢蛏在24 h内,NKA的活性处于稳定状态;在盐度为0.75时,成体缢蛏的NKA活性呈现先降低后增加的趋势,并在12 h内活性最低。而与之相似的,在盐度低至0时,缢蛏的NKA活性也呈现先降低后增加的趋势,在12 h时,出现最低值。
|
星号表示差异显著(*P < 0.05, **P < 0.001) Asterisks indicate significant differences(*P < 0.05, **P < 0.001) 图 2 成体缢蛏在不同盐度急性胁迫下的NKA活性 Fig. 2 NKA activity of adult razor clam underacute stress at different salinity |
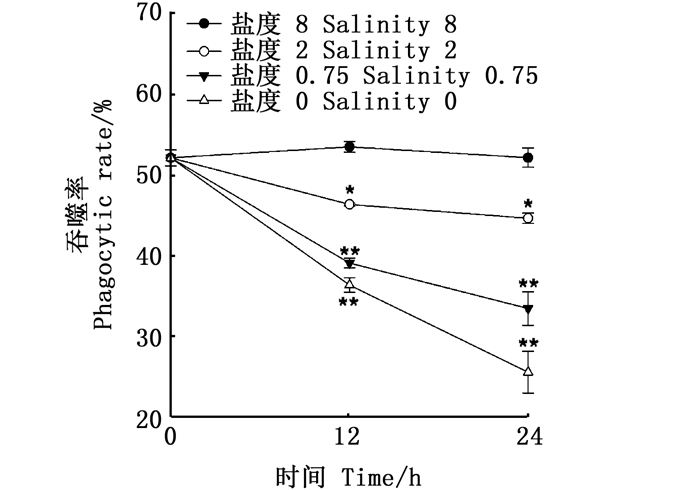
图 3显示:在盐度为8的胁迫下,吞噬率呈现先上升后下降的趋势;在盐度为2时则不同,吞噬率先在12 h内显著下降,在12~24 h出现无显著下降。不同的是,在盐度为0.75和0时,吞噬率一直呈下降趋势。
|
星号表示差异显著(*P < 0.05, **P < 0.001) Asterisks indicate significant differences(*P < 0.05, **P < 0.001) 图 3 成体缢蛏在不同盐度急性胁迫下血淋巴的吞噬能力 Fig. 3 Lymphocyte phagocytic ability of adult razorclam under acute stress at different salinity |
除了少数渗透压调节能力极强的物种(如卤虫[15])外,大部分海洋无脊椎动物都属于变渗动物,即渗透压和外界水环境保持一致。对生活在海水中的变渗无脊椎动物而言,低盐水环境直接影响其体内渗透压的变化,此时体内渗透压高于外界环境,水分进入体内意味着体内将流失大量的盐分。一定浓度的体内盐分是维持动物正常的生理和生长的必要条件,不同盐度耐受能力的无脊椎动物拥有着不一样的体内渗透压调节能力[16-18]。盐度对于缢蛏来说,属于渗透压调节的重要影响因子。从本实验的结果可以看出:在盐度从8降低到2时,缢蛏的存活率接近于100%,3种大小规格缢蛏均没有显著性差异;但是盐度低于2时,缢蛏的存活率逐渐降低,并且成体的存活率始终显著高于亚成体和稚贝。在环境的渗透压降低过程中,外界渗透压在其自身生理活动承受范围内时,缢蛏体内渗透压表现为变渗(随着盐度的降低而降低),当在盐度很低的环境中甚至在淡水情况时可以通过调节代谢和离子转运等手段使其体内保持一个较为稳定的渗透压以维持正常的生理活动。但当超过承受范围内的急性胁迫浓度,缢蛏体内的渗透压无法迅速调节平衡,进而影响生物体的正常生理活动甚至导致死亡[19]。渗透压调节能力极强的物种凡纳滨对虾的体内也存在着相同的调节方式[20]。
NKA酶活性是调节渗透压非常重要的一种酶,NKA酶活性会随着环境盐度的下降而显著上升[21-22]。而在本实验中,成体缢蛏在8和2的盐度时,NKA的活性几乎处于平稳状态,而在盐度为0.75时,NKA的活性有显著的升高。在盐度0时,NKA的活性有先下降后上升的趋势。相似的结果在其他海洋贝类中也有类似的报道,林听听等[23]研究了青蛤(Cyclina sinensis)在盐度16时NKA酶活性变化情况,发现胁迫前16 d其NKA酶活性显著上升,第18天达到峰值后开始回落但是仍然大于初始值。因此可以认为在海洋贝类中NKA酶是调节其体内渗透压稳定的一种非常重要的方式(离子转运调节)。在缢蛏受到低盐急性胁迫的过程中NKA酶参与了渗透压调节过程。
目前针对盐度对海洋无脊椎动物免疫力影响的机理研究尚不清楚,无脊椎动物缺乏后天特异性免疫,当面对病原体侵染的时候海洋无脊椎动物以非特异性免疫来应对和生存,防御体系复杂多样,贝类的血淋巴是机体免疫系统的重要部分,而其吞噬作用是贝类的重要防御功能,但其吞噬能力也容易受环境胁迫的影响[24-25]。在海洋无脊椎动物中关于低盐对凡纳滨对虾免疫影响的研究报道最为系统。研究[26]发现在低盐条件下凡纳滨对虾的血淋巴细胞总数、酚氧化物酶活性、超氧化物歧化酶活性和吞噬活性均显著降低。相同地,在本研究中,成体缢蛏血淋巴细胞的吞噬能力随着盐度的下降和胁迫时间的增加而逐渐下降。杨东敏等[27]研究了低盐对菲律宾蛤仔(Ruditapes philippinarum)免疫力的影响,发现低盐(盐度为7)急性胁迫对其血淋巴细胞总数、吞噬能力和溶菌酶呈现先下降后上升的趋势,预示着菲律宾蛤仔可能具有极强的低盐调节能力。盐度对海洋无脊椎动物的免疫力有重要的影响,在低盐胁迫下其免疫力低于正常环境。另外,低盐胁迫也会导致缢蛏体内生理调节的紊乱[28-31],这也可能是缢蛏吞噬能力降低的主要原因之一。
缢蛏在低盐的胁迫下体内外的渗透压出现失衡,NKA的活力相应升高来维持体内外渗透压的调节。受到低盐的胁迫后,缢蛏机体的生理功能下降,从而导致体内吞噬能力明显下降。而缢蛏在机体承受范围外的盐度下,不能够正常调节急性的胁迫,从而导致机体丧失活力甚至死亡。低于1.5盐度的水域对缢蛏存活会产生急性影响,但是缢蛏对低盐有极高的耐受性,可能是一种极具内陆移殖潜力的海水贝类。
| [1] |
石玉龙.重盐碱地养殖池塘水质特征及变化规律的研究[D].上海: 上海海洋大学, 2009. SHI Y L. Studies on water quality characteristics and change regulations of culture ponds with heavy saline-alkaline soil[D]. Shanghai: Shanghai Ocean University, 2009. |
| [2] |
王萍, 刘济源, 么宗利, 等. 水生动物盐碱适应生理学研究进展[J]. 长江大学学报(自科版), 2015, 12(15): 44-47. WANG P, LIU J Y, YAO Z L, et al. Advances in research on adaptation of saline to alkali in aquatic animals[J]. Journal of Yangtze University (Natural Science Edition), 2015, 12(15): 44-47. |
| [3] |
HUANG H J. Factors affecting the successful culture of Penaeus stylirostris and Penaeus vannamei at an estuarine power plant site: temperature, salinity, inherent growth variability, damselfly nymph predation, population density and distribution, and polyculture[D]. College Station, TX, USA: Texas A & M University, 1983.
|
| [4] |
叶莹莹, 徐梅英, 吴常文. 几种环境因子对厚壳贻贝浮游幼虫生长与存活的影响[J]. 浙江海洋学院学报(自然科学版), 2011, 30(4): 292-296. YE Y Y, XU M Y, WU C W. Influences of some environmental factors on growth and survival of Mytilus coruscus gould larvae[J]. Journal of Zhejiang Ocean University (Natural Science), 2011, 30(4): 292-296. DOI:10.3969/j.issn.1008-830X.2011.04.003 |
| [5] |
杨鹏, 闫喜武, 韩华, 等. 盐度对翡翠贻贝受精卵孵化及幼虫和稚贝生长和存活的影响[J]. 大连海洋大学学报, 2013, 28(6): 549-552. YANG P, YAN X W, HAN H, et al. The influence of salinity on hatching, growth and survival of larvae and juveniles in green mussel Perna viridis[J]. Journal of Dalian Ocean Univerdity, 2013, 28(6): 549-552. DOI:10.3969/j.issn.2095-1388.2013.06.006 |
| [6] |
曹伏君, 刘志刚, 罗正杰. 海水盐度、温度对文蛤稚贝生长及存活的影响[J]. 应用生态学报, 2009, 20(10): 2545-2550. CAO F J, LIU Z G, LUO Z J. Effects of sea water temperature and salinity on the growth and survival of juvenile Meretrix meretrix Linnaeus[J]. Chinese Journal of Applied Ecology, 2009, 20(10): 2545-2550. |
| [7] |
谭杰, 白成, 李燕, 等. 印尼大珠母贝稚贝对温度、盐度的耐受性[J]. 广东海洋大学学报, 2017, 37(3): 110-116. TAN J, BAI C, LI Y, et al. Tolerance of indonesia Pinctada maxima juveniles on temperature and salinity[J]. Journal of Guangdong Ocean University, 2017, 37(3): 110-116. DOI:10.3969/j.issn.1673-9159.2017.03.017 |
| [8] |
谢淑媚, 牛东红, 阮海灯, 等. 缢蛏IGFBP基因结构及生长性状相关SNP筛选[J]. 水产学报, 2015, 39(6): 799-809. XIE S M, NIU D H, RUAN H D, et al. Molecular characterization of IGFBP and association analysis with growth traits in the razor clam Sinonovacula constricta[J]. Journal of Fisheries of China, 2015, 39(6): 799-809. |
| [9] |
刘达博, 牛东红, 姜志勇, 等. 缢蛏7群体的形态差异与判别分析[J]. 海洋渔业, 2009, 31(4): 363-368. LIU D B, NIU D H, JIANG Z Y, et al. Morphological variations and discriminant analysis of seven populations of Sinonovacula constricta[J]. Marine Fisheries, 2009, 31(4): 363-368. DOI:10.3969/j.issn.1004-2490.2009.04.004 |
| [10] |
STEPHAN C E. Methods for calculating an LC50[M]//MAYER F, HAMELINK J. Aquatic Toxicology and Hazard Evaluation. West Conshohocken, PA: ASTM International, 1977: 65-84.
|
| [11] |
SEDMAK J J, GROSSBERG S E. A rapid, sensitive, and versatile assay for protein using Coomassie brilliant blue G250[J]. Analytical Biochemistry, 1977, 79(1/2): 544-552. |
| [12] |
WHEATLY M G, HENRY R P. Branchial and antennal gland Na+/K+-dependent ATPase and carbonic anhydrase activity during salinity acclimation of the euryhaline crayfish Pacifastacus leniusculus[J]. Journal of Experimental Biology, 1987, 133(1): 73-86. |
| [13] |
PENG M X, NIU D H, CHEN Z Y, et al. Expression of a novel complement C3 gene in the razor clam Sinonovacula constricta and its role in innate immune response and hemolysis[J]. Developmental & Comparative Immunology, 2017, 73: 184-192. |
| [14] |
王有基, 林江兴, 李琼珍, 等. 翡翠贻贝血淋巴细胞亚群鉴定及相关免疫功能的流式细胞分析[J]. 水产学报, 2014, 38(3): 385-399. WANG Y J, LIN J X, LI Q Z, et al. Characterization of the subpopulation and flow cytometric analysis of immune-related parameters of hemocytes in the green-lipped mussel Perna viridis[J]. Journal of Fisheries of China, 2014, 38(3): 385-399. |
| [15] |
GEDDES M C. Studies on an Australian brine shrimp, Parartemia zietzian sayce (crustacea:Anostraca)-I. Salinity tolerance[J]. Comparative Biochemistry and Physiology Part A:Physiology, 1975, 51(3): 553-559. DOI:10.1016/0300-9629(75)90341-2 |
| [16] |
PROVENZANO JR A J. The biology of crustacea[M]. New York: Academic Press, 1983.
|
| [17] |
DEATON L. Osmotic and ionic regulation in molluscs[M]//EVANS D H. Osmotic and Ionic Regulation: Cells and Animals. Boca Raton: CRC Press, 2008: 107-133.
|
| [18] |
LARSEN E H, DEATON L E, ONKEN H, et al. Osmoregulation and excretion[J]. Comprehensive Physiology, 2014, 4(2): 405-573. |
| [19] |
PENG M X, LIU X J, NIU D H, et al. Survival, growth and physiology of marine bivalve (Sinonovacula constricta) in long-term low-salt culture[J]. Scientific Reports, 2019, 9(1): 2819. DOI:10.1038/s41598-019-39205-2 |
| [20] |
ROY L A, DAVIS D A, SAOUD I P, et al. Shrimp culture in inland low salinity waters[J]. Reviews in Aquaculture, 2010, 2(4): 191-208. |
| [21] |
PÉQUEUX A. Osmotic regulation in crustaceans[J]. Journal of Crustacean Biology, 1995, 15(1): 1-60. DOI:10.1163/193724095X00578 |
| [22] |
PALACIOS E, BONILLA A, LUNA D, et al. Survival, Na+/K+-ATPase and lipid responses to salinity challenge in fed and starved white pacific shrimp (Litopenaeus vannamei) postlarvae[J]. Aquaculture, 2004, 234(1/4): 497-511. |
| [23] |
林听听, 来琦芳, 陆建学, 等. 几种盐碱因子对青蛤的致毒效应[J]. 海洋渔业, 2012, 34(2): 183-188. LIN T T, LAI Q F, LU J X, et al. Toxic effects of several saline-alkali factors on Cyclina sinensis[J]. Marine Fisheries, 2012, 34(2): 183-188. DOI:10.3969/j.issn.1004-2490.2012.02.009 |
| [24] |
吴芳丽, 王月, 尚跃勇, 等. 水生无脊椎动物血淋巴细胞分类及免疫研究进展[J]. 大连海洋大学学报, 2016, 31(6): 696-704. WU F L, WANG Y, SHANG Y Y, et al. Current progress of research on classification and immunity of hemocytes in aquatic invertebrates:a review[J]. Journal of Dalian Ocean University, 2016, 31(6): 696-704. |
| [25] |
LACOSTE A, MALHAM S K, CUEFF A, et al. Noradrenaline modulates oyster hemocyte phagocytosis via a β-adrenergic receptor-cAMP signaling pathway[J]. General and Comparative Endocrinology, 2001, 122(3): 252-259. |
| [26] |
WANG L U, CHEN J C. The immune response of white shrimp Litopenaeus vannamei and its susceptibility to Vibrio alginolyticus at different salinity levels[J]. Fish & Shellfish Immunology, 2005, 18(4): 269-278. |
| [27] |
杨东敏, 张艳丽, 丁鉴锋, 等. 高温、低盐对菲律宾蛤仔免疫能力的影响[J]. 大连海洋大学学报, 2017, 32(3): 302-309. YANG D M, ZHANG Y L, DING J F, et al. Synergistic effects of high temperature and low salinity on immunity of Manila clam Ruditapes philippinarum[J]. Journal of Dalian Ocean University, 2017, 32(3): 302-309. |
| [28] |
JORGENSEN P L. Importance for absorption of Na+ from freshwater of lysine, valine and serine substitutions in the α1a-isoform of Na, K-ATPase in the gills of rainbow trout (Oncorhynchus mykiss) and atlantic salmon (Salmo salar)[J]. Journal of Membrane Biology, 2008, 223(1): 37-47. |
| [29] |
LIN C H, LEE T H. Sodium or potassium ions activate different kinetics of gill Na, K-ATPase in three seawater- and freshwater-acclimated euryhaline teleosts[J]. Journal of Experimental Zoology Part A:Comparative Experimental Biology, 2005, 303A(1): 57-65. DOI:10.1002/jez.a.130 |
| [30] |
SAOUD I P, ROY L A, DAVIS D A. Chelated potassium and arginine supplementation in diets of pacific white shrimp reared in low-salinity waters of west Alabama[J]. North American Journal of Aquaculture, 2007, 69(3): 265-270. DOI:10.1577/A06-045.1 |
| [31] |
VERBOST P M, SCHOENMAKERS T J M, FLIK G, et al. Kinetics of ATP- and Na+-gradient driven Ca2+ transport in basolateral membranes from gills of freshwater- and seawater-adapted tilapia[J]. Journal of Experimental Biology, 1994, 186: 95-108. |
2. Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquaculture, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


