大银鱼(Protosalanx hyalocranius)隶属于硬骨鱼纲(Osteicthyes)胡瓜鱼目(Osmeriformes)银鱼科(Salangidae)大银鱼亚科(Protosalanginae)大银鱼属(Protosalanx Regan)[1],主要分布于东海、黄海、渤海海域和长江、淮河中下游河道及湖泊水库,是中国银鱼科中分布广泛、产量较高的鱼类,且具有较高的营养价值和经济价值。大银鱼生命周期为1年,个体小、生长快、世代离散,种群易波动,对环境变化较为敏感,是典型的r-对策者[2]。多年来,受环境污染、过度捕捞、水利工程以及生境破碎化等多种不利因素的影响,银鱼分布范围缩小,种群数量急剧下降,天然资源已趋于枯竭[2]。目前,关于大银鱼的研究主要集中在营养[3]、生物学特性[4]、种群生态[5-6]和移植增殖[7]等方面,而在分子生物学方面的研究较少[8-10]。
物种遗传多样性是生物多样性的重要组成部分,遗传多样性不仅是形成生物多样性的基础,也是物种进化潜能的保证[11]。了解物种遗传背景对于物种科学保护和合理利用至关重要。分子标记作为检测物种遗传多样性和遗传结构的一种有效手段,已在鱼类和其他生物中广泛应用。鱼类线粒DNA因其具有严格遵守母系遗传、几乎不发生重组、进化速度快等特征,是探讨种间和种内遗传分化程度及系统演化研究的良好分子标记[12]。细胞色素b(cytochrome b, Cytb)基因是线粒体DNA中的蛋白质编码基因之一,对其结构和功能了解得最为清楚,且该基因具有进化速度较快、易扩增等优点,被广泛用于鱼类遗传多样性及遗传结构研究[13-15]。
江苏省位于长江和淮河下游,湖泊众多,是我国银鱼资源的重要分布区域。长期以来,大银鱼都是江苏省湖泊渔业重要的捕捞对象,也是出口创汇的重要水产品之一。目前,大银鱼在湖泊中已无法形成渔汛,资源趋于枯竭,开展大银鱼种质资源保护刻不容缓[16]。以线粒体Cytb基因序列作为分子标记,分析江苏省4个湖泊(太湖、高邮湖、洪泽湖和骆马湖)大银鱼种群的遗传多样性及遗传结构,以期为科学保护和合理利用大银鱼种质资源提供重要参考。
1 材料与方法 1.1 样本采集2015—2018年,共采集了江苏省太湖(TL)、高邮湖(GYL)、洪泽湖(HZL)和骆马湖(LML)等4个湖泊野生大银鱼群体样本,每个群体均采集40尾样本,共160尾样本。剪取样本肌肉组织用无水乙醇固定,置于-20 ℃冰箱低温保存。
1.2 DNA提取、PCR扩增与测序基因组DNA采用广谱性基因组DNA抽提试剂盒(TaKaRa, 宝日医生物技术有限公司)提取,使用核酸蛋白定量仪(Eppendorf, BioPhotometer Plus, 德国)检测所提DNA浓度与质量,并用1%琼脂糖电泳检测其完整性。DNA样品稀释成40 ng/mL的终浓度, 保存于-20 ℃备用。
Ctyb扩增和测序引物为L14321 (5′-CCAGTGACTTGAAAAACCACCG-3′)、H15634(5′-CTTAGCTTTGGGAGTTAAGGGT-3′)[17]。引物由生工生物工程(上海)股份有限公司合成。PCR扩增体系为50 μL, 包括10×PCR buffer (含Mg2+) 5 μL、dNTPs (10 mmol/L) 4 μL、Taq酶(5 U/μL) 0.5 μL、上游及下游引物(10 μmol/L)各2.0 μL、模板DNA (40 ng/μL) 2.0 μL,补充无菌水至50 μL。PCR扩增程序为: 94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火50 s, 72 ℃延伸90 s, 反应30个循环;72 ℃延伸10 min,4 ℃保存。
扩增产物用1.0%琼脂糖凝胶电泳检测,送生工生物工程(上海)股份有限公司测序。为保证所测序列的准确性,所有样品均采用双向测序, 测序引物与扩增引物相同。
1.3 序列整理与数据处理采用BioEdit 7.0软件和Clustal X 1.81软件对测序结果进行编辑和同源比对。群体序列遗传多样性参数,包括多态性位点数、单倍型数、单倍型多样性(Hd)和核苷酸多样性(π)等由DnaSP 5.0软件获得。
利用MEGA 7.0软件统计序列碱基组成,计算群体间的Kimura双参数模型遗传距离。以太湖新银鱼(Neosalanx taihuensis, GenBank登录号:MH348204.1)作为外群,采用邻接法(neighbor-joining, NJ)构建系统发育进化树,系统发育树分支的置信度用自展法重复检测1 000次。利用Network 5.0软件构建单倍型的简约中介(reduced-median, MJ)网络图,用以检测单倍型之间的进化关系。
采用Arlequin 3.11中的分子变异分析(AMOVA)方法估算遗传变异在群体内和群体间的分布及遗传分化指数(F-statistics, Fst),并用排列测验法(permutation test)检验Fst的显著性(重复次数为1 000)。联合使用Tajima′s D检验、Fu′s Fs检验和核苷酸不配对分布(mismatch distribution)推断群体是否发生扩张的历史。对于不能拒绝种群扩张模型而且错配分布呈现光滑单峰的种群,用公式τ=2ut估算种群扩张时间[18],τ为Tau,是种群扩张参数,由Arlequin软件计算得到,t为每个世代种群的扩张时间,u为每个世代每条序列的变异速率;另根据公式u=2μk计算u,μ为每个碱基的变异速率,参照大银鱼近缘物种太湖新银鱼的碱基突变速率,采用1% per Myr (1×108)[19],k表示序列长度(bp)。扩张时间T=t×世代时间,由于大银鱼生活周期为1年,这里取世代时间为1。
2 结果 2.1 序列变异及遗传多样性经PCR扩增、测序与分析,获得160尾大银鱼Cytb基因全序列长度为1 141 bp。160条序列中共检测到25个变异位点,变异比例为2.19%。其中,单一信息位点有11个,简约信息位点为14个。变异均为转换或颠换,转换与颠换的比为37.5,没有插入或缺失位点。4个种群所有个体序列中的碱基平均含量分别为T(29.3%)、C(32.3%)、A(21.7%)和G(16.7%),A+T含量(51.0%)略高于G+C含量(49.0%),其中碱基G的含量最低,显示出明显的反G偏倚特点。
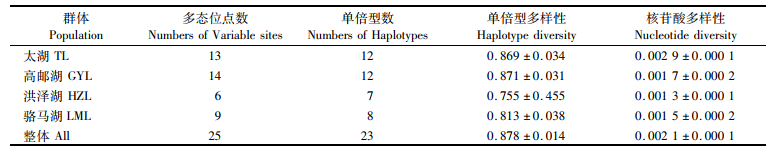
160尾大银鱼个体共检测到25个变异位点,定义了23个单倍型,单倍型和核苷酸多样性分别为0.878±0.014和0.002 1±0.000 1(表 1)。高邮湖群体的单倍型多样性最高,为0.871±0.031;太湖群体的核苷酸多样性最高,为0.002 9±0.000 1;洪泽湖群体的单倍型多样性和核苷酸多样性均最低,分别为0.755±0.455和0.001 3±0.000 1。4个群体的遗传多样性均呈现出高单倍型多样性和低核苷酸多样性特点。
|
表 1 大银鱼群体的遗传多样性参数 Tab.1 Genetic diversity parameters of four Protosalanx hyalocranius populations |
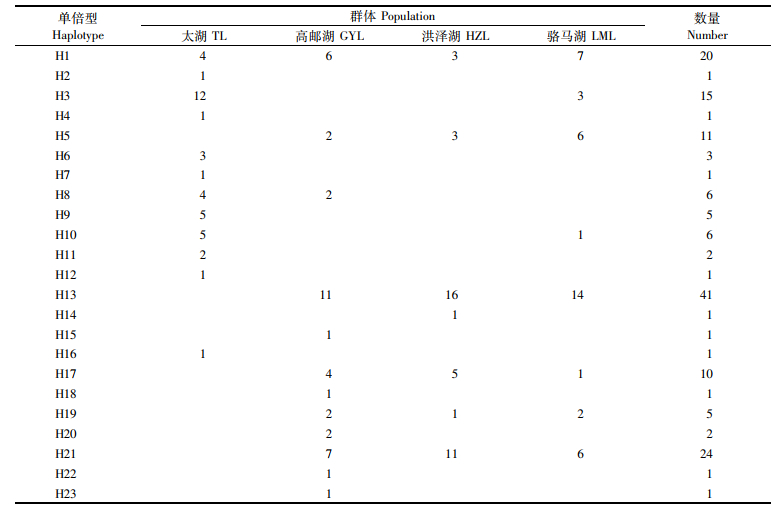
4个群体共定义23个单倍型(H1-H23,表 2),其中H1、H13和H21为优势单倍型,分别占个体数的12.5%、25.6%和15.0%。单倍型H1、H3、H5、H8、H10、H13、H17、H19和H21被2至4个群体共享,其中:H1是分布最广泛的单倍型,在4个群体中都有分布;单倍型H5、H13、H17、H19和H21则为高邮湖、洪泽湖和骆马湖3个群体共享。其他14个单倍型为各群体特有单倍型,其中太湖群体拥有8个特有单倍型,高邮湖群体拥有5个特有单倍型,洪泽湖群体拥有1个特有单倍型。太湖和高邮湖群体单倍型比例均为30.0%,表现了较为丰富的单倍型数;洪泽湖和骆马湖群体单倍型比例分别为17.5%和20.0%,表现了较为贫瘠的单倍型数。
|
表 2 大银鱼群体单倍型组成及分布 Tab.2 The composition and distribution of haplotypes in Protosalanx hyalocranius |
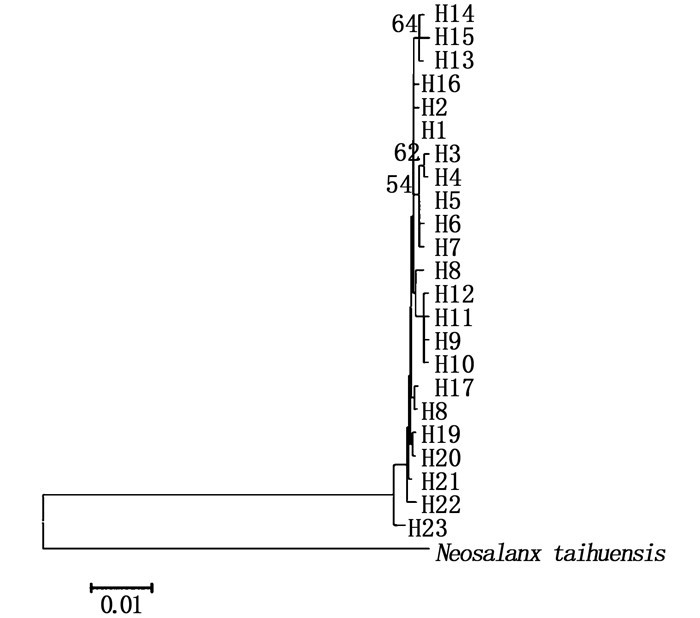
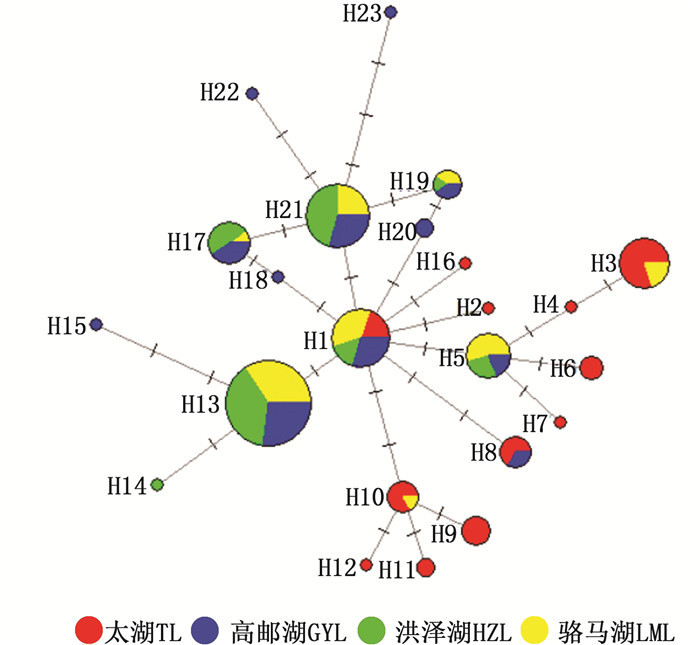
以太湖新银鱼(N. taihuensis)为外类群,采用邻接法构建单倍型分子系统树(图 1)。结果表明,不同群体的单倍型混杂分布,聚集为一支,没有表现出与其地理位置分布相对应的遗传结构关系。利用Network 5.0软件构建大银鱼单倍型进化网络图(图 2),结果显示,最小网络图整体呈星状,单倍型H1位于网络图中心,其他单倍型均由其进化而来,说明H1是祖先单倍型。大多数单倍型之间只有1步突变,各单倍型相互散布在不同的地理种群中,未形成明显的系统地理格局,进一步支持了系统发育树的分析。
|
图 1 大银鱼单倍型NJ系统进化树 Fig. 1 Phylogenetic tree of haplotypes by NJ analysis based on Cytb sequences |
|
图 2 大银鱼单倍型最小网络进化关系图 Fig. 2 Haplotypes minimum spanning network for Protosalanx hyalocranius |
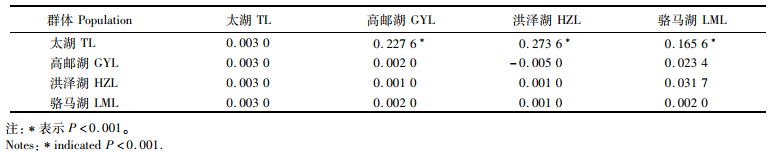
利用MEGA 7.0软件计算群体内和群体间的遗传距离(表 3)。结果表明:太湖群体内的遗传距离为0.003,高邮湖和骆马湖群体内的遗传距离均为0.002,洪泽湖群体内的遗传距离为0.001。太湖群体与其他群体间的遗传距离为0.003,高邮湖与洪泽湖群体间的遗传距离为0.001,与骆马湖群体间的遗传距离为0.002,洪泽湖与骆马湖群体间的遗传距离为0.001。
|
表 3 大银鱼群体内遗传距离(对角线)及群体间遗传距离(对角线下)和遗传分化指数(对角线线上) Tab.3 Genetic distances within population (diagonal), and pairwise genetic distance (below diagonal) and fixation index (above diagonal) among populations of Protosalanx hyalocranius |
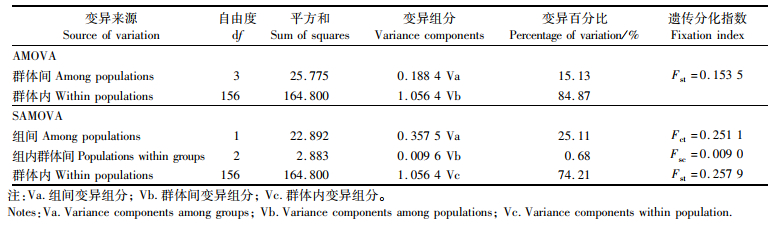
AMOVA结果(表 4)显示,群体间的分子变异占比为15.13%,群体内的分子变异占比为84.87%,群体间的遗传分化指数Fst为0.153 5,达到极显著性水平(P=0.000 0)。两两群体间的Fst值及其统计结果(表 3)显示,高邮湖、洪泽湖和骆马湖群体间没有显著性差异,但均与太湖群体有显著性差异。太湖与洪泽湖群体间的Fst值最大,高邮湖与洪泽湖群体间的Fst值最小。SAMOVA结果(表 4)显示,将太湖群体单独分为一组, 其他3个群体分为一组时,组间遗传分化指数Fct为0.251 1,达到极显著水平(P=0.000 0),表明两组群体间存在显著遗传差异。
|
表 4 大银鱼群体内和群体间的AMOVA和SAMOVA分析结果 Tab.4 Results of AMOVA and SAMOVA analysis among and within Protosalanx hyalocranius populations |
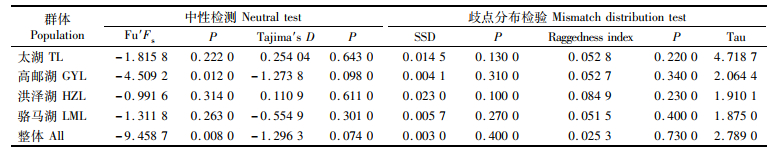
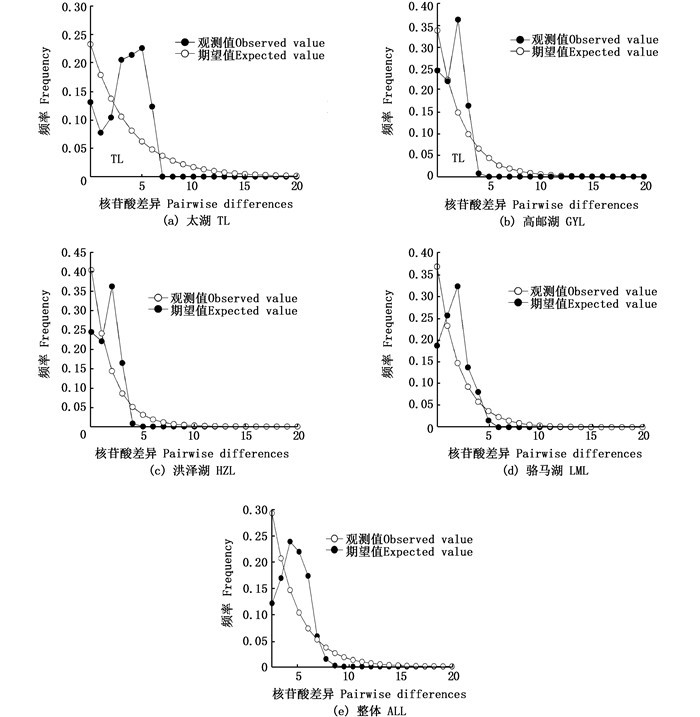
中性检测结果显示,4个大银鱼群体的Fu′Fs值均为负值,且高邮湖群体的统计检验达到显著水平。高邮湖和骆马湖群体的Tajima′s D值为负值,太湖群体和洪泽湖群体的Tajima′s D值为正值,但统计检验均未达到显著水平。将4个大银鱼群体作为一个整体进行中性检验分析,结果表明Fu′Fs和Tajima′s D值均为负值,且Fu′Fs值统计检验达到极显著差异(表 5)。歧点分布图(图 3)分析表明,4个大银鱼群体和大银鱼整体的歧点分布图呈现单峰型,且SSD和Raggedness指数2个参数的统计检验均不显著(P>0.05),说明未显著偏离群体扩张模型。综合中性检验和歧点分布分析结果可以得出,大银鱼群体进化偏离中性检验,经历了种群扩张。根据大银鱼群体的扩张参数值,估算出大银鱼种群扩张事件发生在第四纪更新世晚期(距今10.3万~4.1万年前)。
|
表 5 大银鱼群体历史动态分析结果 Tab.5 Results of neutral tests and mismatch distribution tests |
|
图 3 大银鱼种群的歧点分布图 Fig. 3 Mismatch-distribution analysis of Protosalanx hyalocranius population |
物种的遗传多样性是生物长期进化的产物,遗传多样性的高低与物种的生存能力和进化潜力有密切的相关性。对物种遗传多样性水平、形成机制及分布格局的研究,不仅可以了解物种的进化历史,也可以为分析物种的进化潜力和预测物种发展动向提供重要依据。单倍型多样性(Hd)和核苷酸多样性(π)则是衡量遗传多样性的2个重要指标[20]。根据GRANT和BOWEN提出鱼类遗传多样性标准,单倍型多样性以0.5为临界值,核苷酸多样性以0.005为临界值,二者的值越大,群体的遗传多样性程度越高[21]。江苏省4个湖泊大银鱼群体的单倍型多样性为0.755±0.455~0.871±0.031,核苷酸多样性为0.001 3±0.000 1~ 0.002 9±0.000 1,表明4个大银鱼群体的单倍型多样性较高,而核苷酸多样性较低。整体来看,大银鱼群体的单倍型多样性为0.878±0.014,核苷酸多样性为0.002 1±0.000 1,也显示出较高的单倍型多样性和较低的核苷酸多样性特点。这种高单倍型多样性低核苷酸多样性的模式可能是群体受到瓶颈效应后种群迅速扩张所导致的结果,由于核苷酸多样性所需时间比积累单倍型所需的时间漫长,这说明4个湖泊大银鱼群体是从一个有效种群数量较小的种群,经快速扩张而来的,但是仍然没有达到积累核苷酸变异所需要的时间。这一推测将在后续的历史动态分析中进一步证实。
4个大银鱼群体的遗传多样性高低存在差异,其中太湖群体和高邮湖群体的遗传多样性相对较高,而洪泽湖群体和骆马湖群体的遗传多样性相对较低,这可能与湖泊生态环境、捕捞强度及渔业管理模式等多种因素有关。与其他大银鱼地理群体遗传多样性相比较,如三峡库区群体(Hd: 0.804±0.032, π: 0.001 5±0.000 1)[22]、黑龙江群体(Hd: 0.827± 0.038, π: 0.002 0± 0.000 3)、松花江群体(Hd: 0.876±0.038, π: 0.001 9±0.000 2)、兴凯湖群体(Hd: 0.667± 0.041, π: 0.001 9±0.000 3)和莲花湖群体(Hd: 0.823±0.026, π: 0.001 4±0.000 1)[23],可以得出江苏省湖泊大银鱼群体的遗传多样性较高。与其他种类的银鱼,如太湖新银鱼(Hd: 0.713±0.022, π: 0.002 2±0.000 1, Hd:0.671±0.061, π: 0.002 3±0.000 2)[19, 22]、乔什新银鱼(Hd: 0.590±0.047, π:0.000 9±0.000 1)[24]、短吻间银鱼(Hd: 0.385±0.149, π: 0.000 7±0.000 3)[22]、白肌银鱼(Leucosoma chinensis,Hd: 0.888, π: 0.099 0)[25]和居氏银鱼(Salanx curvieri,Hd: 0.967, π: 0.006 0)[26]相比较,可以得出大银鱼的遗传多样性高于太湖新银鱼、乔什新银鱼及短吻间银鱼的遗传多样性,而低于白肌银鱼和居氏银鱼的遗传多样性。因此,大银鱼种群的遗传多样性还有待进一步提高。
3.2 大银鱼群体遗传结构分析研究群体遗传结构不仅可以用于评价物种群体的变异水平和不同地理群体之间的关系,还可以确定群体中的进化显著单元和管理单元,以及制定资源的保护和管理策略[27]。遗传分化指数Fst是用于评价亚群间遗传分化程度的重要指标:若Fst小于0.05,表明群体间遗传分化较小;Fst为0.05~0.15,表明群体间存在中等分化;Fst大于0.15,表明群体间高度分化[28]。总体来看,4个大银鱼群体间的Fst为0.153 5,且具有显著性差异(P < 0.01,表 4),表明大银鱼群体间存在高度遗传分化。其中:太湖群体与高邮湖、洪泽湖和骆马群体间的Fst均大于0.15,且具有显著性遗传差异(P < 0.01);而高邮湖、洪泽湖和骆马湖群体间的Fst均小于0.05,且差异不显著(P>0.05,表 3)。这说明太湖群体与高邮湖、洪泽湖和骆马群体间具有显著遗传分化,而高邮湖、洪泽湖和骆马群体间没有显著遗传差异,这可能与群体分布流域和地理隔离等因素有关。一般来说,鱼类在不同水系之间存在明显的地理障碍,通常在流域之间存在明显的种群分化,同一流域内的种群通常分化不明显或没有遗传分化[29-30]。从分布流域来看,太湖属于长江水系,位于长江南面,而高邮湖、洪泽湖和骆马湖则属于淮河水系,位于长江北面。同时,由于大量水利工程存在,阻碍了水系间鱼类自由交流的通道。从单倍型组成来看,太湖群体拥有8个特有单倍型,与高邮湖、洪泽湖和骆马湖群体之间仅有1个共享单倍型,而高邮湖、洪泽湖和骆马湖群体之间拥有6个共享单倍型,说明太湖群体与高邮湖、洪泽湖和骆马湖群体间的基因交流较弱,而高邮湖、洪泽湖和骆马湖群体间存在广泛的基因交流。已有研究者[31]基于线粒体COⅠ序列研究了太湖和洪泽湖大银鱼群体间的遗传差异,结果显示两群体间遗传分化系数为0.201 8,表明两群体间存在高度遗传分化,与本研究结果具有一致性。
3.3 大银鱼群体历史动态研究利用中性检验和核苷酸歧点分布可推测种群经过的历史。若Tajima′s D和Fu′s Fs的检测呈负值且歧点分布分析图谱呈泊松状分布的单峰, 说明种群可能发生了瓶颈效应或者种群扩张。4个大银鱼群体Fu′s Fs和Tajima′s D值呈负值(表 5),暗示其偏离中性进化,且歧点分布图均呈明显的单峰形(图 3),均说明4个大银鱼群体在历史上出现过扩张。另外核酸不配对分布检验中,SSD和Raggedness指数两个参数的统计检验均不显著,也说明未显著偏离群体扩张模型。经推算,4个群体扩张时间为10.3万~4.1万年前,属于第四纪更新世晚期大理亚冰期,早于发生约1.8万年前的最后一次大冰期[32]。因此可以推测,随着最后一次冰期结束,气候变暖,海平面上升,大银鱼可能由其避难所向外扩散发生重新殖化事件,形成高单倍型多样性和低核苷酸多样性的遗传多样性模式。
3.4 大银鱼种质资源保护与管理本研究对江苏省4个湖泊大银鱼种群遗传多样性及遗传结构进行了分析,整体来看,大银鱼种群遗传多样性较高,群体间存在显著的遗传分化。由于太湖群体与高邮湖、洪泽湖和骆马湖群体间存在高度的遗传分化,建议将他们作为两个不同的管理单元分别进行保护,尤其应对太湖群体采取重点保护。另外,作为一年生“r-对策”生物,大银鱼种群对生境变化较为敏感,因此要把栖息地保护、水污染控制置于优先考虑的地位。同时,要严格控制捕捞强度,禁止在产卵期捕鱼,并对捕捞工具和网目大小作出规定,保证大银鱼的生殖繁衍和种质资源恢复,进而提高其遗传多样性。
| [1] |
解玉浩, 解涵. 银鱼科鱼类的分类分布和种群生态[J]. 水产学杂志, 1997, 10(2): 11-19. XIE Y H, XIE H. Classification, distribution, and population ecology of Salangidae fishes[J]. Chinese Journal of Fisheries, 1997, 10(2): 11-19. |
| [2] |
王忠锁, 傅萃长, 雷光春. 中国银鱼的多样性及其保护对策[J]. 生物多样性, 2002, 10(4): 416-424. WANG Z S, FU C Z, LEI G C. Biodiversity of Chinese icefishes (Salangidae) and their conserving strategies[J]. Biodiversity Science, 2002, 10(4): 416-424. DOI:10.3321/j.issn:1005-0094.2002.04.009 |
| [3] |
周彦锋, 徐东坡, 单俊峰, 等. 3个地理群体大银鱼营养成分的分析与评价[J]. 上海海洋大学学报, 2011, 20(5): 734-740. ZHOU Y F, XU D P, SHAN J F, et al. An analysis and evaluation of nutritional components of Protosalanx hyalocranius Abbott from three wild populations[J]. Journal of Shanghai Ocean University, 2011, 20(5): 734-740. |
| [4] |
林长虹. 大银鱼生物学特性及移植技术[J]. 水利渔业, 1993(5): 15-17. LIN C H. Biological charactistics of Protosalanx hyalocranius and its transplantation techniques[J]. Reservoir Fisheries, 1993(5): 15-17. |
| [5] |
薛以平, 吴建广. 水库大银鱼种群生态演变规律及增殖利用初探[J]. 淡水渔业, 2004, 34(3): 57-59. XUE Y P, WU J G. Preliminary study on the population ecological evolution and proliferation and utilization of Protosalanx hyalocranius in reservoir[J]. Freshwater Fisheries, 2004, 34(3): 57-59. DOI:10.3969/j.issn.1000-6907.2004.03.019 |
| [6] |
赵丽爽, 程飞, 张磊, 等. 洪泽湖大银鱼和太湖新银鱼的生长、死亡参数及资源利用状况[J]. 水生生物学报, 2018, 42(2): 240-249. ZHAO L S, CHENG F, ZHANG L, et al. Growth, mortality and evaluation of resource utilization for two salangidae, Protosalanx hyalocranius and Neosalanx taihuensis in Hongze Lake[J]. Acta Hydrobiologica Sinica, 2018, 42(2): 240-249. |
| [7] |
戈志强, 沈其璋, 喻叔英. 大银鱼移植、增殖放流技术的探讨[J]. 淡水渔业, 1999, 29(1): 11-13. GE Z Q, SHEN Q Z, YU S Y. Techniques for transplantation enhancement and releasing of large icefish (Protosalanx hyalocranius Abbott)[J]. Freshwater Fisheries, 1999, 29(1): 11-13. DOI:10.3969/j.issn.1000-6907.1999.01.003 |
| [8] |
夏德全, 曹萤, 吴婷婷, 等. 太湖中大银鱼、太湖新银鱼和寡齿新银鱼群体的遗传结构[J]. 水产学报, 1999, 23(3): 254-260. XIA D Q, CAO Y, WU T T, et al. Genetic structures of population of Protosalanx chinensis, Neosalanx taihuensis and Neosalanx oligodontis in Lake Taihu[J]. Journal of Fisheries of China, 1999, 23(3): 254-260. |
| [9] |
夏德全, 曹萤, 吴婷婷, 等. 用RAPD方法分析太湖大银鱼、太湖新银鱼和寡齿新银鱼的亲缘关系[J]. 中国水产科学, 2000, 7(1): 12-15. XIA D Q, CAO Y, WU T T, et al. Study on lineages of Protosalanx chinensis, Neosalanx taihuensis and N.oligodontis in Taihu Lake with RAPD technique[J]. Journal of Fishery Sciences of China, 2000, 7(1): 12-15. DOI:10.3321/j.issn:1005-8737.2000.01.003 |
| [10] |
高天翔, 陈省平, 韩志强, 等. 大银鱼和小齿日本银鱼线粒体细胞色素b和16S rRNA基因部分序列分析[J]. 中国海洋大学学报, 2004, 34(5): 791-794. GAO T X, CHEN S P, HAN Z Q, et al. Partial sequence analysis of mitochondrial cytochrome b and 16S rRNA genes of Protosalanx hyalocranius and Salangichthys microdon[J]. Periodical of Ocean University of China, 2004, 34(5): 791-794. |
| [11] |
李延梅, 牛栋, 张志强, 等. 国际生物多样性研究科学计划与热点述评[J]. 生态学报, 2009, 29(4): 2115-2122. LI Y M, NIU D, ZHANG Z Q, et al. Review of international scientific programmes and frontiers of biodiversity research[J]. Acta Ecologica Sinica, 2009, 29(4): 2115-2122. DOI:10.3321/j.issn:1000-0933.2009.04.059 |
| [12] |
肖武汉, 张亚平. 鱼类线粒体DNA的遗传与进化[J]. 水生生物学报, 2000, 24(4): 384-391. XIAO W H, ZHANG Y P. Genetics and evolution of mitochondrial DNA in fish[J]. Acta Hydrobiologica Sinica, 2000, 24(4): 384-391. DOI:10.3321/j.issn:1000-3207.2000.04.014 |
| [13] |
李大命, 张彤晴, 唐晟凯, 等. 太湖大银鱼(Protosalanx chinensis)细胞色素b基因序列多态性分析[J]. 江苏农业学报, 2015, 31(4): 840-845. LI D M, ZHANG T Q, TANG S K, et al. Genetic polymorphism of mitochondrial DNA cytochrome b (cytb) sequences of Protosalanx chinensis in Lake Taihu[J]. Jiangsu Journal of Agricultural Sciences, 2015, 31(4): 840-845. DOI:10.3969/j.issn.1000-4440.2015.04.021 |
| [14] |
李大命, 李康, 张彤晴, 等. 洪泽湖大银鱼(Protosalanx hyalocranius) Cytb和CO Ⅰ基因序列多态性分析[J]. 渔业科学进展, 2017, 38(6): 25-31. LI D M, LI K, ZHANG T Q, et al. Genetic polymorphism analysis of Cytb and COⅠGene Sequences of Protosalanx hyalocranius in the Hongze Lake[J]. Progress in Fishery Sciences, 2017, 38(6): 25-31. |
| [15] |
蓝昭军, 李强, 舒琥, 等. 基于线粒体细胞色素b基因的光倒刺鲃遗传多样性与遗传结构研究[J]. 海洋与湖沼, 2016, 47(6): 1158-1165. LAN Z J, LI Q, SHU H, et al. Genetic diversity and stuucture of Spinibarbus hollandi based on nucleotide sequences of mtDNA cytochrome b gene[J]. Oceanologia et Limnologia Sinica, 2016, 47(6): 1158-1165. |
| [16] |
倪勇, 伍汉霖. 江苏鱼类志[M]. 北京: 中国农业出版社, 2006: 35-36. NI Y, WU H L. Fishes of Jiangsu Province[M]. Beijing: China Agriculture Press, 2006: 35-36. |
| [17] |
ZHANG J, LI M, XU M Q, et al. Molecular phylogeny of icefish Salangidae based on complete mtDNA cytochrome b sequences, with comments on estuarine fish evolution[J]. Biological Journal of the Linnean Society, 2007, 91(2): 325-340. DOI:10.1111/j.1095-8312.2007.00785.x |
| [18] |
ROGERS A R, HARPENDING H. Population growth makes waves in the distribution of pairwise genetic differences[J]. Molecular Biology and Evolution, 1992, 9(3): 552-569. |
| [19] |
ZHAO L, ZHANG J, LIU Z J, et al. Complex population genetic and demographic history of the Salangid, Neosalanx taihuensis, based on cytochrome b sequences[J]. BMC Evolutionary Biology, 2008, 8: 201. DOI:10.1186/1471-2148-8-201 |
| [20] |
FÉRAL J P. How useful are the genetic markers in attempts to understand and manage marine biodiversity?[J]. Journal of Experimental Marine Biology and Ecology, 2002, 268(2): 121-145. DOI:10.1016/S0022-0981(01)00382-3 |
| [21] |
GRANT W A S, BOWEN B W. Shallow population histories in deep evolutionary lineages of marine fishes:insights from sardines and anchovies and lessons for conservation[J]. Journal of Heredity, 1998, 89(5): 415-426. DOI:10.1093/jhered/89.5.415 |
| [22] |
罗宏伟, 段辛斌, 王珂, 等. 三峡库区3种银鱼线粒体DNA细胞色素b基因序列多态性分析[J]. 淡水渔业, 2009, 39(6): 16-21. LUO H W, DUAN X B, WANG K, et al. Genetic polymorphism analysis of mitochondrial DNA cytochrome b sequences of three species of salangids in the Three Gorges Reservior[J]. Freshwater Fisheries, 2009, 39(6): 16-21. DOI:10.3969/j.issn.1000-6907.2009.06.003 |
| [23] |
TANG F J, LI D M, LIU W, et al. Evolutionary tendency of clearhead icefish Protosalanx hyalocranius inferring Mitochondrial DNA variation analyses in Amur (Heilongjiang) River catchment, China[J]. International Journal of Agriculture and Biology, 2008, 20(10): 2329-2334. |
| [24] |
赵亮, 张洁, 刘志瑾, 等. 乔氏新银鱼基于细胞色素b序列的种群遗传结构和种群历史[J]. 生物多样性, 2010, 18(3): 251-261. ZHAO L, ZHANG J, LIU Z J, et al. Population genetic structure and demographic history of Neosalanx jordani based on cytochrome b sequences[J]. Biodiversity Science, 2010, 18(3): 251-261. |
| [25] |
黄小彧, 章群, 司从利, 等. 基于细胞色素b基因的白肌银鱼遗传多样性[J]. 江苏农业科学, 2012, 40(4): 45-48. HUANG X Y, ZHANG Q, SI C L, et al. Genetic diversity analysis of Leucosoma chinensis based on mtDNA Cytb gene sequences[J]. Jiangsu Agricultural Sciences, 2012, 40(4): 45-48. DOI:10.3969/j.issn.1002-1302.2012.04.013 |
| [26] |
司从利, 章群, 黄小彧, 等. 基于细胞色素b基因序列分析的华南居氏银鱼遗传多样性研究[J]. 海洋渔业, 2012, 34(1): 1-6. SI C L, ZHANG Q, HUANG X Y, et al. Genetic diversity of Salanx curvieri in south China inferred from mtDNA cytb sequences[J]. Marine Fisheries, 2012, 34(1): 1-6. DOI:10.3969/j.issn.1004-2490.2012.01.001 |
| [27] |
O'BRIEN S J. A role for molecular genetics in biological conservation[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(13): 5748-5755. DOI:10.1073/pnas.91.13.5748 |
| [28] |
BALLOUX F, LUGON-MOULIN N. The estimation of population differentiation with microsatellite markers[J]. Molecular Ecology, 2002, 11(2): 155-165. DOI:10.1046/j.0962-1083.2001.01436.x |
| [29] |
PERDICES A, SAYANDA D, COELHO M M. Mitochondrial diversity of Opsariichthys bidens (Teleostei, Cyprinidae) in three Chinese drainages[J]. Molecular Phylogenetics and Evolution, 2005, 37(3): 920-927. DOI:10.1016/j.ympev.2005.04.020 |
| [30] |
XIA Y Z, CHEN Y Y, SHENG Y. Phylogeographic structure of lenok (Brachymystax lenok Pallas) (Salmoninae, Salmonidae) populations in water systems of eastern China, inferred from mitochondrial DNA sequences[J]. Zoological Studies, 2006, 45(2): 190-200. |
| [31] |
赵琳, 张敏莹, 徐东坡, 等. 2个地理种群大银鱼CO Ⅰ基因序列变异与遗传分化[J]. 大连海洋大学学报, 2016, 31(3): 285-289. ZHAO L, ZHANG M Y, XU D P, et al. Sequence variations and genetic differentiations in CO Ⅰ gene in two geographical populations of ice fish Protosalanx hyalocranius[J]. Journal of Dalian Ocean University, 2016, 31(3): 285-289. |
| [32] |
LAMBECK K, ESAT T M, POTTER E K. Links between climate and sea levels for the past three million years[J]. Nature, 2002, 419(6903): 199-206. DOI:10.1038/nature01089 |
 2021,
Vol. 30
2021,
Vol. 30


