2. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306;
3. 上海海洋大学 上海水产养殖工程技术研究中心, 上海 201306
黑色素是动物中最常见的一类色素,存在于黑色素细胞中,由黑素体产生。黑色素细胞是哺乳动物中唯一的色素细胞,主要分布在皮肤、眼睛和毛发及其他组织中[1]。在鱼类中,黑色素细胞与其他色素细胞(如红色素细胞、黄色素细胞和虹彩细胞等)共同形成了多样的体色和色素图案[2]。黑色素细胞作为色素细胞中的主要种类,一直是国外的研究重点,从模式生物斑马鱼(Danio rerio)、观赏性的丽鲷科(Cichlidae)鱼类到经济鱼类的鲤(Cyprinus carpio),均有较多报道[3-6]。国内对鱼类的色素细胞及其色素研究也较为丰富,涉及色素细胞形态、数量、发生和色素含量等多方面[7-11]。因而,黑色素细胞及其产生的黑色素在鱼类的体色形成中具有极为重要的作用。
小眼球相关转录因子a( mitfa )是亮氨酸拉链bHLH-Zip(the basic helix-loop-helix/leucine zipper)蛋白家族成员,在神经嵴细胞和神经上皮细胞衍生的色素细胞形成过程中具有重要的调控作用,并在大部分细胞类型中表达[12]。自HODGKINSON等[13]首次在小鼠中发现 mitf 基因突变引起毛色、眼睛发育、破骨细胞和肥大细胞的缺陷后,人们陆续在鱼类和哺乳动物中发现 mitf 对黑色素形成的调控功能。目前,已在小鼠中发现20余个 mitf 等位基因对毛色有影响[14],人类中有9个 mitf 基因亚型对黑色素细胞发育和黑色素瘤产生具有影响[15]。随着对 mitf 基因的深入研究,在斑马鱼中发现存在 mitfa 和 mitfb 两个基因,原位杂交发现两个基因在眼睛中共表达,在胚体上 mitfa 基因表达,而 mitfb 不表达,表明 mitfa 基因只对胚胎型或仔鱼型的黑色素细胞和成体型黑色素细胞具有功能[16]。在斑马鱼的胚胎发育过程中,敲降 mitfa 基因会延迟黑色素细胞的发育[17]。目前,mitfa 对黑色素形成的功能研究已在斑马鱼、鲤、鲫(Carassius auratus)等多种鱼类中广泛开展,包括从转录水平至基因分子水平等方面研究 mitfa 基因对黑色素形成和黑色素细胞发育的作用[18-21]。
瓯江彩鲤(Cyprinus carpio var.color)是鲤的一种体色变异类型,主要分布于浙江省瓯江流域,在当地俗称“田鱼”[22]。根据瓯江彩鲤体表的色素类型,可分为“全红”(WR)、“大花”(RB)、“麻花”(SB)、“粉玉”(WB)和“粉花”(WW)等5种类型[23]。黑色图案(斑块或斑点)是瓯江彩鲤表型的主要特点之一,但关于黑色斑块的出现、发生与控制机制尚缺乏了解和研究。
本文以瓯江彩鲤养殖生产上广受欢迎的两种体色——“大花”和“全红”为研究对象,首先从表型上观察两种体色瓯江彩鲤黑色素发生的时间和分布位置,了解黑色素在瓯江彩鲤发育过程的发生和发展进程,然后应用原位杂交技术,从内在遗传上检测 mitfa 基因在瓯江彩鲤发育过程中的表达动态。本文的研究目的是了解经济鱼类不同体色类型的黑色素出现特征和发生差异,为瓯江彩鲤的体色遗传规律与决定机制研究积累资料,为进一步选育瓯江彩鲤打下基础。
1 材料与方法 1.1 实验用鱼及样品采集2018年5月,取上海海洋大学水产种质资源试验站(上海新场镇)保存的2种体色(“大花” RB和“全红” WR)瓯江彩鲤的雌雄鱼各1组,经人工催产和授精后,将受精卵均匀涂布于玻璃皿上,放置于曝气水的整理箱中培养,培养水温为21~25 ℃。胚胎孵化出鱼苗后于整理箱中继续饲养,水温也保持在21~25 ℃,共饲养30 d。
分别取受精后24 h(24 hpf)、36 h(36 hpf)和48 h(48 hpf)的受精卵各100粒,以及出膜后1 d(1 dph)、2 d(2 dph)、3 d(3 dph)、5 d(5 dph)、10 d(10 dph)和15 d(15 dph)的仔稚鱼各100尾,用4%多聚甲醛溶液(PFA)固定24 h后,经无水甲醇处理2 h,然后用无水甲醇保存,放于-20 ℃冰箱保藏备用。
1.2 黑色出现及黑色素细胞发育观察分别随机选取上述各个时期的“大花”和“全红”体色的胚胎5个和仔稚鱼10尾,利用体式显微镜观察整个胚胎和仔稚鱼的黑色出现时间及黑色素细胞形态和分布位置,并拍照保存。
1.3 mitfa 基因的仔稚鱼整体原位杂交 1.3.1 原位杂交探针制备根据克隆获得的瓯江彩鲤 mitfa 基因序列,跨越开放阅读框和3′调控区(3′-UTR)设计特异性原位杂交引物( mitfa-insitu-F:AGACATCTCCTCCTTCGTATTC;mitfa-insitu-R:GTTCACAATGCTAACAGCC)。然后用引物进行PCR扩增获得429 bp长的基因片段。将扩增基因片段与Peasy-T3载体连接,转化感受态细胞Top 10,扩培菌液提取质粒,酶切获得 mitfa 基因线性化模板并纯化后,按照Promega T7转录试剂盒说明方法进行转录反应,获得 mitfa 基因原位杂交探针。正义探针利用SP6转录试剂盒进行转录。两种探针保存于-70 ℃备用。
1.3.2 仔稚鱼整体原位杂交取-20 ℃冰箱中保存的5 dph和10 dph 2种体色瓯江彩鲤仔稚鱼各5尾用于原位杂交。
探针杂交:鱼体经75%甲醇[V(甲醇):V(PBST)=3:1],50%甲醇,25%甲醇,PBST(洗3次)依次梯度复水,每次20 min。加入脱色液(0.9 mL DEPC水、0.1 mL 30% H2O2和2.5 μL 5 mol/L NaOH)光照下处理10 min去色素,PBST洗2次,每次15 min;胚胎通透处理,蛋白酶K在37 ℃消化10~20 min;4% PFA固定处理30 min,PBST清洗3次,15 min/次;吸尽PBST,加入预杂交液Hybe-,于65 ℃中温浴4 h。去除预杂交液,加入预热至65 ℃的400 μL杂交液Hybe+(探针工作浓度为1 ng/μL), 65 ℃温浴过夜。
抗体孵育:探针回收,清洗杂交后残留探针,50%甲酰胺和5 × SSC(1 mL:500 μL甲酰胺,250 μL 20 × SSC,250 μL无菌水),65 ℃处理20 min,50%甲酰胺和2×SSC,65 ℃处理20 min,2×SSC,65 ℃处理20 min,0.2 × SSC 65 ℃处理2次,20 min/次(1 mL:10 μL 20× SSC,990 μL无菌水),MABT室温处30 min,PBST处理15 min。加入封闭液(1 mL:10 mg BSA,5 μL Trition-100, 995 μL PBST),37 ℃封闭1 h;去除封闭液,加入抗体(Anti-DIG-AP FAB:封闭液=1:2 000), 4 ℃孵育过夜。
显色反应:回收抗体,清洗非特异性抗体,PBST洗5次,20 min/次;TSM 1(Tris-HCl 0.1 mol/L,pH 8.0, NaCl 0.1 mol/L, MgCl2 0.01 mol/L)清洗2次,20 min/次;TSM 2(Tris-HCl 0.1 mol/L,pH 9.5, NaCl 0.1 mol/L, MgCl2 0.05 mol/L)清洗2次,20 min/次;加入显色液(20 μL NBT/BCIP和1 mL Tris buffer)浸没鱼体,室温避光显色,一定时间观察1次;显色完毕后,PBST洗20 min;拍照观察后,4% PFA固定后4 ℃保存。
2 结果 2.1 两种体色瓯江彩鲤黑色素出现时序观察24 hpf,瓯江彩鲤胚胎发育至肌肉效应期,此时“大花”和“全红”两种体色瓯江彩鲤的胚胎都未观察到黑色素出现(图版Ⅰ-a1,b1)。在36 hpf,两种体色的眼睛部分有少量黑色素出现(图版Ⅰ-a2,b2)。在48 hpf,眼部能明显观察到黑色素,但胚胎其他部位未见黑色素及黑色素细胞出现(图版Ⅰ-a3,b3)。胚胎出膜后,眼睛的黑色素继续加深(图版Ⅰ-a4,a5,b4,b5)。到3 dph前后,“大花”体色瓯江彩鲤的躯体能观察到黑色素,出现点状的黑色素细胞。(图版Ⅰ-a6)。在5 dph,“大花”体色的身体黑色素明显增加,黑色素颗粒增多(图版Ⅰ-a7)。10 dph至15 dph,黑色素继续增加,黑色素细胞呈明显的树突状,但是未观察到大量的黑色素细胞聚集成块。在“全红”体色瓯江彩鲤的15 dph内,整个体表均未观察到黑色素及黑色素细胞(图版Ⅰ-b6,b9)。
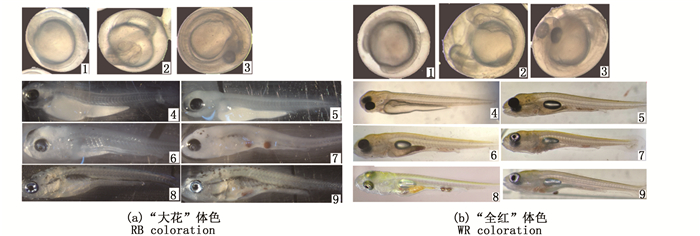
|
1.受精后24 h;2.受精后36 h;3.受精后48 h;4.出膜后1d;5.出膜后2 d;6.出膜后3 d;7.出膜后5 d;8.出膜后10 d;9.出膜后15 d 1. 24 hpf; 2. 36 hpf; 3. 48 hpf; 4. 1 dph; 5. 2 dph; 6. 3 dph; 7. 5 dph; 8. 10 dph; 9. 15 dph 图版 Ⅰ “大花”和“全红”体色瓯江彩鲤黑色素出现时序 Plate Ⅰ Time series of observed melanin in RB and WB color types of Oujiang color common carp |
通过对“大花”体色瓯江彩鲤不同发育时期鱼体体表黑色素的出现进行观察得知,瓯江彩鲤出现黑色的主要部位有头部、背部局部、尾部、尾鳍、鳃部和腹腔膜(图版Ⅱ)。在3 dph,黑色在头部和尾部有零星分布(图版Ⅱ-1~3)。在5 dph,黑色分布的位置增多,除头部和尾部外,躯干背部也出现了一定的黑色素,同时在鳃部听囊部位聚集形成的黑色素带和鳔上腹腔膜形成黑色素带,尾部也出现黑色素细胞聚集成的少量黑色素带(图版Ⅱ-4~6)。在10 dph,黑色继续增多,位置仍主要分布在头部、鳃部、腹腔和尾部,表现为黑色素细胞成熟变大黑色加深,鳃部的黑色素带由5 dph时的“Y”型变为“U型”,腹部和尾部的黑色素带也越加明显,逐渐形成黑色素膜包裹于鳔上(图版Ⅱ-7~9)。从10 dph黑色在鱼体上的出现观察发现,黑色素细胞的出现具有一定的聚集分布现象,总体来看呈现不均匀片段化分布。15 dph,头鳃部、腹部、尾部黑色素分布的位置黑色更加明显,黑色多集中在头部和背部,躯干体侧很明显存在黑色素缺失(图版Ⅱ-10~12)。
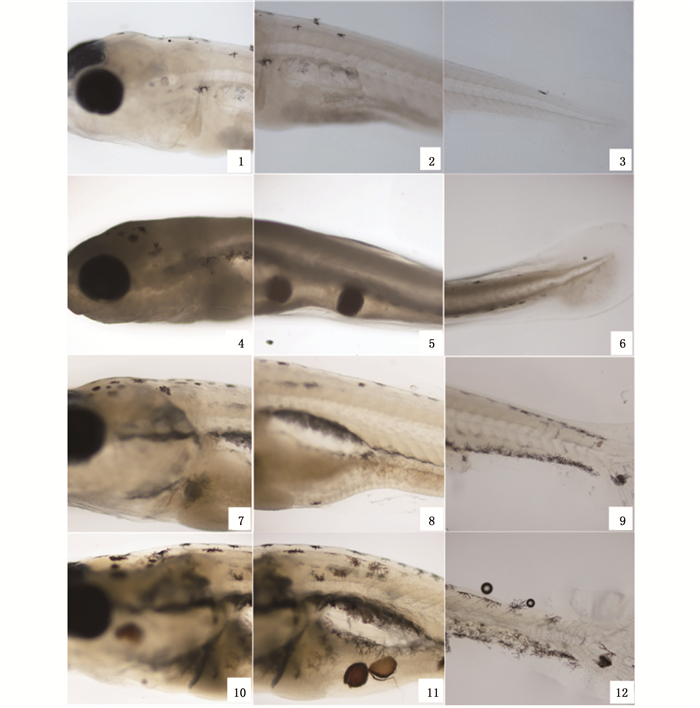
|
1. 3 dph “大花”头部;2. 3 dph “大花”躯干部;3. 3 dph“大花”尾部;4. 5 dph “大花”头部;5. 5 dph“大花”躯干部;6. 5 dph“大花”尾部;7. “大花”10 dph头部;8. 10 dph“大花”躯干部;9. 10 dph “大花”尾部;10. 15 dph“大花”头部;11. 15 dph“大花”躯干部;12. 15 dph“大花”尾部 1. 3 dph RB head; 2. 3 dph RB middle of body; 3. 3 dph RB tail area; 4. 5 dph RB head; 5. 5 dph RB middle of body; 6. 5 dph RB tail; 7. 10 dph RB head; 8. 10 dph RB middle of body; 9. 10 dph RB tail; 10. 15 dph RB head; 11. 15 dph middle of body; 12. 15 dph RB tail 图版 Ⅱ 黑色素在瓯江彩鲤发育过程中的分布特征 Plate Ⅱ Distribution characteristics of melanin during development in Oujiang color common carp |
观察瓯江彩鲤头部黑色素和黑色素细胞类型变化发现,在3 dph时出现在瓯江彩鲤头部的黑色素细胞有两类(图版Ⅲ-1):一类为树突状明显而黑色素较浅的黑色素细胞;一类为树突分支不明显的黑色素颗粒细胞,数量较少;在5 dph时出现具有明显树突分支且黑色较深的黑色素细胞,但此时的黑色素细胞数量较少(图版Ⅲ-2);在10 dph时再出现了分支状明显和不明显的两类黑色素细胞(图版Ⅲ-3);在15 dph时大部分为树突分支明显且多的黑色素细胞(图版Ⅲ-4)。从3 dph至15 dph的发育过程,黑色素细胞数量逐步增多,形态由小变大,整个变化过程中可以明显观察到瓯江彩鲤黑色素细胞由不成熟(仔鱼型)黑色素细胞至成熟(成体型)黑色素细胞的发育过程,且两种类型的黑色素细胞同时出现在同一个发育时期的鱼体上。

|
1. 3 dph;2. 5 dph;3. 10 dph;4. 15 dph;白色三角,颗粒状黑色素细胞(成体型黑色素细胞);红色三角,树突状黑色素细胞(仔鱼型黑色素细胞) 1. 3 dph; 2. 5 dph; 3. 10 dph; 4. 15 dph; white triangle, Granular melanocytes; red triangle, Mature melanocyte 图版 Ⅲ 瓯江彩鲤(头部)黑色素细胞形态变化 Plate Ⅲ Changes in morphology of melanocytes in Oujiang color common carp |
对10 dph“大花”的初步实验结果,瓯江彩鲤黑色素形成至这个时期,mitfa 在躯干体轴部分和眼周部分有特异性点状信号(图版Ⅳ-1),阴性对照无杂交信号(图版Ⅳ-2)。头部杂交信号具有点状和块状分布,体轴部分杂交信号从身体前部至尾部呈有序的线性分布,有明显表达(图版Ⅳ-3, 4)。对黑色素变化明显的5 dph和10 dph时期的“大花”幼鱼进行整体原位杂交,“全红”为对照。结果显示:“大花”在5 dph时,只在体侧神经轴部分和鳃部观察到 mitfa 基因的少量表达,信号呈有序的点状分布(图版Ⅳ-5);“全红”在5 dph时,鱼体躯干部分出现明显的杂交信号且信号分布较广泛,呈点状分散型分布(图版Ⅳ-6)。在10 dph时,除躯干有明显信号外,“大花”腹部出现明显的杂交信号,鳃部也能观察到微量的杂交信号且呈条带状(图版Ⅳ-7)。在10 dph时,“全红”杂交信号明显减少,只在尾部出现较少的杂交信号(图版Ⅳ-8)。

|
1.“大花”10 dph,阳性结果;2. “大花”10 dph,阴性对照;3.“大花” 10 dph头部;4.“大花”10 dph躯干部;5.“大花”5 dph;6.“全红”5 dph;7. “大花” 10 dph;8. “全红” 10 dph(5, 6, 7, 8阳性结果);箭头.杂交信号 1. RB at 10 dph, positive result, mitfa anti-sence probe in situ; 2. RB at 10 dph, Control group, mitfa sence probe in situ; 3. 10 dph RB head; 4. 10 dph RB middle of body; 5. RB at 5 dph; 6. WR at 5 dph; 7. RB at 10 dph; 8. WR at 10 dph(5, 6, 7, 8 positive result); arrow. in-situ signal 图版 Ⅳ “大花”和“全红”体色瓯江彩鲤 mitfa 基因整体原位杂交 Plate Ⅳ Whole-mount in situ hybridization of mitfa gene in Oujiang color common carp |
在同等养殖环境下,“大花”和“全红”两种瓯江彩鲤出膜前黑色素出现的时间和位置一致,黑色素均在36 hpf时于眼睛中出现,说明黑色素的发生时期和鱼的发育时期是一致的。1 dph至2 dph,除眼睛以外,两种体色类型瓯江彩鲤都未观察到黑色素。王良炎[24]对黄河鲤(Cyprinus carpio haematopterus)的观察发现刚出膜的幼鱼身体分布较多的黑色素且卵黄上也有黑色素,而瓯江彩鲤明显与普通鲤鱼不同,黑色素的发生明显缺失。3 dph, “大花”胚体上开始出现黑色素,而“全红”未出现,此时的瓯江彩鲤处于卵黄吸尽期。5 dph至10 dph,“大花”的黑色素变化最为明显,除黑色素变化和黑色素细胞形态的变化,能明显观察到鱼体鳃部的Y型黑素带变为U型黑素带,且色素带由鳔部逐渐延伸至尾基部,这一变化与谭细畅等[25]描述鲤孵出后身体上黑色素较多, “青筋”明显, 耳囊下方黑色素带尤为显著较为一致,而“全红”仍没有出现黑色素且没有上述黑色素变化过程。文胜[26]对三色锦鲤的黑色素及黑色素细胞观察发现,9 dph至10 dph锦鲤的背部和头部才出现黑色素细胞。相比于锦鲤,瓯江彩鲤的头部和背部的黑色素细胞出现时期较早。以上结果说明:瓯江彩鲤作为普通鲤的一种体色变异类型,两者黑色素的发生时期和形态变化明显不同;与其他观赏性鲤相比,瓯江彩鲤黑色素发育和出现具有独特的规律。结合“大花”和“全红”成鱼的色素类型的明显差异,以及本次幼鱼的黑色素发生观察可知:“大花”出现黑斑是由于黑色素细胞分布不均匀,可推测是黑色素细胞的迁移受阻导致黑色素无法均匀分布;“全红”完全没有黑色素在胚体中形成,可推测是由于黑色素细胞未成功分化或黑色素细胞有分化而不具备黑色素形成条件。
从“大花”和“全红”的黑色素发育观察来看,二者的表型明显不一致。WANG等[27]和DU等[28]对瓯江彩鲤皮肤转录组研究表明,瓯江彩鲤体色差异受到复杂的分子机制调控。对于哺乳动物,mitf 是一个生物标志物,可以标识黑色素细胞从神经嵴细胞分化来的过程[29]。JOHNSON等[14]研究认为 mitfa 对黑色素细胞分化和黑色素形成是十分必要的。“大花” mitfa 基因原位杂交结果表明,mitfa 基因在头部和体侧位置有明显表达,该结果与LISTER等[19]在斑马鱼中的研究结果一致。5 dph,“大花”鳃部有明显黑色素带分布,并在鳃部出现带状的杂交信号;至10 dph,“大花”腹部有明显的黑色素而且鳃部色素带更加明显,相应的杂交信号也更加明显:可见 mitfa 在黑色素形成过程中发挥功能且对黑色素细胞的形成是十分必要的。5 dph “全红”头部不存在“大花”黑色带,也没有相应的杂交信号。但“全红”躯干出现大量的杂交信号,表明 mitfa 基因有大量表达,可见即使在体表无黑色素发生的“全红” mitfa 基因也表现出相关功能。“全红”在10 dph发育时期,mitfa 基因的表达信号较5 dph发育时期明显减弱,可能说明在无黑色素细胞的瓯江彩鲤 mitfa 只在初期发挥功能。研究[15]表明 mitfa 对黑色素细胞的发育和分化具有功能,对于其他色素细胞的发生和维持也具有作用,“全红” mitfa 的原位结果与上述观点较为一致。
| [1] |
PARRA E J. Human pigmentation variation:evolution, genetic basis, and implications for public health[J]. American Journal of Physical Anthropology, 2007, 134(s45): 85-105. DOI:10.1002/ajpa.20727 |
| [2] |
KELSH R N. Genetics and evolution of pigment patterns in fish[J]. Pigment Cell Research, 2004, 17(4): 326-336. DOI:10.1111/j.1600-0749.2004.00174.x |
| [3] |
PARICHY D M, JOHNSON S L. Zebrafish hybrids suggest genetic mechanisms for pigment pattern diversification in Danio[J]. Development Genes and Evolution, 2001, 211(7): 319-328. DOI:10.1007/s004270100155 |
| [4] |
BRAASCH I, BRUNET F, VOLFF J N, et al. Pigmentation pathway evolution after whole-genome duplication in fish[J]. Genome Biology and Evolution, 2009, 1: 479-493. DOI:10.1093/gbe/evp050 |
| [5] |
ALBERTSON R C, POWDER K E, HU Y N, et al. Genetic basis of continuous variation in the levels and modular inheritance of pigmentation in cichlid fishes[J]. Molecular Ecology, 2014, 23(21): 5135-5150. DOI:10.1111/mec.12900 |
| [6] |
LIU J H, ZHANG Y Q, GUI S Y, et al. Observation and regression models on body colour inheritance and development in crucian carp and carp[J]. Aquaculture International, 2016, 24(4): 1191-1199. DOI:10.1007/s10499-016-9979-y |
| [7] |
王良炎, 顾靓, 庞小磊, 等. 不同体色锦鲤(Cyprinus carpio)鳞片色素细胞的观察[J]. 河南水产, 2016(1): 17-18, 26. WANG L Y, GU L, PANG X L, et al. Observation on scale chromatophore of koi carps (Cyprinus carpio)[J]. Henan Fisheries, 2016(1): 17-18, 26. |
| [8] |
牟春艳, 郑曙明, 任胜杰, 等. 不同体色血鹦鹉鱼的色素细胞种类、数量及色素含量[J]. 水产科学, 2015, 34(8): 497-501. MU C Y, ZHENG S M, REN S J, et al. Types and number of chromatophores and carotenoid contents in various parts of blood parrot (Amphilophus)[J]. Fisheries Science, 2015, 34(8): 497-501. |
| [9] |
徐伟, 李池陶, 曹顶臣, 等. 几种鲤鲫鳞片色素细胞和体色发生的观察[J]. 水生生物学报, 2007, 31(1): 67-72. XU W, LI C T, CAO D C, et al. Observation on scale chromatophore and body color's genesis of carp and cruscian carp[J]. Acta Hydrobiologica Sinica, 2007, 31(1): 67-72. DOI:10.3321/j.issn:1000-3207.2007.01.010 |
| [10] |
马雪, 董少杰, 贾艳红. 五种观赏鱼色素细胞的初步组织学研究[J]. 天津农业科学, 2013, 19(12): 70-72. MA X, DONG S J, JIA Y H. Preliminary histological study of five species of ornamental fish pigment cells[J]. Tianjin Agricultural Sciences, 2013, 19(12): 70-72. DOI:10.3969/j.issn.1006-6500.2013.12.018 |
| [11] |
刘晓东, 陈再忠. 鱼类色素细胞及体色调控[J]. 水产科技情报, 2008, 35(1): 13-18. LIU X D, CHEN Z Z. Pigment cells and body color regulation of fish[J]. Fisheries Science & Technology Information, 2008, 35(1): 13-18. DOI:10.3969/j.issn.1001-1994.2008.01.002 |
| [12] |
CHRISTIANSEN J H, COLES E G, WILKINSON D G. Molecular control of neural crest formation, migration and differentiation[J]. Current Opinion in Cell Biology, 2000, 12(6): 719-724. DOI:10.1016/S0955-0674(00)00158-7 |
| [13] |
HODGKINSON C A, NAKAYAMA A, LI H, et al. Mutation at the Anophthalmic white locus in Syrian hamsters:haploinsufficiency in the Mitf gene mimics human Waardenburg syndrome type 2[J]. Human Molecular Genetics, 1998, 7(4): 703-708. DOI:10.1093/hmg/7.4.703 |
| [14] |
JOHNSON S L, NGUYEN A T N, LISTER J A. Mitfa is required at multiple stages of melanocyte differentiation but not to establish the melanocyte stem cell[J]. Developmental Biology, 2011, 350(2): 405-413. DOI:10.1016/j.ydbio.2010.12.004 |
| [15] |
PHELEP A, LAOUARI D, BHARTI K, et al. MITF-A controls branching morphogenesis and nephron endowment[J]. PLoS Genetics, 2017, 13(12): e1007093. DOI:10.1371/journal.pgen.1007093 |
| [16] |
LISTER J A, CLOSE J, RAIBLE D W. Duplicate mitf genes in zebrafish:complementary expression and conservation of melanogenic potential[J]. Developmental Biology, 2001, 237(2): 333-344. DOI:10.1006/dbio.2001.0379 |
| [17] |
MELLGREN E M, JOHNSON S L. A requirement for kit in embryonic zebrafish melanocyte differentiation is revealed by melanoblast delay[J]. Development Genes and Evolution, 2004, 214(10): 493-502. |
| [18] |
LIU J H, WEN S, LUO C, et al. Involvement of the mitfa gene in the development of pigment cell in Japanese ornamental (Koi) carp (Cyprinus carpio L.)[J]. Genetics and Molecular Research:GMR, 2015, 14(1): 2775-2784. DOI:10.4238/2015.March.31.7 |
| [19] |
LISTER J A, ROBERTSON C P, LEPAGE T, et al. Nacre encodes a zebrafish microphthalmia-related protein that regulates neural-crest-derived pigment cell fate[J]. Development, 1999, 126(17): 3757-3767. |
| [20] |
田雪, 庞小磊, 王良炎, 等. MITFa及TYR基因在红色锦鲤体色发生不同阶段的表达分析[J]. 水产科学, 2017, 36(2): 197-201. TIAN X, PANG X L, WANG L Y, et al. Expression of MITFa and TYR gene in body color formation in red color koi carp Cyprinus carpio at different stages[J]. Fisheries Science, 2017, 36(2): 197-201. |
| [21] |
HUANG Y P, LUO Y R, LIU J H, et al. A light-colored region of caudal fin:a niche of melanocyte progenitors in crucian carp (Cyprinus carpio L.)[J]. Cell Biology International, 2017, 41(1): 42-50. |
| [22] |
刘豪, 王成辉, 杨新鑫, 等. 红、白两种体色瓯江彩鲤的抑制性差减杂交[J]. 上海海洋大学学报, 2009, 18(6): 662-666. LIU H, WANG C H, YANG X X, et al. Suppressive subtractive hybridization analysis from red and white color patterns of Oujiang color common carp[J]. Journal of Shanghai Ocean University, 2009, 18(6): 662-666. |
| [23] |
王成辉, 项松平, 吕耀平, 等. 瓯江彩鲤红、白两种体色遗传关系的初步研究[J]. 上海水产大学学报, 2008, 17(4): 402-405. WANG C H, XIANG S P, LYU Y P, et al. Preliminary study on inheritance of red and white color phenotypes in Oujiang color carp, C. carpio var. color[J]. Journal of Shanghai Fisheries University, 2008, 17(4): 402-405. |
| [24] |
王良炎.黄河鲤体色发生观察及mitfa和tyr基因cDNA的克隆与组织表达研究[D].新乡: 河南师范大学, 2017. WANG L Y. The observation of body color formation and MITFA and TYR gene cDNA cloning and tissue expression study in Yellow River Carp(Cyprinus carpio haematopterus)[D]. Xinxiang: Henan Normal University, 2017. |
| [25] |
谭细畅, 李新辉, 林建志, 等. 珠江肇庆江段鲤早期发育形态及其补充群体状况[J]. 大连水产大学学报, 2009, 24(2): 125-129. TAN X C, LI X H, LIN J Z, et al. Early morphogenesis and larval resources of common carp at Zhaoqing section in the Pearl River[J]. Journal of Dalian Fisheries University, 2009, 24(2): 125-129. |
| [26] |
文胜. mitfa基因在观赏鱼体色形成中的功能研究[D].长沙: 湖南师范大学, 2014. WEN S. Involvement of mitfa gene in body color formation of the ornamental fish[D]. Changsha: Hunan Normal University, 2014. |
| [27] |
WANG C H, WACHHOLTZ M, WANG J, et al. Analysis of the skin transcriptome in two Oujiang color varieties of common carp[J]. PLoS One, 2014, 9(3): e90074. DOI:10.1371/journal.pone.0090074 |
| [28] |
DU J X, CHEN X W, WANG J, et al. Comparative skin transcriptome of two Oujiang color common carp (Cyprinus carpio var. color) varieties[J]. Fish Physiology and Biochemistry, 2019, 45(1): 177-185. |
| [29] |
LEVY C, KHALED M, FISHER D E. MITF:master regulator of melanocyte development and melanoma oncogene[J]. Trends in Molecular Medicine, 2006, 12(9): 406-414. DOI:10.1016/j.molmed.2006.07.008 |
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


