2. 上海水产品加工及贮藏工程技术中心, 上海 201306;
3. 农业农村部水产品贮藏保鲜质量安全风险评估实验室, 上海 201306
Pb2+是一种稳定性强且不可降解的重金属污染物, 在环境中可长期累积, 对人体与环境有极强的危害性。据有关报道, 环境中的铅含量长期超标会导致人体产生各种疾病[1-5]。因此, 开发高灵敏的铅离子检测方法对于食品安全、环境保护和人类健康具有重要的意义。目前常用检测铅离子的手段包括原子吸收光谱法、电感耦合等离子体质谱(ICP-MS)法、毛细管电泳法、阳极溶出伏安法以及X-射线荧光光谱法等[6]。它们具有准确度高、选择性好、干扰少等优点, 但是样品前处理复杂, 需要大型仪器辅助, 不适用于现场实时监控。
信号放大策略是当前提高铅离子荧光传感器灵敏度的重要手段。LI等[7]基于荧光分析技术和等温信号放大策略成功设计了一种用于检测Pb2+的荧光传感体系。ZHAO等[8]报道了一种基于聚合酶内切酶与等温扩增相结合的新荧光检测系统, 该检测系统将等温链替代扩增(ISDA)和切割酶信号放大(NESA)模块相结合实现了对痕量Pb2+的检测[9-11]。本文将等温链替代扩增技术(ISDA)和指数放大反应(EXPAR)[12-14]两种信号放大策略相藕合, 旨在构建一种新型的高灵敏、无标记的荧光传感体系, 并将其成功应用于实际水样品中痕量Pb2+的检测。
1 材料与方法 1.1 试剂与仪器核酸购自美国IDT公司(INTEGRATED DNA TECHNOLOGIES Coralville, IA), 并且通过高效液相色谱(HPLC)进行纯化, 核酸序列为GR-5底物链: 5'-CTCACTATrAGGAAGAGATGATT-3';GR-5酶链:5'-AATCATCTCTGAAGTAGCGCCGCCGTATAGTGAG-3';Template 1:5'-ACCCACCCACCCACCCAGGAGTCGAATCATCTCTTCC-3'; Template 2: 5'-ACCCACCCACCCACCCAGGAGTCGGGACCCACCCACCCACCCA-3'。4-羟乙基哌嗪乙磺酸(HEPES)、氯化钠、尿素、冰乙酸、四甲基乙二胺(TEMED)、过硫酸铵(APS)、氯化镁、氯化锌、氯化铁、氯化锰、硫代硫酸钠和碳酸钠购自上海生物工程有限公司, 均为分析纯; 铅离子标准液、汞离子标准液、钴离子标准液、铜离子标准液、镍离子标准液购自国家标准物质中心; BSM、Nt.BbvCI购自美国NEB公司; dNTPs购自大连宝生物科技有限公司; 锌原卟啉(ZnPPIX)购自Sigma-Aldrich公司。超纯水比电阻为18.2 MΩ, 购自美国密理博有限公司。
主要仪器包括荧光光谱仪Edinburgh FS5(Edinburgh instruments, 英国)、紫外-可见分光光度计UV-3900(UNICO, 美国)、Detta 320 pH计(Mettler Toledo, 上海)、电子天平(Mettler Toledo, 上海)、DYCP-311电泳槽(北京六一仪器厂, 北京)、TS-100脱色摇床(江苏海门其林贝尔仪器制造有限公司, 江苏)、ES1000热盖型样品恒温孵育器(上海珂淮仪器有限公司, 上海)和Microtek Bio-6000平板式凝胶成像扫描仪(上海中晶科技有限公司, 上海)。
1.2 试验方法 1.2.1 传感体系制备将GR-5 DNAzyme的酶链与底物链以摩尔比为1.0:1.1混合杂交后, 于75 ℃的ES1000热盖型样品恒温孵育器中恒温孵育5 min, 然后冷却至室温, 并于4 ℃冰箱内冷藏储存, 所合成的脱氧核酶下文称GR-5 DNAzyme。
于PCR管中将GR-5 DNAzyme在1×Buffer B中混合均匀使其终浓度为1 μmol/L, 然后加入Template 1和Template 2, 使其终浓度分别为2 μmol/L和2.5 μmol/L, 加入1.5 U的DNA聚合酶BSM、2 U的DNA剪切酶Nt.BbvCI以及300 μmol/L的dNTPs, 充分混合均匀后加入Pb2+或其他常见金属离子至所需检测的浓度, 混合溶液的总体积为100 μL, 将PCR管放入恒温孵育器在37 ℃下恒温孵育90 min。完成孵育后将PCR管放入4 ℃冰箱冷却3 min即可进行荧光信号的检测。
实际样品的检测过程:仅将配置1×Buffer B的超纯水更换为过滤加标后的湖水, 其他检测操作过程不变。
1.2.2 荧光信号检测在恒温孵育后冷藏的反应液中加入ZnPPIX使其终浓度为12 μmol/L, 使用荧光分光光度计, 检测并记录其荧光强度。激发波长为520 nm, 激发狭缝宽为1 nm, 发射波长为592 nm, 发射狭缝宽为1 nm, 检测范围为540 ~700 nm。检测过程在室温下避光进行。
1.2.3 凝胶电泳SDS-PAGE胶的制备方法:20%聚丙烯酰胺凝胶电泳, 将4.2 g尿素, 2.0 g丙烯酰胺, 1 mL 10XTBE加入超纯水中, 使得最终体积为10 mL, 然后加入10 μL TEMED以及10 μL 10%的APS溶液, 快速混匀并把混匀的溶液匀速注入胶板中, 注胶过程中不能有气泡产生。
电泳:25 ℃下, 电泳凝胶约1 h, 上样浓度为100 nmol/L, 通过溴酚蓝着色作为电泳指示剂, 样本体积为8 μL。接通电源, 电泳在1XTBE缓冲液中进行, 先在电压为60 V情况下对胶板进行预电泳, 30 min后, 加注制备好的样本。然后再在恒电压90 V条件下, 电泳约2 h, 待指示剂到达胶板底部便停止电泳, 使用硝酸银染色液进行染色, 用Bio-Rad紫外凝胶成像分析仪对SDS-PAGE结果进行成像分析。
2 结果与讨论 2.1 检测原理本实验将等温链替代扩增技术和指数放大反应相结合, 通过级联放大实现对Pb2+的高灵敏检测。实验原理如图 1所示, Pb2+与GR-5 DNAzyme的特异性识别会激活GR-5 DNAzyme的催化活性从而快速切割底物链, 释放的引物1与Template 1根据碱基互补配对原则相结合, 在DNA聚合酶BSM和dNTPs的存在下沿着Template 1开始DNA核酸链的延伸。延伸出的DNA链中包含限制性内切酶Nt.BbvCI的识别序列, 因此, Nt.BbvCI会在延伸出的DNA链中切割新合成的DNA链, 从而释放信号G4-DNA分子。在DNA聚合酶BSM, DNA剪切酶Nt.BbvCI, dNTPs的共同作用下实现对信号分子的大量扩增, 部分信号分子作为引物2参与第2步指数放大反应。引物2与Template 2根据碱基互补配对原则再次进行等温扩增形成信号G4-DNA分子, 产生的信号G4-DNA分子作为引物2参与二次扩增从而实现信号DNA链的指数扩增。信号G4-DNA分子发生空间折叠形成结构稳定的G-四联体, 当在检测体系中加入ZnPPIX时, G-四联体与ZnPPIX发生相互作用, G-四联体会以ZnPPIX为模板发生空间构型的改变, 从而产生内嵌ZnPPIX的G-四联体作为荧光信号源[15], 并产生与Pb2+浓度相关的荧光信号, 因此可以通过荧光强度的变化来检测体系中Pb2+的含量。
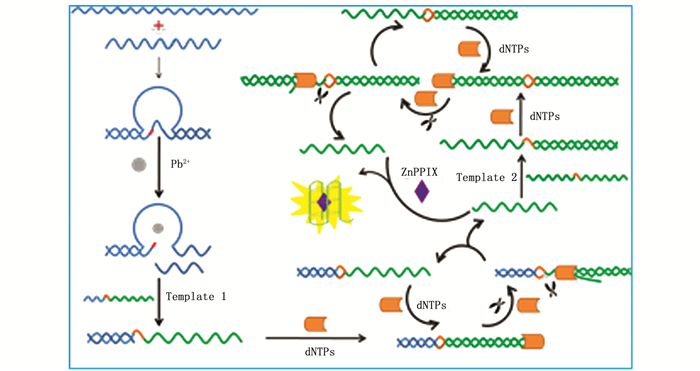
|
图 1 基于核酸等温扩增和链替代反应检测铅离子的原理示意图 Fig. 1 Schematic diagram of detection of Pb2+ based on nucleic acid isothermal amplification and strand displacement reaction |
为验证上述传感体系的可行性, 我们分别采用荧光光谱法与凝胶电泳考察添加Pb2+前后荧光传感体系的改变。如图 2所示, 在没有Pb2+存在条件下, 传感体系的荧光强度很小(曲线1), 识别Pb2+之后, 传感体系的荧光强度显著增强, 增加到原来的近16倍(曲线3), 然而1次扩增的信号强度仅增加4.8倍(曲线2)。如图 2所示, SDS-PAGE进一步证实了添加Pb2+之后, 体系中产生了大量G4-DNA信号分子。上述实验结果表明该传感体系是可行的。
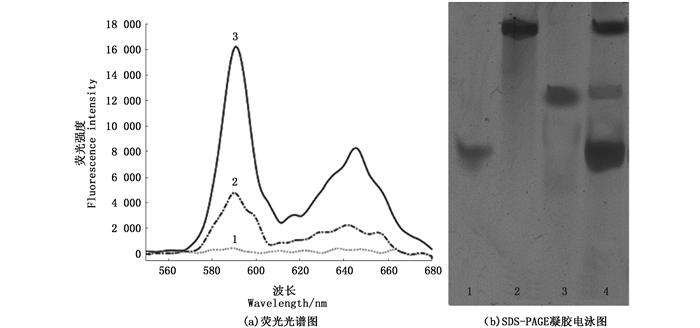
|
(a)曲线1.不含铅离子; 曲线2.加入100 nmol/L铅离子仅有Template 1; 曲线3.加入100 nmol/L铅离子体系包含有Template 1和Template 2(激发波长520 nm); (b)1.人工合成的G4-DNA片段作为对照; 2.酶链; 3.底物链; 4.加入Pb2+扩增后的G4-DNA产物 (a)Fluorescence spectra of sensing system in the absence (curve 1) and presence (curve 2 with Template 1, curve 3 with Template 1 and Template 2) of 100 nmol/L Pb2+ (Excitation: 520 nm); (b) lane 1. positive control; lane 2. the enzyme strand; lane 3. the substrate chain; and lane 4. the amplified G4-DNA product 图 2 传感体系检测铅离子的原理验证图 Fig. 2 Principle verification of sensing system for Pb2+ detection |
为获得传感器的最佳灵敏度, 对实验中所用到的Template 1、Template 2、DNA聚合酶BSM、DNA剪切酶Nt.BbvCI、ZnPPIX等试剂的用量以及等温扩增反应时间分别进行系统的优化实验, 优化实验中用到的GR-5 DNAzyme的浓度为1 μmol/L。由图 3可知, 本实验的最优条件如下:Template 1的浓度为2.0 μmol/L, Template 2的浓度为2.5 μmol/L, DNA聚合酶BSM的用量为2 U, DNA剪切酶Nt.BbvCI的用量为1.5 U, ZnPPIX的用量为12 μmol/L, 等温扩增反应时间为90 min。
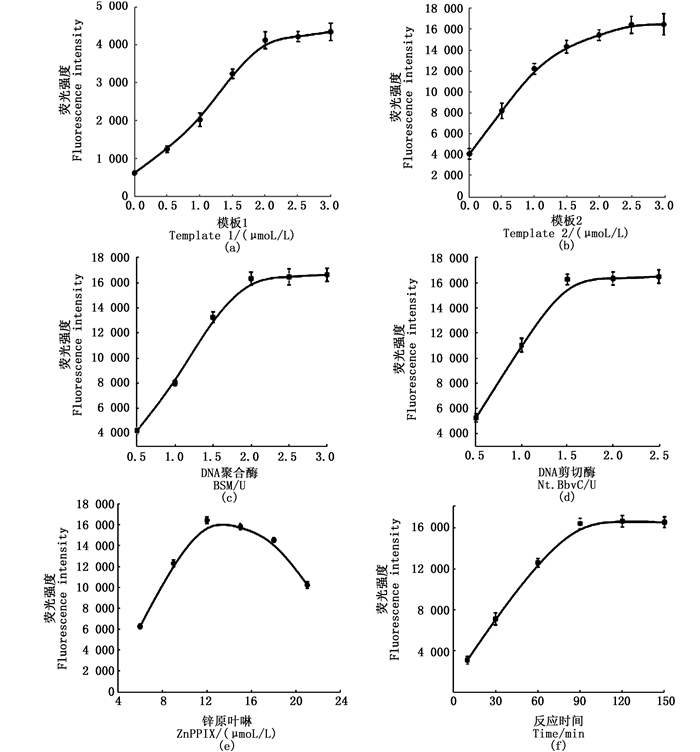
|
图 3 实验条件优化图 Fig. 3 Optimization of experimental conditions |
选用环境水样中常见二价金属阳离子(Zn2+、Ni2+、Ca2+、Co2+、Mn2+、Hg2+、Fe2+和Cu2+等)作为干扰离子来评价荧光传感体系的选择性。由图 4可知, 在同等浓度的传感体系中分别加入1 μmol/L的铅离子和其他金属离子, 干扰离子的加入没有导致传感体系荧光强度的明显变化, 而在同等条件下, 100 nmol/L Pb2+能够使传感体系的荧光强度增长为空白背景荧光的26倍, 这表明该荧光传感体系对Pb2+具有很好的选择性, 这可能源于GR-5 DNAzyme对Pb2+特异性识别。
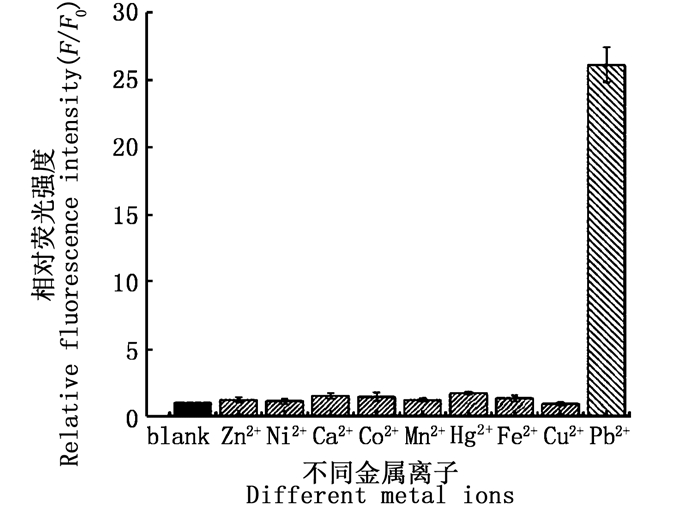
|
图 4 Pb2+荧光传感体系的选择性评价 Fig. 4 Selectivity of the sensing system for Pb2+ over other divalent metal ions |
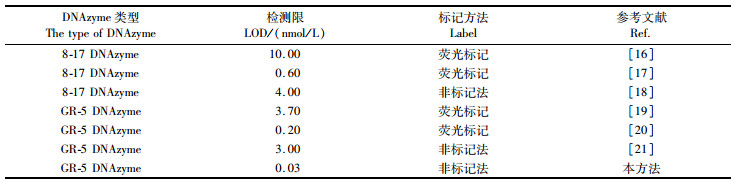
在最优实验条件下, 采用本方法定量测定不同浓度的Pb2+。由图 5a可知, 随着Pb2+浓度的增加, 592 nm处的荧光强度逐渐增强, Pb2+浓度在0.1~50.0 nmol/L时存在较好的线性关系(图 5b), 线性回归方程为y=288.7x+744.7(y为荧光强度,x为Pb2+浓度), R2=0.995, 最低检出限为0.03 nmol/L(S/N=3), 远低于世界卫生组织规定的饮用水中Pb2+最大允许量(72 nmol/L)。与文献[16-21]报道的同类传感体系相比(表 1), 该方法对Pb2+的定量分析具有较高的灵敏度和较宽的线性检测范围。
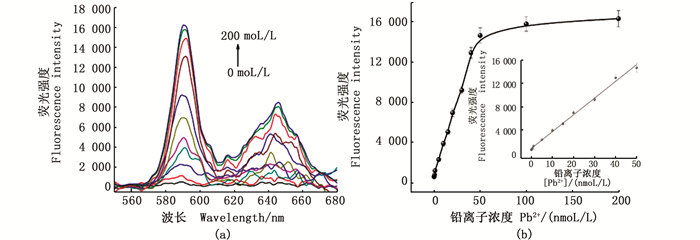
|
图 5 荧光传感体系的线性范围及灵敏度 Fig. 5 Linear range and sensitivity offluorescence sensing system |
|
表 1 同类型荧光传感体系与该荧光传感体系的性能比较 Tab.1 Comparison of DNAzyme-based fluorescent sensing system for the detection of Pb2+ |
采集上海海洋大学镜湖湖水样本。使用前离心过滤除去样本中的悬浮物及杂质, 然后在水样中添加Pb2+标准液, 至终浓度分别为1 nmol/L、5 nmol/L和25 nmol/L。用该荧光传感体系进行检测, 每个样本平行测定3次。根据标准曲线计算出3种样本对应的含铅浓度, 计算加标回收率。检测结果如表 2所示, 3个湖水样本的加标回收率为94.00%~103.16%, 以上检测结果的组内变异系数较小, 说明该荧光传感体系具有较好的精密度和可靠性, 可用于复杂水样中铅离子的痕量检测。

|
表 2 环境水体样品加标回收实验结果 Tab.2 Recovery experiment results using environmental water samples |
以对Pb2+具有特异性识别能力的GR-5 DNAzyme为识别元件, 耦合等温链替代扩增技术和指数放大反应两种信号放大策略, 构建了一种高灵敏检测铅离子的荧光传感体系。该传感体系能在0.1~50.0 nmol/L浓度内定量检测Pb2+, 其检测限为0.03 nmol/L(S/N=3)。与同类型的荧光传感体系相比,其灵敏度高,线性检测范围较宽,综合性能优于同类型荧光传感体系,并成功应用于实际水样的检测。
| [1] |
VERSTRAETEN S V, AIMO L, OTEIZA P I. Aluminium and lead:molecular mechanisms of brain toxicity[J]. Archives of Toxicology, 2008, 82(11): 789-802. DOI:10.1007/s00204-008-0345-3 |
| [2] |
CHEN X, ZHOU S K, ZHANG L M, et al. Adsorption of heavy metals by graphene oxide/cellulose hydrogel prepared from NaOH/Urea aqueous solution[J]. Materials, 2016, 9(7): 582. DOI:10.3390/ma9070582 |
| [3] |
LI C H, LIANG H D, LIANG M, et al. Soil surface Hg emission flux in coalfield in Wuda, inner Mongolia, China[J]. Environmental Science and Pollution Research, 2018, 25(17): 16652-16663. DOI:10.1007/s11356-018-1804-x |
| [4] |
ZHANG J, TANG Y, TENG L M, et al. Low-cost and highly efficient DNA biosensor for heavy metal ion using specific DNAzyme-modified microplate and portable glucometer-based detection mode[J]. Biosensors and Bioelectronics, 2015, 68: 232-238. DOI:10.1016/j.bios.2015.01.001 |
| [5] |
COTTER F E. Antisense therapy for cancer[J]. European Journal of Cancer Supplements, 2003, 1(2): 19-27. DOI:10.1016/S1359-6349(03)00011-9 |
| [6] |
张风英. 电感耦合等离子体发射光谱仪测定重钙中铅、砷、铬、镉含量探析[J]. 世界有色金属, 2018(2): 275, 277. ZHANG F Y. Determination of lead, arsenic, chromium, cadmium content in TSP inductively coupled plasma emission spectrometer[J]. World Nonferrous Metals, 2018(2): 275, 277. |
| [7] |
LI W Y, YANG Y, CHEN J, et al. Detection of lead(Ⅱ) ions with a DNAzyme and isothermal strand displacement signal amplification[J]. Biosensors and Bioelectronics, 2014, 53: 245-249. DOI:10.1016/j.bios.2013.09.055 |
| [8] |
ZHAO Y X, CHEN F, ZHANG Q, et al. Polymerase/nicking enzyme synergetic isothermal quadratic DNA machine and its application for one-step amplified biosensing of lead (Ⅱ) ions at femtomole level and DNA methyltransferase[J]. NPG Asia Materials, 2014, 6(9): e131. DOI:10.1038/am.2014.84 |
| [9] |
LEE S J, CHO Y H, KIM C S, et al. Screening for chlamydia and gonorrhea by strand displacement amplification in homeless adolescents attending youth shelters in korea[J]. Journal of Korean Medical Science, 2004, 19(4): 495-500. DOI:10.3346/jkms.2004.19.4.495 |
| [10] |
徐瑶. Toehold调节的链置换反应在核酸检测中的应用[D].北京: 北京协和医学院, 2014. XU Y. High throughput mutation screening based on metal-enhanced fluorescence and toehold-mediated strand displacement reaction[D]. Beijing: Peking Union Medical College, 2014. |
| [11] |
杨斌.基于DNA链置换反应的新型核酸适配体荧光探针的构建及应用研究[D].长沙: 湖南大学, 2014. YANG B. Studies on design and application of novel aptamer fluorescent probes based on DNA strands displacement strategy[D]. Changsha: Hunan University, 2014. |
| [12] |
VAN NESS J, VAN NESS L K, GALAS D J. Isothermal reactions for the amplification of oligonucleotides[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(8): 4504-4509. DOI:10.1073/pnas.0730811100 |
| [13] |
REID M S, PALIWODA R E, ZHANG H Q, et al. Re-duction of background generated from template-template hybridizations in the exponential amplification reaction[J]. Analytical Chemistry, 2018, 90(18): 11033-11039. DOI:10.1021/acs.analchem.8b02788 |
| [14] |
WANG D, CHAI Y Q, YUAN Y L, et al. A peptide cleavage-based ultrasensitive electrochemical biosensor with an ingenious two-stage DNA template for highly efficient DNA exponential amplification[J]. Analytical Chemistry, 2017, 89(17): 8951-8956. DOI:10.1021/acs.analchem.7b01477 |
| [15] |
LI T, DONG S J, WANG E K. A lead(Ⅱ)-driven DNA molecular device for turn-on fluorescence detection of lead(Ⅱ) ion with high selectivity and sensitivity[J]. Journal of the American Chemical Society, 2010, 132(38): 13156-13157. DOI:10.1021/ja105849m |
| [16] |
LI J, LU Y. A highly sensitive and selective catalytic DNA biosensor for lead ions[J]. Journal of the American Chemical Society, 2000, 122(42): 10466-10467. DOI:10.1021/ja0021316 |
| [17] |
ZHANG X B, WANG Z D, XING H, et al. Catalytic and molecular beacons for amplified detection of metal ions and organic molecules with high sensitivity[J]. Analytical Chemistry, 2010, 82(12): 5005-5011. DOI:10.1021/ac1009047 |
| [18] |
XIANG Y, TONG A, LU Y. Abasic site-containing DNAzyme and aptamer for label-free fluorescent detection of Pb2+ and adenosine with high sensitivity, selectivity, and tunable dynamic range[J]. Journal of the American Chemical Society, 2009, 131(42): 15352-15357. DOI:10.1021/ja905854a |
| [19] |
LAN T, FURUYA K, LU Y. A highly selective lead sensor based on a classic lead DNAzyme[J]. Chemical Communications, 2010, 46(22): 3896-3898. DOI:10.1039/b926910j |
| [20] |
ZHAO X H, KONG R M, ZHANG X B, et al. Graphene-DNAzyme based biosensor for amplified fluorescence "turn-on" detection of Pb2+ with a high selectivity[J]. Analytical Chemistry, 2011, 83(13): 5062-5066. DOI:10.1021/ac200843x |
| [21] |
FU T, REN S L, GONG L, et al. A label-free DNAzyme fluorescence biosensor for amplified detection of Pb2+-based on cleavage-induced G-quadruplex formation[J]. Talanta, 2016, 147: 302-306. DOI:10.1016/j.talanta.2015.10.004 |
2. Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China;
3. Laboratory of Quality and Safety Risk Assessment for Aquatic Product on Storage and Preservation, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


