2. 中国水产科学研究院黑龙江水产研究所, 黑龙江 哈尔滨 150070;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306;
4. 上海海洋大学 上海水产养殖工程技术研究中心, 上海 201306
中华绒螯蟹(Eriocheir sinensis)隶属于节肢动物门(Arthropoda)甲壳纲(Crustacea)十足目(Decapoda)方蟹科(Grapsidae)绒螯蟹属(Eriocheir), 俗称河蟹、毛蟹或大闸蟹, 是我国重要的经济蟹类之一[1]。土著中华绒螯蟹主要分布于中国东南沿海地区通海的河流或湖泊中。长期地理隔离使其分化为不同的地理种群, 主要有辽河、黄河、长江、瓯江和闽江种群等[2-3], 辽河和长江种群是我国中华绒螯蟹养殖最重要的类群。辽宁、吉林和黑龙江等北方地区主要养殖辽河种群, 而长江流域则主要养殖长江种群。目前长江水系中华绒螯蟹已推广至台湾、云南、贵州、陕西、山东和青海等地。近些年来河蟹产量逐渐提高, 并在2015年达到近期峰值(82.33万t), 随后产量逐渐下降并平稳维持在70万t以上。2018年河蟹产量为75.69万t, 产值超过500亿元[4]。江苏、湖北、安徽和江西等省河蟹产量达到了63.31万t, 占总产量的84.30%;辽宁、吉林和黑龙江等省河蟹产量为5.94万t, 占总产量的7.92%。全国90%以上河蟹苗种为辽河和长江水系中华绒螯蟹。20世纪80年代, 随着长江水系野生中华绒螯蟹种质资源量锐减退化[5], 辽河水系中华绒螯蟹被移至长江流域养殖。徐德昆等[6]研究认为长江蟹生长速度和成蟹平均规格均要高于辽河蟹。王成辉等[7]研究认为扣蟹养殖阶段辽河蟹与长江蟹生长差异不显著, 但种群内个体差异较大。
杂交优势是生物界普遍存在的现象, 种内不同地理种群杂交可以丰富基因自由组合度和遗传结构, 一般表现为养殖性能方面优于其亲本自交组合, 因此利用杂交优势是改良当前水产品养殖性状的主要途径之一[8]。在提高水产动物生长速度和肉质品质等方面, 种间杂交技术手段较为困难[9-10], 而种内不同地理种群杂交则报道较多, 如扇贝[11-12]、贻贝[13-14]、牡蛎[15-16]、三疣梭子蟹[17-18]和罗氏沼虾[8]等。
前人[19-21]已经研究了辽河和长江水系野生及人工养殖扣蟹在上海崇明岛的养殖性能差异, 但未见人工养殖辽河、长江水系及其杂交种养殖性能的比较, 这对辽河和长江水系中华绒螯蟹种质资源评价是不利的。因此, 为了更好地了解辽河、长江水系及其杂交种中华绒螯蟹养殖性能, 亟需对其养殖性能进行评价, 以期为种质资源保护和新品种培育提供参考。
1 材料与方法 1.1 扣蟹来源及养殖管理实验用辽河、长江水系及其杂交种扣蟹来自上海海洋大学崇明基地, 2018年3—12月进行成蟹养殖实验。选择12个面积等大(实际水面长×宽×深=10.4 m ×7.6 m ×1.2 m)的小型室外实验池塘, 四周设有50 cm高的防逃围网, 围网内侧顶部缝有35 cm高的塑料防逃板防止实验蟹逃逸或混杂。2017年12月底使用含氯石灰(南通市高阳漂白粉有限公司, 10 kg/塘)对实验池塘消毒和清塘处理, 两周后在池塘内种植伊乐藻(Elodea nuttallii)供河蟹隐蔽, 株距为2 m, 行距为2 m。
2018年3月10日, 从辽河、长江水系及其杂交种扣蟹中挑选规格相近、活力旺盛的个体进行养殖实验。辽河水系扣蟹雌雄个体平均体质量分别为(8.39±1.25)g和(8.94±0.11)g; 长江水系为(8.07±0.54)g和(9.90±0.33)g; 长江♂ ×辽河♀为(9.89±0.73)g和(10.07±1.03)g; 辽河♂ ×长江♀为(8.58±1.21)g和(9.09±0.43)g。扣蟹经30 mg/L聚维酮碘溶液浸泡消毒0.5 h后随机放养于12个池塘中, 每种组合重复3次, 每个池塘共放养90只扣蟹(♀: ♂ =1: 1), 放养密度为1.0~1.1只/m2。为调节水质及控制野杂鱼数量, 于5月初在每个池塘内投放5 kg螺蛳(Margarya melanioides)、3条花鲢(Aristichthys nobilis, 250 g/尾)、3条白鲢(Hypophthalmichthys molitrix, 250 g/尾)和3条鳜(Siniperca chuatsi, 3 cm/尾)。整个养殖期间, 根据伊乐藻的生长和外界气温变化合理控制池塘水位。夏季高温期水位保持在1.0~1.2 m。初期种植伊乐藻, 后期搭配水花生(Alternanthera philoxeroides)。通过及时梳理水草, 防止水草过密而导致池塘水体缺氧。当池塘水温升高至12 ℃时开始投喂人工配合饲料(浙江澳华饲料有限公司), 通过检查饵料台上残饵情况合理调整投喂量。7月初开始夜间每个池塘微孔增氧。通过肉眼观察水质变化, 用试剂盒检测水质“好坏”, 每周换水1~2次, 保证水质清新。养殖期间尽量保证pH在7.0~9.0, DO > 3 mg/L, 氨氮<0.4 mg/L, 亚硝酸盐氮<0.15 mg/L。
1.2 数据采集及分析 1.2.1 生长性能分别于5月、7月、9月和11月25日对每个池塘河蟹打样, 雌雄各打样10~20只。用毛巾吸干河蟹体表水分, 游标卡尺精确测量头胸甲长和头胸甲宽(精确到0.01 mm)。电子天平精确称重(精确到0.01 g), 以此计算增重率(weight gain rate, WGR, %)和特定生长率(specific growth rate, SGR, %/d)。
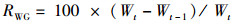 (1)
(1)
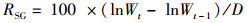 (2)
(2)
式中:RWG为增重率, %; RSG为特定生长率, %/d; Wt为第t月蟹的平均体质量, g; Wt-1为第t-1月蟹的平均体质量, g; D为采样的间隔时间, d。
1.2.2 生殖蜕壳率和性腺发育7月25日开始, 每隔15天, 每个池塘分别打样20~30只河蟹, 参照王武等[22]判别方法判断河蟹是否完成生殖蜕壳并逐个记录, 计算生殖蜕壳率(puberty molting rate, %)。为观察河蟹性腺发育状况, 9—11月, 每月25日从池塘中随机取6只蟹(♀: ♂ =1: 1), 精确称量后活体解剖, 取出全部肝胰腺和性腺, 计算肝胰腺指数(hepatosomatic index, HSI, %)和性腺指数(gonadosomatic index, GSI, %)。
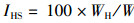 (3)
(3)
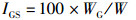 (4)
(4)
式中:IHS为肝胰腺指数, %; IGS为性腺指数, %; WH为肝胰腺质量, g; WG为性腺质量, g; W为体质量, g。
1.2.3 成活率、产量及饲料系数10月份河蟹开始上岸, 日常夜间抓捕上岸河蟹。11月25日养殖实验结束, 排干池塘水, 抓捕剩余成蟹。精确称重成蟹用于计算产量(yield, Y, kg/hm2); 统计存活个体数用于计算成活率(survival rate, SR, %); 存活和解剖个体的总质量与养殖期间消耗饲料总质量用于计算饲料系数(feed conversion ratio, FCR)[21]。
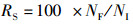 (5)
(5)
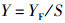 (6)
(6)
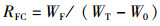 (7)
(7)
式中:RS为成活率, %; NF为最终存活个体和解剖个体数之和; NI为初始投放个体数; Y为单位面积产量, kg/hm2; YF为最终产量, kg; S为成蟹养殖水域面积, hm2; RFC为饲料系数; WF为消耗的饲料总质量, g; WT为最终养成成蟹总质量, g; W0为起始放养扣蟹总质量, g。
1.2.4 最终平均体质量及其分布根据每个池塘中最终捕获的雌、雄蟹分别计算平均体质量。逐只准确称量体质量, 参照HE等[23]方法进行规格分级。雄体分为7级, 分别为≥250.00 g、225.00~249.99 g、200.00~224.99 g、175.00~199.99 g、150.00~174.99 g、125.00~149.99 g和<125.00 g; 雌体分为5级, 分别为≥150.00 g、125.00~149.99 g、100.00~124.99 g、75.00~99.99 g和<75.00 g。记录河蟹只数用于计算各体质量等级所占比例。
1.2.5 数据分析应用SPSS 19.0软件对实验数据进行统计分析, 所有数据均采用平均值±标准误(Mean±SE)表示。采用Levene法进行方差齐性检验, 当不满足齐性方差时对百分比数据进行反正弦或平方根处理。采用One-way ANOVA检查各项指标间的差异性, P<0.05为差异显著。
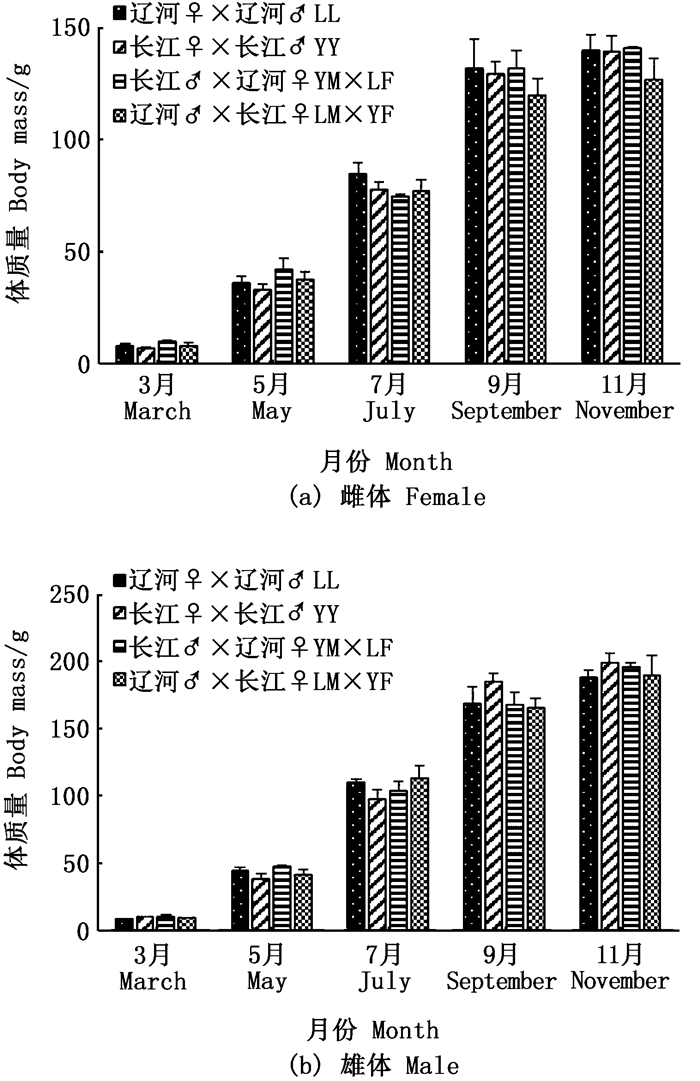
2 结果 2.1 生长性能图 1表明, 随着养殖时间延长, 4组中华绒螯蟹的体质量呈增加趋势, 但无显著性差异(P> 0.05)。不论是雌体还是雄体, 3—9月体质量均明显增加, 而9—11月体质量无显著性差异。就雌体而言, LL自交组平均体质量略高于YY自交组, LM×YF组平均体质量在生长后期(9—11月)最低。就雄体而言, 在生长前期(3—7月), LL组平均体质量略高于YY组, 但生长后期(9—11月)则以YY组为高。
|
图 1 成蟹阶段体质量的月变化 Fig. 1 Monthly changes of body mass during adult Eriocheir sinensis culture stage |
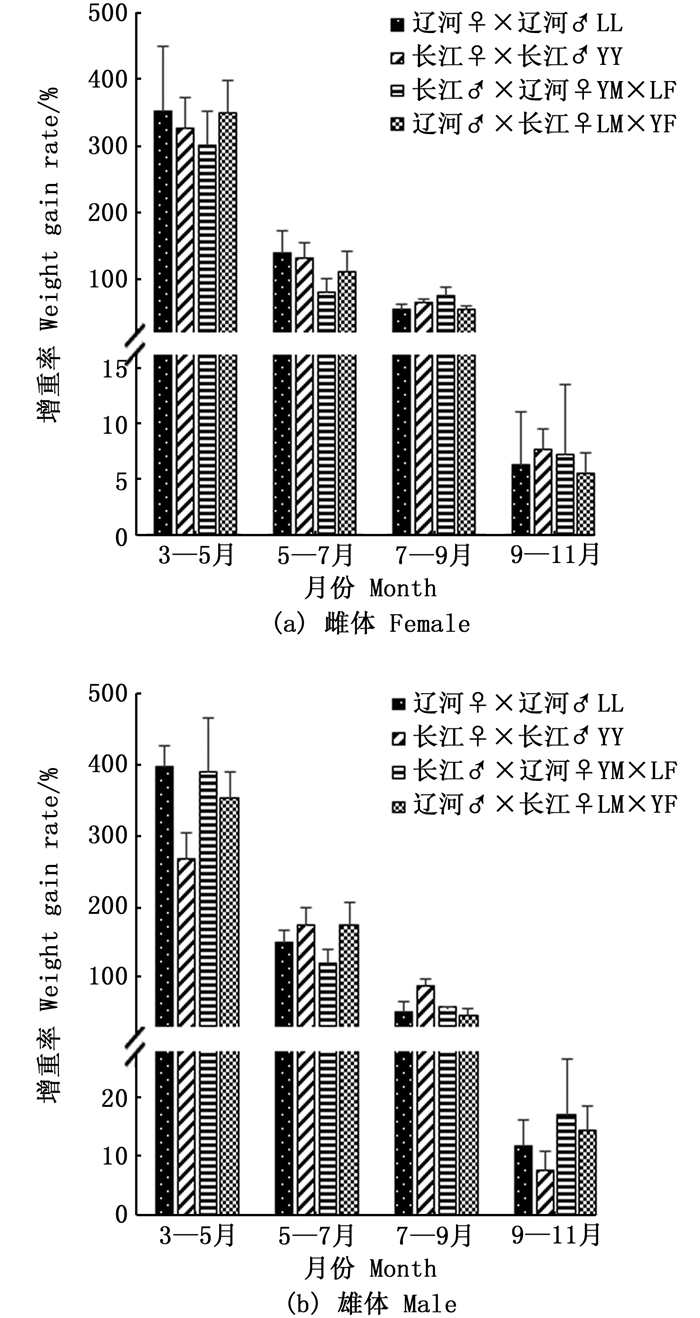
图 2表明, 4组中华绒螯蟹的WGR呈现下降趋势, 但无显著性差异(P>0.05)。3—5月WGR最高, 约为300%;而9—11月WGR最低, 雌体约为7%, 雄体约为10%。就雌体而言, 3—7月YM×LF组WGR较低, 但7—11月WGR则较高。就雄体而言, 3—5月和9—11月YY组WGR最低, 5—9月WGR则较高。
|
图 2 成蟹阶段增重率比较 Fig. 2 Monthly comparison of body weight gain rate (WGR) during adult Eriocheir sinensis culture stage |
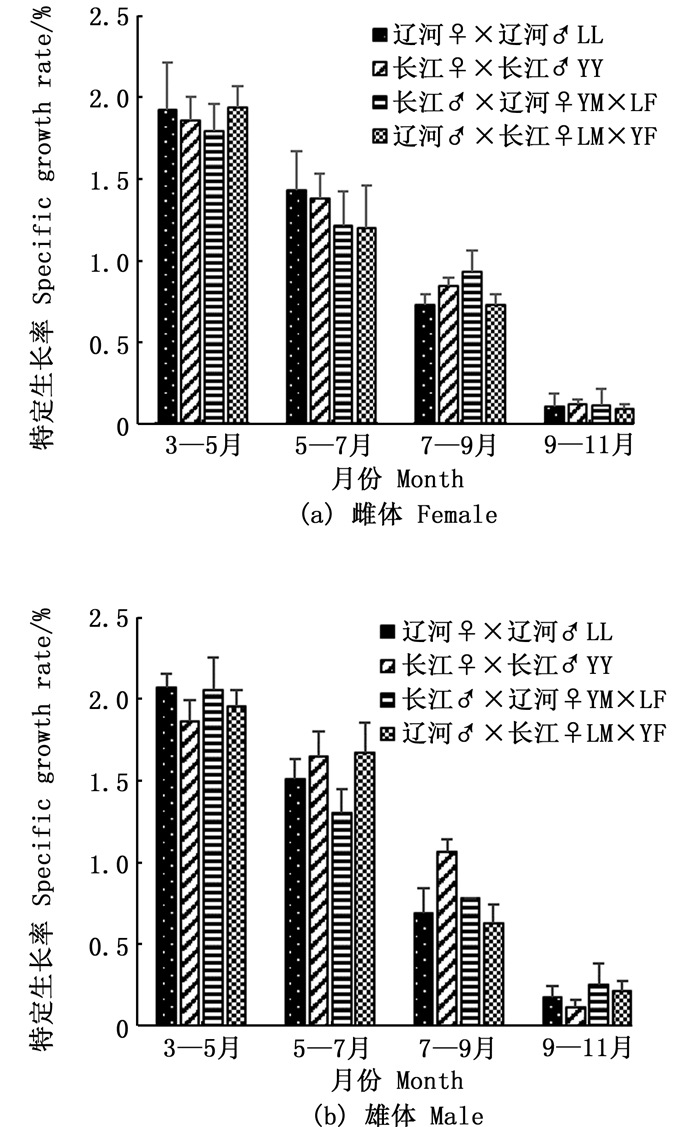
图 3表明, SGR的变化趋势与WGR基本一致。就雌体而言, 3—7月YM×LF组SGR较低, 但7—11月SGR则较高。就雄体而言, 3—5月和9—11月YY组SGR最低, 5—9月SGR则较高。
|
图 3 成蟹阶段特定生长率比较 Fig. 3 Monthly comparison of specific growth rate (SGR) during adult Eriocheir sinensis culture stage |
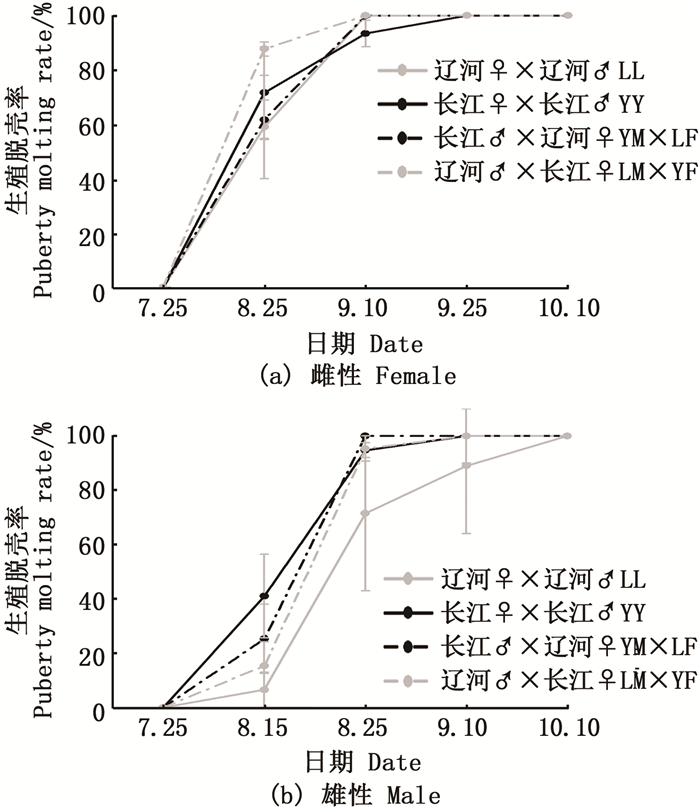
由图 4可知:4组中华绒螯蟹从8月开始陆续生殖蜕壳; 雌体生殖蜕壳早于雄体, 雌体的生殖蜕壳高峰出现在7月25到8月25, 而雄体则延迟为8月25到9月25日。整体来看, 杂交组生殖蜕壳略早于自交组, 但无显著性差异(P> 0.05)。就雌体而言:8月25日, LM×YF生殖蜕壳率最高, 随后依次为YY组、YM×LF组和LL组; 9月25日, 雌体全部完成生殖蜕壳。就雄体而言, 8月25日生殖蜕壳率由高到低依次为YY> YM×LF>LM×YF>LL; 1 0月10日雄体全部完成生殖蜕壳。
|
图 4 成蟹阶段生殖蜕壳率比较 Fig. 4 Comparison of puberty molting rate during adult Eriocheir sinensis culture stage |
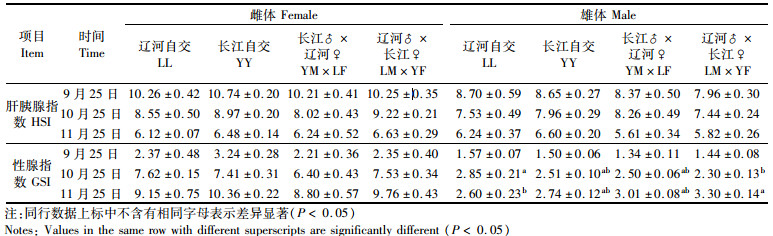
生殖蜕壳完成后, 性腺发育速度显著加快。不论是雌体还是雄体, 在性腺发育期间肝胰腺指数(HSI)逐渐下降, 性腺指数(GSI)显著升高(表 1)。就雌体而言:9—11月4组中华绒螯蟹HSI和GSI均无显著性差异(P> 0.05);HSI下降幅度由高到低依次为LL(40.35%)>YY(39.66%)>YM×LF(38.88%)>LM×YF(35.32%), GSI增加幅度由高到低依次为LM×YF(315.32%)>YM×LF(298.19%)> LL(286.08%)>YY(219.75%)。就雄体而言:9—11月4组中华绒螯蟹HSI下降幅度不大, GSI则显著升高, 9—10月增加幅度最大, 分别达到81.53%、82.67%、124.63%和129.17%;10月和11月25日4组中华绒螯蟹GSI存在显著性差异(P<0.05)。
|
表 1 成蟹阶段肝胰腺指数及性腺指数比较 Tab.1 Comparison of the gonadosomatic index (GSI) and hepatosomatic index (HSI)during adult Eriocheir sinensis culture stage |
由表 2可知:就成活率而言, 雌体间存在显著性差异(P<0.05), 由高到低依次为LM×YF>YY>YM×LF>LL, 雄体和整体无显著性差异(P>0.05);就产量而言, 雌体和总体存在显著性差异(P<0.05), 而雄体则无显著性差异(P>0.05);就饲料系数而言, LL组最高, 随后依次为LM×YF组和YM×LF组, YY组最低, 其中杂交组与自交组存在显著性差异(P<0.05)。
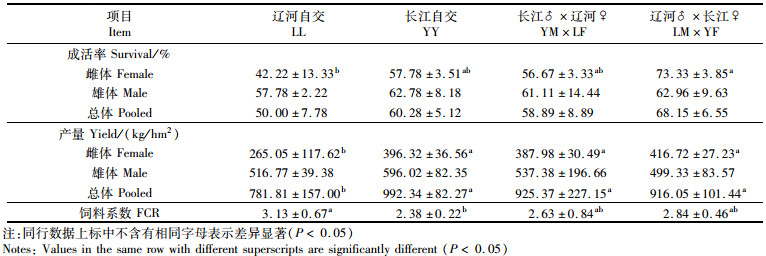
|
表 2 成蟹阶段成活率、产量及饲料系数比较 Tab.2 Comparison of survival, yield and feed conversion ratio (FCR) during adult Eriocheir sinensis culture stage |
LL组、YY组、YM×LF组和LM×YF组成蟹雌体平均体质量分别为(137.52±23.77)g、(138.46±18.37)g、(129.13±19.03)g和(140.66±24.33)g, 雄体平均体质量分别为(181.47±44.97)g、(199.49±25.20)g、(196.21±26.10)g和(192.34±35.42)g。4组中华绒螯蟹最终养成成蟹的规格百分比均呈正态分布(图 5), 但各规格成蟹比例存在一定差异。就雌体而言, 体质量主要集中在100.00 ~175.00 g, 仅LL组无<100.00 g成蟹, 其余3组则存在一定比例。YM×LF组≥175.00 g成蟹比例最高, 但各组间差异不显著(P>0.05)。就雄蟹而言, 体质量主要集中在175.00~225.00 g, LL组无≥250.00 g成蟹。
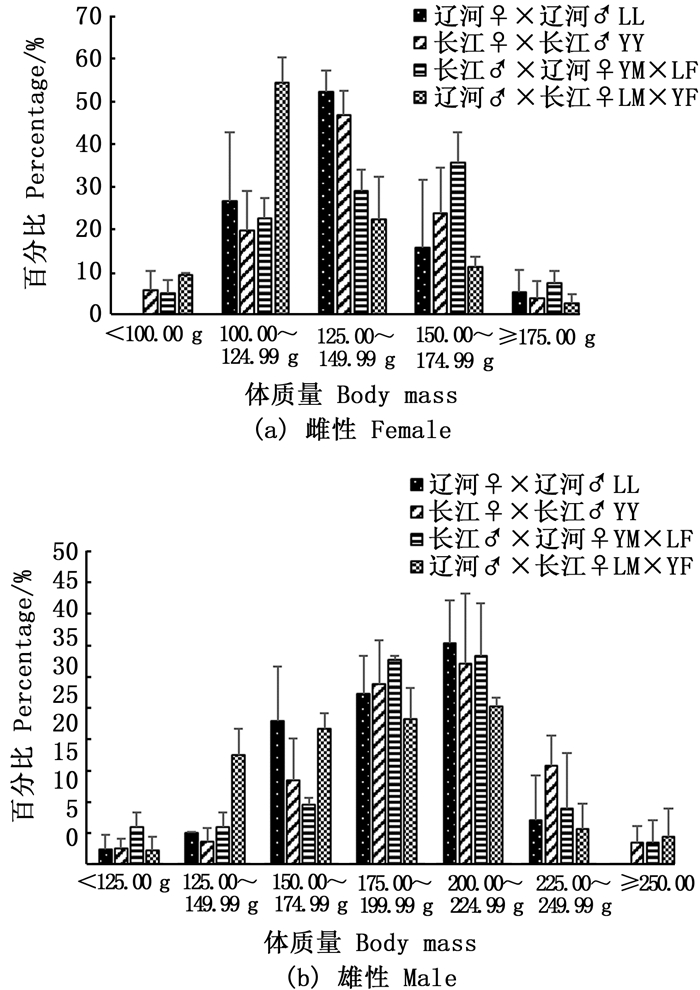
|
图 5 最终养成成蟹体质量分布 Fig. 5 Distribution of different final body mass classes |
杂种优势是指两个遗传背景不同的亲本杂交产生的子代在生长、生殖力、抗逆性和产量比亲本一方或双方优越的现象[24-26]。亲本间的遗传差异是产生杂种优势的重要原因[16], 群体内基因纯合程度越高, 群体间的基因频率差异越大, 则后代产生杂交优势的可能性也就越高[12, 27], 反之则可能出现杂交性状不但得不到改良, 反而出现杂种劣势的现象[28]。研究表明:在生长性能方面, 自交组与杂交组各月体质量无显著性差异(P>0.05), 杂交组并未表现出明显的杂种优势, 甚至LM×YF组雌体还表现出一定的杂交劣势。可能原因:(1)中华绒螯蟹长江种群和辽河种群遗传距离较近[29-30], 导致等位基因差异较小或者不显著; (2)20世纪80年代长江水系野生中华绒螯蟹种质资源锐减, 导致蟹种价格急剧攀升[5], 因此一些商贩将辽河水系中华绒螯蟹运输到长江流域, 并且大量销售, 致使长江水系中华绒螯蟹种质资源混杂, 不纯的中华绒螯蟹种质导致杂交后配子重组差异较小, 杂交优势不明显。以上结果表明, 通过杂交手段达到超越亲本生长性状是较为困难的。但通过增大遗传距离或选用较纯种质的方法或许可以达到提升生长性能的目的。本文辽河和长江水系中华绒螯蟹终体质量高于WU等[20]养殖的成蟹平均体质量, 可能与2018年上海崇明岛气温适宜有关[21]。不论是雌体还是雄体, 4组中华绒螯蟹的WGR和SGR均随着养殖时间的延长而逐渐下降, 这与文献[19-21]一致。
生殖蜕壳是中华绒螯蟹性腺发育的重要起点, 受遗传和环境两大因素共同作用[23]。整体来看, 杂交组生殖蜕壳率略早于自交组, 但无显著性差异(P>0.05)。在相似的养殖条件下, 可能遗传因素起到了主要的作用, 杂种优势并不明显。值得注意的是, 辽河水系中华绒螯蟹在长江流域经过适应性养殖后, 其生殖蜕壳提前的现象消失。先前研究[20-21]表明辽河水系野生和人工养殖扣蟹移植到长江流域后, 保持了生殖蜕壳提前的早熟性状, 说明不同地理种群中华绒螯蟹已经形成了可以遗传的经济性状。但经过几代适应性养殖后, 其辽河水系中华绒螯蟹子代表现出了更好地环境适应性, 与长江水系土著中华绒螯蟹经济性状极为相似。可能与其表观遗传有关, 特别是性腺发育相关基因的DNA甲基化[31]。9—11月, 4组中华绒螯蟹HSI逐渐降低, GSI显著增加。主要原因是在性腺发育阶段, 肝胰腺中营养物质向性腺中转移, 提供了性腺发育的部分能量来源[32]。虽然9月25日杂交组雄体GSI略低于自交组, 但11月25日杂交组雄体GSI显著高于自交组(P<0.05), 说明杂交组在性腺发育后期增速较快, 表现出一定的杂交优势。
成活率、产量和饲料系数是水产经济动物种质资源评价的重要组成部分, 是产业发展过程中受关注的重要经济指标[23]。本研究表明杂交组和自交组成活率存在显著性差异(P<0.05), 整体上杂交组成活率要高于自交组, 尤其是LM×YF组显著高于辽河水系自交组, 且产量也显著高于辽河自交组(P<0.05), 杂交优势明显。但正反交组结果差异较大, 以长江水系中华绒螯蟹为母本的杂交组呈现出更大的杂种优势, 而辽河水系中华绒螯蟹为母本的则和长江水系自交组差异不大, 这与郑怀平等[33]和王好锋等[18]研究结果一致, 推测可能是以长江蟹作为母本所得到的子代的杂合度更高, 而杂合度与其生长的适应性呈正相关[15], 也有可能与母性效应、性别连锁、细胞质遗传等有关[24, 34]。而正是这种正反交的差异为杂交育种中需要采用特定的亲本提供了理论基础[34]。辽河水系自交组饲料系数最高, 长江水系自交组饲料系数最低, 而杂交组则处于两者之间, 说明在饲料系数经济性状上, 杂交组与自交组有显著性差异(P<0.05)。
综上, 在生长性能上, 杂交组与自交组并无显著性差异, 杂交优势不明显, 甚至以长江水系中华绒螯蟹作为母本的杂交组雌体反而呈现一定杂交劣势。辽河水系自交组在经过长江流域适应性养殖后, 生长性能得到提高, 雌体与长江水系自交组差别不大, 同时其二龄早熟性状消失, 反而以长江水系中华绒螯蟹作为母本的杂交组生殖蜕壳最早。以长江水系中华绒螯蟹作为母本的杂交组成活率和产量显著高于辽河水系自交组, 且≥175.00 g大规格成蟹比例较高, 杂交优势明显。
| [1] |
堵南山. 中华绒螯蟹的同属种类及其英文名称[J]. 水产科技情报, 1998, 25(3): 108-109. DU N S. Chinese mitten crab specises in some genus and their English names[J]. Fisheries Science & Technology Information, 1998, 25(3): 108-109. |
| [2] |
王成辉, 李思发. 中华绒螯蟹种质研究进展[J]. 中国水产科学, 2002, 9(1): 82-86. WANG C H, LI S F. Advances in studies on germplasm in Chinese mitten crab, Erocheir sinensis[J]. Journal of Fishery Sciences of China, 2002, 9(1): 82-86. |
| [3] |
WANG S H, ZHANG C, SHANG M, et al. Genetic diversity and population structure of native mitten crab (Eriocheir sensu stricto) by microsatellite markers and mitochondrial COI gene sequence[J]. Gene, 2019, 693: 101-113. DOI:10.1016/j.gene.2018.12.083 |
| [4] |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会. 中国渔业统计年鉴-2018[M]. 北京: 中国农业出版社, 2019: 24. Bureauof Fisheries, Ministry of Agriculture and Rural Affairs, PRC, National Fisheries Technology Extension Center, China Society of Fisheries. 2018 China fishery statistical yearbook[M]. Beijing: China Agriculture Press, 2019: 24. |
| [5] |
CHENG Y X, WU X G, YANG X Z, et al. Current trends in hatchery techniques and stock enhancement for Chinese mitten crab, Eriocheir japonica sinensis[J]. Reviews in Fisheries Science, 2008, 16(1/3): 377-384. |
| [6] |
徐德昆, 林乐峰. 不同水系河蟹幼蟹的养成效果分析[J]. 水产养殖, 1997(1): 26-27. XU D K, LIN Y F. Analysis on the growth effect of crabs in different water systems[J]. Journal of Aquaculture, 1997(1): 26-27. |
| [7] |
王成辉, 李思发, 李晨虹, 等. 中华绒螯蟹长江种群与辽河种群一龄阶段的成活率与生长性能比较[J]. 上海水产大学学报, 2000, 9(2): 111-115. WANG C H, LI S F, LI C H, et al. Comparison on survival rate and growth of juvenile crab of Yangtze population and Liaohe population[J]. Journal of Shanghai Fisheries University, 2000, 9(2): 111-115. |
| [8] |
罗坤, 杨国梁, 孔杰, 等. 罗氏沼虾不同群体杂交效果分析[J]. 海洋水产研究, 2008, 29(3): 67-73. LUO K, YANG G L, KONG J, et al. Analysis of the effect of hybridization between different groups of Macrobrachium rosenbergii[J]. Marine Fisheries Research, 2008, 29(3): 67-73. |
| [9] |
LAWRENCE A L, BRAY W A, WILKENFELD J S, et al. Successful interspecific cross of two species of marine shrimp Penaeus stylirostris and Penaeus setiferus in captivity[C]//15th Annual Conference of the World Aquaculture Society.Baton Rouge, Louisiana, 1984: 39.
|
| [10] |
REDÓN M J, ROS R M, RIELO J A, et al. First attempt of interspecific hybridization between the shrimps Penaeus kerathurus Forskäl, 1775 and Penaeus japonicus Bate, 1888[J]. Aquaculture Research, 1997, 28(4): 271-277. DOI:10.1111/j.1365-2109.1997.tb01043.x |
| [11] |
CRUZ P, IBARRA A M. Larval growth and survival of two catarina scallop (Argopecten circularis, Sowerby, 1835) populations and their reciprocal crosses[J]. Journal of Experimental Marine Biology and Ecology, 1997, 212(1): 95-110. DOI:10.1016/S0022-0981(96)02742-6 |
| [12] |
刘小林, 常亚青, 相建海, 等. 栉孔扇贝中国种群与日本种群杂交一代的中期生长发育[J]. 水产学报, 2003, 27(3): 193-199. LIU X L, CHANG Y Q, XIANG J H, et al. The medium-term growth and development of hybrid between Chinese and Japanese populations of Chlamys farreri[J]. Journal of Fisheries of China, 2003, 27(3): 193-199. |
| [13] |
DEL RIO-PORTILLA M A, BEAUMONT A R. Larval growth, juvenile size and heterozygosity in laboratory reared mussels, Mytilus edulis[J]. Journal of Experimental Marine Biology and Ecology, 2000, 254(1): 1-17. DOI:10.1016/S0022-0981(00)00265-3 |
| [14] |
常抗美, 刘慧慧, 李家乐, 等. 紫贻贝和厚壳贻贝杂交及F1代杂交优势初探[J]. 水产学报, 2008, 32(4): 552-557. CHANG K M, LIU H H, LI J L, et al. A primary study on hybridization of Mytilus galloprovincialis, Mytilus coruscus, heterosis of F1 generation[J]. Journal of Fisheries of China, 2008, 32(4): 552-557. |
| [15] |
ENGLISH L J, MAGUIRE G B, WARD R D. Genetic variation of wild and hatchery populations of the Pacific oyster, Crassostrea gigas (Thunberg), in Australia[J]. Aquaculture, 2000, 187(3/4): 283-298. |
| [16] |
官俊良, 张跃环, 苏家齐, 等. 两个地理群体香港牡蛎(Crassostrea hongkongensis)杂交子代早期生长发育的杂种优势研究[J]. 海洋与湖沼, 2016, 47(1): 182-187. GUAN J L, ZHANG Y H, SU J Q, et al. Heterosis in early growth stage of Hong Kong oyster Crassostrea hongkongensis hybridids from two geographical populations[J]. Oceanologia et Limnologia Sinica, 2016, 47(1): 182-187. |
| [17] |
高保全, 刘萍, 李健, 等. 三疣梭子蟹(Portunus trituberculatus)不同地理种群内自繁和种群间杂交子一代生长性状的比较[J]. 海洋与湖沼, 2008, 39(3): 291-296. GAO B Q, LIU P, LI J, et al. Heterosis of F1Portunus trituberculatusfrom matings and crosses among different geographical populations[J]. Oceanologia et Limnologia Sinica, 2008, 39(3): 291-296. |
| [18] |
王好锋, 韩晓琳, 段亚飞, 等. 三疣梭子蟹自交与杂交家系子一代生长和存活的比较[J]. 渔业科学进展, 2014, 35(3): 74-81. WANG H F, HAN X L, DUAN Y F, et al. Comparison of growth and survival of the hybrid and inbred families of Portunus trituberculatus[J]. Progress in Fishery Sciences, 2014, 35(3): 74-81. |
| [19] |
何杰, 吴旭干, 姜晓东, 等. 野生和人工繁育大眼幼体在成蟹阶段的养殖性能比较[J]. 上海海洋大学学报, 2015, 24(1): 60-67. HE J, WU X G, JIANG X D, et al. Comparison of the culture performance of wild-caught and artifical breeding Chinese mitten crab megalopae reared in the grow-out ponds during the adult Eriocheir sinensisculture stage[J]. Journal of Shanghai Ocean University, 2015, 24(1): 60-67. |
| [20] |
WU X G, ZHAO H L, JIANG X D, et al. Comparison of culture performance and gonadal development of wild caught Chinese mitten crab Eriocheir sinensis juveniles from three major river populations[J]. Fisheries Science, 2018, 84(6): 929-937. DOI:10.1007/s12562-018-1237-y |
| [21] |
王世会, 周永昌, 吴旭干, 等. 辽河和闽江水系中华绒螯蟹扣蟹在成蟹阶段的养殖性能比较[J]. 水产学杂志, 2019, 32(2): 19-25. WANG S H, ZHOU Y C, WU X G, et al. Comparison of culture performance of juveniles mitten handed crab(Eriocheir sinensis) derived from Liaohe river and Minjiang river in food crab culture[J]. Chinese Journal of Fisheries, 2019, 32(2): 19-25. |
| [22] |
王武, 王成辉, 马旭洲. 河蟹生态养殖[M]. 2版. 北京: 中国农业出版社, 2013: 59-84. WANG W, WANG C H, MA X Z. Ecological culture of Chinese mitten carb[M]. 2nd ed.. Beijing: Chinese Agricultural Press, 2013: 59-84. |
| [23] |
HE J, WU X G, LI J Y, et al. Comparison of the culture performance and profitability of wild-caught and captive pond-reared Chinese mitten crab (Eriocheir sinensis) juveniles reared in grow-out ponds:implications for seed selection and genetic selection programs[J]. Aquaculture, 2014, 434: 48-56. DOI:10.1016/j.aquaculture.2014.07.022 |
| [24] |
高保全, 刘萍, 李健. 三疣梭子蟹3个地理种群杂交子一代生长和存活率的比较[J]. 大连水产学院学报, 2008, 23(5): 325-329. GAO B Q, LIU P, LI J. Comparative growth and viability of hybrid F1 in different geographical populations of crab Portunus trituberculatus[J]. Journal of Dalian Fisheries University, 2008, 23(5): 325-329. |
| [25] |
XU F, ZHANG G F, LIU X, et al. Laboratory Hybridization between Crassostrea ariakensis and C. Sikamea[J]. Journal of Shellfish Research, 2009, 28(3): 453-458. DOI:10.2983/035.028.0305 |
| [26] |
HUO Z M, WANG Z P, YAN X W, et al. Fertilization, survival, and growth of Crassostrea hongkongensis ♀ × Crassostrea ariakensis ♂ hybrids in Northern China[J]. Journal of Shellfish Research, 2013, 32(2): 377-385. DOI:10.2983/035.032.0217 |
| [27] |
楼允东. 鱼类育种学[M]. 北京: 中国农业出版社, 1998: 23. LOU Y D. Fishbreeding[M]. Beijing: China Agricultural Press, 1998: 23. |
| [28] |
张国范, 郑怀平. 海湾扇贝养殖遗传学[M]. 北京: 科学出版社, 2009: 76-99. ZHANG G F, ZHENG H P. Aquaculture genetics in Bay Scalllop[M]. Beijing: Science Press, 2009: 76-99. |
| [29] |
刘青, 刘皓, 吴旭干, 等. 长江、黄河和辽河水系中华绒螯蟹野生和养殖群体遗传变异的微卫星分析[J]. 海洋与湖沼, 2015, 46(4): 958-968. LIU Q, LIU H, WU X G, et al. Genetic variation of wild and cultured populations of Chinese mitten crab Eriocheir sinensis from the Yangtze, Huanghe, and Liaohe River basins using microsatellite marker[J]. Oceanologia etLimnologia Sinica, 2015, 46(4): 958-968. |
| [30] |
ZHANG C, LI Q Q, WU X G, et al. Genetic diversity and genetic structure of farmed and wild Chinese mitten crab(Eriocheir sinensis)populations from three major basins by mitochondrial DNA COI and Cyt b gene sequences[J]. Mitochondrial DNA Part A, 2018, 29(7): 1081-1089. DOI:10.1080/24701394.2017.1404048 |
| [31] |
CRESPO B, GÓMEZ A, MAZÓN M J, et al. Isolation and characterization of Ff1 and Gsdf family genes in European sea bass and identification of early gonadal markers of precocious puberty in males[J]. General and Comparative Endocrinology, 2013, 191: 155-167. DOI:10.1016/j.ygcen.2013.06.010 |
| [32] |
成永旭, 堵南山, 赖伟. 中华绒螯蟹卵巢和胚胎发育期脂类在卵黄物质中存在的形态及其变化[J]. 动物学杂志, 1999, 34(1): 51-55. CHENG Y X, DU N S, LAI W. On the ultrastructure of yolk lipid distribution and its changes during the Chinese crab, Eriocheir sinensis ovarian maturation and embryonic development[J]. Chinese Journal of Zoology, 1999, 34(1): 51-55. |
| [33] |
郑怀平, 张国范, 刘晓, 等. 海湾扇贝杂交家系与自交家系生长和存活的比较[J]. 水产学报, 2004, 28(3): 267-272. ZHENG H P, ZHANG G F, LIU X, et al. Comparison of growth and survival between the self-fertilized and hybridized families in Argopecten irradians irradians[J]. Journal of Fisheries of China, 2004, 28(3): 267-272. |
| [34] |
BENTSEN H B, EKNATH A E, PALADA-DE VERA M S, et al. Genetic improvement of farmed tilapias:growth performance in a complete diallel cross experiment with eight strains of Oreochromis niloticus[J]. Aquaculture, 1998, 160(1/2): 145-173. |
2. Heilongjiang Fisheries Research Institute, Chinese Academy of Fishery Sciences, Harbin 150070, Heilongjiang, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
4. Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


