2. 农业农村部水产品贮藏保鲜质量安全风险评估实验室, 上海 201306;
3. 上海水产品加工及贮藏工程技术研究中心, 上海 201306;
4. 上海海洋大学 食品热加工工程技术研究中心, 上海 201306
副溶血性弧菌(Vibrio parahaemolyticus, VP)是我国常见的食源性致病菌[1], 广泛存在于沿海和河口地区[2], 能够引发细菌性肠胃炎, 伤口感染以及败血症[3]。VP可以黏附在各种食品和加工器械表面, 通过分泌胞外多糖、蛋白质等水合性胞外基质(extracellular polymeric substances, EPS)将自身包裹, 形成生物被膜[4-5]。生物被膜一旦形成就很难被彻底去除, 一方面会损害设备器械造成经济损失, 另一方面残留的生物被膜在食品生产、加工、流通和贮藏等过程中容易发生食品间的交叉污染而引发食物中毒等食品安全问题[6]。
目前对于食源性致病菌生物被膜生长过程的研究主要集中在静置环境下被膜的生成过程。但是在食品生产、加工、运输过程中, 存在各式各样的器械设备, 如振动筛、传送带、搅拌器、发酵罐等, 食源性致病菌往往处于振动环境中[7]。研究在振动条件下被膜的形成过程更符合食品实际生产环境, 对实际生产环境中有害生物被膜的防治更具有参考意义。本研究主要模拟食品加工过程中不同振动方式, 初步探究振动对食源性致病菌生物被膜形成的影响。
生物被膜被认为是一种黏弹性材料[8-9], 它可以由弹性响应、黏性响应或黏弹性响应支配, 这取决于施加的负荷大小、时间以及施加负荷的速率[10]。所以本研究在实验室条件下模拟了3种振动方式(水平旋转式振动:100 r/min, 200 r/min; 翘板式振动:100 r/min; 垂直翻转式振动:100 r/min), 检测VP在振动条件下孵育72 h生物被膜形成过程, 探究振动方式及振动大小对食源性致病菌生物被膜形成的影响, 为食品加工行业对不同机械设备的选择以及食品安全风险评估提供理论参考。
1 材料与方法 1.1 菌株所用菌株为副溶血性弧菌VP-S36, 本实验室从虾中分离。
1.2 主要试剂与仪器硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(thiosulfate citrate bile salts sucrose agar culture medium, TCBS), 胰酶大豆肉汤培养基(tryptone soybean broth, TSB)购自北京陆桥技术有限责任公司; 结晶紫购自美国Sigma公司; 20×磷酸缓冲液(PBS)购自生工生物工程(上海)股份有限公司; SYBR Green Ⅰ染料购自北京索莱宝科技有限公司; 25%戊二醛溶液, 浓硫酸购自上海展云化工有限公司; 无水乙醇(分析纯AR), 氯化钠(NaCl)购自国药集团化学试剂有限公司; 福林酚购自Sigma-Aldrich有限公司。
24和96孔板购自美国康宁公司; BioTek酶标仪购自美国伯腾仪器有限公司; MIR154高精度低温培养箱, MLS-3750型高压灭菌锅购自日本三洋电机生物医药株式会社; OptiMairⓇ垂直流超净工作台, AirstreamⓇA2型二级生物安全柜购自Esco China公司; LSM710型激光扫描共聚焦显微镜购自德国卡尔蔡司公司; THZ-100恒温培养摇床购自上海一恒科学仪器有限公司; RS-100翘板摇床购自杭州佑宁仪器有限公司; Grant PTR-60旋转混合器购自上海法润科学仪器; ZQZY-70B振荡培养箱购自上海知楚仪器公司; 5417C型小型高速台式冷冻离心机; 恒温金属浴购自Eppendorf公司。
1.3 菌株的活化将保存在-80 ℃冰箱的副溶血性弧菌划线于TCBS培养基上, 37 ℃恒温培养箱中静置过夜培养, 挑单菌落接种至装有9 mL配制的含3% NaCl的TSB培养基的试管中, 在180 r/min的摇床中37 ℃恒温过夜培养12 h, 连续活化两次, 用酶标仪测菌液在600 nm下的吸光值, 将菌液调到OD600=0.6备用[11]。
1.4 生物被膜的培养在实验室条件下用水平旋转式摇床、翘板式摇床、Grant PTR-60旋转混合器模拟了水平旋转式振动、翘板式振动和垂直翻转式振动模式。选用食品行业常见的食品接触材料玻璃和不锈钢(304型号)作为实验材料。本实验探究细菌在3种不同振荡方式培养条件下被膜的形成过程。生物被膜培养方法参考KADAM等[12]并稍作改良。将无菌的不锈钢片和玻璃片分别置于24孔板中, 并依次在超净台加入990 μL TSB + 3% NaCl培养基和10 μL菌液。将加好菌液的24孔板用保鲜袋包裹并做好标记, 分别放置于0 r/min(静置)摇床、100 r/min和200 r/min旋转式摇床(振幅:水平20 mm), 100 r/min翘板式摇床(摆幅:上下25 mm/10°)5 ℃分别培养12、24、36、48、60和72 h, 每次3个平行。另将无菌的不锈钢片放置于5 mL离心管中, 加入1 980 μL TSB+3% NaCl培养基和20 μL菌液。做好标记, 放置于Grant PTR-60旋转混合器中, 25 ℃, 100 r/min垂直翻转模式下培养12、24、36、48、60和72 h, 每次3个平行。见图 1。

|
图 1 实验示意图(箭头表示振动方向) Fig. 1 Experimental schematic(Arrow indicates the direction of vibration) |
采用传统的结晶紫染色法检测1.4节中培养的VP生物被膜[12-13], 并稍作改良, 生物被膜用结晶紫染色后加乙醇溶解, 根据颜色深浅可定量生物被膜量[14-15]。将上述24孔板和试管取出, 去掉悬浮液, 取出不锈钢片和玻璃片(注意被膜生长面朝上)放入无菌的24孔板中, 每孔每次加入1 mL PBS清洗3次以去除浮游菌体。室温干燥后加入1 mL结晶紫染液染色30 min。去掉染液, 每孔每次加入1 mL PBS清洗3次, 干燥30 min后加入1 mL 95%乙醇洗脱30 min。吸取200 μL的洗脱液至96孔板中, 用酶标仪检测洗脱液在600 nm处的吸光度值并记录。
1.6 激光共聚焦显微镜观察生物被膜将1.4节中培养后的被膜中的上清液吸出, PBS清洗3次后, 用4%的戊二醛溶液固定30 min, 然后用PBS溶液清洗3次, 用SYBR Green Ⅰ染料放置暗室染色30 min, 再用PBS溶液清洗3次, 将不锈钢片取出, 用激光共聚焦显微镜观察, 每个样品3个平行。
1.7 基于ISA软件分析生物被膜的结构将1.6节中获得的CLSM图片导入ISA软件(美国蒙大纳州立大学BEYENAL教授提供)并运行程序, 获得数据并分析。
1.8 EPS中胞外多糖和胞外蛋白的测定采用超声波法提取并测定EPS, 并稍作改良[16-17]。将1.4节培养后的24孔板和试管取出, 吸出200 μL菌液至96孔板, 用酶标仪测定其OD595, 将不锈钢片和玻璃片取出放置于无菌的24孔板中, 每孔每次加入1 mL PBS清洗3次以去除浮游菌体。每孔加入1 mL 0.01 mol/L的氯化钾溶液后, 用枪头将黏附在不锈钢和玻璃表面的生物被膜刮起并反复吹打混匀, 再进行超声处理(每次5 s, 每个循环间隙5 s, 循环5次)。收集被膜到1.5 mL无菌离心管中, 4 ℃条件下4 000 g离心20 min。再用0.22 μm滤膜过滤到新的离心管中备用。
苯酚-硫酸法测胞外多糖:取100 μL上述滤液至1.5 mL无菌离心管中, 加入200 μL浓硫酸静置反应30 min, 加入25 μL 6%苯酚溶液后90 ℃金属浴5 min, 然后吸取200 μL反应液至96孔板, 测定OD490, 生物被膜胞外多糖相对含量为OD490/OD595。
Lowry法测定胞外蛋白:吸取40 μL上述滤液于1.5 mL无菌离心管中, 随后加入200 μL lowry reagent溶液室温静置反应10 min。加入20 μL福林-酚试剂反应30 min。用酶标仪测定OD750, 生物被膜胞外蛋白相对含量为OD750/OD595。
1.9 数据处理采用Origin 9.0(information)软件作图, 应用SPSS 20.0(information)软件进行单因素方差分析(LSD统计分析), 检验水平P < 0.05代表差异显著。
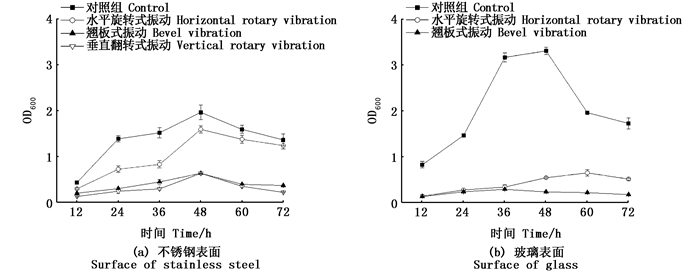
2 结果 2.1 结晶紫染色法检测不同振动方式下VP生物被膜的生长过程采用结晶紫染色法观察不同振动方式下VP在不锈钢和玻璃表面生物被膜形成的变化过程, 每隔12 h观测1次, 观察时长为72 h。静置培养作为对照组。如图 2所示, VP生物被膜的形成是一个动态过程。在静置条件下, VP在玻璃表面被膜形成量多, 但是在同种振动方式下, 在不锈钢表面被膜形成量相对较多。在两种材料表面, 在振动条件下被膜生成量明显小于对照组, 在被膜量达到峰值时, 在振动模式下被膜与对照组差异非常大。在不锈钢表面, VP生物被膜在3种振动条件下与静置培养生物被膜生长趋势相同, 都是先上升后下降。12~48 h为被膜发展期, VP快速生长, 被膜形成速度快, 被膜生成量逐渐增加; 48 h为被膜成熟期, 被膜生成量达到峰值; 48~72 h为被膜分散期, 被膜生成量开始减少。孵育相同时间, 在不同振动方式下生物被膜生成量情况:静置>水平旋转式振动>翘板式振动>垂直翻转式振动。
|
图 2 结晶紫染色法测定在不同振动方式下副溶血性弧菌不同表面被膜形成过程 Fig. 2 VP biofilm development process on the different surfaces in different vibration modes by crystal violet staining method |
玻璃表面被膜形成情况与不锈钢表面类似。在两种振动方式下被膜生成量:静置培养>水平旋转式振动>翘板式振动; 被膜生长趋势也呈先上升后下降趋势。
由表 1发现在不锈钢表面, 水平旋转式振动被膜生成量平均减少了27.67%, 翘板式振动被膜生成量平均减少了69.51%, 垂直翻转式振动被膜生成量平均减少了84.58%。12~72 h被膜减少大致趋势:被膜发育前期被膜减少量相对较多, 被膜成熟期和分散期被膜减少量相对较小。

|
表 1 与静置相比在振动条件下副溶血性弧菌生物被膜的减少率 Tab.1 Reduction ratio of the VP biofilm formation compared to the control |
在玻璃表面, 被膜减少大致趋势与不锈钢表面类似。水平旋转式振动被膜生成量平均减少了77.04%, 翘板式振动被膜生成量平均减少了86.46%, 通过对比玻璃和不锈钢表面被膜平均减少情况, 发现在同种振动方式下在玻璃表面被膜量平均减少更多, 说明振动对在玻璃表面培养的被膜生长的影响要大于在不锈钢表面培养的被膜。
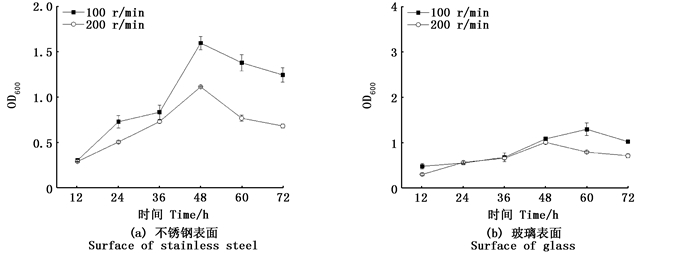
此外, 还发现在同种振动方式下, 增加转速, 被膜形成量减少。如图 3, 在水平旋转式振动条件下, 被膜形成量随着转速的增加而减少, 而且在玻璃表面被膜减少量比在不锈钢表面被膜减少量大。
|
图 3 结晶紫染色法测定在不同转速下副溶血性弧菌在不同表面被膜形成过程 Fig. 3 VP biofilm development process on the different surfaces at different rotating speedby crystal violet staining method |
激光扫描共聚焦显微镜(confocal laser scanning microscopy, CLSM)可以观察到生物被膜原有的、不脱水状态下的三维结构, 在生物被膜结构的研究过程中发挥着很重要的作用。本实验利用激光共聚焦显微镜直观地观察VP生物被膜的生长过程。
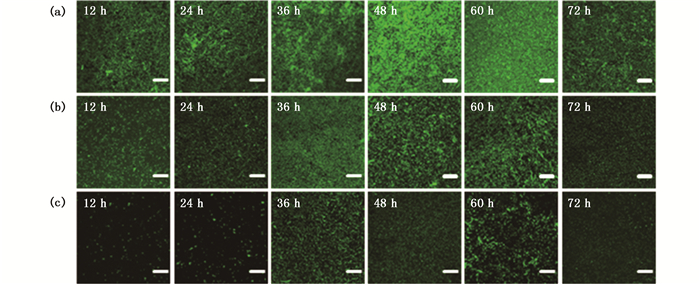
由图 4和图 5可知, 结晶紫染色法与CLSM结果一致。VP在玻璃和不锈钢表面的形成过程都是一个动态生长过程。生物被膜的形成过程主要可以分为3个阶段:黏附发展期, 生物被膜成熟期以及被膜分散期。荧光强度与被膜形成量呈正相关, 生物被膜的形成量不断上升, 荧光强度逐渐增加, 到达峰值后被膜量开始不断减少, 荧光强度开始降低。

|
(a)静置培养; (b)水平旋转式振动; (c)翘板式振动; (d)垂直翻转式振动; 标尺为20 μm (a) Control; (b) Horizontal rotary vibration; (c) Bevel vibration; (d) Vertical rotary vibration; scale bar represents 20 μm 图 4 激光共聚焦观察在3种振动方式下副溶血性弧菌在不锈钢表面生物被膜形成过程 Fig. 4 VP biofilm development process on the surface of stainless steel in three vibration modes by CLSM |
|
(a)静置培养; (b)水平旋转式振动; (c)翘板式振动; 标尺为20 μm (a) Control; (b) Horizontal rotary vibration; (c) Bevel vibration; scale bar represents 20 μm 图 5 激光共聚焦观察在2种振动方式下副溶血性弧菌在玻璃表面生物被膜形成过程 Fig. 5 VP biofilm development process on the surface of glass in two vibration modes by CLSM |
在玻璃和不锈钢表面, 在静置培养条件下, VP前36 h黏附在玻璃表面不断生长发育, 分泌大量的胞外基质, 生物被膜不断生长逐渐覆盖整个玻片, 被膜结构变得复杂, 48 h时形成成熟的具有三维立体结构的成熟生物被膜, 随着孵育时间的增加, 细菌代谢物质不断积累, 同时营养物质也不断被消耗, 细菌生长受到限制, 被膜发育进入分散期, 部分生物被膜开始分散出去, 被膜结构趋于简单, 被膜量不断减少, 可以看到被膜中出现缝隙。
在振动条件下, 被膜形成量比对照组明显要少, 荧光强度也相对较弱。VP在玻璃和不锈钢表面黏附比较困难, 黏附期VP很难聚集, 可以看到只有少量的生物被膜覆盖在材料表面, 随着孵育时间的增加, 被膜形成量缓慢增加, 荧光强度逐渐增加, 到被膜发育后期, 可以明显看到被膜量减少, 材料表面出现大面积缝隙, 被膜比较分散, 荧光强度变弱。
2.3 不同振动方式对副溶血性弧菌生物被膜三维结构参数的影响如图 6所示, 培育时间相同, 在不同振动模式条件下被膜结构参数与对照组存在明显差异性(P < 0.05)。VP生物被膜形成过程中总生物量变化与结晶紫数据类似。在不锈钢表面, 生物被膜中总生物量变化趋势为先增加后减少。12~48 h总生物量随着孵育时间的增加而增加, 60~72 h被膜总生物量不断减少。在振动条件下被膜总生物量明显小于对照组。在玻璃表面被膜总生物量变化与不锈钢表面相类似。

|
*表示与对照组具有显著性差异(P < 0.05) Statistical significance with control is shown by * (P < 0.05) 图 6 在不同振动方式下副溶血性弧菌生物被膜总生物量、多孔性和均一性的结构参数变化 Fig. 6 Changes of biovolume, porosity and homogeneity of VP biofilm in diifferent vibration modes |
多孔性反映了生物被膜内部结构中孔隙的变化情况。在静置条件下, VP生物被膜在玻璃和不锈钢表面多孔性与被膜生长曲线相反, 呈先下降后上升的趋势。在被膜不断发育过程中, 结构逐渐致密, 空隙不断减少; 在被膜成熟期, 结构最为致密, 多孔性最小; 在被膜分散期, 被膜开始分散出去, 被膜结构开始松散, 多孔性增大。在振动条件下, 被膜多孔性增大, 相对来说翻转式振动导致被膜多孔性最大, 翘板式振动其次, 水平旋转式振动相对较小。
被膜均一性也是衡量被膜结构的重要参数。在静置条件下被膜均一性与多孔性变化情况相一致。在被膜成熟时, 被膜结构复杂, 均一性相对较小。振动导致生物被膜均一性显著地增加, 被膜结构趋于简单。
2.4 不同振动方式对副溶血性弧菌生物被膜EPS的影响如图 7所示, 生物被膜EPS中胞外多糖和胞外蛋白的变化与图 2中被膜生长曲线类似, 被膜发育前期, 胞外多糖和胞外蛋白含量不断增高。在48~60 h胞外多糖和胞外蛋白含量达到最大值。被膜分散期, 胞外多糖和胞外蛋白含量开始减少。

|
图 7 副溶血性弧菌胞外多糖(OD490/OD595)和胞外蛋白(OD750/OD595)相对含量的变化 Fig. 7 Changes of relative content of extracellular polysaccharide (OD490/OD595) and extracellular protein (OD750/OD595) in VP |
不锈钢表面在不同振动方式下胞外多糖和胞外蛋白大小:静置>水平旋转式振动>翘板式振动>垂直翻转式振动。在玻璃表面, 生物被膜胞外多糖和胞外蛋白含量变化与不锈钢表面类似:静置培养>水平旋转式振动>翘板式振动。
3 讨论与结论由于培养基、生存空间的限制, VP生物被膜的形成趋势都是先增加后减少。被膜发育后期, 营养物质不断消耗, 代谢废物不断积累, 细菌生长受到抑制, 被膜量开始不断减少, 生物被膜的形成是一个动态过程[18-19]。
本研究使用食品生产加工等过程中常接触的玻璃和不锈钢, 探究了两种材料表面被膜的形成。在被膜形成过程中, 细菌黏附在玻璃和不锈钢表面主要通过疏水作用等非特异性相互作用[20]。细菌黏附过程分为两步:第一步停靠, 细菌被流体冲刷或者自身鞭毛运动游走到界面表面, 克服细菌表面与材料表面的排斥作用(静电作用)黏附到材料表面。第二步锁定, 细菌分泌胞外多糖和蛋白质等水合性胞外基质将自身固定在物体表面, 形成复杂的三维结构[21-22]。材料不同所带电荷不同, 所以菌株在不同材料表面黏附能力出现差异性, 被膜形成情况出现差异性。赵爱静等[23]研究发现VP带负电荷, 更容易黏附在带正电的玻璃材料表面, 所以在玻璃表面被膜形成能力比不锈钢表面强。本文结果与之相同, 静置培养VP在玻璃表面被膜形成量多。但是在振动条件下, 在不锈钢表面被膜生成量多, 说明振动导致被膜在玻璃和不锈钢表面黏附能力发生改变, 可能增强了VP在不锈钢表面的黏附能力, 所以在不锈钢表面被膜形成能力相对较强。
生物被膜受施加的负荷大小、时间以及施加负荷的速率影响, 细菌在物体表面黏附生长发育并与作用它们的机械力响应, 形成生物被膜的结构[10]。在生物被膜培养过程中, 振动方式不同, 生物被膜形成情况存在差异性, 在同种振动方式下, 转速增加, 生物被膜在材料表面形成能力降低, 被膜生成量相对较少。金黄色葡萄球菌在振荡培养条件下, 被膜量较少, 细菌聚集体的密度较小, 且呈散在分布[24], 结晶紫的结果表明, 振荡培养的副溶血性弧菌也有类似的变化。SCHMIDT等[25]探究了电动牙刷对邻面菌斑生物膜生长的影响, 发现电动牙刷处理的生物被膜与对照组相比:生物被膜密度降低, 被膜总生物量减少, 激光共聚焦显微镜下观察的被膜荧光强度也偏低, 在本研究中振荡培养的生物被膜激光共聚焦显微观察也有类似的结果。FABBRI等[10]研究发现, 生物被膜在受到高速流体流动时, 结构会发生变化。在本研究中振荡会影响生物被膜的均一性等结构特性, 使得被膜结构变得松散。朱秀菊等[26]研究发现高强度聚焦超声可以破坏生物被膜, 增大被膜孔径, 这与本研究中振动会影响被膜的孔径结果一致。生物被膜的不均一性是生物被膜中微生物自我保护的重要手段[27], VP被膜形成过程中不均一性随着时间的增加而增加, 结构越来越复杂。微生物生物膜与游离态的菌体相比, 最显著的特征是存在水合性胞外基质(EPS)[28-29]。EPS在生物被膜中占主要成分, 被膜中细菌的聚集, 结构维持和被膜中细菌的生活方式都依赖于EPS[30]。本研究发现振动导致EPS中胞外多糖和胞外蛋白含量降低, 被膜结构发生变化。
综上, 本文从被膜量、被膜结构和被膜EPS 3个方面初步探究了振动对细菌生物被膜形成的影响。结果发现, 在不同的器械振动条件下, 生物被膜形成情况存在差异, 研究发现垂直翻转式振动可有效地减少与抑制生物被膜的生长。在振动模式下选择玻璃材料, 被膜形成量明显降低, 为食品加工器械的选择提供理论参考。振动会导致细菌生物被膜结构发生变化, 影响被膜的孔径、均一性等结构特性, 并使得胞外多糖和蛋白减少, 被膜结构变得松散。研究生物被膜形成过程中被膜结构与流体动力学之间的相互作用是生物被膜动力学研究中的一大问题[10], 此外目前尚未知细菌通过何种机制感应截切力, 并在生长过程中做出反馈, 对于细菌对剪切力的感应机制, 有待进一步系统、深入探究。
| [1] |
BOONYAWANTANG A, MAHAKARNCHANAKUL W, RACH-TANAPUN C, et al. Behavior of pathogenic Vibrio parahaemolyticus in prawn in response to temperature in laboratory and factory[J]. Food Control, 2012, 26(2): 479-485. DOI:10.1016/j.foodcont.2012.02.009 |
| [2] |
RASZL S M, FROELICH B A, VIEIRA C R W, et al. Vibrio parahaemolyticus and Vibrio vulnificus in South America:water, seafood and human infections[J]. Journal of Applied Microbiology, 2016, 121(5): 1201-1222. DOI:10.1111/jam.13246 |
| [3] |
BROBERG C A, CALDER T J, ORTH K. Vibrio parahaemolyticus cell biology and pathogenicity determinants[J]. Microbes and Infection, 2011, 13(12/13): 992-1001. |
| [4] |
JAMAL M, AHMAD W, ANDLEEB S, et al. Bacterial biofilm and associated infections[J]. Journal of the Chinese Medical Association, 2018, 81(1): 7-11. DOI:10.1016/j.jcma.2017.07.012 |
| [5] |
LIU Y, TAY J H. Detachment forces and their influence on the structure and metabolic behaviour of biofilms[J]. World Journal of Microbiology and Biotechnology, 2001, 17(2): 111-117. |
| [6] |
陈小雪, 陈晶瑜, 韩北忠. 食品加工过程中细菌生物被膜的危害及控制[J]. 中国酿造, 2016, 35(1): 1-4. CHEN X X, CHEN J Y, HAN B Z. Hazard and control of bacterial biofilm during the food processing[J]. China Brewing, 2016, 35(1): 1-4. |
| [7] |
DEGUCHI S, SHIMOSHIGE H, TSUDOME M, et al. Microbial growth at hyperaccelerations up to 403, 627×g[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(19): 7997-8002. DOI:10.1073/pnas.1018027108 |
| [8] |
PETERSON B W, HE Y, REN Y J, et al. Viscoelasticity of biofilms and their recalcitrance to mechanical and chemical challenges[J]. FEMS Microbiology Reviews, 2015, 39(2): 234-245. DOI:10.1093/femsre/fuu008 |
| [9] |
BILLINGS N, BIRJINIUK A, SAMAD T S, et al. Material properties of biofilms-a review of methods for understanding permeability and mechanics[J]. Reports on Progress in Physics, 2015, 78(3): 036601. DOI:10.1088/0034-4885/78/3/036601 |
| [10] |
FABBRI S, LI J, HOWLIN R P, et al. Fluid-driven interfacial instabilities and turbulence in bacterial biofilms[J]. Environmental Microbiology, 2017, 19(11): 4417-4431. DOI:10.1111/1462-2920.13883 |
| [11] |
SONG X Y, MA Y J, FU J J, et al. Effect of temperature on pathogenic and non-pathogenic Vibrio parahaemolyticus biofilm formation[J]. Food Control, 2017, 73: 485-491. DOI:10.1016/j.foodcont.2016.08.041 |
| [12] |
ANTONIANI D, BOCCI P, MACIAG A, et al. Monitoring of diguanylate cyclase activity and of cyclic-di-GMP biosynthesis by whole-cell assays suitable for high-throughput screening of biofilm inhibitors[J]. Applied Microbiology and Biotechnology, 2010, 85(4): 1095-1104. DOI:10.1007/s00253-009-2199-x |
| [13] |
DOREL C, VIDAL O, PRIGENT-COMBARET C, et al. Involvement of the Cpx signal transduction pathway of E. coli in biofilm formation[J]. FEMS Microbiology Letters, 1999, 178(1): 169-175. DOI:10.1111/j.1574-6968.1999.tb13774.x |
| [14] |
JIN H, ZHOU R, KANG M S, et al. Biofilm formation by field isolates and reference strains of Haemophilus parasuis[J]. Veterinary Microbiology, 2006, 118(1/2): 117-123. |
| [15] |
O'TOOLE G A, KOLTER R. Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signalling pathways:a genetic analysis[J]. Molecular Microbiology, 1998, 28(3): 449-461. DOI:10.1046/j.1365-2958.1998.00797.x |
| [16] |
KIM H S, PARK H D. Ginger extract inhibits biofilm formation by Pseudomonas aeruginosa PA14[J]. PLoS One, 2013, 8(9): e76106. DOI:10.1371/journal.pone.0076106 |
| [17] |
NAKAMURA H, TAKAKURA K I, SONE Y, et al. Biofilm formation and resistance to benzalkonium chloride in Listeria monocytogenes isolated from a fish processing plant[J]. Journal of Food Protection, 2013, 76(7): 1179-1186. DOI:10.4315/0362-028X.JFP-12-225 |
| [18] |
刘露露, 徐溢, 王人杰, 等. 生物被膜的形成及其电化学阻抗检测[J]. 生物工程学报, 2018, 34(3): 320-333. LIU L L, XU Y, WANG R J, et al. Detection of biofilms formation by electrochemical impedance spectroscopy[J]. Chinese Journal of Biotechnology, 2018, 34(3): 320-333. |
| [19] |
柴旭锋, 齐家伟, 赵莉, 等. 副溶血弧菌在鱼鳞表面形成生物被膜的动态过程及酸性电解水对其清除效果[J]. 上海海洋大学学报, 2019, 28(5): 792-800. CHAI X F, QI J W, ZHAO L, et al. Eradication effect of acidic electrolyzed water on Vibrio parahemolyticus biofilm formed on fish scale surface[J]. Journal of Shanghai Ocean University, 2019, 28(5): 792-800. |
| [20] |
甘田生, 龚湘君. 生物被膜的物理特性及其表征[J]. 生物工程学报, 2017, 33(9): 1390-1398. GAN T S, GONG X J. Characterization of the physical properties of biofilms[J]. Chinese Journal of Biotechnology, 2017, 33(9): 1390-1398. |
| [21] |
CARPENTIER B, CERF O. Biofilms and their consequences, with particular reference to hygiene in the food industry[J]. Journal of Applied Bacteriology, 1993, 75(6): 499-511. DOI:10.1111/j.1365-2672.1993.tb01587.x |
| [22] |
DUNNE W M JR. Bacterial adhesion:seen any good biofilms lately?[J]. Clinical Microbiology Reviews, 2002, 15(2): 155-166. DOI:10.1128/CMR.15.2.155-166.2002 |
| [23] |
赵爱静, 付娇娇, 宋雪迎, 等. 致病性与非致病性副溶血性弧菌在不同温度和接触材料表面生物被膜形成情况分析[J]. 食品与生物技术学报, 2018, 37(1): 7-14. ZHAO A J, FU J J, SONG X Y, et al. Analysis of biofilm formation by pathogenic and no-pathogenic Vibrio parahaemolyticus at various temperatures and contact surfaces[J]. Journal of Food Science and Biotechnology, 2018, 37(1): 7-14. |
| [24] |
石文琪, 张会彦, 胡泽阳, 等. 金黄色葡萄球菌在静置和振荡培养条件下的生物被膜构造[J]. 中国食品学报, 2018, 18(4): 37-44. SHI W Q, ZHANG H Y, HU Z Y, et al. Biofilm architecture of Staphylococcus aureus during static and shaking cultivation[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(4): 37-44. |
| [25] |
SCHMIDT J C, ASTASOV-FRAUENHOFFER M, WALTIMO T, et al. Efficacy of various side-to-side toothbrushes and impact of brushing parameters on noncontact biofilm removal in an interdental space model[J]. Clinical Oral Investigations, 2017, 21(5): 1565-1577. DOI:10.1007/s00784-016-1969-y |
| [26] |
朱秀菊, 王嫣, 余加林, 等. 高强度聚焦超声对体外铜绿假单胞菌生物被膜的杀菌作用及其空间结构的影响[J]. 中国超声医学杂志, 2011, 27(2): 97-101. ZHU X J, WANG Y, YU J L, et al. Effects of high-intensity focused ultrasound on bactericidal action and structure of Pseudomonas aeruginosa biofilm in vitro[J]. Chinese Journal of Ultrasound in Medicine, 2011, 27(2): 97-101. |
| [27] |
OBERHOLZER C, OBERHOLZER A, CLARE-SALZLER M, et al. Apoptosis in sepsis:a new target for therapeutic exploration[J]. The FASEB Journal, 2001, 15(6): 879-892. DOI:10.1096/fsb2fj00058rev |
| [28] |
SEREBRYANNYY L, PARILLA M, ANNIBALE P, et al. Nuclear actin dynamics regulate nuclear organization and transcription[J]. Biophysical Journal, 2015, 108(2): 536a. |
| [29] |
SATPUTE S K, BANAT I M, DHAKEPHALKAR P K, et al. Biosurfactants, bioemulsifiers and exopolysaccharides from marine microorganisms[J]. Biotechnology Advances, 2010, 28(4): 436-450. DOI:10.1016/j.biotechadv.2010.02.006 |
| [30] |
DWORKIN M, FALKOW S, ROSENBERG E, et al. The prokaryotes:volume 1:symbiotic associations, biotechnology, applied microbiology[M]. 3rd ed. New York: Springer, 2006.
|
2. Laboratory of Quality & Safety Risk Assessment for Aquatic Product on Storage and Preservation, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China;
4. Engineering Research Center of Food Thermal-processing Technology, Shanghai Ocean University, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


