2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306;
3. 农业农村部水产品贮藏保鲜质量安全风险评估实验室, 上海 201306;
4. 上海德诺产品检测有限公司, 上海 200436
副溶血性弧菌(Vibrio parahaemolyticus, Vp)是一种革兰氏阴性噬盐细菌,被认为是亚洲区域引发海产品食物中毒的首要致病菌,食用被该菌感染的食物后,易引发头痛、发热、呕吐、腹泻等症状,严重的甚至造成原发性败血症等食源性疾病[1-2]。副溶血性弧菌主要的致病因子有3种:耐热性溶血毒素(thermostable direct hemolysin, TDH)、耐热性溶血毒素相关的溶血毒素(thermostable direct hemolysin-related hemolysin, TRH)和不耐热溶血毒素(thermolabile hemomysin, TLH)[3]。基于预测微生物学模型的生长和失活模型,可用于控制副溶血性弧菌的患病风险,对于保障水产品质量安全和改善公共卫生状况具有十分重要的意义[4-5]。由于副溶血性弧菌具有较高的致病率和风险性,国内外科研人员已经对其生长或失活趋势展开了一系列的预测模型研究[6-8]。
菌株的失活异质性广泛存在于预测微生物模型之中,在相同杀菌条件的作用下,同种微生物的不同菌株之间,其失活趋势会呈现明显的差异,直接影响微生物风险评估和控制的准确性[9-10]。温度是影响细菌失活的关键因素,在食品工业中常用基于温度构建失活模型,以控制副溶血性弧菌的潜在风险。其中,巴氏消毒是一种利用相对较低温度(60~82 ℃)的除菌方法[11],能够较好地保持水产品原有的理化性质和风味。此外,冷链贮藏也被视为控制弧菌风险的可靠措施,通过保持水产品加工、贮藏、运输、销售的低温环境(10 ℃),以达到保障食品品质、控制致病菌滋生的目的[12]。但目前为止,关于副溶血性弧菌在巴氏消毒温度(65 ℃)及冷链温度(10 ℃)作用下的失活异质性探究,尚属研究空白。
因此,选取了2种不同来源、3个基因型的19株副溶血性弧菌菌株作为研究对象,探究其在65 ℃巴氏消毒温度以及10 ℃冷链温度作用下的热失活与冷失活趋势,通过Weibull模型来拟合获得细菌的失活参数(tR值),来分析副溶血性弧菌的热和冷失活异质性。同时,由于单一模型拟合的缺陷,运用概率分布拟合副溶血性弧菌冷热失活参数,初步构建了失活异质性随机模型,可为提升副溶血性弧菌风险评估的准确性提供理论参考,为副溶血性弧菌的风险控制提供可靠的科学工具。
1 材料与方法 1.1 材料主要试剂包括胰蛋白胨大豆琼脂培养基(TSA)、胰蛋白胨大豆肉汤培养基(TSB)、硫代硫酸盐-柠檬酸盐-胆盐蔗糖琼脂(TCBS琼脂)来自北京陆桥技术有限责任公司,其他试剂均为国产分析纯。
主要仪器包括高精度恒温培养箱(日本Sanyan公司)、离心机(德国Eppendorf公司)、Bio-Tek酶标仪(美国伯腾仪器有限公司)、金属浴等。
1.2 副溶血性弧菌菌株对19株副溶血性弧菌进行热失活和冷失活异质性的研究,其中3株是直接从水产品中分离得到,16株临床分离株由上海市第一人民医院检验科馈赠。具体菌株信息见表 1。表中Vp与致病因子相关的基因如TDH,TRH和TLH用于区分菌株不同的基因型。受试菌株样本的基因型分为tdh+/trh-、tdh-/trh+和tdh+/trh+ 3种。其中:临床菌株中有9株tdh+/trh-型、3株tdh-/trh+型和3株tdh+/trh+型;环境菌株共3株,2株tdh+/trh-型、1株tdh-/trh+型。

|
表 1 19株副溶血性弧菌菌株信息表 Tab.1 Strains information of 19 |
在制备实验菌液前,所有菌株被保存于-80 ℃的25%甘油浓度的试管中。首先将副溶血性弧菌菌株划线到TCBS(北京陆桥科技有限公司,北京)平板上,在37 ℃环境中培养18 h到24 h。然后将TCBS板上的单个绿色菌落接种到含有质量分数3.0% NaCl的9 mL TSB (pH 8.0,北京陆桥科技有限公司)培养基中,放入37 ℃恒温培养箱中培养18 h制备受试菌株样本。培养后,初始菌株含量~109 CFU/mL。
1.4 菌株的失活实验热失活异质性:将1.3节中培养获得的副溶血性弧菌菌液梯度稀释到107 CFU/mL,并将稀释好的菌液分别分装到6个1.5 mL的无菌离心管中,将无菌离心管置于温度为65 ℃的金属浴中,调节振荡频率为250 r/min,处理时间为0、60、90、120、150、180 s。加热完成后,迅速将离心管置于常温水中(25 ℃)冷却2 s,然后进行系列梯度稀释,涂布于TCBS平板上,过夜培养后进行微生物计数。
冷失活异质性:将1.3节中培养获得的副溶血性弧菌菌液梯度稀释到107 CFU/mL,并将稀释好的菌液分别分装到8个1.5 mL的无菌离心管中,将无菌离心管至于10 ℃恒温培养箱中,处理时间为0、(170±10)、(340±10)、(510±10)、(680±10)、(850±10) h。待冷处理完成后,于超净台进行微生物计数。
1.5 微生物计数在热处理和冷处理之后,将菌液用0.85 g/L无菌生理盐水进行梯度稀释,选择合适的稀释度,取100 μL的稀释液在TSA琼脂板上进行涂布,每个处理时间3个平行,将平板置于37 ℃条件下培养24 h计算菌落数。
1.6 修正的Weibull模型拟合副溶血性弧菌冷热失活情况使用修正的Weibull曲线模型来拟合微生物的失活,Weibull模型是常用的拟合凸面、凹面以及线性失活的预测微生物学模型[13-15]。Weibull模型方程式如下:
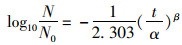 (1)
(1)
式中:α为比例参数;β为形状参数;N0为在失活处理前的初始菌量,CFU/ mL;N为热失活和冷失活后的菌量,CFU/ mL;t为失活处理的时间,s或h。
研究表明,微生物的失活大多以曲线的形状呈现,其中β的大小代表着曲线的形状:当β < 1时,曲线的形状向上凸;当β>1时,曲线向下凹。同时,由α和β可以得出用来表示失活耐受能力的参数tR, tR的计算公式如下:
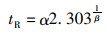 (2)
(2)
式中:tR值代表减菌90%所用的时间[16]。
1.7 菌株异质性随机模型的拟合运用美国Palisade公司的@Risk 5.5软件,采用蒙特卡洛模拟方法进行10 000次模拟,结合@Risk软件独有的分布拟合功能(distribution fitting),对19株副溶血性弧菌的热失活和冷失活条件下对应的失活参数(tR)进行概率分布拟合,以卡方检验(Chi-squared statistic)、安德森达尔令检验(Anderson darling statistic)以及柯尔莫可洛夫-斯米洛夫检验(Kolmogorov-Smirnov statistic)评估最适合描述其冷热失活异质性的概率分布,以构建菌株失活异质性随机模型。数值越小,表明其拟合度越高。
1.8 统计分析法为了比较模型的准确性,利用以下统计指标进行模型拟合准确性的评价,具体包括相关度系数(R2),相关性检验的P,变异系数(Coefficient of Variation,CV)。其数学表达式分别为
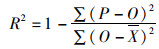 (3)
(3)
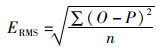 (4)
(4)
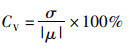 (5)
(5)
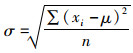 (6)
(6)
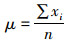 (7)
(7)
式中:O是实际的观察值;P是模型的预测值;X为平均数;n代表观察的次数;R2处于0~1之间且越靠近1说明预测模型的拟合效果越好。当平均算数平方根误差RMSE靠近0时,表明模型中数据拟合度更高;CV表示数据的离散程度,CV越大,表明一组数的离散程度越大,CV越小则说明数据分布越集中;σ代表标准差;μ代表平均数。
另外,Af代表准确性因子,Af值越大,表明该模型预测的平均精确度越低。Bf代表偏差因子。使用P的相关性来验证副溶血性弧菌热失活与冷失活间的关系。通过得到的P与0.05进行比较,当P < 0.05时具有显著的相关性。整个数据统计使用SPSS统计软件包17.0(SPSS Inc.,Chicago,IL)进行统计分析。
2 结果 2.1 副溶血性弧菌热失活Weibull模型拟合结果及失活参数分析由图 1可知,副溶血性弧菌的起始细菌含量为6.11~7.02 log CFU /mL,在65 ℃作用下19株菌株均呈现明显的失活趋势,热处理180 min之后,其细菌含量降为0.85 ~2.98 log CFU/mL。通过Weibull模型对这19株副溶血性弧菌的热失活趋势进行拟合,结果见表 2,模型拟合R2为0.793~0.976,均方根误差(RMSE)趋近于0,Af值与Bf值均为0.9~1.1,表明该模型能够较好地描述这19株副溶血性弧菌在65 ℃作用下的失活趋势。

|
(a)热失活异质性; (b)耐热性最强菌株和耐热性最弱菌株的失活曲线 (a)Heat inactivation variability of 19 Vibrio parahaemolyticus; (b) Heat inactivation curve of the most 图 1 在65 ℃作用下19株副溶血性弧菌热失活Weibull模型拟合 Fig. 1 Fit of Weibull model to 19 Vibrio parahaemolyticus under 65 ℃ heat inactivation |

|
表 2 在65 ℃作用下19株副溶血性弧菌热失活Weibull模型拟合相关参数 Tab.2 The related parameters of fit of Weibull model to 19 Vibrio parahaemolyticus under 65 ℃ inactivation |
由表 2可知,在65 ℃作用下,尽管同为副溶血性弧菌的菌株,但其浓度减少90%所用的时间(tR值)却呈现出很大的差异,介于22.62和67.23 s之间,变异系数(CV)为0.27,呈现出较大的离散性。VPC-1、VPC-12、VP-2、VPC-8、VPC-5、VPC-4、VPC-14的tR值均大于50 s,表现出了较强的菌株耐热性。其中,VPC-1的tR值最高,65 ℃作用下其浓度较少90%所需的时间为67.23 s,在19株细菌中呈现出最强的耐热特性,VPC-12的tR值与VPC-1相近,为67.13 s,为第二耐热的菌株。VPC-10、VPC-7、VPC-3的tR值均小于30 s,表明其对菌株65 ℃处理较为敏感,仅需不到30 s就能使其含量较少90%。其中,VPC-10的tR值最小,仅为22.62 s,在19株细菌中呈现出最不耐热的特性。结果表明,19株副溶血性弧菌呈现出极大的热失活异质性,仅对单一菌株进行模型拟合,很难描述其整体的热失活趋势。
2.2 副溶血弧菌冷失活Weibull模型拟合结果及失活参数分析由图 2可知,副溶血弧菌的起始细菌含量为6.30~6.80 log CFU/mL,在10 ℃的冷激作用下,呈现出缓慢的下降趋势,在800 h之后降为1.70~3.95 log CFU /mL。运用Weibull模型对这19株副溶血弧菌的冷失活趋势进行拟合,其相关度系数R2为0.950 ~ 0.998,均方根误差(RMSE)趋近于0,Af值与Bf值均为0.9~1.1,表明Weibull模型能够较好地描述这19株副溶血弧菌在10 ℃作用下的冷失活趋势。

|
(a)热失活异质性; (b)耐热性最强菌株和耐热性最弱菌株的失活曲线 (a)Heat inactivation variability of 19 Vibrio parahaemolyticus; (b) Heat inactivation curve of the most 图 2 在10 ℃作用下19株副溶血弧菌冷失活Weibull模型拟合 Fig. 2 Fit of Weibull model to 19 Vibrio parahaemolyticus under 10 ℃ cold inactivation |
19株副溶血弧菌在10 ℃贮藏条件下的冷失活参数见表 3,其含量减少90%所用的时间(tR值)为113.95~371.38 h,变异系数(CV)为0.30,呈现出较大的离散性。VPC-3、VPC-7、VP-2菌株浓度下降90%所需的时间均在300 h(约12天)以上,表现出了较强的菌株耐冷特性。其中,VPC-3的tR值最高,其含量下降90%所需的时间长达371.38 h,约15 d。VPC-2的tR值最小,仅需不到5 d含量就能降低90%以上。结果进一步表明,菌株失活异质性广泛存在于副溶血弧菌之中,基于单一菌株构建的模型也无法描述其整体的冷失活趋势。

|
表 3 在10 ℃作用下19株副溶血弧菌冷失活Weibull模型拟合相关参数 Tab.3 Related parameters of fit of Weibull model to 19 Vibrio parahaemolyticus under 10 ℃ inactivation |
进一步运用相关性分析,探究了19株副溶血弧菌耐热性与耐冷性之间的相关性,以及其耐热性、耐冷性分别与基因型的相关性。结果表明,在巴氏消毒温度(65 ℃)及冷链温度(10 ℃)作用下,19株副溶血弧菌的热失活和冷失活的tR值的相关性P为0.56,说明其耐热性和耐冷性之间没有明显相关性。而9株tdh+/trh-型临床菌株,3株tdh-/trh+型临床菌株,3株tdh+/trh+型临床菌株以及3株环境菌株之间tR值的相关性P依次为0.15、0.70、0.10、0.17,这些值均大于0.05,说明19株副溶血弧菌的基因型与其耐冷性、耐热性之间没有相关性。
2.4 副溶血弧菌热失活异质性的分析运用@Risk 5.5软件的分布拟合功能,对19株副溶血弧菌的热失活参数(tR)与冷失活参数(tR)进行概率分布拟合。在65 ℃作用下的热失活趋势:根据卡方检验结果,最适合描述的概率分布模型分别为Normal分布、Weibull分布和ExtValue分布,其评估值分别为0.16、0.58和0.58;根据安德森-达尔令检验结果,最适合描述的概率分布模型分别为Weibull分布、InvGauss分布和Normal分布,其评估值分别为0.17、0.17和0.18;根据柯尔莫可洛夫-斯米洛夫检验结果,最适合描述的概率分布模型分别为Normal分布、Weibull分布和InvGauss分布,其评估值分别为0.08、0.09和0.09。
综合以上结果分析,Normal分布的卡方检验值和柯尔莫可洛夫-斯米洛夫检验值最低,其安德森-达尔令检验与Weibull分布、InvGauss分布相比并无明显差异,因此选用Normal分布对其热失活异质性进行拟合,其分布拟合公式为Normal(44.82, 12.27),如图 3所示,19株副溶血弧菌的热失活参数平均值为44.82 s,标准差为12.27 s,90%置信区间为24.6 s至65.0 s。该模型由多株副溶血弧菌的失活参数拟合构成,可用来代替传统单一菌株所构建的模型,描述副溶血弧菌在65 ℃作用下的热失活异质性。

|
图 3 65 ℃作用下19株副溶血弧菌热失活参数tR值的概率分布 Fig. 3 Probability distribution of tR of 19 Vibrio parahaemolyticus under 65 ℃ heat inactivation |
10 ℃作用下的冷失活趋势:最适合描述的概率分布模型分别为Loglogistic分布、ExtValue分布和Person5分布,其评估值分别为0.58、1.42和1.42;根据安德森-达尔令检验结果,最适合描述的概率分布模型分别为Loglogistic分布、ExtValue分布和Person5分布,其评估值分别为0.23、0.28和0.29;根据柯尔莫可洛夫-斯米洛夫检验结果,最适合描述的概率分布模型分别为Loglogistic分布、ExtValue分布和Person5分布,其评估值分别为0.09、0.10和0.10。
综合以上结果分析,3种检验方法结果均显示Loglogistic分布为最适拟合分布,其分布拟合公式为Loglogistic(51.45, 148.88, 4.67),如图 4所示,19株副溶血弧菌的冷失活参数平均值为212.21 h,标准差为68.98h,90%置信区间为131 h至331 h。该模型由多株副溶血弧菌的失活参数拟合构成,可用来代替传统单一菌株所构建的模型,描述副溶血弧菌在10 ℃作用下的冷失活异质性。

|
图 4 在10 ℃作用下19株副溶血弧菌冷失活参数tR值的概率分布 Fig. 4 The probability distribution of tR of 19 Vibrio parahaemolyticus under 10 ℃ cold inactivation |
目前,菌株的失活异质性主要有3类:酸失活,热失活和非热加工失活[17],这些失活异质性广泛存在于单增李斯特菌(Listeria monocytogenes)、伤寒沙门氏菌DT104(Salmonella enterica serovar Typhimurium DT104)、金黄色葡萄球菌(Staphylococcus aureus)等食源性致病菌中[18-20],影响微生物风险评估过程的“危害特征描述”和“暴露评估”环节,从而降低微生物风险评估的准确性。19株副溶血弧菌在热失活条件下,Weibull模型拟合的热失活tR值为22.62~67.23 s,最不耐热与最耐热菌株之间相差近3倍。冷失活的tR值为113.95~371.38 h,最耐冷和最不耐冷之间相差3.2倍。结果表明,菌株的失活异质性广泛存在于副溶血弧菌之中,仅基于单一菌株进行失活模型的拟合,很难描述其整体的失活趋势。
目前,微生物风险评估过程多以一株或几株菌株为研究对象,失活异质性的存在,加大了工业生产中杀菌的难度,最终对危害特征描述甚至微生物风险评估过程的准确性产生不利影响。因此,本文进一步运用@Risk软件,探究了副溶血弧菌失活参数的最适概率分布模型。在65 ℃作用下,19株副溶血弧菌热失活参数(tR值)的最适概率分布模型分别为Normal分布,其分布拟合公式为Normal(44.82, 12.27),平均值为44.817 5 s,标准差为12.267 5 s,90%置信区间为24.6~65.0 s。在10 ℃作用下,19株副溶血弧菌冷失活参数(tR值)的最适概率分布模型Loglogistic (51.45, 148.88, 4.66),平均值为212.21 h,标准差为68.98 h,90%置信区间为131~331 h。以上两个模型由多株副溶血弧菌的失活参数拟合构成,可用来代替传统单一菌株所构建的模型,能够更好地描述副溶血弧菌热失活异质性。
本实验展示了19株副溶血型弧菌的冷热失活异质性的现象,并结合Weibull失活模型分析了其失活参数的多样性和不确定性,并初步使用概率分布代替传统的失活参数,构建了菌株失活异质性的随机模型。后续课题将针对更大量的菌株进行研究,以获得更全面的菌株失活异质性信息,进一步构建更全面、更准确、更符合副溶血弧菌失活趋势的随机模型。
| [1] |
陈瑞英, 鲁建章, 苏意诚, 等. 食品中副溶血性弧菌的危害分析、检测与预防控制[J]. 食品科学, 2007, 28(1): 341-347. CHEN R Y, LU J Z, SU Y C, et al. Review on risk analysis, detection and control of Vibrio parahaemolyticus in food[J]. Food Science, 2007, 28(1): 341-347. DOI:10.3321/j.issn:1002-6630.2007.01.088 |
| [2] |
MAKINO K, OSHIMA K, KUROKAWA K, et al. Genome sequence of Vibrio parahaemolyticus:a pathogenic mechanism distinct from that of V cholerae[J]. The Lancet, 2003, 361(9359): 743-749. DOI:10.1016/S0140-6736(03)12659-1 |
| [3] |
马冯莉, 张昭寰, 吴佳敏, 等. 胁迫温度下两株高致病性副溶血弧菌的生长差异比较分析[J]. 食品与生物技术学报, 2018, 37(6): 580-588. MA F L, ZHANG Z H, WU J M, et al. Comparison of growth characteristics of two highly pathogenic Vibrio parahaemolyticus at stress temperature[J]. Journal of Food Science and Biotechnology, 2018, 37(6): 580-588. DOI:10.3969/j.issn.1673-1689.2018.06.003 |
| [4] |
张昭寰.南美白对虾中常见食源性致病菌快速检测技术及分子预测微生物模型的构建[D].上海: 上海海洋大学, 2015. ZHANG Z H. Rapid detection techniques and molecular predictive model of common foodborne pathogens in Litopenaeus vannamei[D]. Shanghai: Shanghai Ocean University, 2015. |
| [5] |
张昭寰, 娄阳, 杜苏萍, 等. 分子生物学技术在预测微生物学中的应用与展望[J]. 食品科学, 2017, 38(9): 248-257. ZHANG Z H, LOU Y, DU S P, et al. Application and prospects of molecular biology techniques in predictive microbiology:a review[J]. Food Science, 2017, 38(9): 248-257. |
| [6] |
王璐华, 宁喜斌. 副溶血性弧菌生长预测模型的建立与应用探讨[J]. 华北农学报, 2008, 23(s1): 263-267. WANG L H, NING X B. Predictive model for effect of temperature on the growth of Vibrio Parahaemo lyticus[J]. Acta Agriculturae Boreali-Sinica, 2008, 23(s1): 263-267. DOI:10.7668/hbnxb.2008.S1.061 |
| [7] |
XIE T F, RUI P, WU Q P, et al. Cold tolerance regulated by the pyruvate metabolism in Vibrio parahaemolyticus[J]. Frontiers in Microbiology, 2019, 10: 178. DOI:10.3389/fmicb.2019.00178 |
| [8] |
LOVE D C, LANE R M, DAVIS B J K, et al. Performance of cold chains for Chesapeake Bay farmed oysters and modeled growth of Vibrio parahaemolyticus[J]. Journal of Food Protection, 2019, 82(1): 168-178. DOI:10.4315/0362-028X.JFP-18-044 |
| [9] |
ARYANI D C, DEN BESTEN H M W, HAZELEGER W C, et al. Quantifying variability on thermal resistance of Listeria monocytogenes[J]. International Journal of Food Microbiology, 2015, 193: 130-138. DOI:10.1016/j.ijfoodmicro.2014.10.021 |
| [10] |
ELHADIDY M, ÁLVAREZ-ORDÓÑEZ A. Diversity of survival patterns among Escherichia coli O157:H7 genotypes subjected to food-related stress conditions[J]. Frontiers in Microbiology, 2016, 7: 322. DOI:10.3389/fmicb.2016.00322 |
| [11] |
柴旭锋, 齐家伟, 赵莉, 等. 副溶血弧菌在鱼鳞表面形成生物被膜的动态过程及酸性电解水对其清除效果[J]. 上海海洋大学学报, 2019, 28(5): 792-800. CHAI X F, QI J W, ZHAO L, et al. Eradication effect of acidic electrolyzed water on Vibrio parahemolyticus biofilm formed on fish scale surface[J]. Journal of Shanghai Ocean University, 2019, 28(5): 792-800. |
| [12] |
BADIA-MELIS R, MC CARTHY U, RUIZ-GARCIA L, et al. New trends in cold chain monitoring applications-a review[J]. Food Control, 2018, 86: 170-182. DOI:10.1016/j.foodcont.2017.11.022 |
| [13] |
KIM M J, MIKŠ-KRAJNIK M, KUMAR A, et al. Inactivation by 405±5 nm light emitting diode on Escherichia coli O157:H7, Salmonella Typhimurium, and Shigella sonnei under refrigerated condition might be due to the loss of membrane integrity[J]. Food Control, 2016, 59: 99-107. DOI:10.1016/j.foodcont.2015.05.012 |
| [14] |
KUMAR A, GHATE V, KIM M J, et al. Kinetics of bacterial inactivation by 405 nm and 520 nm light emitting diodes and the role of endogenous coproporphyrin on bacterial susceptibility[J]. Journal of Photochemistry and Photobiology B:Biology, 2015, 149: 37-44. DOI:10.1016/j.jphotobiol.2015.05.005 |
| [15] |
KIM M J, TANG C H, BANG W S, et al. Antibacterial effect of 405±5nm light emitting diode illumination against Escherichia coli O157:H7, Listeria monocytogenes, and Salmonella on the surface of fresh-cut mango and its influence on fruit quality[J]. International Journal of Food Microbiology, 2017, 244: 82-89. DOI:10.1016/j.ijfoodmicro.2016.12.023 |
| [16] |
BIALKA K L, DEMIRCI A, PURI V M. Modeling the inactivation of Escherichia coli O157:H7 and Salmonella enterica on raspberries and strawberries resulting from exposure to ozone or pulsed UV-light[J]. Journal of Food Engineering, 2008, 85(3): 444-449. DOI:10.1016/j.jfoodeng.2007.08.007 |
| [17] |
KOUTSOUMANIS K P, ASPRIDOU Z. Individual cell heterogeneity in Predictive Food Microbiology:challenges in predicting a "noisy" world[J]. International Journal of Food Microbiology, 2016, 240: 3-10. |
| [18] |
DYKES G A, MOORHEAD S M. Survival of osmotic and acid stress by Listeria monocytogenes strains of clinical or meat origin[J]. International Journal of Food Microbiology, 2000, 56(2/3): 161-166. |
| [19] |
BERK P A, DE JONGE R, ZWIETERING M H, et al. Acid resistance variability among isolates of Salmonella enterica serovar Typhimurium DT104[J]. Journal of Applied Microbiology, 2005, 99(4): 859-866. DOI:10.1111/j.1365-2672.2005.02658.x |
| [20] |
ZHANG L H, KOU X X, ZHANG S, et al. Effect of water activity and heating rate on Staphylococcus aureus heat resistance in walnut shells[J]. International Journal of Food Microbiology, 2018, 266: 282-288. DOI:10.1016/j.ijfoodmicro.2017.12.019 |
2. Shanghai Engineering Research Center of Aquatic Product Processing & Preservation, Shanghai 201306, China;
3. Laboratory of Quality and Safety Risk Assessment for Aquatic Product on Storage and Preservation, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
4. Shanghai Denuo Product Testing Service Co., Ltd, Shanghai 200436, China
 2020,
Vol. 29
2020,
Vol. 29


