2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306;
3. 国家淡水水产品加工技术研发分中心, 上海 201306;
4. 上海海洋大学 农业农村部种质资源与利用重点开放实验室, 上海 201306
纤维素是世界上最丰富的可再生资源,纤维素酶(Cellulase)可以催化纤维素链β-1, 4-糖苷键水解,将纤维素转化葡萄糖、纤维二糖、纤维低聚糖[1],传统上将其分为3类[2]:内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶,分别水解底物羧甲基纤维素钠、微晶纤维素和水杨素。纤维素酶可被广泛应用于食品、饲料、纺织、发酵等领域[3-5]。纤维素酶的来源十分广泛,昆虫、动物体、细菌、真菌等都能产生纤维素酶,且纤维素酶多来源于微生物,尤其是细菌与真菌[6]。
近年来研究较多的是从食草性陆生动物与昆虫消化道或者土壤、木屑中筛选纤维素酶产生菌[4]并多为细菌。例如从土壤中筛选出纤维素酶产生菌Bacillus mycoides S122C [7],分离出分子量为62 ku的纤维素酶,最适温度及pH分别为50 ℃和7。从米糠中筛选出纤维素酶产生菌Bacillus amyoliquefaciens DL-3[8],生产纤维素酶的分子量为43 ku。研究草食性水生动物肠道来着手研究的很少,随着水产品加工业的不断发展,面临的最大问题是饲料的利用率不高[9],大多数水产品饲料中含有丰富的蛋白酶、纤维素酶、淀粉酶等来补充动物的消化酶,促进营养吸收,消除抗营养因子改善饲料的品质[10-11],所以这类天然酶的研究对水产品加工业来说有着至关重要的作用。
目前从水生动物肠道内筛选出的纤维素酶产生菌多为细菌,本研究从团头鲂肠道内筛选出的真菌雪白曲霉Aspergillus niveus MA35为出发菌株,发酵生产纤维素酶分离得到了一种纤维素酶,并初步探索了部分酶学性质,对更好地为草食性鱼类饲料的配比提供了一定的技术支持,并且为真菌纤维素酶工程菌种的构建提供了优良的基因源[12]。本文底物选取的是羧甲基纤维素钠,故分离得到的纤维素酶属于内切型纤维素酶。
1 材料与方法 1.1 试验材料团头鲂肠道菌株Aspergillus niveuMA35由上海海洋大学食品学院提供。
1.2 试剂与仪器主要试剂:Sephadex G-100葡聚糖凝胶填料购于GE公司;Q-Sepharose Fast Flow离子交换填料购自上海高信化玻仪器有限公司;羧甲基纤维素钠(CMC-Na)、三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(SDS)、30%丙烯酰胺溶液、聚丙烯酰胺凝胶电泳(SDS-PAGE)标准蛋白、过硫酸铵等购于上海生工生物工程有限公司;酒石酸钾钠、3,5-二硝基水杨酸、氯化锰、氯化钠、氢氧化钠、氯化钾、氯化铜、氯化钴、氯化亚铁等购于国药集团化学试剂有限公司,分析纯。
主要仪器:HDB-7L电脑高灵敏度紫外检测仪、CBS-A程控全自动部分收集器(上海沪西分析仪器厂有限公司);Sorvall Lynx 4000高速冷冻离心机(赛默飞世尔科技);DYY-Ⅲ型稳压稳流电泳仪、DYCZ-24D型垂直板电泳槽(北京市六一仪器厂);TS-2000A型脱色摇床(海门市其林贝尔仪器制造有限公司);Bio-6000扫描仪(上海中晶科技有限公司);超声波处理器FS-1200N(上海生析超声仪器有限公司)。
1.3 培养基羧甲基纤维素培养基(g/L):CMC-Na 10;KH2PO4 4;Na2HPO4 4;MgSO4·7H2O 0.2;CaCl2 0.001;FeSO4·7H2O 0.001;蛋白胨2;琼脂粉15。
种子培养液(g/L):葡萄糖2:KH2PO4 4;Na2HPO4 4;MgSO4·7H2O 0.2;CaCl2 0.001;FeSO4·7H2O 0.004;蛋白胨2(pH 7.0)。
发酵培养液(g/L):CMC-Na 10;KH2PO4 4;Na2HPO4 4;MgSO4·7H2O 0.2;CaCl2 0.001;FeSO4·7H2O 0.004;蛋白胨2(pH 7.0)。
1.4 纤维素酶的制备与纯化 1.4.1 纤维素酶的制备挑取菌体接入装液量为200 mL种子培养基的1 L三角瓶中,在28 ℃、150 r/min的条件下培养36 h。再将种子液以3%接种量接入装液量为200 mL发酵培养液的1 L三角瓶中,在32 ℃、160 r/min的条件下培养60 h得到发酵液。真空抽滤将发酵液与菌体分离,得菌体加入20 mmol/L Na2HPO4-NaH2PO4缓冲液(pH 7.0)15 mL重悬,超声波细胞破碎(600 W)45 min(3 s/6 s)后,12 000 r/min、4 ℃离心15 min离心得上清液,经0.22 μm水系膜过滤后所得溶液即为粗酶液。
1.4.2 纤维素酶的纯化Q-Sepharose Fast Flow离子交换层析:将所得粗酶液上样于已用20 mmol/L Na2HPO4-NaH2PO4缓冲液(pH 7.0)平衡好的离子交换层析柱(1.5 cm×20 cm)中,待样品刚好进入凝胶,用上述缓冲液洗脱未结合的蛋白,被吸附的蛋白用含0~1 mol/L NaCl该缓冲液进行线性梯度洗脱,洗脱流速为1.5 mL/min,全自动部分收集器收集,每管收集5.0 mL。测定各管的酶活力和蛋白浓度,收集活性峰,进行冷冻干燥浓缩并保存。
Sephadex G-100葡聚糖凝胶层析:将Q-Sepharose Fast Flow离子交换柱活性峰处收集的样品,用适量20 mmol/L Na2HPO4-NaH2PO4缓冲液(pH 7.0)溶解,经0.22 μm水系膜过滤后上样于已用该缓冲液平衡过的Sephadex G-100葡聚糖凝胶柱(1.0 cm×40 cm)中,待样品刚好进入凝胶时用该缓冲液洗脱,洗脱流速为0.5 mL/min,全自动部分收集器收集,每管收集5.0 mL,测定各管的酶活力和蛋白浓度,收集活性峰,用于鉴定纯化后纤维素酶的纯度、分子量及部分酶学性质。
1.4.3 纤维素酶活力检测方法酶活力方法主要参照何力等[13],并作部分调整。将酶液与含1% CMC-Na的20 mmol/L柠檬酸缓冲液(pH 4.8)置于50 ℃水浴锅中预热5 min,各取0.5 mL将二者混合,50 ℃条件下反应30 min,立即置于100 ℃沸水浴锅中灭活5 min,终止反应。加入DNS溶液煮沸5 min显色,立即冷却,定容至25 mL,于波长540 nm处测定其吸收值。上述反应以煮沸灭活的酶液作为对照,每组3个平行重复实验。一个酶活力单位(U)定义为每分钟释放1 μg葡萄糖所需要的酶量。
1.4.4 蛋白质浓度测定方法采用Folin-酚法[14]测定粗酶液和酶活峰中的蛋白含量。取1 mL稀释一定倍数的酶液,加入5 mL Folin-酚A试剂混匀,置于室温下10 min,再加入Folin-酚B试剂立即混匀,置于室温下30 min,于波长650 nm处测定其吸光值。上述反应以去离子水作为对照,每组3个平行重复实验。
用紫外分光光度计于波长280 nm处检测柱层析过程中的蛋白质浓度。
1.4.5 蛋白纯度及分子量测定使用5%浓缩胶与12%分离胶对纯化后的内切纤维素酶进行SDS-PAGE电泳,分离胶配方5 mL[1.9 mL去离子水、1.7 mL 30%丙烯酰胺、0.05 mL 10%(w/v)SDS、1.3 mL 1.5 mol/L Tris-HCl(pH 8.8)、0.05 mL 10%(w/v)过硫酸铵、0.002 mL TEMED],浓缩胶配方3 mL[2.1 mL去离子水、0.5 mL 30%丙烯酰胺、0.03 mL 10%(w/v)SDS、0.38 mL 1.0 mol/L Tris-HCl(pH 6.8)、0.03 mL 10%(w/v)过硫酸铵、0.003 mL TEMED]。硝酸银染色法分析纤维素酶蛋白的纯化效果,用标准蛋白质(98~14.4 ku)作对照。
1.4.6 纤维素酶酶学性质研究酶的最适反应温度:将酶液分别置于温度为30~80 ℃的水浴中反应30 min,不改变其他条件,绘制酶活力对温度的曲线,研究酶的最适反应温度。
酶的热稳定性:将酶液置于温度为30~80 ℃水浴中孵育2 h,间隔30 min取出部分酶液,按照1.4.3节中酶活力测定方法测定其活力大小。绘制相对酶活力对温度的曲线,研究纤维素酶的温度稳定性。以未经过热处理的纤维素酶活力计为100%。
酶的最适反应pH:用pH分别为3.0~10.0的缓冲液配制浓度为1%的CMC-Na底物溶液,所用缓冲液为20 mmol/L Na2HPO4-柠檬酸(pH 3.0~8.0)、20 mmol/L Tris-HCl(pH 9.0)、20 mmol/L Na2CO3-NaHCO3(pH 10.0),不改变其他条件测定酶活力大小,绘制酶活力对pH的曲线,确定酶的最适反应pH。
酶在不同pH下的稳定性:将酶液与等量的各pH(3.0~10.0)缓冲液混合,置于4 ℃下孵育20 h后,测定酶活力,绘制相对酶活对pH的曲线,研究纤维素酶对pH的稳定性。以未经过酸碱处理的纤维素酶活力计为100%。金属离子对酶活力的影响:将不同金属离子的溶液与酶液混合,离子终浓度分别为1 mmol/L和10 mmol/L。然后测定其相应的酶活力,研究各金属离子对该纤维素酶活力的影响。以不加金属离子的纤维素酶活力计为100%。
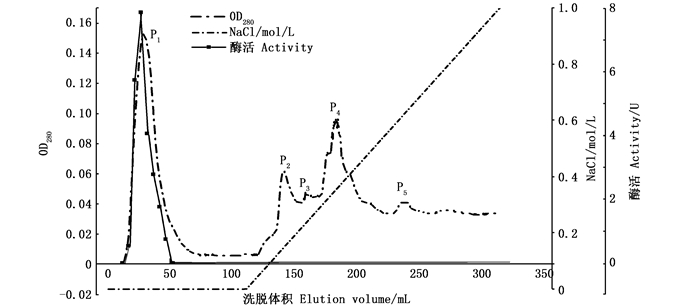
2 实验结果 2.1 纤维素酶的层析柱纯化结果 2.1.1 Q-Sepharose Fast Flow离子交换的纯化结果将粗酶液上样于Q-Sepharose Fast Flow离子交换层析柱中,根据酶所带电荷不同,共洗脱出5个蛋白峰(图 1),其中P1为未结合峰,显示具有较高的活性,用含有0~1 mmol/L NaCl缓冲液洗脱,由P2~P5显示蛋白没有很好地分开,对其酶活力大小检测发现并未有酶活,可舍去故收集P1峰处的酶液,进行冷冻干燥浓缩并保存,用于下一步的纯化。
|
图 1 Q-Sepharose Fast Flow离子交换层析洗脱图谱 Fig. 1 Q-Sepharose Fast Flow column chromatography of cellulase |
将2.1.1节收集到的经冷冻干燥浓缩后的样品用适量缓冲液溶解过膜后,上样于葡聚糖凝胶层析柱中,根据分子量的大小,共洗脱出4个蛋白峰,其中P1和P4蛋白含量较大,但酶活很低或未检测到酶活,P2则是蛋白含量低且并未显示有活性,故可认为这3个峰均为杂蛋白峰,P3中蛋白含量虽没有很高却显示具有较高的活性,综上收集P3峰处的酶液,进一步鉴定其分子量以及纯度。见图 2。

|
图 2 Sephadex G-100凝胶层析洗脱图谱 Fig. 2 Sephadex G-100 chromatography of cellulase |
纯化的纤维素酶液由于蛋白含量较低,故经聚丙烯酰胺凝胶电泳后,选择银染作为染色方式,根据聚丙烯酰胺凝胶电泳结果,可知在经过离子交换层析后已除去大部分杂蛋白,泳道3即经过葡聚糖凝胶层析后呈现单一条带,表明该酶已得到高度纯化(图 3),并且根据标准蛋白质的相对分子质量的对数lgMw与其迁移率Rf的线性关系,可得该内切纤维素酶分子质量约为45 ku。

|
0.标准蛋白;1.粗酶液;2. Q-Sepharose Fast Flow离子交换层析后酶液;3.葡聚糖G-100凝胶层析后酶液 0. Protein marker; 1. Crude; 2. Q-Sepharose Fast Flow column chromatography of Cellulase; 3. Sephadex G-100 chromatography of Cellulase 图 3 纤维素酶酶纯化过程电泳图 Fig. 3 SDS-PAGE of cellulose |
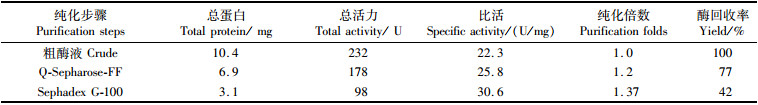
本文对团头鲂肠道菌株Aspergillus niveus MA35产纤维素酶进行了两步纯化,Q-Sepharose Fast Flow离子交换层析和Sephadex G-100葡聚糖凝胶层析,得到了一种高纯度胞内内切型纤维素酶,从表 1可看出,最终纤维素酶的纯化倍数为1.37,其比活力为30.6 U/mg,回收率为42%。
|
表 1 Aspergillus niveus MA35产纤维素酶的纯化结果 Tab.1 Purification of Cellulase from Aspergillus niveus MA35 |
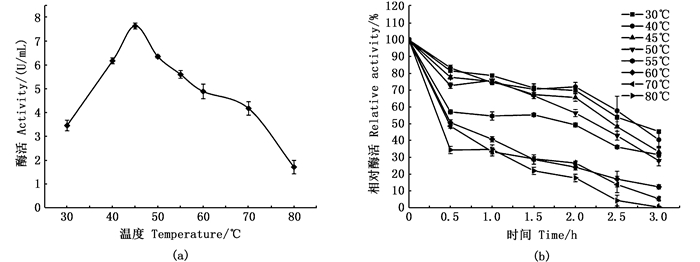
在酶促反应最适pH缓冲体系中,改变反应温度,测定纤维素酶活力,结果见图 4a,在30~45 ℃之间,随着温度的升高,酶活力呈上升趋势,在45~80 ℃之间,酶活力随着温度的升高在逐渐下降,故该酶催化底物CMC-Na最适反应温度为45 ℃。
|
图 4 纤维素酶的最适反应温度(a)及温度稳定性(b) Fig. 4 The optimum temperature(a)and thermal stability(b)of cellulase |
取一定量的酶液在不同温度下孵育3 h,每间隔30 min取出部分酶液测定剩余酶活力,结果如图 4 b所示,不同温度下酶孵育1.5 h后,在30~50 ℃之间,剩余酶活在60%以上,且各温度下剩余酶活相差不大,故在1.5 h内该酶在30~50 ℃之间具有良好的稳定性,在55~80 ℃之间,将酶孵育30 min后,剩余酶活在60%以下,当温度为80 ℃时,剩余酶活不足40%,且随着时间的增长酶活大小迅速下降甚至丧失酶活,故该酶在高温下酶活极不稳定,在不同温度下孵育3 h后,30~55 ℃之间,酶活保留30%以上,30 ℃时酶活仍保留50%,由以上可见,该酶在30~55 ℃之间具有良好的稳定性。
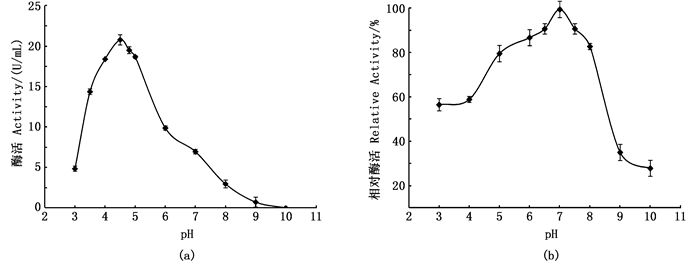
2.2.4 纤维素酶最适反应pH及其pH稳定性由如图 5 a可知,在pH 3.0至pH 4.5之间,随着pH的增长,酶活力也呈上升趋势,在pH 4.5至pH 10.0之间,随着pH的下降,酶活力大小逐渐减小直至丧失酶活,由此可见,该内切纤维素酶最适反应的pH为4.5。
|
图 5 纤维素酶的最适反应pH(a)及pH稳定性(b) Fig. 5 The optimum pH(a)and pH stability(b)of cellulase |
将一定量的酶液分别加入等体积不同pH的缓冲液中置于4℃冰箱中孵育,测定剩余纤维素酶活力,检测该酶pH的稳定性。由图 5b可知,在pH 5.0至pH 8.0之间,剩余酶活力在80%以上,具有良好的稳定性,当pH>8.0时,剩余酶活力骤降至30%,故当pH>8时该酶活力极不稳定易丧失酶活。在pH 3.0至pH 5.0之间酶活仍保留55%以上,该酶具有良好的耐酸性。
2.2.5 金属离子对酶活力的影响用含有不同离子浓度的CMC-Na底物,各离子终浓度分别为1 mmol/L和10 mmol/L,在最适条件下测定酶活力大小,由表 2可看出Zn2+、Mn2+对酶的活性有激活作用,Mg2+、Cu2+、Fe2+、Cd2+、Co2+对酶的活性有抑制作用,其中Mg2+、Cu2+、Fe2+抑制作用较强,Na+、K+、Ca2+对酶的活性几乎没有影响。
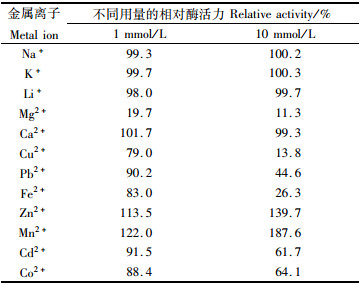
|
表 2 不同金属离子对纤维素酶活力的影响 Tab.2 The effect of metal ions on activity of cellulase |
本研究在实验室前期研究的基础上,进一步将雪白曲霉Aspergillus niveus MA35发酵生产的纤维素酶采用离子交换层析和葡聚糖凝胶层析分离纯化得到了一种内切纤维素酶,酶的比活力由22.3 U/mg提高到30.6 U/mg,SDS-PAGE显示该酶的分子量约为45 ku。近年来纤维素酶的研究引起了研究者们的关注,WON等[15]通过Sephadex G-25葡聚糖凝胶层析、DEAE-Sepharose离子交换层析、DEAE-cellulose离子交换层析和Sephadex G-100葡聚糖凝胶层析4步从Penicillium camemberti产生的纤维素酶液中分离得到纤维素酶的3种组分,分子量分别为99 ku、87 ku和61 ku;ISLAM等[16]采用DEAE-cellulose和CM-cellulose两步离子交换层析从细菌发酵液中分离得到内切纤维素酶,其分子量为67 ku;ANNAMALAI等[17]从Bacillus licheniformis AU01分离得到一种纤维素酶,其分子量为37 ku。由此可知,纤维素酶分子量的大小会因为来源的不同而表现出差异性。
该纤维素酶部分性质研究发现,该酶最适反应温度和pH分别为45 ℃和4.5,在pH 4.0~8.0以及30~55 ℃之间具有良好的稳定性。研究表明,真菌酶通常在微酸性pH和中等温度下显示出最高的催化活性,而细菌酶在较宽的pH和温度条件范围内显示活性[18]。该真菌所产纤维素酶特性符合目前的研究结果。
各金属离子对纤维素酶活力的影响研究发现,Zn2+、Mn2+浓度在1 mmol/L和10 mmol/L时对酶有激活作用;Mg2+、Cu2+、Fe2+、Cd2+、Co2+对酶有抑制作用,其中Mg2+、Cu2+、Fe2+抑制作用较强,Na+、K+、Ca2+对酶几乎没有影响。根据国内外研究表明,各金属离子对来源不同的纤维素酶的影响存在部分差异,Mg2+对ANNAMALAI等[17]从牡蛎中分离得到的纤维素酶有激活作用,Ca2+对其表现出抑制作用,与本研究一致的是K+和Na+对纤维素酶是没有明显影响的,但是不能因此判定这两种离子对纤维素酶没有影响,有研究[8]表明K+和Na+对Bacillus mycoides S122C所生产纤维素酶有轻微的抑制作用,因此实现纤维素酶应用的最大化,金属离子影响研究是有必要的。本研究中还可以逐步增加Na+、K+、Ca2+金属离子浓度,研究这3种离子对纤维素酶活力是否有影响。
目前在工业化生产中,纤维素酶产生菌多为木霉和曲霉,但是在实验水平中筛选出的纤维素酶产生菌大多为细菌,本文从曲霉出发分离得到该纤维素酶,并且通过对该内切纤维素酶性质的研究,为真菌纤维素酶工程菌种的构建提供了优良的基因源,对更好地开发纤维素资源提供了一定的技术支持。
| [1] |
王魁云, 蒋霞云, 江小妹, 等. 团头鲂和草鱼肠道纤维素酶产生菌的筛选和鉴定[J]. 上海海洋大学学报, 2018, 27(4): 624-632. WANG K Y, JIANG X Y, JIANG X M, et al. Screening and identification of cellulase-producing strains from intestines of Megalobrama amblycephala and Ctenopharyngodon idellus[J]. Journal of Shanghai Ocean University, 2018, 27(4): 624-632. |
| [2] |
HAN S J, YOO Y J, KANG H S. Characterization of a bifunctional cellulase and its structural gene. The cel gene of Bacillus sp. D04 has exo-and endoglucanase activity[J]. The Journal of Biological Chemistry, 1995, 270(43): 26012-26019. |
| [3] |
SINGHANIA R R, SUKUMARAN R K, PATEL A K, et al. Advancement and comparative profiles in the production technologies using solid-state and submerged fermentation for microbial cellulases[J]. Enzyme and Microbial Technology, 2010, 46(7): 541-549. |
| [4] |
LIN H L, LI W G, GUO C H, et al. Advances in the study of directed evolution for cellulases[J]. Frontiers of Environmental Science & Engineering in China, 2011, 5(4): 519-525. |
| [5] |
MAKI M, LEUNG K T, QIN W S. The prospects of cellulase-producing bacteria for the bioconversion of lignocellulosic biomass[J]. International Journal of Biological Sciences, 2009, 5(5): 500-516. |
| [6] |
张传富, 顾文杰, 彭科峰, 等. 微生物纤维素酶的研究现状[J]. 生物信息学, 2007, 5(1): 34-36. ZHANG C F, GU W J, PENG K F, et al. Present situation of research on microbial cellulase[J]. China Journal of Bioinformatics, 2007, 5(1): 34-36. |
| [7] |
BALASUBRAMANIAN N, TOUBARRO D, TEIXEIRA M, et al. Purification and biochemical characterization of a novel thermo-stable carboxymethyl cellulase from azorean isolate Bacillus mycoides S122C[J]. Applied Biochemistry and Biotechnology, 2012, 168(8): 2191-2204. |
| [8] |
LEE Y J, KIM B K, LEE B H, et al. Purification and cha-racterization of cellulase produced by Bacillus amyoliquefaciens DL-3 utilizing rice hull[J]. Bioresource Technology, 2008, 99(2): 378-386. |
| [9] |
解绶启, 张文兵, 韩冬, 等. 水产养殖动物营养与饲料工程发展战略研究[J]. 中国工程科学, 2016, 18(3): 29-36. XIE S Q, ZHANG W B, HAN D, et al. Study on the developmental strategies for the engineering of aqua nutrition and feed[J]. Engineering Science, 2016, 18(3): 29-36. |
| [10] |
刘大森, 鞠涛, 杨方, 等. 纤维素酶在反刍动物饲料中的应用研究进展[J]. 东北农业大学学报, 2011, 42(6): 7-11. LIU D S, JU T, YANG F, et al. Applied research progress of cellulase in ruminant animal feed[J]. Journal of Northeast Agricultural University, 2011, 42(6): 7-11. |
| [11] |
孙乐常, 巫朝华, 蔡秋凤, 等. 九孔鲍鱼纤维素酶的分离纯化与性质分析[J]. 中国食品学报, 2010, 10(3): 76-82. SUN L C, WU C H, CAI Q F, et al. Isolation, purification and characterization analysis of a cellulase from abalone (Haliotis diversicolor)[J]. Journal of Chinese Institute of Food Science and Technology, 2010, 10(3): 76-82. |
| [12] |
王刚, 丛子添, 郭明珠, 等. 绿色木霉Fn10-1纤维素酶的分离纯化及酶学特性测定[J]. 湖北农业科学, 2014, 53(16): 3874-3876, 3881. WANG G, CONG Z T, GUO M Z, et al. Isolation, purification and characteristics of Trichoderma viride Fn10-1[J]. Hubei Agricultural Sciences, 2014, 53(16): 3874-3876, 3881. |
| [13] |
何力.草鱼纤维素分解菌筛选、酶提纯及其相关活性研究[D].武汉: 华中农业大学, 2008. HE L. Study on cellulose-decomposing strains from Herbivorous Fish and purification of the cellulase and related activity[D]. Wuhan: Huazhong Agricultural University, 2008. |
| [14] |
LOWRY O H, ROSEBROUGH N J, FARR A L, et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry, 1951, 193(1): 265-275. |
| [15] |
WON J C, ZENGH M M, MEK S K. Purification of the cellulase complex produced by Penicillium camemberti and its partial characterization[J]. Folia Microbiologica, 1992, 37(3): 199-204. |
| [16] |
ISLAM F, ROY N. Screening, purification and characterization of cellulase from cellulase producing bacteria in molasses[J]. BMC Research Notes, 2018, 11: 445. |
| [17] |
ANNAMALAI N, RAJESWARI M V, ELAYARAJA S, et al. Purification and characterization of thermostable alkaline cellulase from marine bacterium Bacillus licheniformis AU01 by utilizing cellulosic wastes[J]. Waste and Biomass Valorization, 2012, 3(3): 305-310. |
| [18] |
SUKUMARAN R K, SINGHANIA R R, PANDEY A. Microbial cellulases-production, applications and challenges[J]. Journal of Scientific & Industrial Research, 2005, 64(11): 832-844. |
2. Engineering Research Center for Processing and Storage of Shanghai Seawater Products, Shanghai 201306, China;
3. National Freshwater Aquatic Products Processing Technology R&D Center, Shanghai 201306, China;
4. Key Laboratory of Aquatic Genetic Resources and Utilization, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


