肿瘤坏死因子(tumor necrosis factor,Tnf)是40年前CARSWELL等[1]在接种卡介苗(BCG)的小鼠注射LPS的血清中分离的一种能够杀伤肿瘤细胞或使体内肿瘤组织出现坏死的细胞因子,多年的研究表明,Tnf在机体的防御反应、炎症反应、促进细胞增殖分化以及杀伤或抑制肿瘤细胞中发挥重要作用[1-3]。Tnf通过激活细胞膜上的特异性受体发挥生物学功能。目前Tnf受体超家族(Tnf receptor superfamily,Tnfrsf)在高等脊椎动物中得到了广泛研究,研究[4]表明人类含有29个Tnfrsf成员,tnfα的信号传导由Tnfr1(Tnfrsf1a)或Tnfr2(Tnfrsf1b)两个受体完成。Tnfrsf1a几乎在所有细胞中表达,而tnfrsf1b仅限于在一些免疫细胞中表达。Tnfrsf1a胞内含有一个典型的死亡结构域(death domain),被Tnfα激活后能够招募下游信号因子,调控NF-КB和JNK/SAPK途径促进细胞增殖[5-6]。另一方面,Tnfrsf1a能够激活Tnf受体相关死亡结构域(Tnf receptor-associated death domain,TRADD)和Fas相关死亡结构域(Fas-associated death domain,FADD)介导的死亡诱导信号,激活caspase 3、6和7,诱导细胞凋亡[7-9]。与Tnfrsf1a相比,Tnfrsf1b只在部分信号通路中发挥作用。
目前tnfα基因在多种鱼类中得到了克隆和鉴定[10-16]。研究[17]表明,鱼类的tnfα基因结构与哺乳动物同源基因基本一致,蛋白结构也具有Tnf家族的典型特征[18];而且,鱼类Tnfα与哺乳动物的Tnfα在生物学功能上存在许多相似之处[10]。功能实验表明Tnfα重组蛋白可以诱导鱼类细胞凋亡[9, 17],增强白细胞的迁移与吞噬活性[11, 19],诱导促炎症因子的表达,促进胸腺细胞的增殖和一氧化氮(NO)的生成和细胞增殖[11-12, 20]。Tnfα在细菌和病毒感染后呈现差异表达[10, 21-23],表明其在免疫防御中发挥重要作用。如将斑马鱼的tnf基因敲除后,其对分枝杆菌的易感性增加[24];病毒性出血败血症病毒(viral haemorrhagic septicemia virus,VHSV)和传染性造血器官坏死病毒(infectious haematopoietic necrosis virus,IHNV)能够诱导tnfα表达[25]。本研究通过腹腔注射免疫刺激物和病原,比较分析LPS、胞内菌迟缓爱德华氏菌(Edwardsiella tarda)、胞外菌嗜水气单胞菌(Aeromonas hydrophila)、poly(I:C)和鲤春病毒血症病毒(spring viraemia of carp virus,SVCV)对斑马鱼tnfα和tnfrsf1a在免疫器官(肾脏和脾脏)中的动态表达,为进一步研究宿主应答细菌和病毒感染的免疫反应机理奠定基础。
1 材料与方法 1.1 材料 1.1.1 实验动物AB品系野生型斑马鱼购自中国科学研究院水生生物研究所斑马鱼资源中心,在本实验室斑马鱼养殖系统28 ℃饲养1个月。所有动物实验严格遵守国家和上海市有关实验动物工作管理法规并通过上海海洋大学动物实验伦理委员会审核批准。
1.1.2 菌株和毒株大肠杆菌DH5α感受态细胞购买自北京全式金生物技术有限公司,SVCV由中国科学研究院水生生物研究所昌鸣先老师赠送[26],迟缓爱德华式菌由中国科学研究院水生生物研究所谢海侠老师赠送[27],嗜水气单胞菌由中国科学研究院水生生物研究所李爱华老师赠送[28]。
1.1.3 主要试剂ExTaq Mix、PMD19-T和DNA marker购自TaKaRa公司;琼脂糖凝胶和DNA回收试剂盒购自Omega公司;异丙醇、氯仿和乙醇购自国药集团化学试剂有限公司;Trizol购自Invitrogen;逆转录试剂盒[HifairⓇⅡ1st Strand cDNA Synthesis Kit (gDNA digester plus)]和qPCR试剂盒(UNICONⓇ qPCR SYBR Green Master MixqPCR)购自上海翊圣生物科技有限公司;脂多糖(lipopolysaccharide,LPS)、聚肌苷酸-聚胞苷酸[polyinosinic acid-polycytidylic acid,poly(I:C)]、磷酸缓冲盐溶液(phosphate buffer saline,PBS)和间氨基苯甲酸乙酯甲磺酸盐(3-Aminobenzoic acid ethyl ester methanesulfonate,MS-222)购自Sigma公司。
1.2 方法 1.2.1 斑马鱼攻毒实验斑马鱼(体长约3 cm,体质量约0.25 g)在28 ℃养殖系统中饲养1个月,实验前1天停止喂食。斑马鱼在0.05%MS-222的水中进行麻醉后,每尾鱼注射10 μL刺激物或病原,分别在不同的时间点解剖取脾脏和肾脏组织,并将组织置于1 mL Trizol中,用组织破碎仪(QIANGEN)破碎,放置于-80 ℃冰箱保存备用。
1.2.2 引物设计与合成根据美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库公布的斑马鱼tnfα(NCBI登录号:NM_212859.2)和tnfrsf1a基因(NCBI登录号:NM_213190.1)顺序,在编码区设计跨内含子的引物用于检测基因表达,进行荧光定量PCR(qPCR)分析(表 1)。引物合成和基因测序由上海生工生物工程有限公司完成。
1.2.3 斑马鱼tnfα和tnfrsf1a基因的组织表达分析取30尾健康斑马鱼,随机分成3组,每组10尾鱼。解剖后分别取肾脏、脾脏、鳃、肠、皮肤和肝组织,置于1 mL Trizol溶液中,用组织破碎仪破碎2 min,用Trizol试剂提取总RNA,按照HifairⓇ Ⅱ 1st Strand cDNA Synthesis Kit说明书制备cDNA模板。用qPCR检测tnfα和tnfrsf1a基因在各组织的表达情况。
1.2.4 LPS和poly(I:C)刺激实验注射处理预准备详见1.2.1节,分别用10 μL 100 μg/mL LPS或poly(I:C)对斑马鱼进行腹腔注射[29-30],对照组注射10 μL PBS。在注射后12、24、48和72 h分别取脾脏和肾脏,放于1 mL Trizol中,每个时间点设计3个生物学重复样本,每个样本为10尾鱼的组织混合。有机溶剂法提取总RNA,严格按照HifairⓇ Ⅱ 1st Strand cDNA Synthesis Kit说明书制备qPCR模板,qPCR检测tnfα和tnfrsf1a基因的表达情况。
1.2.5 迟缓爱德华氏菌感染实验将迟缓爱德华式菌菌种从-80 ℃冰箱中取出,用枪头挑取少量菌液放入1 mL胰蛋白胨大豆肉汤培养基(TSB)中,28 ℃振荡活化2 h,涂平板(胰蛋白胨大豆琼脂培养基,TSA),挑取单克隆,通过DNA促旋酶B亚单位蛋白(gyrB)验证(表 1)[31]。将阳性菌落接种到1 mL TSB培养基中,在28 ℃培养箱中160 r/min振荡培养过夜。按照1: 100转接至新鲜TSB培养基中,在培养箱中振荡培养至OD600为0.6~0.8,4 000 r/min离心5 min,弃上层清液,用无菌PBS洗涤1次,加入5 mL PBS悬浮细菌,并用PBS稀释菌液,稀释梯度为10-5、10-6、10-7和10-8,分别取0.2 mL菌液涂平板,每个梯度5个重复(剩余PBS悬浮菌液放入4 ℃冰箱)。取菌落数在10~100之间的平板进行计数,计算原菌液浓度为4.6×107 CFU/mL。经预实验选取感染且不致死的菌液浓度, 感染过程中实验组鱼未出现明显的感染症状。取10 μL稀释梯度为10-2的菌液(4.6×105 CFU/mL)对斑马鱼进行腹腔注射,对照组注射相同体积的PBS。在12、24、48和72 h时取肾脏和脾脏组织,放入1 mL Trizol中,提取总RNA,按照HifairⓇ Ⅱ 1st Strand cDNA Synthesis Kit说明书制备cDNA模板,利用qPCR检测tnfα和tnfrsf1a基因的表达。
1.2.6 嗜水气单胞菌感染实验实验前处理详见1.2.1节,菌落计数确定原菌液浓度步骤同1.2.5节。取10 μL菌液浓度为4.5×104 CFU/mL的嗜水气单胞菌,对斑马鱼进行腹腔注射,对照组注射相同体积的PBS, 实验过程中实验组鱼未出现明显的感染症状。在6、12、24和48 h时取肾脏和脾脏组织,放入1 mL Trizol中,提取总RNA,按照HifairⓇ Ⅱ 1st Strand cDNA Synthesis Kit说明书制备cDNA模板,利用qPCR检测tnfα和tnfrsf1a基因的表达。
1.2.7 鲤春病毒血症病毒感染实验实验前处理详见1.2.1节,每条成年斑马鱼腹腔注射10 μL浓度为1×107 TCID50/mL的SVCV,对照组用相同体积的DMEM处理,实验组鱼在感染5 d后出现脾脏充血肿大,且伴有内脏出血现象。分别在1、3、5、7和15 d取肾脏和脾脏组织,放于1 mL Trizol中,提取总RNA,按照HifairⓇ Ⅱ 1st Strand cDNA Synthesis Kit说明书制备qPCR模板,qPCR检测tnfα和tnfrsf1a基因的表达情况。
1.2.8 荧光定量数据处理根据基因的编码开放阅读框和基因组序列设计跨外显子的qPCR引物(表 1),用ExTaq酶扩增基因片段,琼脂糖凝胶DNA回收(严格按照Omega公司试剂盒说明书操作),用Nanodrop 2 000超微量紫外分光光度计(Thermo Scientific)测定核酸浓度,进行10倍连续稀释8个梯度。采用荧光SYBR Green核酸染色方法测定基因的Ct值(按照UNICONⓇ qPCR SYBR Green Master Mix说明书操作)。qPCR在荧光定量仪器LightCyclerⓇ96(Roche)上进行,程序如下:1个循环:95 ℃/30 s;40个循环:变性95 ℃/5 s,退火62 ℃/30 s,延伸72 ℃/10 s;1个循环:95 ℃/10 s,65 ℃/60 s,97 ℃/20 s。以log10(拷贝数)为横坐标,Ct值为纵坐标制作目标基因和内参基因(Elongation factor 1 alpha,ef1α)的标准曲线。计算实验组与对照组mRNA拷贝数的比值(fold change),用T检验法进行分析数据间差异性的显著程度,P < 0.01(用*表示)和P<0.001(用**表示)分别表示差异显著和差异极显著。采用Graphpad prism软件进行图片制作和编辑。
2 结果 2.1 斑马鱼tnfα、tnfrsf1a的组织表达分析本研究选用ef1α为内参基因进行荧光定量分析,计算目的基因相对表达量(图 1)。结果显示tnfα和tnfrsf1a基因在健康斑马鱼的肾脏、脾脏、皮肤、肠、鳃和肝6个组织中均有表达;tnfα基因在肠和肝脏两组织中表达量极低,在肾脏、鳃和皮肤3个组织中高量表达。tnfrsf1a在所有组织中的表达量均显著高于tnfα,其中在鳃中表达量最高。
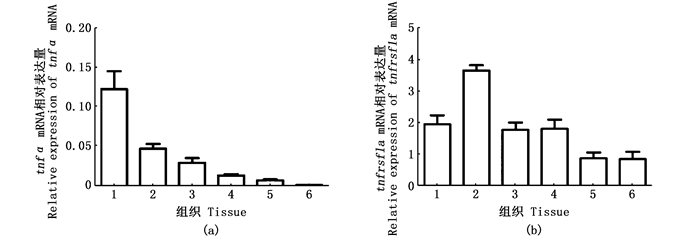
|
1.肾脏; 2.鳃; 3.皮肤; 4.脾脏; 5.肝; 6.肠 1.Kidney; 2.Gill; 3.Skin; 4.Spleen; 5.Liver; 6.Intestine 图 1 斑马鱼tnfα和tnfrsf1a基因在不同组织中的表达(n=3) Fig. 1 Expression of tnfα and tnfrsf1a in zebrafish tissues(n=3) |
本研究用10 μL 100 μg/mL LPS或poly(I:C)对斑马鱼进行腹腔注射,在12、24、48和72 h取脾脏和肾脏,荧光定量检测tnfα和tnfrsf1a基因的表达情况(图 2)。结果显示,通过LPS刺激后,肾脏tnfα表达在24 h和72 h有显著上调;脾脏tnfα表达在24 h和48 h下降,但在72 h显著上升。肾脏tnfrsf1a表达量在12 h相对于对照组上升了7倍,但随后下降;脾脏tnfrsf1a表达除24 h出现下降外,在其他时间点均有显著升高。在poly(I:C)刺激后,肾脏tnfα在所有取样时间点均显著上调;脾脏tnfα表达在刺激12 h和72 h显著上调,在24 h和48 h显著下调。肾脏tnfrsf1a表达在感染前期(12 h和24 h)受到抑制,在48 h和72 h显著升高。
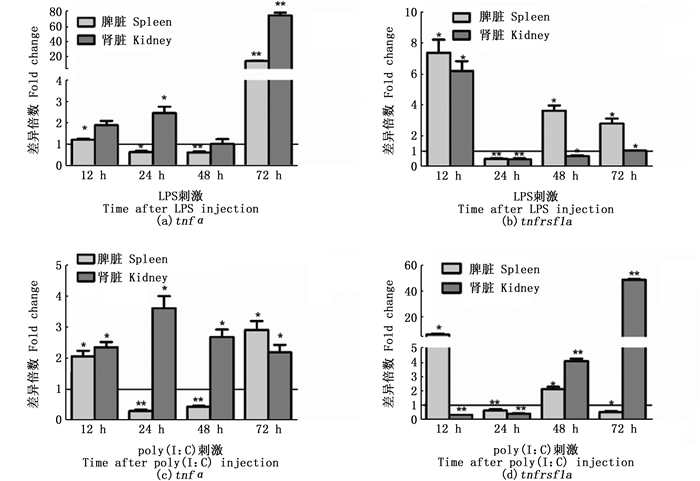
|
图 2 LPS和poly(I:C)刺激斑马鱼后tnfα和tnfrsf1a在脾脏和肾脏中的表达 Fig. 2 Expression of tnfα and tnfrsf1a in spleen and kidney after i.p. injection with LPS or poly(I:C) |
用浓度为4.6×105 CFU/mL的迟缓爱德华氏菌菌液腹腔注射斑马鱼(10 μL),对照组注射相同体积的PBS。在6、12、24和72 h取肾脏和脾脏组织,荧光定量检测tnfα和tnfrsf1a基因的表达,结果表明,在被感染的斑马鱼脾脏中无法检测到tnfα的表达。但在肾脏中tnfα表达在各个时间点都显著升高,在12 h升高达1 000倍。tnfrsf1a基因在脾脏和肾脏中6 h和72 h均明显上调。在肾脏中上调倍数远大于脾脏,在肾脏中最高上调倍数近1 600倍。见图 3。

|
图 3 迟缓爱德华氏菌感染斑马鱼后,tnfα(a)和tnfrsf1a (b)基因在脾脏和肾脏中的表达 Fig. 3 Expression of tnfα(a) and tnfrsf1a(b) in spleen and kidney after i.p. injection with E.tarda |
用10 μL浓度为4.5×104 CFU/mL的嗜水气单胞菌腹腔注射斑马鱼,在6、12、24和48 h取肾脏和脾脏组织,荧光定量检测tnfα和tnfrsf1a基因的表达情况,结果表明在感染24 h和48 h后,tnfα基因在脾脏中表达水平显著上调,在肾脏中仅48 h有显著上调;在脾脏中的上调倍数远大于在肾脏中的上调倍数,在脾脏中最高(上调18倍)。tnfrsf1a基因在脾脏(12 h)和肾脏(24 h)有显著上调。在脾脏中有较高上调倍数,上调的最大倍数是8倍。见图 4。

|
图 4 嗜水气单胞菌感染斑马鱼后,tnfα(a)和tnfrsf1a (b)基因在脾脏和肾脏中的表达 Fig. 4 Expression of tnfα(a) and tnfrsf1a(b) in spleen and kidney after i.p. injection with A. hydrophila |
用10 μL浓度为1×107 TCID50/mL的SVCV病毒腹腔注射斑马鱼,分别在1、3、5、7和15 d取肾脏和脾脏组织,荧光定量检测tnfα和tnfrsf1a基因的表达。实验结果表明:在肾脏中tnfα和tnfrsf1a表达在第1~15天均有明显上调,而脾脏中tnfα表达只在第1天升高,tnfrsf1a表达在第1天、第3天和第15天有明显上调。见图 5。

|
图 5 鲤春病毒血症病毒感染斑马鱼后,tnfα(a)和tnfrsf1a (b)基因在脾脏和肾脏中的表达 Fig. 5 Expression of tnfα(a) and tnfrsf1a(b) in spleen and kidney after i.p. injection with SVCV |
已有的研究结果表明,鱼类tnfα基因在不同鱼类组织中呈现差异表达[11, 14, 17, 32],例如tnfα在鲶鱼中呈组成型表达,在虹鳟中呈诱导性表达。本研究分析了斑马鱼tnfα和tnfrsf1a基因在健康鱼不同组织中的表达情况,发现tnfα和tnfrsf1a在正常鱼组织(如肾脏、脾脏、皮肤、鳃、肝脏和肠)中均呈组成型表达;通过腹腔注射LPS、poly(I:C)、细菌和病毒可调控tnfα和tnfrsf1a在免疫组织中的表达,但调控模式存在差异。实验结果表明斑马鱼Tnfα和Tnfrsf1a参与宿主防御细菌和病毒感染的免疫反应。
硬骨鱼类含有多个tnfα基因,分为tnfα Ⅰ型和Ⅱ型两大类[21]。在过去20年中,tnfα基因的表达得到了较为深入的研究[21, 33-34],研究结果表明它们在表达应答细菌和病毒时存时空差异。斑马鱼含有2个同源tnfα基因;BATES等[34]用50 μg/mL LPS处理7 d的斑马鱼胚胎,能够诱导tnfα基因表达;通过腹腔注射感染斑马鱼,LPS能诱导tnfα和tnfβ的表达,且在刺激4 h后达到高峰。本研究发现,斑马鱼在注射LPS和poly(I:C)后,肾脏和脾脏的tnfα和tnfrsf1a表达明显上升,LPS和poly(I:C)为典型的细菌和病毒病原相关分子模式(pathogen associated molecular patterns,PAMPs),大量研究显示它们能激活Toll类受体(Toll-like receptor,TLR),由此推测,斑马鱼tnfα的表达受到识别LPS和poly(I:C)的类Toll受体的调控。已有研究[35]表明,鱼类存在识别poly(I:C)的TLR受体(TLR3和TLR22);TLR4在哺乳类中为识别LPS的主要受体,但鱼类TLR4跟LPS结合力极弱[36]。
本研究发现斑马鱼tnfα对A. hydrophila和E. tarda的表达应答存在差异。A. hydrophila在肾脏和脾脏中上调tnfα的表达;在注射E. tarda的斑马鱼中,肾脏的tnfα表达显著增加,但脾脏的tnfα表达完全被抑制(40个PCR循环内检测不到),与已发表的结果类似。例如,PURCELL等[25]现在用海豚链球菌感染的斑马鱼中,tnfα也没有表现出明显的变化。A. hydrophila为胞外病原,而E. tarda则可进入宿主细胞内繁殖,为胞内感染细菌,鱼类tnfα是否在胞外和胞内细菌感染过程中受到不同调控还需要进一步的研究。另外,tnfα对A. hydrophila和E. tarda的表达差异也可能与病原的感染剂量有关。
tnfα在调控宿主应答病毒感染的免疫反应过程中起着非常重要的作用。在病毒感染后,鱼类tnfα表达得到明显上调,已经知道传染性脾肾坏死病毒(infectious spleen and kidney necrosis virus,ISKNV)、病毒性出血败血症病毒(VSHV)和传染性造血器官坏死病毒(IHNV)均可诱导宿主tnfα表达[18, 25];与此类似,在本实验中,SVCV感染斑马鱼初期(1 d和3 d),脾脏和肾脏中tnfα和tnfrsf1a基因表达均呈现显著上调。这些结果证明tnfα在鱼类应答病毒感染的免疫反应中起着非常重要的作用。
综上所述,鱼类tnfα在抵御外界细菌和病毒感染中可能发挥重要作用。本研究初步分析了斑马鱼tnfα及其受体tnfrsf1a对应答细菌和病毒感染的转录表达,其结果为进一步研究Tnfα及其受体Tnfrsf1a的功能,阐明其作用机理、信号通路和宿主的防御机制奠定基础。
| [1] |
CARSWELL E A, OLD L J, KASSEL R L, et al. An endotoxin-induced serum factor that causes necrosis of tumors[J]. Proceedings of the National Academy of Sciences of the United States of America, 1975, 72(9): 3666-3670. |
| [2] |
BAUD V, KARIN M. Signal transduction by tumor necrosis factor and its relatives[J]. Trends in Cell Biology, 2001, 11(9): 372-377. |
| [3] |
BEMELMANS M H, VAN TITS L J, BUURMAN W A. Tumor necrosis factor:function, release and clearance[J]. Critical Reviews in Immunology, 2017, 37(2/6): 249-259. |
| [4] |
XIANG Z M, XIAO S, WANG F X, et al. Cloning, characterization and comparative analysis of four death receptor TNFRs from the oyster Crassostrea hongkongensis[J]. Fish&Shellfish Immunology, 2016, 59: 288-297. |
| [5] |
ZHANG J Y, ADAMS A T, RIDKY T W, et al. Tumor necrosis factor receptor 1/c-Jun-NH2-kinase signaling promotes human neoplasia[J]. Cancer Research, 2007, 67(8): 3827-3834. |
| [6] |
TESZ G J, GUILHERME A, GUNTUR K V P, et al. Tumor necrosis factor α(TNFα) stimulates Map4k4 expression through TNFα receptor 1 signaling to c-Jun and activating transcription factor 2[J]. Journal of Biological Chemistry, 2007, 282(27): 19302-19312. |
| [7] |
TAKADA Y, SUNG B, SETHI G, et al. Evidence that genetic deletion of the TNF receptor p60 or p80 inhibits Fas mediated apoptosis in macrophages[J]. Biochemical Pharmacology, 2007, 74(7): 1057-1064. |
| [8] |
SHEIKH M S, HUANG Y. Death receptor activation complexes:it takes two to activate TNF receptor 1[J]. Cell Cycle, 2003, 2(6): 549-551. |
| [9] |
WERTZ I E. TNFR1-activated NF-κB signal transduction:regulation by the ubiquitin/proteasome system[J]. Current Opinion in Chemical Biology, 2014, 23: 71-77. |
| [10] |
ZHANG A Y, CHEN D Y, WEI H, et al. Functional characterization of TNF-α in grass carp head kidney leukocytes:induction and involvement in the regulation of NF-κB signaling[J]. Fish&Shellfish Immunology, 2012, 33(5): 1123-1132. |
| [11] |
ZOU J, SECOMBES C J, LONG S, et al. Molecular identification and expression analysis of tumor necrosis factor in channel catfish (Ictalurus punctatus)[J]. Developmental&Comparative Immunology, 2003, 27(10): 845-858. |
| [12] |
KADOWAKI T, HARADA H, SAWADA Y, et al. Two types of tumor necrosis factor-α in bluefin tuna (Thunnus orientalis) genes:molecular cloning and expression profile in response to several immunological stimulants[J]. Fish&Shellfish Immunology, 2009, 27(5): 585-594. |
| [13] |
EIMON P M, KRATZ E, VARFOLOMEEV E, et al. Delineation of the cell-extrinsic apoptosis pathway in the zebrafish[J]. Cell Death&Differentiation, 2006, 13(10): 1619-1630. |
| [14] |
LAING K J, WANG T H, ZOU J, et al. Cloning and expression analysis of rainbow trout Oncorhynchus mykiss tumour necrosis factor-α[J]. European Journal of Biochemistry, 2001, 268(5): 1315-1322. |
| [15] |
PLEIC'I L, SECOMBES C J, BIRD S, et al. Characterization of three pro-inflammatory cytokines, TNFα1, TNFα2 and IL-1β, in cage-reared Atlantic bluefin tuna Thunnus thynnus[J]. Fish&Shellfish Immunology, 2014, 36(1): 98-112. |
| [16] |
ZOU J, SECOMBES C J. The function of fish cytokines[J]. Biology, 2016, 5(2): 23. |
| [17] |
PRAVEEN K, EVANS D L, JASO-FRIEDMANN L, et al. Constitutive expression of tumor necrosis factor-alpha in cytotoxic cells of teleosts and its role in regulation of cell-mediated cytotoxicity[J]. Molecular Immunology, 2006, 43(3): 279-291. |
| [18] |
ORDÁS M C, COSTA M M, ROCA F J, et al. Turbot TNFα gene:molecular characterization and biological activity of the recombinant protein[J]. Molecular Immunology, 2007, 44(4): 389-400. |
| [19] |
GRAYFER L, WALSH J G, BELOSEVIC M, et al. Cha-racterization and functional analysis of goldfish (Carassius auratus L.) tumor necrosis factor-alpha[J]. Developmental&Comparative Immunology, 2008, 32(5): 532-543. |
| [20] |
SAEIJ J P J, STET R J M, DE VRIES B J, et al. Molecular and functional characterization of carp TNF:a link between TNF polymorphism and trypanotolerance?[J]. Developmental&Comparative Immunology, 2003, 27(1): 29-41. |
| [21] |
HONG S, LI R G, XU Q Q, et al. Two types of TNF-α exist in teleost fish:phylogeny, expression, and bioactivity analysis of type-Ⅱ TNF-α3 in rainbow trout Oncorhynchus mykiss[J]. The Journal of Immunology, 2013, 191(12): 5959-5972. |
| [22] |
KIM M S, HWANG Y J, YOON K J, et al. Molecular cloning of rock bream (Oplegnathus fasciatus) tumor necrosis factor-α and its effect on the respiratory burst activity of phagocytes[J]. Fish&Shellfish Immunology, 2009, 27(5): 618-624. |
| [23] |
ROHER N, CALLOL A, PLANAS J V, et al. Endotoxin recognition in fish results in inflammatory cytokine secretion not gene expression[J]. Innate Immunity, 2011, 17(1): 16-28. |
| [24] |
谢玲玲, 王风华, 王德成, 等. 肿瘤坏死因子α突变型斑马鱼在海分枝杆菌感染中的应用研究[J]. 微生物与感染, 2017, 12(3): 156-163. XIE L L, WANG F H, WANG D C, et al. Application of tumor necrosis factor α mutant zebrafish in Mycobacterium marinum infection[J]. Journal of Microbes and Infections, 2017, 12(3): 156-163. |
| [25] |
PURCELL M K, KURATH G, GARVER K A, et al. Quantitative expression profiling of immune response genes in rainbow trout following infectious haematopoietic necrosis virus (IHNV) infection or DNA vaccination[J]. Fish&Shellfish Immunology, 2004, 17(5): 447-462. |
| [26] |
WU X M, HU Y W, XUE N N, et al. Role of zebrafish NLRC5 in antiviral response and transcriptional regulation of MHC related genes[J]. Developmental&Comparative Immunology, 2017, 68: 58-68. |
| [27] |
XIE H, NIE P, SUN B. Characterization of two membrane-associated protease genes obtained from screening out-membrane protein genes of Flavobacterium columnare G (4)[J]. Journal Fish Diseases, 2004, 27(12): 719-729. |
| [28] |
JI C, LI A H, XIE J, et al. Bactericidal activity of grass carp Ctenopharyngodon idella C9-deficient serum against Aeromonas hydrophila[J]. Journal of Fish Biology, 2011, 79(7): 2083-2086. |
| [29] |
CUI Z, SAMUEL-SHAKER D, WATRAL V, et al. Attenuated Mycobacterium marinum protects zebrafish against mycobacteriosis[J]. Journal of Fish Disease, 2010, 33(4): 371-375. |
| [30] |
NOVOA B, BOWMAN T V, ZON L, et al. LPS response and tolerance in the zebrafish (Danio rerio)[J]. Fish&Shellfish Immunology, 2009, 26(2): 326-331. |
| [31] |
刘春, 李凯彬, 王庆, 等. 斑马鱼迟缓爱德华氏菌的鉴定、致病性及药物敏感性[J]. 华中农业大学学报, 2013, 5(3): 105-111. LIU C, LI K B, WANG Q, et al. Identification, pathogenicity and drug sensitivity of Edwardsiella tarda from Danio rerio[J]. Journal of Huazhong Agricultural University, 2013, 5(3): 105-111. |
| [32] |
HIRONO I, NAM B H, KUROBE T, et al. Molecular cloning, characterization, and expression of TNF cDNA and gene from Japanese flounder Paralychthys olivaceus[J]. The Journal of Immunology, 2000, 165(8): 4423-4427. |
| [33] |
ZOU J, WANG T, HIRONO I, et al. Differential expression of two tumor necrosis factor genes in rainbow trout, Oncorhynchus mykiss[J]. Developmental&Comparative Immunology, 2002, 26(2): 161-172. |
| [34] |
BATES J M, AKERLUND J, MITTGE E, et al. Intestinal alkaline phosphatase detoxifies lipopolysaccharide and prevents inflammation in zebrafish in response to the gut microbiota[J]. Cell Host&Microbe, 2007, 2(6): 371-382. |
| [35] |
PALTI Y. Toll-like receptors in bony fish:from genomics to function[J]. Developmental&Comparative Immunology, 2011, 35(12): 1263-1272. |
| [36] |
SEPULCRE M P, ALCARAZ-PÉREZ F, LÓPEZ-MUÑOZ A, et al. Evolution of lipopolysaccharide (LPS) recognition and signaling:fish TLR4 does not recognize LPS and negatively regulates NF-κB activation[J]. The Journal of Immunology, 2009, 182(4): 1836-1845. |
 2020,
Vol. 29
2020,
Vol. 29


