2. 上海海洋大学 水产与生命学院, 上海 201306
草鱼(Ctenopharyngodon idellus)是我国重要的淡水养殖鱼类之一,2018年全国产量为535万t,约占全国水产品总量的9%。在20世纪70年代初,广东省五七干校技术人员偶然发现在草鱼成鱼养殖阶段投喂单一饲料蚕豆(Vicia faba)90~120 d后,其肌肉硬度增加、肉质紧实和口感脆爽。这种肌肉性质改变的草鱼被称脆化草鱼或脆肉鲩[1]。脆肉鲩因口感改善深受消费者喜爱,目前已推广至全国,部分产品远销东南亚和北美。脆肉鲩不仅拓宽了普通草鱼的销售市场,而且脆肉鲩的市场价格通常是普通草鱼的二倍以上,显著提高了养殖户的经济效益。
然而脆肉鲩,在养殖过程中,不仅出现生长缓慢,而且其肝脏受到摄食蚕豆的影响,表现为肝脏抗氧化能力降低和功能受损[2-3],在快速游动后肝脏会严重充血[4]。另外,有研究发现,蚕豆投喂陆生动物后,其肝脏也有类似的现象。MARTÍNEZ等[5]将蚕豆作为唯一蛋白来源投喂给小鼠后发现小鼠生长减缓和肝脏重量显著减少。ORTIZ等[6]用含有蚕豆提取物单宁的饲料投喂给鸡和小鼠后,发现肝脏均水肿变性。本团队前期研究还发现投喂蚕豆后,草鱼肝脏中的粗脂肪含量增多[7]。这说明蚕豆可能导致了草鱼肝脏中的脂肪代谢失衡,造成脂肪在肝脏中蓄积。到目前为止,对投喂蚕豆造成草鱼肝脏脂肪蓄积的机制未见有报道。此外,研究[8-10]表明鱼类脂肪肝的发生不仅会降低鱼类的生长性能、免疫能力和抗病能力,更严重的是还会降低肌肉的品质,影响口感。因此降低脂肪肝的发生、维持肝脏的健康状态对保证脆肉鲩肌肉品质有积极的意义。
为了探究蚕豆引起草鱼肝脏脂肪蓄积的原因,以蚕豆为单一饲料源投喂草鱼120 d后,采集摄食蚕豆的草鱼(脆肉鲩)和摄食配合饲料的普通草鱼的血液和肝脏样品,进行肝脏的H & E染色、油红O染色和肝细胞透射电镜观察,同时测定血液和肝脏中与脂肪代谢相关的生理生化指标,并利用Real-time PCR技术定量分析基因acc和fas的表达变化,以期望为脆肉鲩的营养调控提供科学数据。
1 材料与方法 1.1 试验材料试验草鱼的养殖在珠江水产研究所养殖基地进行,养殖鱼池规格为4.5 m×4.5 m×1.1 m的水泥池,取规格基本一致且体质健康的草鱼180尾[(816.44±57.96) g],分成对照组(投喂普通配合饲料)和试验组(投喂单一蚕豆),每组设置3个重复,每个重复为30尾,养殖时间为2018年6月中旬至2018年10月中旬(120 d)。蚕豆的粗蛋白质与粗脂肪含量分别为287 g/kg和23.1 g/kg, 而普通饲料的粗蛋白与粗脂肪分别为360 g/kg和6.2 g/kg。投饵量按体质量的3%~5%计算,每天投喂2次(9:00和18:00)。试验期间水温为25~30 ℃,pH为6.5~7.5,溶解氧大于5.0 mg/L。养殖试验结束后,试验组草鱼和对照组草鱼体质量分别为(1 798±129)g和(2 225±100)g。
1.2 取样每个重复取3尾鱼,经丁香酚麻醉后,用5 mL无菌注射器从尾静脉取血,采集的血液置于10 mL无菌离心管中,4 ℃冰箱中静置3 h后,在3 500 r/min离心10 min,取上层血清用于生理生化指标的测定。解剖试验鱼,取约1 g肝脏组织,液氮速冻,于-80 ℃冰箱保存用于基因表达检测;切割厚度小于0.5 cm的肝脏组织固定于4%多聚甲醛和10%甲醛中,分别用于H & E染色和油红O染色;取厚度小于0.2 cm的肝脏组织固定于2.5%戊二醛溶液中用于透射电镜观察;取约5 g的肝脏组织,液氮速冻,于-80 ℃保存,用于肝脏生理生化指标的检测。
1.3 H & E染色和油红O染色肝脏组织在4%多聚甲醛中固定24 h后,进行脱水、透明和浸蜡包埋,制备石蜡组织切片再进行常规染色。待切片水化后浸入苏木精染色10 min,蒸馏水速洗,用0.1%盐酸乙醇分色,浸入1%伊红中染色2 min,再用盐酸乙醇分色,经95%乙醇与无水乙醇脱水,二甲苯透明,中性树胶封片后,光镜下观察肝脏组织的病理学特征。
肝脏组织冰冻切片后,60%异丙醇洗30 s,油红O原液6 mL加蒸馏水4 mL混匀后浸染切片10 min,60 %异丙醇洗去多余染液,苏木素染核2 min,水洗至细胞核蓝化,最后用甘油明胶封片。光镜下观察肝细胞中的红色脂滴。
1.4 透射电镜肝脏组织在2.5%戊二醛中固定24 h后。用0.1 mol/L磷酸盐缓冲液(pH=7.4)冲洗4 h,在1%锇酸培养基中固定,然后用0.1 mol/L磷酸盐缓冲液冲洗,分别使用体积分数为50%、70%、80%、90%和100%乙醇和100%叔丁醇进行脱水。将切片用乙酸双氧铀染色,然后用柠檬酸铅染色。观察超微结构变化,并使用S-3400N透射电子显微镜拍摄显微照片,观察肝细胞的超显微结构。
1.5 生理生化指标的测定将1.2节中所取的同一重复的3条试验鱼样品混合。按照南京建成生物工程研究所的试剂盒说明书,测定血清甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)、过氧化氢(hydrogen peroxide, H2O2)、过氧化氢酶(catalase, CAT)、谷胱甘肽(glutathione, GSH)、丙二醛(malonaldehyde, MDA)、谷丙转氨酶(alanine aminotransferase, ALT)的活性和谷草转氨酶(aspartate aminotransferase, AST)的活性。肝脏的甘油三酯(TG)、总胆固醇(TC)、过氧化氢(H2O2)、过氧化氢酶(CAT)、谷胱甘肽(GSH)和丙二醛(MDA)的测定采用南京建成生物工程研究所的试剂盒;肝脏和血清中的葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase, G6PD)活性检测使用北京索莱宝科技有限公司的试剂盒。
1.6 Real-time PCR检测基因mRNA表达情况按照RNA提取试剂盒(TaKaRa, 日本)说明书提取肝脏总RNA, 经OD260/280分析测定RNA浓度后,使用反转录试剂盒(TaKaRa, 日本)将1 μg RNA反转录为cDNA。采用实时荧光定量PCR(qPCR)检测对照组草鱼和试验组草鱼肝脏中的乙酰辅酶a羧化酶(acetyl CoA carboxylase, acc)和脂肪酸合酶(fatty acid synthase, fas)基因的表达情况,以草鱼β-actin编码的基因作为内参基因。实时荧光定量所用到的引物均由上海英潍捷基贸易有限公司合成,引物信息详见表 1[11]。

|
表 1 内参基因与目的基因的引物 Tab.1 Primers of reference and target genes |
实时荧光定量PCR采用荧光染料SYBRⓇ GREEN I NUCLEIC A。PCR反应体系如下:14.0 μL超纯水,2.0 μL 10×PCR缓冲液(200.0 mmol/L Tris-HCL,500.0 mmol/L KCl),1.0 μL镁离子(50.0 mmol/L),1.0 μL模板,0.5 μL dNTPs(10 mmol/L),0.5 μL上游引物(10 μmol/L),0.5 μL下游引物(10.0 μmol/L),0.3 μL SYBR(20×),0.2 μL Taq酶(5.0 U/μL)。反应条件:95 ℃变性5 min;95 ℃10 s,58 ℃30 s,72 ℃30 s,40个循环,溶解温度60~95 ℃。采用StepOnTMReal-Time PCR System检测阈值周期数(Ct)。采用2-ΔΔCt方法[12]对数据进行处理。
1.7 统计分析所有数据采用平均值±标准差(Means±SD)表示。使用SPSS 22.0软件对数据进行单因素方差分析(One-Way ANOVA),P < 0.05表示显著差异,P<0.01表示极显著差异。
2 结果与分析 2.1 肝脏外形观察与对照组草鱼肝脏相比,试验组草鱼肝脏外观颜色发黄,贫血肿大,具有油腻感,表面出现大小不一的白色坏死病灶。
2.2 H & E染色的肝脏切片观察将对照组草鱼与试验组草鱼的肝脏切片进行H & E染色观察。由图版Ⅰ-1和图版Ⅰ-3可知:对照组草鱼肝小叶中央静脉周围肝索结构排列规则,并呈正常的放射状;肝索间可见肝窦;肝细胞形态与大小正常, 核圆、大和居中,细胞胞质充盈;肝细胞未见肿胀,仅有零星的空泡分散在肝脏中。由图版Ⅰ-2和图版Ⅰ-4可知:试验组草鱼肝小叶结构紊乱, 界限不清;肝索排列不规则;肝细胞明显肿胀,部分细胞核贴壁,细胞胞浆内有大量大小不一的空泡。
2.3 油红O染色的肝脏切片观察将对照组草鱼与试验组草鱼的肝脏进行油红O染色切片观察,在光镜下肝细胞内的脂肪滴呈红色,细胞核呈蓝色。由图版Ⅱ-1和图版Ⅱ-3可知:对照组草鱼肝细胞仅有少许红色小脂滴。由图版Ⅱ-2和图版Ⅱ-4可知:试验组草鱼肝细胞明显肿大、变圆,明显可见细胞内有大小不等的红色脂滴,呈弥漫状; 中央静脉周围的肝细胞油红染色较深,肝脏脂肪蓄积严重,表现为脂肪变性状态。
2.4 肝脏透射电镜观察将对照组草鱼与试验组草鱼的肝脏切片进行透射电镜观察。由图版Ⅲ-1和图版Ⅲ-3可知:对照组肝细胞细胞质内可见丰富的线粒体和内质网,线粒体结构完整,嵴清晰明显; 内质网以粗面内质网为主,呈捆状整齐的排列在细胞核和线粒体的周围;细胞核形状较规则,常染色质均匀分布。由图Ⅲ-2和图版Ⅲ-4可知:试验组肝细胞线粒体、内质网数量形态异常,数量明显减少,杂乱地分布在细胞质中;肝细胞体积变大,排列无规则;肝细胞核边缘形状不规则。
2.5 投喂蚕豆对草鱼血清脂肪代谢相关指标的影响由表 2可知:试验组草鱼血清中的甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)和丙二醛(MDA)的含量显著高于对照组(P<0.05);试验组草鱼血清中的过氧化氢(H2O2)、谷丙转氨酶(ALT)活性和谷草转氨酶(AST)活性极显著高于对照组(P<0.01),但过氧化氢酶(CAT)、葡萄糖-6-磷酸脱氢酶(G6PD)的活性和还原型谷胱甘肽与氧化型谷胱甘肽的比值(GSH/GSSH)极显著低于对照组(P<0.01)。两组血清中的高密度脂蛋白胆固醇(HDL-C)差异不显著(P>0.05)。
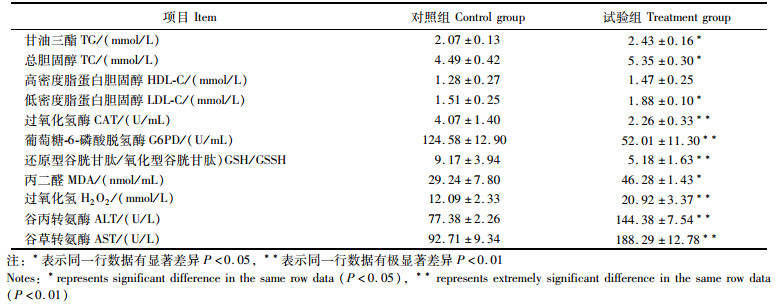
|
表 2 投喂蚕豆对草鱼血清脂肪代谢相关指标的影响 Tab.2 Effects of feeding broad bean on serum indexes of grass carp related to fat metabolism |
由表 3可知:试验组草鱼肝脏中的甘油三酯(TG)、总胆固醇(TC)和过氧化氢(H2O2)的含量均极显著高于对照组(P<0.01),且丙二醛(MDA)的含量也显著高于对照组(P<0.05);试验组草鱼肝脏中的过氧化氢酶(CAT)、葡萄糖-6-磷酸脱氢酶(G6PD)的活性和还原型谷胱甘肽与氧化型谷胱甘肽的比值(GSH/GSSH)均极显著低于对照组(P<0.01)。

|
表 3 投喂蚕豆对草鱼肝脏脂肪代谢相关指标的影响 Tab.3 Effects of feeding broad bean on liver indexes of grass carp related to fat metabolism |
由图 1所知,试验组草鱼肝脏中的acc和fas的基因表达均极显著高于对照组(P<0.01),分别比对照组高出了243.17 %和76.99%。

|
**表示极显著差异(P<0.01) **represents extremely significant difference (P < 0.01) 图 1 投喂蚕豆对草鱼肝脏脂肪酸合成相关基因(acc和fas)的表达的影响 Fig. 1 Effect of feeding broad bean on the gene expression of fatty acid synthesis (acc and fas) in grass carp liver |
肝脏作为碳水化合物、蛋白质和脂质合成、代谢、存储、重新分配的主要场所,在维持机体代谢稳态中起着重要作用。当肝脏所吸收的能量大于支出时,TG会在肝脏中积聚,从而引起肝脏的脂肪蓄积,表现为肝脏脂肪变性(或称为脂肪肝)[13]。目前,已有大量的研究[8-10]表明:脂肪肝会引起鱼类食欲不振、生长性能降低、饵料系数提高;肌肉品质降低;应激耐受性和免疫力降低,对病害的敏感性和死亡率提高等现象。通常患脂肪肝的鱼其肝脏外观发黄、肿大,具有油腻感;肝细胞内出现明显的脂滴;线粒体和内质网形态异常甚至溶解消失[14-15]。以蚕豆作为单一饵料投喂草鱼120 d后,经外观、H&E染色、油红O染色和透射电镜观察发现试验组草鱼肝脏表现出类似病理特征,呈现出典型的肝脏脂肪变性状态。
研究[16]表明脂肪酸的过量供应是肝脏脂肪变性的一个重要决定因素。试验组草鱼血液中的TC、TG和转运内源性胆固醇的LDL-C显著高于对照组,这表明蚕豆可以诱导草鱼血脂异常,从而可能促进试验组草鱼肝细胞从血液中摄取和储存TC和TG。此外,脂肪酸从头合成(de novo lipogenesis, DNL)也是导致肝脏脂肪变性的关键途径[17-18],该途径主要是乙酰辅酶A羧化酶将乙酰辅酶A转化为丙二酰辅酶A,再由脂肪酸合成酶将其转化为棕榈酸(C16:0),并在其他酶的作用下进行延伸[19],最终以TG形式存储[13, 20],而DNL受acc和fas这两个关键基因的调控,经检测发现试验组草鱼肝脏中的acc和fas基因表达均显著高于对照组,表明试验组草鱼肝脏细胞中DNL途径上调,这会促进脂肪酸在肝脏中的合成增加。
脂肪酸氧化代谢主要通过线粒体β-氧化进行的[21],因此线粒体的功能是否正常,在细胞中数量的多少直接影响着脂肪酸代谢。在正常生理状态下,线粒体一般会产生占总耗氧量2%的活性氧(reactive oxygen species, ROS),主要为O2-[22],因此线粒体通常也为高水平ROS的氧化靶点。研究[23-24]表明,高水平的ROS会氧化线粒体膜、电子传递链复合物蛋白和线粒体DNA(mitochondrial DNA, mtDNA)等,从而造成细胞内线粒体数量减少和形态结果异常。另外,O2-会被歧化成过H2O2(H2O2属于ROS,具有氧化性),通常会被细胞内的抗氧化剂CAT和依赖于G6PD还原的GSH转化为无毒性的水[22, 25]。试验组草鱼肝脏中的H2O2含量极显著高于对照组,而CAT和G6PD活性以及GSH的含量均显著较低,表明试验组草鱼肝脏中的H2O2可能会超出正常阈值水平而引起氧化应激,从而对线粒体造成氧化损伤。从透射电镜观察到试验组草鱼肝细胞中线粒体数量减少,形态结构异常的结果正好应证了这一点。以上结果表明,试验组草鱼肝细胞中氧化应激的发生导致线粒体数量的减少,进而降低了脂肪在肝脏中的氧化代谢。
同时,试验组草鱼肝细胞膜也受到了氧化应激的作用。在哺乳动物中,血液中的ALT和AST的活性的高低意味着肝脏健康与否,当ALT和AST在血液中的活性增加时,表明肝功能受损[26]。目前已有许多学者[27-28]利用这两个指标来判断鱼类的肝功能是否正常。试验组草鱼血液中的ALT和AST极显著高于对照组,这表明了试验组草鱼肝脏功能受损,可能的原因是氧化应激引起了脂质过氧化而破坏了肝细胞膜,使主要存在肝细胞内的ALT和AST大量地从细胞内逸出进入血液,致使ALT和AST在血液中的活性增加。MDA是多不饱和脂肪酸过氧化物的降解产物,其含量的大小能直接反映脂质过氧化水平[2]。试验组草鱼肝脏中的MDA显著增加在一定程度上验证了肝细胞膜受到了“氧化应激”的破坏。
目前研究[29]已证实,在哺乳动物中,氧化应激在非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)发生和进展中起着重要作用。也有研究表明在鱼类肝脏发生脂肪变性时,氧化应激可能也起着类似促进作用,如SITJà-BOBADILLA等[8]用100%植物蛋白源替代鱼粉时,发现金头鲷(Sparus aurata)肝脏发生脂肪变性时伴随有严重的氧化应激。LIU等[30]发现全氟十二烷酸诱导斑马鱼(Barchydanio rerio)肝脏脂肪变性涉及脂肪酸β-氧化和氧化应激的紊乱。由此,推测氧化应激可能是试验组草鱼肝脏发生脂肪变性的关键因素。
| [1] |
YU E M, ZHANG H F, LI Z F, et al. Proteomic signature of muscle fibre hyperplasia in response to faba bean intake in grass carp[J]. Scientific Reports, 2017, 7: 45950. DOI:10.1038/srep45950 |
| [2] |
魏静, 郑小淼, 冷向军, 等. 草鱼脆化过程中血液学指标及组织氧化还原的动态变化[J]. 上海海洋大学学报, 2016, 25(4): 559-568. WEI J, ZHENG X M, LENG X J, et al. Effects of feeding broad bean on haematological indexes and redox balance of grass carp (Ctenopharyngodon idellus)[J]. Journal of Shanghai Ocean University, 2016, 25(4): 559-568. |
| [3] |
毛盼, 胡毅, 郇志利, 等. 投喂蚕豆饲料和去皮蚕豆饲料对草鱼生长性能、肌肉品质及血液生理生化指标的影响[J]. 动物营养学报, 2014, 26(3): 803-811. MAO P, HU Y, HUAN Z L, et al. Effects of feeding broad bean and dehulling broad bean diets on growth performance, muscle quality and blood physiological-biochemical indices of grass carp (Ctenopharyngodon idellus)[J]. Chinese Journal of Animal Nutrition, 2014, 26(3): 803-811. DOI:10.3969/j.issn.1006-267x.2014.03.033 |
| [4] |
谭乾开, 黎华寿. 食物与水环境因子对草鱼(Ctenopharyngodon idellus C. et V)脆化过程的影响[J]. 生态学报, 2006, 26(7): 2409-2415. TAN Q K, LI H S. Effects of diets dose and water quality on the transformation of common grass carp (Ctenopharyngodon idellus C. et V) to crisped grass carp[J]. Acta Ecologica Sinica, 2006, 26(7): 2409-2415. DOI:10.3321/j.issn:1000-0933.2006.07.046 |
| [5] |
MARTÍNEZ J A, MACARULLA M T, MARCOS R, et al. Nutritional outcome and immunocompetence in mice fed on a diet containing raw field beans (Vicia faba, var. minor) as the source of protein[J]. British Journal of Nutrition, 1992, 68(2): 493-503. DOI:10.1079/BJN19920107 |
| [6] |
ORTIZ L T, ALZUETA C, TREVINO J, et al. Effects of faba bean tannins on the growth and histological structure of the intestinal tract and liver of chicks and rats[J]. British Poultry Science, 1994, 35(5): 743-754. DOI:10.1080/00071669408417739 |
| [7] |
王一飞, 吉红, 陈昊杰, 等. 投喂蚕豆对草鱼肌肉质构特性、脂质蓄积状况及组织脂肪酸组成的影响[J]. 南方农业学报, 2015, 46(11): 2040-2045. WANG Y F, JI H, CHEN H J, et al. Effects of feeding broad bean on muscle texture characteristics, lipid accumulation and tissue fatty acid composition of grass carp (Ctenopharynodon idellus)[J]. Journal of Southern Agriculture, 2015, 46(11): 2040-2045. DOI:10.3969/j:issn.2095-1191.2015.11.2040 |
| [8] |
SITJÀ-BOBADILLA A, PEÑA-LLOPIS S, GóMEZ-REQUENI P, et al. Effect of fish meal replacement by plant protein sources on non-specific defence mechanisms and oxidative stress in gilthead sea bream (Sparus aurata)[J]. Aquaculture, 2005, 249(1/4): 387-400. |
| [9] |
GONZÁLEZ-FÉLIX M L, MINJAREZ-OSORIO C, PEREZ-VELAZQUEZ M, et al. Influence of dietary lipid on growth performance and body composition of the Gulf corvina, Cynoscion othonopterus[J]. Aquaculture, 2015, 448: 401-409. DOI:10.1016/j.aquaculture.2015.06.031 |
| [10] |
杜震宇. 养殖鱼类脂肪肝成因及相关思考[J]. 水产学报, 2014, 38(9): 1628-1638. DU Z Y. Causes of fatty liver in farmed fish:a review and new perspectives[J]. Journal of Fisheries of China, 2014, 38(9): 1628-1638. |
| [11] |
LI A X, YUAN X C, LIANG X F, et al. Adaptations of lipid metabolism and food intake in response to low and high fat diets in juvenile grass carp (Ctenopharyngodon idellus)[J]. Aquaculture, 2016, 457: 43-49. DOI:10.1016/j.aquaculture.2016.01.014 |
| [12] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [13] |
MATHERLY S C, PURI P. Mechanisms of simple hepatic steatosis:not so simple after all[J]. Clinics in Liver Disease, 2012, 16(3): 505-524. DOI:10.1016/j.cld.2012.05.005 |
| [14] |
MOSCONI-BAC N. Hepatic disturbances induced by an artificial feed in the sea bass (Dicentrarchus labrax) during the first year of life[J]. Aquaculture, 1987, 67(1/2): 93-99. |
| [15] |
黄春红, 肖调义, 胡毅, 等. 养殖鱼类脂肪肝研究现状分析[J]. 动物营养学报, 2014, 26(7): 1715-1722. HUANG C H, XIAO T Y, HU Y, et al. Analysis on research status of fatty liver disease in aquaculture fish[J]. Chinese Journal of Animal Nutrition, 2014, 26(7): 1715-1722. DOI:10.3969/j.issn.1006-267x.2014.07.001 |
| [16] |
BRADBURY M W. Lipid metabolism and liver inflammation. Ⅰ. Hepatic fatty acid uptake:possible role in steatosis[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2006, 290(2): G194-G198. DOI:10.1152/ajpgi.00413.2005 |
| [17] |
BROWNING J D, HORTON J D. Molecular mediators of hepatic steatosis and liver injury[J]. Journal of Clinical Investigation, 2004, 114(2): 147-152. DOI:10.1172/JCI200422422 |
| [18] |
TAKAISHI K, DUPLOMB L, WANG M Y, et al. Hepatic insig-1 or -2 overexpression reduces lipogenesis in obese Zucker diabetic fatty rats and in fasted/refed normal rats[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(18): 7106-7111. DOI:10.1073/pnas.0401715101 |
| [19] |
MOON Y A, HORTON J D. Identification of two mammalian reductases involved in the two-carbon fatty acyl elongation cascade[J]. Journal of Biological Chemistry, 2003, 278(9): 7335-7343. DOI:10.1074/jbc.M211684200 |
| [20] |
DIRAISON F, MOULIN P, BEYLOT M. Contribution of hepatic de novo lipogenesis and reesterification of plasma non esterified fatty acids to plasma triglyceride synthesis during non-alcoholic fatty liver disease[J]. Diabetes & Metabolism, 2003, 29(5): 478-485. |
| [21] |
TESSARI P, CORACINA A, COSMA A, et al. Hepatic lipid metabolism and non-alcoholic fatty liver disease[J]. Nutrition, Metabolism and Cardiovascular Diseases, 2009, 19(4): 291-302. DOI:10.1016/j.numecd.2008.12.015 |
| [22] |
ZOROV D B, JUHASZOVA M, SOLLOTT S J. Mitoch-ondrial reactive oxygen species (ROS) and ROS-induced ROS release[J]. Physiological Reviews, 2014, 94(3): 909-950. DOI:10.1152/physrev.00026.2013 |
| [23] |
RICCI C, PASTUKH V, LEONARD J, et al. Mitochondrial DNA damage triggers mitochondrial-superoxide generation and apoptosis[J]. American Journal of Physiology-Cell Physiology, 2008, 294(2): C413-C422. DOI:10.1152/ajpcell.00362.2007 |
| [24] |
RACHEK L I, YUZEFOVYCH L V, LEDOUX S P, et al. Troglitazone, but not rosiglitazone, damages mitochondrial DNA and induces mitochondrial dysfunction and cell death in human hepatocytes[J]. Toxicology and Applied Pharmacology, 2009, 240(3): 348-354. DOI:10.1016/j.taap.2009.07.021 |
| [25] |
SAVASKAN N E, UFER C, KÜHN H, et al. Molecular biology of glutathione peroxidase 4:from genomic structure to developmental expression and neural function[J]. Biological Chemistry, 2007, 388(10): 1007-1017. |
| [26] |
SLAM R, ALAM M J. Evaluation of liver protective activity of Moringa oleifera bark extract in paracetamol induced hepatotoxicity in rats[J]. BioRxiv, 2019, 513002. DOI:10.1101/513002 |
| [27] |
WANG C, LIU Y, SUN G X, et al. Growth, immune response, antioxidant capability, and disease resistance of juvenile Atlantic salmon (Salmo salar L.) fed Bacillus velezensis V4 and Rhodotorula mucilaginosa compound[J]. Aquaculture, 2019, 500: 65-74. DOI:10.1016/j.aquaculture.2018.09.052 |
| [28] |
LI H T, TANG S Y, DU W H, et al. The effects of ethoxyquin and Angelica sinensis extracts on lipid oxidation in fish feeds and growth, digestive and absorptive capacities and antioxidant status in juvenile red carp (Cyprinus carpio var. xingguonensis):a comparative study[J]. Fish Physiology and Biochemistry, 2019, 45(1): 43-61. DOI:10.1007/s10695-018-0533-x |
| [29] |
BORRELLI A, BONELLI P, TUCCILLO F M, et al. Role of gut microbiota and oxidative stress in the progression of non-alcoholic fatty liver disease to hepatocarcinoma:Current and innovative therapeutic approaches[J]. Redox Biology, 2018, 15: 467-479. DOI:10.1016/j.redox.2018.01.009 |
| [30] |
LIU Y, WANG J S, WEI Y H, et al. Induction of time-dependent oxidative stress and related transcriptional effects of perfluorododecanoic acid in zebrafish liver[J]. Aquatic Toxicology, 2008, 89(4): 242-250. DOI:10.1016/j.aquatox.2008.07.009 |
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29


