2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306;
3. 国家淡水水产品加工技术研发分中心, 上海 201306
FGFC1是海洋真菌长孢葡萄穗霉菌FG216(Staohybotrys Longispora FG216)的次级代谢产物,是具有溶栓药效的双吲哚海洋生物碱[1]。FGFC1作用机理为提高血液纤溶因子纤溶酶促进血栓溶解,该途径纤溶反应平稳且安全高效,因此FGFC1具有成为小分子溶栓候选药物的潜力[2]。已有研究通过比格犬模型内药物代谢动力学特征及组织分布特征[3]、异硫氰酸荧光素-纤维蛋白降解法、急性肺血栓大鼠模型法[4],证明FGFC1具有良好溶栓效果,能在比格犬体内迅速代谢,且滞留时间长,吸收后组织分布广泛,能很好地发挥生物学作用,表明FGFC1具有良好的成药性。
肝微粒体体外实验对药物浓度和反应时间的可控性高,可模拟药物的肝脏代谢。目前,已有研究利用体外肝微粒体体系分析槟榔碱与槟榔次碱转化为去甲基槟榔碱和去甲基槟榔次碱[5]、白屈菜碱的体外药代动力学特征及其生物转化过程[6]。但对于双吲哚类生物碱生物转化过程的研究,目前尚未见报导。
构建体外肝微粒体体系研究FGFC1的生物转化过程,分析其体外药物代谢动力学特征及其转化产物,可进一步阐明FGFC1体内代谢规律,为FGFC1作为新型溶栓药物的使用提供理论基础。
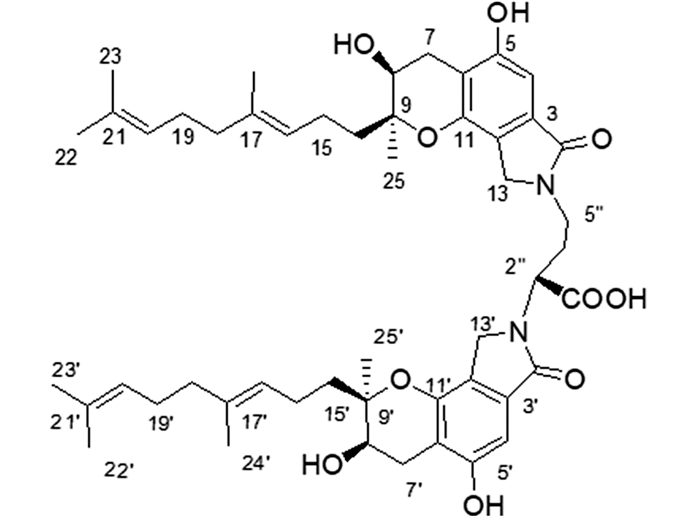
1 材料与方法 1.1 样品与试剂 1.1.1 样品FGFC1由上海海洋大学海洋药物实验室制备(纯度>98%,溶解度为12.5 mg/mL),分子结构见图 1。
|
图 1 FGFC1的分子结构式 Fig. 1 Molecular structure of FGFC1 |
NADPH(还原性辅酶Ⅱ,上海罗氏制药有限公司),甲醇、乙腈(色谱纯,均购自国药集团化学试剂有限公司),Tris-HCl缓冲液(pH=7.4)、PBS缓冲液(pH=7.4)、乙酸乙酯、氯化钙、碳酸氢钠、蔗糖(分析纯,均购自国药集团化学试剂有限公司),三氟乙酸(色谱纯,美国Sigma公司),Folin试剂(美国Sigma公司),牛血清白蛋白、4-苯基-1, 2, 3-噻二唑、去乙酰环丙氯地孕酮和苯妥英钠(百灵威化学试剂有限公司)。
1.1.3 仪器主要仪器:高速冷冻离心机(CR21G型,日本日立公司),酶标仪(CORONA SH-1000型,上海天美生化仪器有限公司),超高速冷冻离心机(Hitachi himac CP70ME型,德国IKA公司),高效液相色谱仪(HITACHI L-2000型,日本日立公司),制备型高效液相色谱仪(P270型,大连依利特有限公司),组织匀浆机(R104型,德国IKA公司),超纯水净化系统(Direct-Q3型,默克密理博公司),96孔板(美国康宁公司),超低温冰箱(DW-8GL388型,中科美菱有限公司),液相色谱质谱联用仪(TSQ-VANTAGE型,赛默飞世尔科技有限公司)。
1.2 实验动物Wistar大鼠购自上海杰思捷动实验动物中心[SCXK(沪)201703213],体质量为350~400 g,7~9周龄,共4只。
在动物房适应性饲养一周,相对湿度50%±5%,温度(25±2)℃,自然正常通风,昼夜自由饮水和进食。
1.3 实验方法 1.3.1 大鼠肝微粒体制备超高速离心法和钙离子沉淀法制备大鼠肝微粒体[7]。
配置0.9%生理盐水注射液,SD大鼠适应性饲养后,连续尾静脉注射3日,每日1次,每次注射剂量2 mL。
大鼠最后一次静脉注射12 h后,禁食不禁水,再经12 h麻醉后处死,解剖取肝脏,冰浴的生理盐水冲洗净血污,手术剪剪为肝脏小块,冰浴的蔗糖溶液冲洗至肝脏小块呈无色,按1:4(W/V)的比例加入蔗糖溶液,冰浴条件匀浆1 min,匀浆液称重后分装至离心管中。
4 ℃下25 000 g离心25 min,取上清液,加入CaCl2溶液(调整Ca2+的浓度至8 mmol/L),置于超速离心管,4 ℃、100 000 g条件下离心60 min,弃上清液取沉淀,用Tris-HCl溶液混悬均匀,再次以4 ℃、100 000 g条件离心60 min。取沉淀用Tris-HCl缓冲液按照1:2(W/V)的比例混悬均匀,分装后置于-80 ℃冰箱保存备用。
1.3.2 肝微粒体蛋白浓度测定采用Lowry法[8],按照标准方法制备,构建牛血清白蛋白标准曲线,测定肝微粒体浓度。
1.3.3 FGFC1内标定量检测方法精密称取FGFC1适量,以碳酸氢钠为溶媒(FGFC1 /NaHCO3,m /m,1:1)配置原液,连续稀释至0.5、1、5、10、15、20、25 μg/mL。所有样品用乙腈提取,0. 22 μm滤膜过滤后进行HPLC检测。以FGFC1的峰面积(Y)对FGFC1的浓度(X)进行线性回归,用于后续肝微粒体体系中FGFC1定量。
1.3.4 FGFC1药物代谢动力学特征分析方法反应体系总体积400 μL,反应体系以肝微粒体为代谢酶,使用NADPH来启动反应[8],冰浴的乙酸乙酯终止反应,PBS用于补充体积,同时设无NADPH的对照组。体外反应体系各组分终浓度:肝微粒体蛋白质浓度0.1 mg/mL,NADPH 1.0 mmol/L,FGFC1 14.0 μg/mL。反应体系加入FGFC1,37 ℃的恒温培养箱中预孵育5 min,加入NADPH启动反应,反应时间为0、1、5、15、30、40、60和120 min时,分别加入200 μL冰冷的乙酸乙酯终止反应,设置3组平行对照。样品经1.3.8步骤处理后进行HPLC分析,用1.3.3建立的线性回归方程计算FGFC1及其转化产物的浓度,以反应时间0 min的浓度作为100%,其他各时间点的百分比剩余量的自然对数作线性回归,依据公式(1)和(2)计算FGFC1的体外半衰期T1/2和固有清除率CLint[10]。
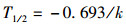 (1)
(1)
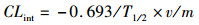 (2)
(2)
式中:k为各时间点的百分比剩余量的自然对数作线性回归后的斜率;v为反应体系体积,mL;m为肝微粒体酶含量,mg。
1.3.5 准确度与精密度在肝微粒体反应体系中加入FGFC1标准液,浓度分别为1 μg/mL、10 μg/mL、50 μg/mL,按1.3.4节中的方法处理后,检测值与真实值(平均值)的接近程度定义为准确度,测定FGFC1的日内、日间相对标准偏差(RSD),对其检测值进行分析,并用RSD表示。
1.3.6 回收率低、中、高3个浓度的质控样品(1、10、50 μg/mL),取定量样品按1.3.4步骤处理(不启动反应),混匀后经125 000 g离心15 min,取上清液过滤进HPLC检测。经乙腈提取检测到的FGFC1浓度与质控样品检测到的FGFC1浓度比值为回收率。
1.3.7 方法专属性验证分别设置空白肝微粒体组、空白肝微粒体加入FGFC1(A)和加入NADPH的温孵反应体系(B)。按1.3.4中的条件,观察方法的专属性和FGFC1在肝微粒体中的代谢稳定性[9]。
1.3.8 肝微粒体反应体系FGFC1的提取方法37 ℃肝微粒体反应体系孵育FGFC1为1~120 min,加入200 μL冷冻乙酸乙酯终止反应,分层后取有机相,氮气干燥,干燥的样品用HPLC流动相复溶。该过程重复3次。流动相复溶后以25 000 g离心15 min,0.22 μm滤膜过滤,置于样品瓶中,进样量为30 μL,按照1.3.9与1.3.10中条件进行HPLC分析。
1.3.9 FGFC1的HPLC检测方法液相色谱柱是HP-C18色谱柱(4.6×250 mm,5 μm),柱温度:40 ℃,流动相:乙腈(A)和水(0.1%三氟乙酸)(B),洗脱梯度:0~30 min,45% A~15%A,55%B~85%B,流速:1 mL/min,检测波长:265 nm[11]。
1.3.10 FGFC1转化产物的HPLC检测方法液相色谱柱是HP-C18色谱柱(4.6×250 mm,5 μm),柱温度:40 ℃,流动相:5%乙腈(A)和0.1%三氟乙酸(B),洗脱梯度:0~16 min,15% A~55% A,85% B~45% B,流速:1 mL/min,检测波长:265 nm[12]。
1.3.11 FGFC1转化产物分离方法制备型色谱柱是依利特SinoChrom ODS-BP色谱柱(20×250 mm,10 μm),柱温度:40 ℃,流动相:5%乙腈(A)和0.1%三氟乙酸(B),洗脱梯度:0~16 min,15% A~55% A,85% B~45% B,流速:10 mL/min,检测波长:265 nm。
1.3.12 FGFC1转化产物质谱分析[13]1.3.11节中分离纯化出的转化产物利用LC-MS/MS确定代谢产物的相对分子量后,对其结构进行初步推测,并基于此推测FGFC1在肝微粒体系中的生物转化过程。
质谱柱是HP-C18色谱柱(4.6×250 mm,5 μm),流动相:5%乙腈(A)和0.1%三氟乙酸(B),洗脱梯度:0~16 min,15% A~55% A,85% B~45% B,电离模式:正离子检测模式,质核比检测条件:400~500,毛细管电压:3.0 kV,锥电压:40 kV,离子源温度100 ℃,去溶剂化温度450 ℃,去溶剂气体流量900 L/h,流速为50 L/h[14]。
1.3.13 FGFC1的CYP代谢表型分析方法参考文献[15-16],设置添加CY450亚型抑制因子的实验组与无抑制因子的对照组。观察抑制不同CYP450亚型后FGFC1与PIO终浓度质量。对照组:在1.3.4节反应体系中,FGFC1终质量浓度为14 μg/mL;CYP2B4,CYP2E1抑制组:FGFC1终质量浓度为14 μg/mL,同时添加4-苯基-1, 2, 3-噻二唑,体系终质量浓度为10 μg/mL;CYP1A2抑制组:FGFC1终质量浓度为14 μg/mL,同时添加去乙酰环丙氯地孕酮,体系终质量浓度为10 μg/mL;CYP2C9、CYP2C19抑制组:FGFC1终质量浓度为14 μg/mL,同时添加苯妥英钠,体系终质量浓度为10 μg/mL;CYP3A4抑制组:FGFC1终质量浓度为14 μg/mL,同时添加酮康唑,体系终浓度为10 μg/mL。上述5组在37 ℃的恒温培养箱中预孵育5 min后,加入NADPH启动反应,反应进行至60 min,分别加入400 μL冰冷的乙酸乙酯终止反应。样品经1.3.8步骤处理后,HPLC方法检测FGFC1及其代谢产物的终浓度。
2 结果 2.1 肝微粒体蛋白浓度分析采用Lowry法,用牛血清白蛋白为标准蛋白,在0~500 μg/mL的质量浓度范围内构建标准曲线,得到蛋白含量(x, μg /mL)和吸光度值(y)的线性关系为y = 0.001 4x + 0.005 (R2=0.999 1)。
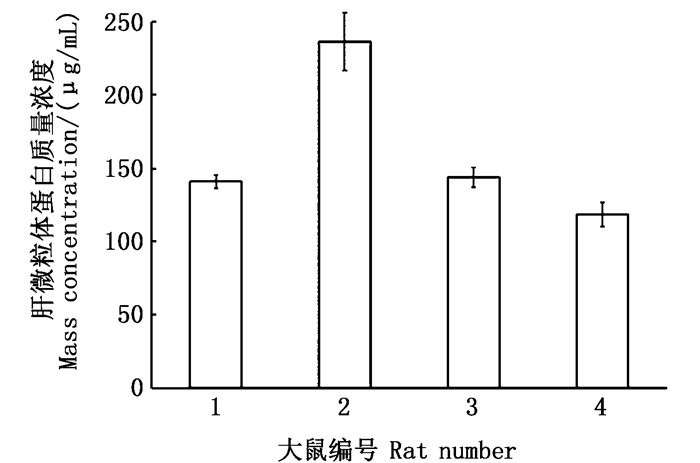
基于标准曲线,4只Wistar大鼠的肝微粒体蛋白质质量浓度分别是(140.81±4.67)μg/mL、(236.14±19.69)μg/mL、(143.75±6.62)μg/mL和(143.75±6.62)μg/mL(图 2),构建肝微粒体系所需的微粒体蛋白终质量浓度为0.1 mg/mL[17],制备的肝微粒体均大于该要求,可适用于后续实验。
|
图 2 Wistar大鼠的肝微粒体蛋白质量浓度 Fig. 2 Liver microsomal protein mass concentration in Wistar rats |
在1.3.9节的分析条件下,构建的肝微粒体反应体系不干扰FGFC1以及内标的测定。FGFC1在0.1~15 μg/mL的质量浓度范围内内呈良好的线性关系y=0. 456 1x+ 0.082 7 (R2= 0997),检测下限为0.1 μg/mL。
2.2.2 准确度与精密度FGFC1的日内和日间精密度RSD均小于5%,表明该方法满足分析样品中未知药物浓度的要求(表 1)。
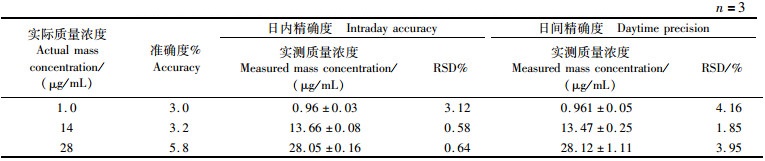
|
表 1 FGFC1样品准确度,日间、日内精密度及其RSD Tab.1 FGFC1 sample accuracy, daytime and intraday precision and its RSD |
准确度RSD值均小于6%(表 1),表明该方法能满足FGFC1及其转化产物定量检测的需要。
2.2.3 回收率方法的回收率平均值均大于97%,RSD均在4%以内(表 2),表明从肝微粒体中提取的样品在保存和处理过程中均稳定,未发生明显的降解。
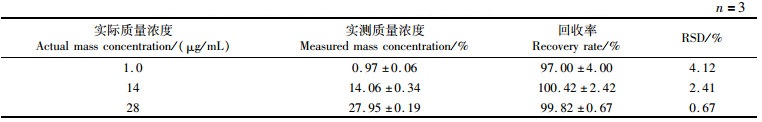
|
表 2 FGFC1在体外肝微粒体系中的回收率及其RSD Tab.2 Recovery of FGFC1 in liver microparticle system and its RSD |
空白肝微粒体组(a)、未加入NADPH组(b)与加入NADPH组(c)的HPLC分析结果见图 3,对比空白肝微粒体组,FGFC1和其他峰分离良好,在肝微粒体中无内源性物质干扰测定,说明本方法的专属性高。在未加入NADPH的组中,FGFC1不发生代谢转化。在加入NADPH的实验组中,FGFC1浓度减少。3组平行以60 min反应时间为基准的剩余率分别为42.23%、40.38%和41.91%, 表明FGFC1可以在NADPH的作用下在肝微粒体体系中发生生物转化。
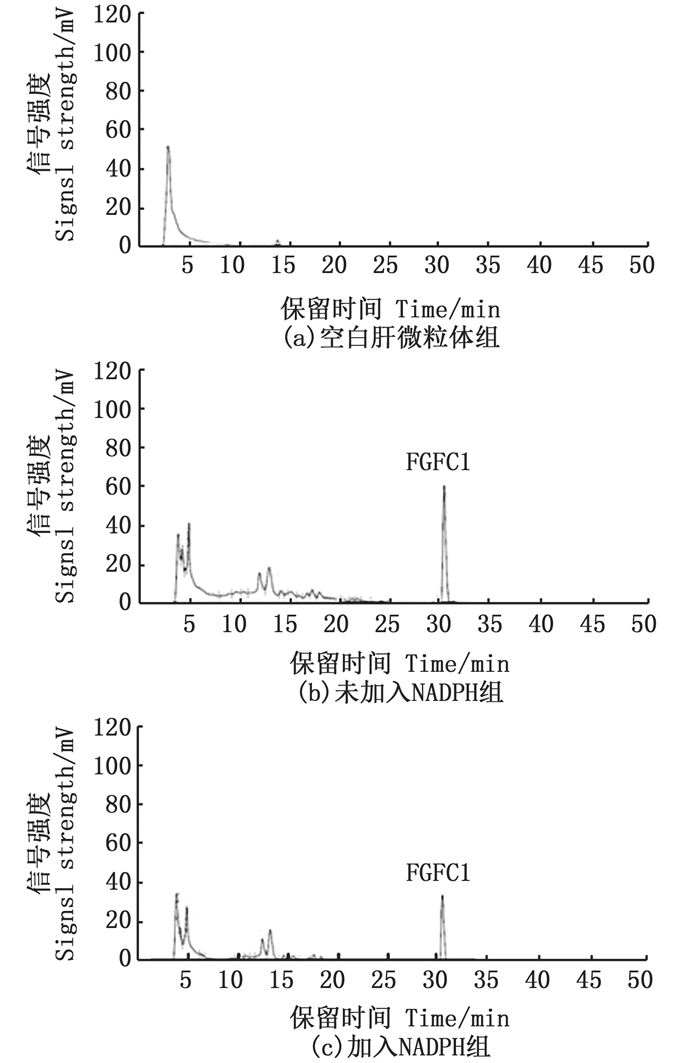
|
图 3 方法专属性及稳定性验证(n=3)HPLC检测图谱 Fig. 3 Method specificity and stability verification (n=3) HPLC detection pattern |
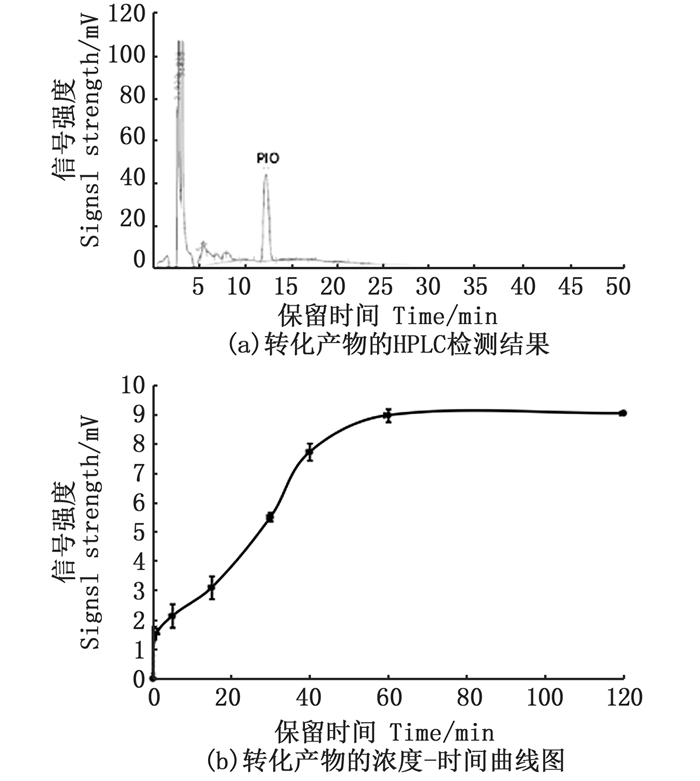
HPLC分析结果表明,FGFC1能在肝微粒体中发生生物转化,FGFC1在1~15 min时转化速率较快,转化速率逐渐趋于平缓,60 min后几乎观察不到FGFC1质量浓度的减少,体外肝微粒体模型药代动力学(n=3),代谢转化率(n=3)见图 4、图 5。FGFC1的体外代谢半衰期T1/2=(96.25±2.3)min,固有清除率CLint= (0.0720±0.0014)mL/(min·mg)。
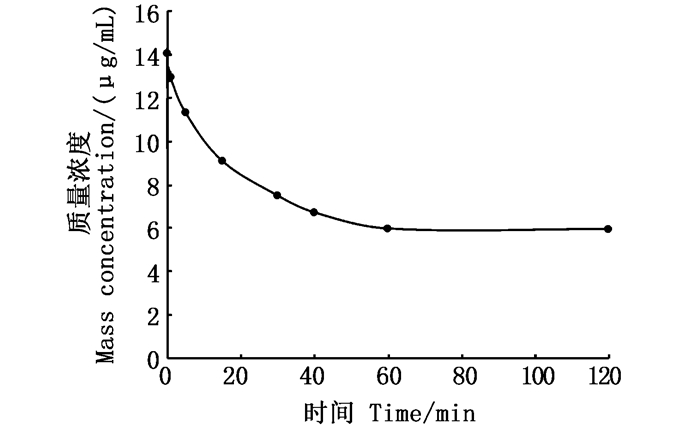
|
图 4 FGFC1的体外肝微粒体模型药代动力学(n=3) Fig. 4 In vitro liver microsomal model pharmacokinetics of FGFC1 (n=3) |

|
图 5 FGFC1的体外肝微粒体代谢转化率(n=3) Fig. 5 In vitro liver microsomal metabolic conversion rate of FGFC1 (n=3) |
按照1.3.10节进行高效液相分析,检测FGFC1转化产物产生情况,观察到FGFC1在代谢过程中产生一种转化产物,其HPLC检测结果及其浓度-时间曲线如图 6所示。
|
图 6 转化产物的检测结果 Fig. 6 Detection results of transformed products |
利用制备型色谱按照1.3.11中的条件对FGFC1转化产物进行分离纯化,通过LC-MS/MS鉴定分析,结果见图 7。

|
图 7 FGFC1转化产物的LC-MS/MS质谱图 Fig. 7 LC-MS/MS spectrum of FGFC1 conversion product |
在对分离纯化后的转化产物进行检测时,在保留时间8.65 min时检测到PIO,其质子峰为463.30[M+乙腈+H]+,其片段离子峰为110.90[C7H8O+H+H]+、215.70[C13H26O2+H]+、337.00[C18H27NO5]+、337.00[C25H31NO2]+(图 7)。
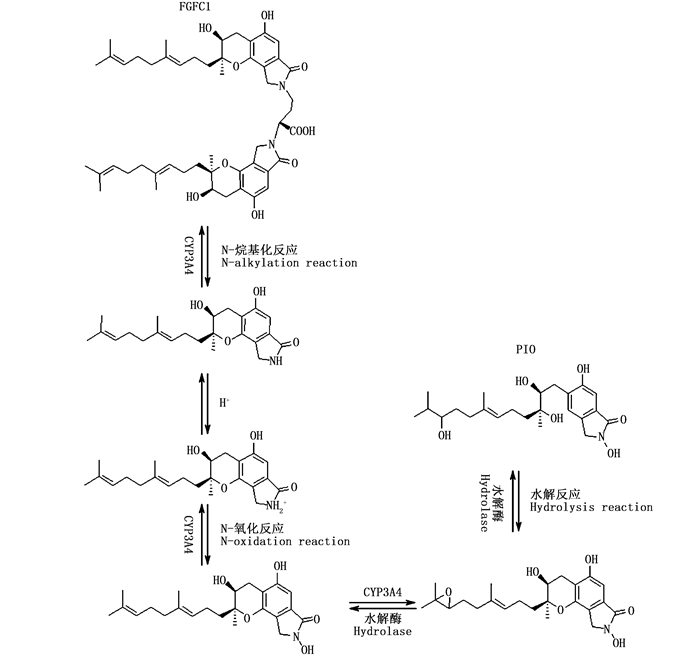
PIO的LC-MS/MS检测模式为正离子模式,基于FGFC1的分子结构,从FGFC1分子双吲哚结构特征和肝微粒体酶系中可能发生的生物转化过程推测。FGFC1的肝微粒体体系转化产物PIO在正离子检测模式中结合[CH3CN]+离子与[H]+离子于质荷比(m/z) 463.3处检测到其相对分子质量M=421.2,推测其在肝微粒体体系中通过N-脱烷基化反应、N-氧化反应等反应发生生物转化,产生PIO(图 8)。
|
图 8 FGFC1的肝微粒体生物转化过程示意图 Fig. 8 Schematic diagram of liver microsome biotransformation process of FGFC1 |
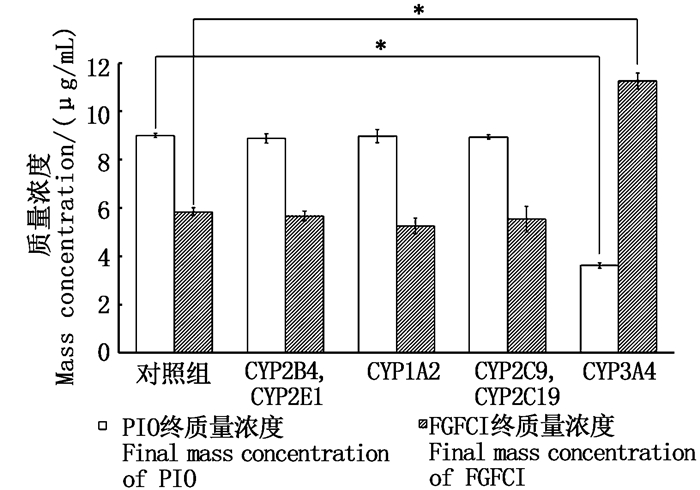
不同CYP450亚型抑制因子对FGFC1及其转化产物PIO最终质量浓度的影响如图 9所示。
|
图 9 不同处理组FGFC1及PIO的终浓度 Fig. 9 Final mass concentration of FGFC1 and PIO in different treatment groups |
对照组的FGFC1及PIO终质量浓度为(5.838±0.157)、(8.992±0.086)μg/mL,CYP3A4抑制组终质量浓度分别为(11.249±0.330)、(3.617±0.108)μg/mL,其余实验组相对于对照组无统计学差异(P>0.05)。
在CYP2B4、CYP2E1、CYP1A2、CYP2C9、CYP2C19进行选择性抑制时,FGFC1及PIO的终浓度无显著统计学差异,而对CYP3A4进行选择性抑制时,FGFC1的终质量浓度及PIO的终质量浓度较对照组具有显著统计学差异(P<0.05),故可以判断FGFC1在肝微粒体体系中的生物转化过程主要介由CYP3A4催化,受其它亚型影响小。同时也为2.4中的生物转化过程推断提供了依据。
3 讨论FGFC1能通过肝微粒体体系进行药物代谢,所建立的HPLC定量分析方法专属性强、标准曲线及线性范围良好,方法准确度与精密度均符合实验要求[3],可以在肝微粒体体系中检测到FGFC1(29 min左右出峰),能够满足大鼠肝微粒体Ⅰ相代谢孵育体系下定量检测需要,并应用于FGFC1体外肝微粒体药代动力学研究。
FGFC1在体外肝微粒体中发生生物转化,在0~15 min时代谢速度较快,FGFC1的体外代谢半衰期T1/2= (96.25±2.3) min,固有清除率CLint =(0.0720±0.0014) mL/(min·mg)。生物转化过程在120 min时趋于饱和,FGFC1呈现的体外药代动力学特征,说明FGFC1可通过主要药物代谢器官肝脏高效代谢,具有成药性,可作为溶血栓候选药物进一步研究与开发。
CYP3A4亚型催化多种生物碱类化合物的生物转化[16],也是催化FGFC1在肝微粒体体系中发生生物转化的主要酶系。FGFC1在肝微粒体中代谢途径相对单一,推测该药在临床上与其他CYP3A4抑制型药物联合使用时,效用可能会受到影响,对于进一步研究生物体内该药的代谢和临床合理联合用药具有重要的参考意义。
CYP3A4亚型催化多种生物碱类化合物的生物转化[16],也是催化FGFC1在肝微粒体体系中发生生物转化的主要酶系。FGFC1在肝微粒体中代谢途径相对单一,推测该药在临床上与其他CYP3A4抑制型药物联合使用时,效用可能会受到影响,对于进一步研究生物体内该药的代谢和临床合理联合用药具有重要的参考意义。
FGFC1在肝微粒体中经N-脱烷基化反应、N-氧化反应、水解反应发生生物转化产生产生一种转化产物((2S, 3S)-2-((E)-7, 8-dihydroxy-4-methylnon-3-en-1-yl)-3, 5, 8-trihydroxy-2-methyl-3, 4, 8, 9-tetrahydropyrano[2, 3-e]isoindol-7(2H)-one)[18],PIO分子量为421.2,不再具有双吲哚特征结构,其是否具有纤溶活性及其完全降解需深入研究。
| [1] |
王格, 严婷, 傅诗情, 等. 基于Caco-2细胞模型研究FGFC1吸收和转运的特性[J]. 中国新药杂志, 2016, 25(9): 1040-1045. WANG G, YAN T, FU S Q, et al. Absorption and transportation characteristics of FGFC1 in Caco-2 cell monolayer[J]. Chinese Journal of New Drugs, 2016, 25(9): 1040-1045. |
| [2] |
徐蓓蕾, 吴文惠, 朱全刚, 等. 海洋候选药物FGFC1冻干粉针剂处方工艺研究[J]. 上海海洋大学学报, 2016, 25(5): 775-785. XU B L, WU W H, ZHU Q G, et al. A study on the formulation of FGFC1 power injection[J]. Journal of Shanghai Ocean University, 2016, 25(5): 775-785. |
| [3] |
王格, 吴文惠, 王小雨, 等. 比格犬体内FGFC1药物代谢动力学特征及组织分布的研究[J]. 中国药理学通报, 2015, 31(7): 1019-1023. WANG G, WU W H, WANG X Y, et al. Pharmacokinetics and tissue distribution of FGFC1, a novel marine fibrinolytic compound in Beagle dogs[J]. Chinese Pharmacological Bulletin, 2015, 31(7): 1019-1023. DOI:10.3969/j.issn.1001-1978.2015.07.026 |
| [4] |
傅诗情, 严婷, 吴文惠, 等. 海洋微生物代谢产物FGFC1的纤溶促进作用[J]. 药学服务与研究, 2015, 15(2): 99-102. FU S Q, YAN T, WU W H, et al. Fibrinolysis promoting activity of a novel metabolic product of marine microbe-FGFC1[J]. Pharmaceutical Care and Research, 2015, 15(2): 99-102. |
| [5] |
王豪, 张久旭, 李梦薇, 等. 槟榔碱不同配伍环境下在肝微粒体中的代谢研究[J]. 中医药学报, 2018, 46(5): 58-61. WANG H, ZHANG J X, LI M W, et al. Study on arecoline metabolism in liver microsomes under different compatibility[J]. Acta Chinese Medicine and Pharmacology, 2018, 46(5): 58-61. |
| [6] |
张慧霞, 王鑫, 刘有平, 等. 白屈菜碱在大鼠肝微粒体中代谢的酶动力学及CYP450酶特异性抑制剂对其代谢的影响[J]. 沈阳药科大学学报, 2015, 32(4): 276-280. ZHANG H X, WANG X, LIU Y P, et al. Metabolic kinetic and subtypes of CYP450 of chelidonine in rat liver microsomal enzyme[J]. Journal of Shenyang Pharmaceutical University, 2015, 32(4): 276-280. |
| [7] |
沈晶晶, 张春华, 陈山乔, 等. 海藻-昆布药对对大鼠肝微粒体代谢酶的影响及肝毒性研究[J]. 药物评价研究, 2015, 38(3): 256-261. SHEN J J, ZHANG C H, CHEN S Q, et al. Effects of Sargassumfusiforme-Laminaria japonica Chinese medicine pair on cytochrome P450in vitro and study on its hepatotoxicity[J]. Drug Evaluation Research, 2015, 38(3): 256-261. |
| [8] |
李海玲, 彭书明, 李凛, 等. 4种常用蛋白浓度测定方法的比较[J]. 中国生化药物杂志, 2008, 29(4): 277-278, 282. LI H L, PENG S M, LI L, et al. Studies on four conventional methods for protein determination[J]. Chinese Journal of Biochemical Pharmaceutics, 2008, 29(4): 277-278, 282. |
| [9] |
WANG X X, REN J, ZHU S X, et al. Pharmacokinetics and tissue distribution of eupatilin and its metabolite in rats by an HPLC-MS/MS method[J]. Journal of Pharmaceutical and Biomedical Analysis, 2018, 159: 113-118. DOI:10.1016/j.jpba.2018.06.037 |
| [10] |
吴桐, 阳海鹰, 原梅, 等. 雷公藤甲素在人和大鼠肝微粒体代谢消除和酶动力学的比较研究[J]. 中国药理学通报, 2018, 34(10): 1414-1419. WU T, YANG H Y, YUAN M, et al. Comparative study of metabolic clearance and enzymatic kinetics of triptolide in human and rat liver microsomes[J]. Chinese Pharmacological Bulletin, 2018, 34(10): 1414-1419. DOI:10.3969/j.issn.1001-1978.2018.10.017 |
| [11] |
乔湜, 石蕊, 刘蔓, 等. HPLC-QTrap-MS鉴定欧前胡素体内代谢物及肝微粒体孵化产物[J]. 中国药学杂志, 2017, 52(15): 1352-1358. QIAO S, SHI R, LIU M, et al. Identification of imperatorin and its metabolites in vitro and in vivo by HPLC-QTrap-MS technology[J]. Chinese Pharmaceutical Journal, 2017, 52(15): 1352-1358. |
| [12] |
WANG J L, ZHENG D D, WANG Y Z, et al. Pharmacokinetics study of Erhuang decoction extracts in rats by HPLC-MS/MS[J]. Journal of Chromatography B, 2017, 1059: 35-42. DOI:10.1016/j.jchromb.2017.05.019 |
| [13] |
张瑜瑜, 董文慧, 徐静静, 等. 白屈菜碱在人肝微粒体中代谢产物的鉴定[J]. 沈阳药科大学学报, 2018, 35(6): 477-483. ZHANG Y Y, DONG W H, XU J J, et al. Identification of metabolites of chelidonine in human liver microsomes[J]. Journal of Shenyang Pharmaceutical University, 2018, 35(6): 477-483. |
| [14] |
TAN A M, FANARAS J C. How much separation for LC-MS/MS quantitative bioanalysis of drugs and metabolites[J]. Journal of Chromatography B, 2018, 1084: 23-35. DOI:10.1016/j.jchromb.2018.03.019 |
| [15] |
TANEJA I, KARSAULIYA K, RASHID M, et al. Species differences between rat and human in vitro metabolite profile, in vivo predicted clearance, CYP450 inhibition and CYP450 isoforms that metabolize benzanthrone:Implications in risk assessment[J]. Food and Chemical Toxicology, 2018, 111: 94-101. DOI:10.1016/j.fct.2017.11.009 |
| [16] |
DE LEON J, ARMSTRONGS C, COZZA K L, et al. Clinical guidelines for psychiatrists for the use of pharmacogenetic testing for CYP4502D6 and CYP4502C19[J]. Psychosomatics, 2006, 47(1): 75-85. DOI:10.1176/appi.psy.47.1.75 |
| [17] |
杨岩涛, 杨岩, 王韧, 等. 鱼腥草注射液与新鱼腥草素钠注射液体外肝微粒体代谢研究[J]. 药物评价研究, 2018, 41(12): 2214-2220. YANG Y T, YANG Y, WANG R, et al. Metabolism of Houttuyniae injection and sodium new Houttuyfonate injection in liver microsomes[J]. Drug Evaluation Research, 2018, 41(12): 2214-2220. |
| [18] |
CHADHA N, SILAKARI O. Indoles as therapeutics of interest in medicinal chemistry:Bird's eye view[J]. European Journal of Medicinal Chemistry, 2017, 134: 159-184. DOI:10.1016/j.ejmech.2017.04.003 |
2. Shanghai Engineering Research Center for Processing and Storage of Seawater Products, Shanghai 201306, China;
3. National Freshwater Aquatic Products Processing Technology R & D Center, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


